药品不良反应及报告填写
药品不良反应事件报告表填写示例

药品不良反应事件报告表填写示例示例文章篇一:哎呀呀,这“药品不良反应事件报告表填写示例”,刚开始我还真不太懂呢!不过听老师一讲,好像也没那么难。
就说上次吧,老师在课堂上给我们讲这个,大家都一脸懵。
“这是啥呀?”“怎么填呀?”教室里充满了这样的疑问声。
老师先给我们展示了一张报告表,哇,上面好多格子好多字!老师笑着说:“同学们,别害怕,咱们一步一步来。
”先看这姓名栏,这不就跟咱们写作业写名字一样嘛,得写清楚谁用了药出了问题。
再看年龄,这可得准确,小宝宝和大人用药反应能一样吗?然后是药品名称,这可不能写错,不然医生怎么知道是哪种药出了状况。
就好像我们认错了同学,那不是闹笑话啦?用药的剂量也重要得很,多了少了都可能有影响。
这就好比我们吃饭,吃多了撑得慌,吃少了又饿肚子。
还有用药时间,啥时候用的药得记清楚,这就像我们记住哪天过生日一样重要。
症状描述这一块,可得仔细说清楚。
是头疼?还是肚子疼?是痒痒?还是晕乎乎?要像给好朋友讲故事一样,把所有的不舒服都讲明白。
再看看过敏史,有没有对啥药过敏,这可关系到以后用药安不安全。
填这报告表就像是给药品做一次“体检”,每个细节都不能马虎。
要是填错了,医生不就找不到问题的关键啦?我觉得呀,认真填写这报告表太重要啦!它能帮助医生更好地了解情况,让病人更快地好起来。
大家说是不是呀?示例文章篇二:哎呀呀,说起这药品不良反应事件报告表,这可真是个重要的东西呢!就拿我上次生病来说吧,医生给我开了一堆药。
我乖乖地吃了,结果呢,身上居然起了好多小红疹子,痒痒得不行。
这可把我和爸爸妈妈急坏啦!你们想想,药品本来是用来治病的,可要是出现了不好的反应,那得多让人担心呀!这时候,填写药品不良反应事件报告表就变得超级重要啦。
比如说,报告表上会问你吃的是啥药,这就像警察叔叔查案,得先知道“嫌疑犯”是谁。
然后还会问你啥时候吃的,吃了多少,这就好比了解“犯罪”的时间和“作案”的程度。
还有啊,它会让你说一说身体出现了啥不舒服的情况。
药品不良反应报告表的填写及相关注意事项

《药品不良反应/事件报告表》可大致分为报告基本情况、患者基本情况、使用药品情况、ADR过程描述、关联性评价、报告人报告单位信息六部分。
1.报告基本情况首次报告□跟踪报告□编码:是电子上报后自动形成的每份报告的唯一编码。
报告类型:新的□严重□一般□(1)严重的药品不良反应:①导致死亡危及生命②致癌、致畸、致出生缺陷③导致显著的或者永久的人体伤残或者器官功能损伤④导致住院时间时间延长(2)新的药品不良反应:指药品说明书中未载明的不良反应或者说明书中已有描述,但不良反应发生的性质、程度、后果获准频率与说明书描述不一致或者严重,按照新的药品不良反应处理。
报告单位类别:医疗机构□√经营企业□生产企业□个人□其他□2.患者相关情况患者姓名:填写患者真实全名。
①当新生儿被发现有出生缺陷时,如果报告者认为这种出生缺陷可能与孕妇在妊娠期间服用药品有关时,患者是新生儿,并且将母亲使用的可能引起新生儿出现ADR的药品列在可以药品栏中;②如果孕妇在妊娠期间服用药品出现ADR没有影响到胎儿/新生儿,患者是母亲;如果ADR是胎儿死亡或自然流产,患者是母亲;③如果新生儿和母亲都发生ADR,应填写两张报告表,并且注明两张报告表的相关性。
出生日期/年龄:患者的出生年应填写4位数,如2004年。
如果患者的出生日期无法获得,应填写发生不良反应时的年龄(月龄/日龄)。
体重:注意以千克(公斤)为单位。
如果不知道准确的体重,请做一个最佳的估计。
联系方式:最好填写患者的联系电话或者移动电话。
如果填写患者的通信地址,请附上邮政编码。
原患疾病:患者所患的所有疾病。
若同时患有几种疾病,尽量完整填写所有疾病,建议首先填写与怀疑药品的使用相关的疾病。
疾病诊断应填写标准全称,如急性淋巴细胞白血病,不能写ALL。
既往药品不良反应/事件情况:包括药物过敏史:如选择“有”,应具体说明。
家族药品不良反应/事件:根据实际情况正确选择,如选择“有”,应具体说明。
相关重要信息:此栏的过敏史是指药物过敏史之外的其他过敏经历,如花粉过敏、牛奶过敏、花生过敏等;药物过敏史应在“既往药品不良反应/事件”一栏说明。
药品不良反应报告表 填写示例及填写说明
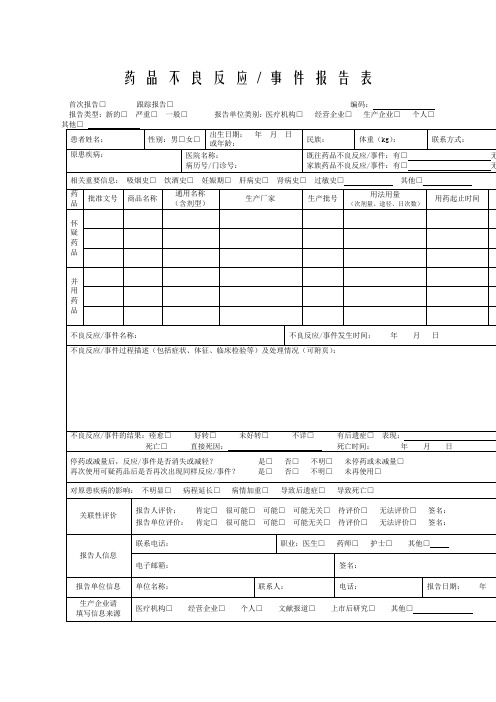
药品不良反应/ 事件报告表首次报告□跟踪报告□编码:报告类型:新的□严重□一般□报告单位类别:医疗机构□经营企业□生产企业□个人□药品不良反应/ 事件报告表示例首次报告□跟踪报告□编码:1.《药品不良反应/事件报告表》应填写真实事件,报表所列患者信息及怀疑药品信息项目必须真实、完整、准确。
2.《药品不良反应/事件报告表》填写字迹要清晰,其中选择项画“√”,叙述项应准确、简明,不得有缺漏项。
3. 新的□严重□一般□(1)新的药品不良反应:是指药品说明书中未载明的不良反应。
说明书中已有描述,但不良反应发生的性质、程度、后果或者频率与说明书描述不一致或者更严重的,按照新的药品不良反应处理。
根据不良反应/事件损害的严重程度,不良反应/事件可能是新的严重的,也可能是新的一般的。
(2)严重药品不良反应,是指因使用药品引起以下损害情形之一的反应:1) 导致死亡;2)危及生命;3)致癌、致畸、致出生缺陷;4)导致显著的或者永久的人体伤残或者器官功能的损伤;5)导致住院或者住院时间延长;6)导致其他重要医学事件,如不进行治疗可能出现上述所列情况的。
(3)一般:指新的、严重的药品不良反应以外的所有不良反应。
4. 单位名称:必须填写单位的完整全称,如日照市人民医院。
5. 部门:应填写科室的标准全称,如:消化内科、普外三科等。
6. 电话:填写报告部门(即科室)的电话。
7. 报告日期:指上交不良反应/事件报告的时间。
新的或严重的药品不良反应/事件应于发现之日起15日内报告,其中死亡病例须立即报告,其他药品不良反应应30日内报告。
有随访信息的,应当及时报告。
8. 患者姓名:填写患者真实全名。
9. 体重:以千克为单位。
如果不知道准确体重,请做一个最佳的估计。
10. 联系方式:最好填写患者的联系电话,也可填写患者的通信地址。
11. 家族药品不良反应/事件及既往药品不良反应/事件情况:请选择正确选项。
如果选择“有”,则在报告的空白处清晰叙述。
药品不良反应及报告填写

降低血脂
横纹肌溶解 肾功能不全
2001年
修改说明书 撤市
基础知识
(二)促进临床合理用药
开展药品不良反应报告和监测工作,有助于提高医护人员、药 师对药品不良反应的警惕性和识别能力,注意选用比较安全的品种, 避免配伍禁忌,从而提高了合理有效用药水平 .
头孢曲松钠
含钙溶液/药物
肺、肾中出
合用
现钙-头孢曲ຫໍສະໝຸດ 基础知识药品为什么会产生不良反应
药品因素:是药三分毒 个体差异:人与人不同,花有百样红
基础知识
哪些人容易出现药品不良反应
过敏性体质的人、老年人、孕妇、儿童和有 肝脏、肾脏等方面疾病的人,容易发生药品不良 反应。孕妇、哺乳期妇女服用某些药物还可能影 响胎儿、乳儿的健康。
基础知识
药品不良反应的自我判定
C aged)
E
目的单纯 (Too restricted)
D 用药条件控制较严
(Too homogeneous )
基础知识
(一)弥补药品上市前研究的不足,为上市后再评价提供服务
由于药品上市前研究的局限性,使得一些意外的、未知的、发 生率低的不良反应只有在上市后的大面积推广使用中才能显现
拜斯亭
1997年上市
市后风险管理提供技术支持
➢ 促进新药的研制开发 ➢ 及时发现重大药害事件,防止药害事件的蔓延
和扩大,保障公众健康和社会稳定
基础知识
(一)弥补药品上市前研究的不足,为上市后再评价提供服务
药品上市前研究的局限性
研究时间短(Too short)
B
病例少(Too few)
A
上市前 研究局 限性
试验对象年龄范围窄 (Too medium-
药品不良反应及药害报告制度模版(三篇)

药品不良反应及药害报告制度模版药品不良反应及药害报告制度是一种保障公众安全和健康的重要制度。
药品的研发、生产和使用过程中难免会出现不良反应和药害事件,及时准确地报告和处理这些事件,对于规范药品市场、提高药品安全是十分必要的。
以下是药品不良反应及药害报告制度的范文,以供参考。
药品不良反应及药害报告制度模版(二)一、药品不良反应报告制度范文:1.报告发起人信息:姓名:(请填写报告人的姓名)职务:(请填写报告人的职务)单位:(请填写报告人所在的单位)联系方式:(请填写报告人的联系方式)2.药品信息:药品名称:(请填写药品的名称)商标:(请填写药品的商标)规格:(请填写药品的规格)剂型:(请填写药品的剂型)生产厂家:(请填写药品的生产厂家)3.患者信息:患者姓名:(请填写患者的姓名)性别:(请填写患者的性别)年龄:(请填写患者的年龄)联系方式:(请填写患者的联系方式)4.不良反应信息:不良反应的发生时间:(请填写不良反应的发生时间)不良反应的症状:(请填写不良反应的症状)不良反应的严重程度:(请填写不良反应的严重程度)是否触发不良反应的因素:(请填写是否有触发不良反应的因素)5.处理情况:报告发起人对该不良反应的处理情况:(请填写报告发起人对该不良反应的处理情况)医生对该不良反应的处理情况:(请填写医生对该不良反应的处理情况)6.其他补充信息:请在此栏填写其他需要补充的信息。
二、药害报告制度范文:1.报告发起人信息:姓名:(请填写报告人的姓名)职务:(请填写报告人的职务)单位:(请填写报告人所在的单位)联系方式:(请填写报告人的联系方式)2.药品信息:药品名称:(请填写药品的名称)商标:(请填写药品的商标)剂型:(请填写药品的剂型)生产厂家:(请填写药品的生产厂家)3.药害事件信息:药害事件的发生时间:(请填写药害事件的发生时间)药害事件的情况描述:(请填写药害事件的情况描述)药害事件的严重程度:(请填写药害事件的严重程度)是否已采取措施避免进一步发生类似事件:(请填写是否已采取控制措施)4.处理情况:报告发起人对该药害事件的处理情况:(请填写报告发起人对该药害事件的处理情况)监管部门对该药害事件的处理情况:(请填写监管部门对该药害事件的处理情况)5.其他补充信息:请在此栏填写其他需要补充的信息。
药品不良反应报告范文

药品不良反应报告范文
尊敬的药品监管部门:
我是某某医院的一名医生,根据医疗工作的要求和职责,我特此向贵部门报告一起关于某某药品导致不良反应的病例。
该病例涉及患者某某,男,50岁,因肝病入院治疗。
在治疗
过程中,患者一直服用贵公司生产的某某药物。
然而,服药期间患者出现严重的不良反应,包括高热、呕吐、肝酶升高等症状。
经过进一步检查和评估,我们推断这些不良反应与患者服用某某药物有关。
首先,根据患者的病史和检查结果,我们排除了其他可能导致不良反应的因素。
患者在服用某某药物前没有服用其他药物,并不存在药物相互作用的可能性。
此外,患者在服药期间的生活习惯和饮食均保持稳定,没有其他可能导致不良反应的因素。
其次,根据该药物的药理学特点和临床研究数据,我们发现该药物确实存在导致肝脏损伤的风险。
该药物主要通过肝脏代谢,可能对肝脏产生直接毒性作用。
近期的临床研究也提到了该药物与肝脏损伤之间的关联,进一步支持了我们的推断。
最后,我们对该病例进行了积极的处理措施。
我们立即停止了患者的某某药物治疗,并采取了相应的解毒措施和疗效监测,以避免患者病情的进一步恶化。
同时,我们将该病例报告给贵部门,希望能引起药品监管部门的重视,加强对该药物的监测和评估工作,以确保患者的用药安全和权益。
衷心希望贵部门能及时处理该报告,并采取相应的措施,确保患者的权益得到有效保护。
希望贵部门能加强对药品的监管工作,加强药品安全监测和评估,确保患者的用药安全和权益。
谢谢!
敬礼!
某某医院
医生:XXX
日期:XX-XX-XXXX。
药品不良反应报告表填写示例及填写说明
药品不良反应/ 事件报告表首次报告□ 跟踪报告□ 编码:报告类型:新的□ 严重□ 一般□ 报告单位类别:医疗机构□ 经营企业□ 生产企业□ 个人□不良反应事件名称:不良反应事件发生时间:年月日不良反应/ 事件过程描述(包括症状、体征、临床检验等)及处理情况(可附页)不良反应/ 事件的结果:痊愈□好转□ 未好转□ 不详□ 有后遗症□ 表现:死亡□ 直接死因:死亡时间:年月日停药或减量后,反应/ 事件是否消失或减轻?是□ 否□不明□ 未停药或未减量□再次使用可疑药品后是否再次出现同样反应/ 事件?是□ 否□ 不明□ 未再使用□电子邮箱: 签名:×××药 品 不 良 反 应 / 事 件 报 告 表示例不良反应 / 事件过程描述(包括症状、体征、临床检验等)及处理情况(可附页) 一般格式为:患者因×××疾病于×××月×××日(必要时应详细到×××时分)以×××途径给予×××药品,×××剂量,用药×× ×时间出现×××反应(反应描述须明确、具体) ,×××时间后给予是否停药及×××处理(包括以×××途径给予×××药品及×××剂 和其他处理措施) ,处理后×××时间患者转归情况。
对原患疾病的影响: 不明显□ 病程延长□ 病情加重□ 导致后遗症□ 导致死亡□报告人评价: 肯定□ 很可能□ 可能□ 可能无关□ 待评价□ 无法评价□ 签名:××× 报告单位评价:肯定□很可能□可能□可能无关□待评价□无法评价□签名:×××报告人信息患者姓名:×××性别:男□女□出生日期: 年 月 日 或年龄: ××民族:××体重( kg ):××联系方式:××××××原患疾病:指患者此次入 诊的主要疾病(如果有多 疾病可以补充在相关重要 是备注里面),不能写字院或就 种慢性信息或 母缩写。
药店药品不良反应报告表填写范文
药店药品不良反应报告表填写范文一、患者基本信息。
1. 患者姓名:张三。
2. 性别:男。
3. 年龄:35岁。
4. 联系方式:138xxxxxxxx。
5. 家庭住址:xx市xx区xx街道xx小区x栋x单元x室。
这张三啊,平时看着身体还挺壮实的,没想到吃个药还出了点小状况。
二、不良反应发生情况。
1. 怀疑药品。
药品名称:阿莫西林胶囊。
剂型:胶囊剂。
生产厂家:xx制药厂。
批准文号:国药准字xxxxxx。
批号:xxxxxx。
用药起止时间:从x月x日开始吃,吃到x月x日就感觉不对劲了。
阿莫西林啊,这可是个常用药,谁知道这次在张三身上就“调皮”了一下呢。
2. 不良反应发生时间:大概是吃了三天阿莫西林之后,x月x日下午就开始有反应了。
3. 不良反应表现。
首先是感觉肚子有点不舒服,就像有只小老鼠在里面捣鼓似的,咕噜咕噜直叫。
然后就开始拉肚子了,一趟趟地往厕所跑,那叫一个狼狈啊。
整个人都没什么力气了,感觉像是被抽走了精气神一样。
4. 不良反应的严重程度:中等吧,虽然没有到那种要住院急救的程度,但也确实把张三折腾得够呛,班都上不了了,只能在家躺着哼哼。
5. 采取措施。
发现不良反应后,张三就赶紧停了阿莫西林胶囊,不敢再吃了。
自己在家喝了点淡盐水补充水分,怕拉脱水了。
还吃了点之前家里备着的止泻药,叫蒙脱石散,不过效果不是特别明显。
三、怀疑药品使用情况。
1. 用药剂量:按照说明书上写的,一次吃两粒,一天三次。
张三可是个老实人,严格按照这个剂量吃的,可没想到还是出问题了。
2. 用药途径:口服,就着温水把胶囊咽下去,这也是正常的吃法呀。
四、原患疾病情况。
张三本来就是有点小感冒,喉咙有点发炎,想着吃点阿莫西林消炎呢,谁知道这药没把炎症治好,还带来了这些麻烦。
五、报告人信息。
1. 报告人姓名:李四(药店工作人员)2. 报告人联系方式:139xxxxxxxx。
我李四在药店里工作这么久,第一次遇到张三这样的情况,觉得还是得好好报告一下,让大家都注意注意。
药品不良反应分析报告
药品不良反应分析报告一、引言药品的不良反应是指使用药物后产生的对人体不良的生理或心理反应。
药品的不良反应可能会对患者的治疗效果、生活质量以及严重程度产生重大的影响。
因此,对药品的不良反应进行及时、准确的分析是非常重要的。
本报告将以一种普遍使用的抗生素“X药物”为例,对其不良反应进行分析。
二、药品背景“X药物”是一种广谱抗生素,常用于治疗多种细菌感染。
该药物的主要作用机制是通过抑制细菌的蛋白质合成来抑制细菌的生长和繁殖。
然而,由于每个人体内的生理状况和对药物的敏感性不同,使用“X药物”可能会导致不同的不良反应。
三、药品的不良反应1.常见的不良反应根据研究数据和患者反馈,使用“X药物”后最常见的不良反应包括:恶心、呕吐、腹泻、头痛、皮疹等。
这些不良反应通常是轻微的,可以在停药后迅速缓解。
然而,对于患有特定疾病或体质较弱的患者来说,这些不良反应可能会严重影响其日常生活和治疗效果。
2.罕见但严重的不良反应虽然罕见,但是一些严重的不良反应也被发现与“X药物”的使用有关。
例如,光毒性反应是一种可能发生的严重不良反应,主要表现为光疗,即患者暴露在阳光下后皮肤发红、瘙痒、水疱等。
此外,也有报道称使用“X药物”可以导致过敏性休克、肝功能异常等严重不良反应。
这些不良反应可能会对患者的生命安全和健康产生重大影响。
四、不良反应的原因分析1.药物本身的特性“X药物”是一种抗生素,它通过抑制细菌的蛋白质合成来达到抗菌的目的。
然而,由于药物的特定结构和化学特性,它可能会与人体内的其他分子结合并引发不良反应。
同时,药物的代谢过程也可能导致药物的降解产物或代谢产物对人体产生不良影响。
2.患者个体差异每个人的机体状况和生理特点都是不同的,这也决定了他们对药物的反应不同。
例如,一些患者可能对“X药物”具有较高的敏感性,从而更容易产生不良反应。
此外,患者的基础疾病或其他药物的使用也可能增加不良反应的发生率。
五、预防和管理策略1.临床前评估在患者使用“X药物”之前,医生应该对患者进行全面的评估,包括患者的病史、过敏史、基础疾病等。
药品不良反应报告范文
药品不良反应报告范文
尊敬的医药监管部门:
我是某某医院的某某医生,今天向您报告一起药品不良反应的案例。
患者姓名,某某。
性别,男。
年龄,45岁。
病史,高血压。
就诊时间,2021年6月15日。
就诊科室,心血管内科。
就诊医生,某某医生。
患者某某因高血压长期服用降压药物A药,病情一直稳定。
但在6月15日复
诊时,患者向我反映近期出现头痛、恶心、乏力等不适症状,经询问得知这些症状出现在服用药物A药后。
我立即对患者进行了详细的询问和体格检查,并考虑到
可能是药物不良反应导致的症状,建议患者停止使用药物A药,并转为使用B药。
患者在停用药物A药后,症状逐渐减轻,并在换药后病情得到了控制。
经过一段时间的观察,患者的症状完全消失,目前病情稳定。
根据患者的病史和症状表现,我认为患者出现的不良反应与药物A药有关。
因此,我特此向贵部门报告此案,并建议对药物A药进行进一步的监测和评估,以
确保患者和其他服用该药物的患者的安全。
同时,我也提醒患者在使用药物时要密切关注自身的身体反应,一旦出现不良
反应要及时就医,并在医生的指导下进行调整用药。
希望贵部门能够重视此案,并对药物A药进行进一步的监测和评估,确保患者的用药安全。
谨此报告。
某某医生。
日期,2021年6月20日。
此份报告仅供参考,具体情况请以实际情况为准。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
两次蒸馏 清毒、解毒、 利湿 控制感染
鱼腥草 注射液
过敏性 休克
国家中心对此提出关注
分析、评价
对该品种通报
提出安全 建议
暂停该 品种
基础知识
(四)促进新药的研制开发
开展对药品不良反应的监测对于药品的研制和开发也有重要 的促进作用,研制高效、低毒的药品是新药开发的必然趋势
特非那丁
4.填写详细要求
4.1报告的基本信息 • 首次报告□ 跟踪报告□(新增)
• 如果报告的是跟踪报告,搜索到原始报告后在原始报告上
进行修改,补充资料后保存。
• 编码
• 是报告单位内部编码,电子上报后系统自动形成的电子编 码,报告单位要记录在纸制报告上
报告类型
• 新的□ 严重□ 一般□
• 新的药品不良反应,是指药品说明书中未载明的不良反应。(说明 书中已有描述,但不良反应发生的性质、程度、后果或者频率与说 明书描述不一致或者更严重的,按照新的药品不良反应处理。) • (原:新的药品不良反应 是指药品说明书中未载明的不良反应。) • 严重药品不良反应,是指因使用药品引起以下损害情形之一的反应: 1.导致死亡; 2.危及生命; 3.致癌、致畸、致出生缺陷; 4.导致显著的或者永久的人体伤残或者器官功能的损伤; 5.导致住院或者住院时间延长; 6.导致其他重要医学事件,如不进行治疗可能出现上述所列情 况的。
基础知识
正确对待药品不良反应
使用药品就可能发生药品不良反应
出现药品不良反应后应: 咨询医生,积极进行治疗 停止用药 建议医生向有关部门进行报告(ADR监测机构)
基础知识
如何安全用药
要按照医生处方或药品包装盒内的药品 说明书规定的适应症、用法用量使用。 消费者需要学习一些合理用药、安全用 药知识,提高这方面的自我保护能力。
含钙溶液/药物
合用
肺、肾中出 现钙-头孢曲 松钠沉淀物
新生儿死亡
工作背景
美国FDA 生产企业
修改药品 说明书
联合发布消息 提出风险警示
基础知识
(三)为遴选、整顿和淘汰药品提供依据,为药品上市后 风险管理提供技术支持
药品上市后再评价的主要内容包括药品有效性、药品不良反应和药物 经济学研究。作为药品上市后再评价工作的组成部分,药品不良反应报告 和监测工作在对药品安全性评价方面发挥着重要作用
不能透过血脑屏障,成为 最受欢迎的抗过敏药物
死亡报 告
撤市
心脏毒性
非索非那定
特非那定 代谢产物
具有药 理作用
新型抗 组胺药
基础知识
(五)及时发现重大药害事件,防止药害事件的蔓延和扩大, 保障公众健康和社会稳定。
分析 收集ADR报告 评价 研究 采取措施 避 免 重 复 发 生
发布信息
齐二药事件
我国药品不良反应监测系统发 挥了至关重要的作用,充分体 现了我国药品不良反应报告制 度的重大意义
2.药品不良反应/事件新旧报告表格的不同
• 新报告表将报告分为:
• 基本情况、患者基本情况、使用药品情况、不良反应过程 描述、关联性评价、报告人和报告单位信息6部分,
• 较旧报告表在方便填写、名称规范和有效信息提
取方面都有改进。
新增
新增
新增
新增
新增,方便上报和名称规范
食物、花粉
去激发 再激发
生率低的不良反应只有在上市后的大面积推广使用中才能显现
1997年上市
拜斯亭
横纹肌溶解 2001年
降低血脂
修改说明书
肾功能不全 撤市
基础知识
(二)促进临床合理用药
开展药品不良反应报告和监测工作,有助于提高医护人员、药
师对药品不良反应的警惕性和识别能力,注意选用比较安全的品种,
避免配伍禁忌,从而提高了合理有效用药水平 . 头孢曲松钠
新增
3、填写注意事项
《药品不良反应报告和监测管理办法》
第十五条要求:《药品不良反应/事件报告表》的填报内 容应真实、完整、准确。
3.1《药品不良反应/事件报告表》是药品安全性监测工 作的重要档案资料,手工报表需要长期保存,因此务必 用钢笔书写,填写内容、签署意见(包括有关人员的签 字)字迹要清楚,不得用报告表中未规定的符号、代号、 不通用的缩写形式和花体式签名。其中选择项画“√” , 叙述项应准确、完整、简明,不得有缺漏项。 3.2 每一个病人填写一张报告表。
基础知识
开展ADR监测工作意义
弥补药品上市前研究的不足,为上市后再评
价提供服务 促进临床合理用药 为遴选、整顿和淘汰药品提供依据,为药品 上市后风险管理提供技术支持 促进新药的研制开发 及时发现重大药害事件,防止药害事件的蔓 延和扩大,保障公众健康和社会稳定
基础知识
(一)弥补药品上市前研究的不足,为上市后再评价提供服务 药品上市前研究的局限性
• 第十九条 药品生产、经营企业和医疗机构应当主动收集药品不 良反应,获知或者发现药品不良反应后应当详细记录、分析和处 理,填写《药品不良反应/事件报告表》(见附表1)并报告。 • 第二十条 新药监测期内的国产药品应当报告该药品的所有不良 反应;其他国产药品,报告新的和严重的不良反应。 进口药品自首次获准进口之日起5年内,报告该进口药品的所 有不良反应;满5年的,报告新的和严重的不良反应。 • 第二十一条 药品生产、经营企业和医疗机构发现或者获知新的、 严重的药品不良反应应当在15日内报告,其中死亡病例须立即报 告;其他药品不良反应应当在30日内报告。有随访信息的,应当 及时报告。
4
基本概念
药品属性的两重性:
药品既有其有利的 一面,又有其有害的一 面,在达到治疗作用的 同时,也会发生不良反 应,对人体造成危害。
基本概念
药品不良反应的定义:
合格药品 正常用法用量 与用药目的无关的、意外的 有害反应
不等同于医疗事故以及药品质量问题引起的有害反应。
6
基本概念
在四环素类药物不仅可以影响婴幼儿时期 发育的恒牙牙色,而且孕妇若服用此类药物, 还可以通过胎盘影响胎儿期发育的乳牙牙色。 许多儿童的龋齿与骨骼发育障碍均与四环素有 关。
ADR相关法律法规
药品不良反应报告和监测管理办法
第十三条 药品生产、经营企业和医疗机构应当建立药 品不良反应报告和监测管理制度。药品生产企业应当设 立专门机构并配备专职人员,药品经营企业和医疗机构 应当设立或者指定机构并配备专(兼)职人员,承担本 单位的药品不良反应报告和监测工作。
第四十六条 药品经营企业和医疗机构应当对收集到的 药品不良反应报告和监测资料进行分析和评价,并采取 有效措施减少和防止药品不良反应的重复发生。
一般:新的、严重的药品不良反应以外的所有不良反应
报告单位类别
• 选择药品不良反应报告表的填报单位的类型
医疗机构□ 生产企业□ 经营企业□ 个人□ 其他
• 医疗机构:指从事预防、诊断、治疗疾病活动 并使用药品的机构。
• 生产企业、经营企业:指药品的生产企业和药 品的销售企业 • 个人:指作为消费者本人
ADR相关法律法规
药品不良反应报告和监测管理办法
第六十条 医疗机构有下列情形之一的,由所在地卫生行 政部门给予警告,责令限期改正;逾期不改的,处三万元 以下的罚款。情节严重并造成严重后果的,由所在地卫生 行政部门对相关责任人给予行政处分: (一)无专职或者兼职人员负责本单位药品不良反应监测 工作的; (二)未按照要求开展药品不良反应或者群体不良事件报 告、调查、评价和处理的; (三)不配合严重药品不良反应和群体不良事件相关调查 工作的; 药品监督管理部门发现医疗机构有前款规定行为之一的, 应当移交同级卫生行政部门处理。
药品因素:是药三分毒
个体差异:人与人不同,花有百样红
基础知识
哪些人容易出现药品不良反应
过敏性体质的人、老年人、孕妇、儿童和 有肝脏、肾脏等方面疾病的人,容易发生药品 不良反应。孕妇、哺乳期妇女服用某些药物还 可能影响胎儿、乳儿的健康。
基础知识
药品不良反应的自我判定
序来判断; 根据具体症状来判断; 是否有再激发现象;
控制
基础知识
药品不良反应的分类: 严重的,一般,新的
引起死亡 药 品 严 重 不 良 反 应 事 件
致癌、致畸、致出生缺陷
对生命有危险并能够导致人 体永久的或显著的伤残
患者出现对生命 有危险的不良反 应,若不及时救 治就可能导致人 体永久的或显著 的伤残
对器官功能产生永久损伤
/
导致住院或住院时间延长
ADR相关法律法规
药品不良反应报告和监测管理办法
《药品不良反应报告和监测管理办法》已于2010 年12月13日经中华人民共和国卫生部部务会议审议 通过,现予以发布,自2011年7月1日起施行。 适用于境内的 药品生产、经营企业和医疗卫生机构 药品不良反应监测专业机构 (食品)药品监督管理部门 其它有关主管部门
第三节
报告表填报相关要求及注意
事项
报告表填报相关要求及注意事项
• 分四部分:
• 1.药品不良反应/事件报告表法规依据
• 2.药品不良反应/事件新旧报告表格的不同
• 3.药品不良反应/事件报告表填写注意事项
• 4.药品不良反应/事件报告表填写的详细要
求
1.药品不良反应/事件报告表法规依据
• 《药品不良反应报告和监测管理办法》
填写注意事项
3.3 个人报告建议由专业人员填写,可以是诊治医务人 员、生产企业、经营企业专职人员及专业监测机构人员。 3.4尽可能详细地填写报告表中所要求的项目。有些内容 无法获得时,填写“不详”。 3.5 对于报告表中的描述性内容,如果报告表提供的空 间不够,可另附A4白纸说明。并将“附件”写在一张纸的 顶部。所有的附件应按顺序标明页码。附件中必须指出 继续描述的项目名称。
