间充质干细胞
间充值干细胞和免疫干细胞的区别

间充值干细胞和免疫干细胞的区别
间充质干细胞和免疫干细胞是两类干细胞,
从功能上划分,间充质干细胞可以分化为各种组织器官,如:
可以分化为肌肉、骨骼、神经、肝脏、肠、皮肤等不同器官。
免疫干细胞只能分化为免疫类细胞,如可以分化为淋巴细胞、单核细胞、粒细胞等,这些都是可以具有免疫作用的细胞。
另外,间充质干细胞和免疫干细胞,来源不同。
间充质干细胞可以有多种来源,目前主要从脐带、胎盘、脂肪、牙髓、胚胎里面提取。
而免疫干细胞只能从血液或骨髓里面提取。
有朋友问,那种干细胞更适合自己呢?这当然要区别对待,取决于治疗目的、身体情况、年龄等等综合因素,不能一概而论。
专题三:成体干细胞(前言和间充质干细胞)

精选2021版课件
13
精选2021版课件
14
精选2021版课件
15
间充质干细胞分离培养
采集部位:髂骨上嵴、胫骨和股骨、胸骨和腰椎。 分离方法:
细胞帖壁筛选法 密度梯度离心法 细胞分子标记分选法 细胞筛筛选法
精选2021版课件
16
图1 第三代hBMMSCs HE染色 ×1000 图2 hBMMSCs P1,P3,P5代生长曲线
“环境依赖性分化”(milieu-dependent differentiation)内容: 认为生长因子、细胞因子、细胞外基质等以及它们在干细胞/宿 主细胞之间的相互作用,在诱导MSCs向心肌分化方面起着重要 作用。
尽管MSCs向心肌分化的具体机制不清楚,但一致倾向认为:组 织损伤和高水平的多能细胞是其分化的两个重要的决定因素。
间充质干细胞诱导分化
精选2021版课件
19
诱导分化—成骨细胞
在MSCs培养体系中加入地塞米松、β-磷酸甘油和抗坏血酸等 单独或联合诱导,发现培养的MSCs逐渐形成聚集体或结节,碱性 磷酸酶活性也随之增高,基质钙化明显,可分化为成骨细胞。
透明质酸、骨形态形成蛋白-2 (BMP-2) 以及铜等均可促使 MSCs 向成骨细胞分化。
(2) 电镜检查类心肌细胞的超微结构时可观察到:特征性的经闰 盘连接的肌节、中心核和心房颗粒;
(3) 5氮胞苷处理2~5周后,分化的MSCs电生理检测到至少有2 种完全不同的动作电位:
精选2021版课件
24
2 体内分化
由MSCs向类心肌细胞分化过程中,除5氮胞苷外,体内心脏微环境 对MSCs的分化也至关重要。Wang等在其实验中提及心肌微环境 可以支持MSCs移植后的生长和向心肌细胞分化。
脐带间充质干细胞制备原理

脐带间充质干细胞制备原理一、概述脐带间充质干细胞(Wharton's jelly mesenchymal stem cells,WJ-MSCs)是一种来源于新生儿脐带的干细胞。
与其他来源的干细胞相比,WJ-MSCs具有易于获取、无伦理争议、低免疫原性和多向分化潜能等优点,因此在临床应用中具有广泛的前景。
本文将就WJ-MSCs制备原理进行详细介绍。
二、脐带间充质干细胞的来源脐带是连接胎盘和新生儿的管道,其中包含了丰富的干细胞资源。
在脐带中,除了血液造血干细胞外,还存在着一种特殊类型的干细胞——脐带间充质干细胞。
这种干细胞主要存在于脐带Wharton's jelly (WJ)中,与周围组织隔离。
三、WJ-MSCs制备方法1. 脐带获取制备WJ-MSCs首先需要获取新生儿脐带组织。
通常情况下,在新生儿出生后不久即可进行采集。
采集过程中需要注意消毒和无菌操作。
2. 分离WJ组织将采集到的脐带组织进行分离,去除血管和外层膜等部分,得到WJ组织。
WJ组织是一种透明的胶状物质,通常呈现出白色或浅黄色。
3. 制备单细胞悬液将WJ组织切成小块,并加入胶原酶等消化酶进行消化。
消化后,用PBS等缓冲液洗涤多次,最后制备成单细胞悬液。
4. 培养和扩增将制备好的单细胞悬液接种在干细胞培养基中,并放置于37℃、5% CO2的培养箱内进行培养和扩增。
在培养过程中需要定期更换培养基,并对干细胞进行观察和评估。
5. 鉴定和纯化经过一段时间的培养,可以通过流式细胞术等方法对干细胞进行鉴定和纯化。
通常情况下,WJ-MSCs表达CD73、CD90、CD105等特征性标志物,并且不表达CD34、CD45等血液细胞特征性标志物。
6. 冻存经过纯化和鉴定后,WJ-MSCs可以进行冻存。
在冻存过程中需要使用特殊的冻存液,并在低温下保存。
四、WJ-MSCs的应用前景WJ-MSCs具有广泛的应用前景。
目前已经有多项临床试验显示,WJ-MSCs可以用于治疗多种疾病,如心血管疾病、神经系统疾病、肝脏疾病等。
间充质干细胞分离及培养方案
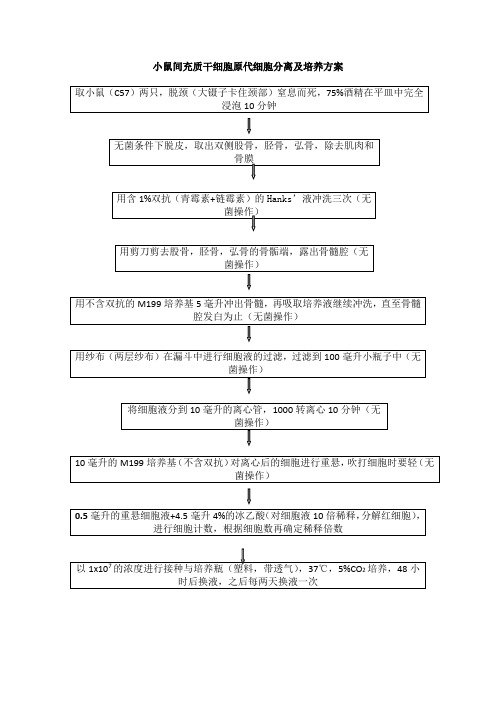
取小鼠(C57)两只,脱颈(大镊子卡住颈部)窒息而死,75%酒精在平皿中完全浸泡10分钟
无菌条件下脱皮,取出双侧股骨,胫骨,弘骨,除去肌肉和骨膜
用含1%双抗(青霉素+链霉素)的Hanks’液冲洗三次(无菌操作)
用剪刀剪去股骨,胫骨,弘骨的骨骺端,露出骨髓腔(无菌操作)
0.5毫升的重悬细胞液+4.5毫升4%的冰乙酸(对细胞液10倍稀释,分解红细胞),进行细胞计数,根据细胞数再确定稀释倍数
以1x107的浓度进行接种与培养瓶(塑料,带透气),37℃,5%CO2培养,48小时后换液,之后每两天换液一次
用不含双抗的M199培养基5毫升冲出骨髓,再吸取培养液继续冲洗,直至骨髓腔发白为止(无菌操作)
用纱布(两层纱布)在漏斗中进行细胞液的过滤,过滤到100毫小瓶子中(无菌操作)
将细胞液分到10毫升的离心管,1000转离心10分钟(无菌操作)
10毫升的M199培养基(不含双抗)对离心后的细胞进行重悬,吹打细胞时要轻(无菌操作)
脐带间充质干细胞PPT

分离与培养技术
01
02
03
酶消化法
使用特定的酶如胶原酶、 胰酶等分解脐带组织,释 放出间充质干细胞。
组织块贴壁法
将脐带组织切割成小块, 贴壁培养,让间充质干细 胞从组织块中爬出并扩增。
流式细胞术分离法
利用间充质干细胞的表面 标记物,通过特定的抗体 进行免疫分离。
诱导分化与基因编辑
再生医学
组织工程
脐带间充质干细胞具有多向分化潜能,可诱导分化为多种组 织细胞,如骨细胞、软骨细胞、脂肪细胞等。在组织工程领 域,可用于构建人工组织器官,为器官移植提供新的来源。
损伤修复与再生
脐带间充质干细胞可分泌多种生长因子和细胞因子,具有促 进损伤组织修复和再生的能力。在损伤修复领域,可用于治 疗烧伤、创伤等,促进受损组织的再生与修复。
技术挑战与解决方案
技术挑战
脐带间充质干细胞的分离、培养和分化等技术在实践中仍面临一些技术难题,如低分离效率、低细胞活率等。
解决方案
加强基础研究,深入了解脐带间充质干细胞的生物学特性和调控机制;采用先进的分离和培养技术,提高细胞的 分离效率和活率;加强国际合作,共享技术和资源,推动干细胞技术的进步。
05
脐带间充质干细胞的挑战与解 决方案
伦理挑战与解决方案
伦理挑战
脐带间充质干细胞的研究和应用涉及到伦理问题,如胚胎和胎儿的权益、人类基因编辑 等。
解决方案
建立严格的伦理审查机制,确保研究符合伦理标准;加强公众教育和科普,提高公众对 干细胞研究的认知和理解;尊重和保护受试者的权益,确保研究过程的公正和透明。
社会影响与普及程度
疾病治疗
脐带间充质干细胞在多种疾病的 治疗中展现出巨大潜力,有望为
送检中检院间充质干细胞质量标准

【生物学活性检查】
诱导分化能力检测
成骨成脂诱导分化染色法
具有成骨成脂诱导分化潜能
成瘤性检测
软琼脂克隆生长试验
无克隆形成
成品细胞(P4代)的质量标准
人脐带间充质干细胞P4代成品细胞临床研究用质量标准
检测项目
检测方法
标准规定
【生物学属性】
细胞形态
镜检
细胞贴壁生长时,呈梭形,应为成纤维样细胞
细胞计数
细胞计数仪检测
检测项目
检测方法
标准规定
细胞计数
细胞计数仪检测
标示量的90%~110%
细胞活率
细胞计数仪检测
不低于85%
可见异物
药典2015版《通则0904》
应符合ห้องสมุดไป่ตู้定
革兰氏染色
革兰氏染色镜检
未检出
细菌内毒素
药典2015版《通则1143》
<0.5EU/ml
阴性
HPV
荧光PCR核酸检测
阴性
HHV6/7
PCR核酸检测
阴性
猪细小病毒
PCR核酸检测
阴性
猪细环病毒
PCR核酸检测
阴性
猪圆环病毒
PCR核酸检测
阴性
【生物学活性检查】
诱导分化能力检测
成骨成脂诱导分化染色法
具有成骨成脂诱导分化潜能
成瘤性检测
软琼脂克隆生长试验
无克隆形成
成品发放细胞(P4)质量标准
P4代hUC-MSCs成品细胞发放质量标准
不低于95%
CD 105
不低于95%
CD44
不低于95%
CD166
不低于95%
CD 45
不得过2%
骨髓间充质干细胞培养方法大全

一、四种方法简介及优缺点:骨髓间充质干细胞主要有4种体外分离方法:贴壁筛选法,密度梯度离心法,流式细胞仪分离法和免疫磁珠分离法。
贴壁筛选法是利用细胞贴壁时间及贴壁牢固性的不同逐步将非贴壁细胞和其它杂质细胞去除的一种简单易行的培养MSCS的方法。
贴壁分离培养法分离的MSCS能在体外培养条件下生长良好、可连续传代,体外培养扩增能力较强,其缺点是细胞纯度较低。
此方法简便,冲出骨髓直接培养,然后利用骨髓MSCS 贴壁生长特性,更换培养液逐步去处漂浮生长的造血系细胞即可获得较纯化的MSCS;而且骨髓中的造血干细胞能分泌生长因子和促贴壁物质,可促进MSCS 贴壁生长,因此全骨髓贴壁法更为可取。
密度梯度离心法梯度离心法的核心主要是基于密度梯度离心技术。
梯度离心法是根据骨髓中细胞成分的比重不同,使用淋巴细胞分离液提取单个核细胞,再进行贴壁培养,从而达到分离、纯化MSCS的目的。
Pittenger等的研究发现通过密度梯度离心分离培养的间充质干细胞在第一代时纯度可以达到95%。
常用的分离方法免疫磁珠法,是利用免疫学的技术分离MSCS,分离细胞的纯度高。
Phinney 用一种免疫耗损技术精确地将造血细胞系和内皮细胞系从基质细胞中分离出来,提供了一种能高效的分离纯化间充质干细胞的方法,但目前仍未筛选到真正特异性的细胞表面标记;而且,这两种分离方法的操作对细胞活性都有较大影响,造成MSCS损伤,出现增殖缓慢等问题,这些技术问题很大程度上限制了这两种方法的应用。
因此,如何能简便高效地获得均质性的间充质干细胞和细胞群仍需要继续探索。
分离细疫磁珠分离和流式细胞仪筛选的方法,不仅对细胞活性影响较大,而且操作复杂,价格昂贵。
然而,这些纯化间充质干细胞的方法比较复杂,一般仅限于在各自的实验室应用。
二、具体实验流程1. 免疫磁珠法分离纯化骨髓间充质干细胞:1 实验动物Sd大鼠2 试剂和仪器BSA、荧光标记小鼠抗体x、PE磁珠试剂盒、抗生物素磁珠、MiniMACS分离器及MS分离柱。
骨髓间充质干细胞分离培养鉴定方法

骨髓间充质干细胞(BMSCs)的分离培养鉴定方法主要包括以下步骤:**一、分离方法**1. **差速贴壁法**:利用BMSCs与骨髓中其他细胞的贴壁性能差异及酶消化敏感性差异进行分离。
这种方法快速、简单、经济,但细胞纯度可能相对较低。
2. **密度梯度离心法**:基于骨髓中不同细胞的大小和密度差异进行分选。
通过流式细胞术检测,细胞表面抗原表达CD105,CD73和CD90必须≥95%,同时表达CD45、CD34、CD14或CD11b、CD79α,或CD19和HLA - DR必须≤2%。
**二、培养方法**培养BMSCs的难点在于保持细胞活性。
不同种属来源的BMSCs在体外培养扩增方法基本相似,但细微的营养条件、培养环境等差异都将会对细胞性能产生影响。
**三、鉴定方法**1. **细胞形态学观察**:利用组织块贴壁法、酶消化法或其结合来分离MSC,并通过传代培养进行形态学观察。
几乎所有的MSC都是贴壁生长,具有较强的贴壁能力。
MSC多数呈纤维细胞样生长,少量呈梭形或不规则三角形。
2. **表面标志物鉴定**:采用流式细胞仪对MSC的细胞表型进行鉴定。
MSC的表面抗原具有非专一性,可以同时表达间质细胞、内皮细胞和表皮细胞的表面标志,如粘附因子、生长因子和细胞因子受体以及整合素家族等。
MSC的细胞表面标志物鉴定标准为:CD105、CD73和CD90的阳性率≥90%;而CD45、CD34、CD14、CD19和HLA-DR 呈阴性,阳性率≤5%。
综上所述,骨髓间充质干细胞的分离、培养和鉴定是一个复杂的过程,涉及多个步骤和专业的技术操作。
在进行这些操作时,需要严格遵守实验规程,确保实验的准确性和安全性。
同时,对实验结果的解读也需要具备一定的专业知识和技能。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
分化为心肌细胞
间充质干细胞应用
在组织修复中的应用 1. 脊髓损伤中应用 2. 治疗小儿重度脑性瘫痪
间充质干细胞应用
寻找新药方面的应用 与原代细胞或修饰过的细胞相比, 间充质干细胞具有很多优点基因正常,有 独特的生理反应,可长期培养、扩增。最 近人类间充质干细胞的证实及分离更加缩 短了新治疗方法的评估时间,也减少了离 体实验及实验的总量。
间充质干细胞是中胚层发育的早期细胞,具备干 细胞的基本特性。在发育的不同阶段和特定环境 条件下,间充质干细胞可向骨、软骨、肌肉、神 经、血管及血液细胞等多种方向分化。在成体的 很多器官和组织中也存在着间充质干细胞,以备 修复和再生所用。间充质干细胞易于体外培养, 扩增迅速,可以分化为多种细胞,为干细胞生物 工程提供了一个很好的种子细胞。间充质干细胞 具有巨大的临床应用价值和科学研究价值。
展望
间充质干细胞的应用前景 间充质干细胞具有多向分化潜能、能 支持造血和促进造血干细胞植入、调节免 疫以及分离培养操作简便等特点,正日益 受到人们的关注。随着间充质干细胞及其 相关技术的日益成熟,临床研究已经在美 国等国家开展。
展望
间充质干细胞临床应用 1. 造血干细胞移植:增强造血功能;促使造 血干细胞移植物的植入;治疗移植物抗宿 主病。 2. 组织损伤的修复:骨、软骨、关节损伤、 心脏损伤;肝脏损伤;脊髓损伤和神经系 统疾病。 3. 自身免疫性疾病:系统性红斑狼疮、硬皮 病、炎性肠炎等。 4. 作为基因治疗的载体。
研究背景
人类胚胎干细胞在体外培养成功,实现了 人类胚胎干细胞体外的非分化增殖。 间充质干细胞的横ห้องสมุดไป่ตู้分化的发现,能分化 为体内所有的组织和器官。
研究意义
间充质干细胞具有高度的增殖和自我更新 能力可以分化为不同的细胞,在个体发育 中起着组织修复和再生作用,在体外扩增 培养和定向的诱导其向定向细胞发展,还 将为组织工程及其相关组织器官损伤的治 疗提供有利条件,甚至可以为基因治疗提 供良好的种子细胞。
国内外研究现状
美国 镰刀状细胞贫血症获得治疗 日本 建立了间充质干细胞库 中国 列入“863” “973” 计划
间 充 质 干 细 胞
生物学特性
多向分化潜能 免疫功能 来源广泛
间充质干细胞的鉴定
间充质干细胞培养时贴壁,呈成纤维细胞状,用 来作为鉴定间充质干细胞的抗体有SH2、CD44。 不同来源的间充质干细胞所表达的抗原不尽相同 表达量也有所变化:如CD 44,在三月胎龄人胚 胎的骨髓、血液和肝脏内,间充质干细胞正常表 达CD44;在新生胎儿的中胚层早期细胞内,CD -44表达量很少;在成人的骨髓间充质干细内,C -D44正常表达。一般利用间充质干细胞的贴壁生 长鉴定,并利用其这一特性分离。
间充质干细胞的分化
间充质干细胞的分化机制 1. 地塞米松对诱导MSCs向骨、软骨分化有促 进作用。 2. 氢化可的松促进MSCs向脂肪细胞分化。胰 岛素和丙酮酸钠对软骨分化有作用。 3. β-甘油磷酸对骨形成有促进作用。 4. β-巯基乙醇可诱导MSCs向骨骼肌分化。 5. 在GM-CSF等诱导下,MSCs不分化为造血 细胞。
间充质干细胞的分化
间充质干细胞的可塑性 1.向肝细胞样细胞分化 2.向胰岛样细胞分化 3.向肾脏组织的分化 4.向神经元样细胞的分化 5.向内皮细胞和表皮细胞分化 6.心脏组织的分化
分 化 为 神 经 细 胞
间充质干细胞应用
1. 2. 3. 4. 在疾病治疗中的应用 间充质干细胞对肝病的治疗 心肌疾病治疗 肿瘤治疗中的研究进展 慢性肺部疾病的治疗
间充质干细胞应用
癌症治疗中的应用 间充质干细胞与癌细胞有一定的相似 性。两者均可自我增殖;两者均可分化。 最近的研究表明,进一步的研究证实某些特 异性的基因可调节正常成体干细胞和癌症 干细胞的增殖。这些资料证明癌细胞与成 体干细胞具有一些共同的特性。因此我们 可能应用干细胞生物学原则来治疗癌症。
间充质干细胞的应用现状 The application situation of Mesenchymal stem cells
主要内容
研究背景 研究意义 国内外研究现状 生物学特性 间充质干细胞的鉴定 间充质干细胞的分化 间充质干细胞应用 展望 结论
间充质干细胞
结论
间充质干细胞是一类具有自我复制和多向分化能 力的细胞,它们可以不断地自我更新,并在特定 条件下转变成为一种或多种构成人体组织或器官 的细胞。间充质干细胞是机体的起源细胞,是形 成人体各种组织器官的始祖细胞。 间充质干细胞临床应用于解决多种血液系统疾病, 心血管疾病,肝硬化,神经系统疾病,膝关节半 月板部分切除损伤修复,自身免疫性疾病等方面 取得了重大突破,挽救了更多病患的生命。此外, 间充质干细胞在神经系统修复及更多方面具有长 远的发展前景。
