间充质干细胞培养方法
间充质干细胞培养方法

间充质干细胞培养方法1、间充质干细胞MSC基本形态2、干细胞应用与干细胞调控。
3、间充质干细胞MSC生长过程4、间充质干细胞MSC培养得合适气体环境5、细胞培养板得选择7、如何维持培养液p H6、如何选用细胞培养基ﻫ8、血清与干细胞得培养ﻫ9、胎牛血清(F B S )就是否需要灭活ﻫ10、细胞得细菌、真菌污染及排除ﻫ11、细胞培养污染得预防12、使用胰蛋白酶时加入 E DTA得目得就是什么13、胶原酶得种类与选型ﻫ14、胶原酶V S胰酶ﻫ15、干细胞得种类与表面标记16、间质干细胞培养原理概述ﻫ17、间质干细胞成脂与成骨诱导分化ﻫ18、干细胞老化得表现20、冷冻保护剂作用与选择ﻫ21、细胞冻存指导19、细胞传代消化过程指导ﻫ与处理ﻫ22、干细胞冷冻与复苏23、移植细胞得基因修饰ﻫ1。
间充质干细胞MSC基本形态ﻫ体外培养细胞根据它们在培养器皿就是否能贴附于支持物上生长特征,可分为贴附型生长细胞,常表现为成纤维型细胞与上皮细胞。
悬浮型细胞在培养中悬浮生长.ﻫ间充质干细胞MSC基本形态:形态与成纤维细胞类似,细胞在支持物表面呈梭形或不规则三角形生长,细胞中央有卵圆形核,胞质向外伸出2-3厘米个长短不同得突起。
可瞧到细胞成螺旋状生长。
ﻫ2.干细胞应用与干细胞调控干细胞得调控就是指给出适当得因子条件,对干细胞得增殖与分化进行调控,使之向指定得方向发ﻫ2、1内源性调控展.ﻫ干细胞自身有许多调控因子可对外界信号起反应从而调节其增殖与分化,包括调节细胞不对称分裂得蛋白,控制基因表达得核因子等。
另外,干细胞在终末分化之前所进行得分裂次数也受到细胞内调控因子得制约。
(1)胞内蛋白对干细胞分裂得调控ﻫ干细胞分裂可能产生新得干细胞或分化得功能细胞。
这种分化得不对称就是由于细胞本身成分得不均等分配与周围环境得作用造成得.细胞得结构蛋白,特别就是细胞骨架成分对细胞得发育非常重要。
如在果蝇卵巢中,调控干细胞不对称分裂得就是一种称为收缩体得细胞器,包含有许多调节蛋白,如膜收缩蛋白与细胞周期素A。
脐带间充质干细胞培养操作细则

脐带间充质干细胞分离培养操作细则一、样本接收1.观察运输箱的温度是否符合要求,采集瓶有无渗漏。
2.查看客户信息是否与交接表一致。
3.样本采集瓶外表面喷酒精擦拭消毒,并粘贴样本编码,填写样本接收记录,传入洁净区准备制备。
二、脐带间充质干细胞分离与接种1)准备耗材试剂:10cm培养皿、15ml离心管、50ml离心管、离心管架、10ml 移液管、T75培养瓶、离心管架、无尘布、50ml注射器针头、封口膜、灭菌止血钳、灭菌镊子、灭菌剪刀、废液缸、无血清干细胞培养基(常温复温)、生理盐水、75%酒精(已过滤)。
2)仪器设备准备及预热:电动移液枪、生物安全柜、离心机3)将75%酒精喷到台面,用无尘布擦拭台面,包括侧面及玻璃。
4)将生物安全柜开紫外30min通风10min,样本喷酒精擦拭,放入生物安全柜中,电动移液枪、移液管、离心管、离心管架喷酒精擦拭放入生物安全柜中,无菌棉球放入到广口瓶中加75%酒精放入生物安全柜中。
50ml、15ml离心管放到离心管架上,10cm皿5-7个。
将装有灭菌器械的灭菌盒喷酒精擦拭放入生物安全柜中。
5)取5个10cm皿依次摆开,1,2,4,5号皿依次加入适量的生理盐水,3号皿加入适量的已过滤的75%酒精。
拿出灭菌盒中已灭菌的止血钳,将脐带从保存瓶中取出放到第一个皿里,并取适量样本保存液留样送检支原体。
使用两个止血钳将脐带在第一个皿里清洗尽量去除脐带外表面的血污以及动静脉的血液和血凝块,将脐带转移至2号皿中,同样的方法再次清洗一次并测量其长度。
6)将清洗干净的脐带转移到装有已过滤75%酒精的3号皿中浸泡1min左右(不要超过两分钟),计时结束后,将脐带转移至4号皿中,同样的洗涤方法去除酒精。
清洗结束后将脐带剪成1-2cm短节,放入5号皿中,再次洗涤尽量去除血管内的血污。
再次拿两个10cm皿,加入适量的生理盐水,去一皿的盖子加少许盐水湿润底部及可。
7)将1-2cm的脐带小段转移到新的皿里,用带齿口的镊子取一段脐带,将脐带展开,再按血管走势剔除脐带的两条动脉,一条静脉。
人脐带间充质干细胞操作规范

人脐带间充质干细胞操作规范一、人脐带间充质干细胞的分离和培养1.准备4~5个培养皿,打开放在超净台中,将消毒过的平剪×1,弯剪×2,有齿镊子×4,放入超净台,紫外照射30 min,通风10 XXX;2.在1#、3#和4#号培养皿倒入25 ml生理盐水,在2#培养皿倒入25 ml酒精;3.将盛放脐带的器皿用酒精消毒外表面后放入超净台,用弯嘴钳取出脐带放入1#培养皿,清洗残留血渍,用第2把弯嘴钳配合挤出脐带血管内的积血。
4.将脐带转移至2#培养皿,完全浸泡,计时1 XXX;5.将脐带转移至3#培养皿,用平剪剪成3 cm左右的小段,清洗脐带内的积血(如果积血较多,可再次转入另一加盐水的培养皿);6.用有齿镊子分离2根动脉和1根静脉,剥离华尔通氏胶,放入4#培养皿。
7.将剥离的胶体转移至50 ml离心管中,2000 rpm离心5 min。
8.弃上清液,将胶体倒入干净的培养皿中,用小剪刀将其剪成糊状并转移至50 ml离心管中;9.以0.5 ml/瓶的量将胶体构造块接种至T75培养瓶,每瓶插手4 ml脐带有血清培养液(DMEM/F12 + 10% FBS + 1% L-Glutamine + 1% MEM NEAA + 10 ng/mlbFGF),水平摇晃培养瓶使组织块分布均匀;10.第2天观察是否有污染,每3天换一次液,并观察细胞爬出情况(过程中须注意平稳地拿放培养瓶,避免组织块发生移动);11.培养14天左右,倒去上清培养液,加心理盐水(3 ml/瓶)洗濯,用0.25%胰酶(2 ml/瓶)消化下爬出细胞及构造块,并用上清培养液(1 ml/瓶)终止消化;12.收集细胞及组织块悬液,2000 rpm离心5 min;13.弃上清液,插手适当心理盐水混匀,用70 μm滤网过滤去除构造块,即得到P0代脐带间充质干细胞;614.细胞计数,按10/瓶接种,每瓶插手10 ml脐带无血清培养液UltraCULTURE + 2% XXX 1% Glutamine + 1% MEM NAA),每3天换一次液。
比较不同培养基培养脐带间充质干细胞

比较不同培养基培养脐带间充质干细胞1 资料与方法1.1 一般资料经产妇知情同意,采集足月剖宫产健康胎儿脐带,无菌情况下放入含有抗生素的生理盐水中,4C保存,6h内无菌处理。
1.2 脐带的分离和原代培养植块法分离脐带:用止血钳及剪刀无菌取胎儿脐带4~5cm,D-hank's 液充分洗涤,去除脐静脉及动脉内的新鲜血液,分离并去除脐带外膜组织和血管组织,获得脐带wharton 胶。
将其剪碎至1mm31织块,使用吸管将组织块逐一植入T75培养瓶底,密度20〜25块/瓶为宜,组织小块在瓶底要分布均匀,倒置放入37 C,体积分数为5%CO饱和湿度培养箱内。
3〜5h 后待组织块粘附牢固正向放置到超净台内,加入适量含10%台牛血清的DMEM/F1培养基,正向放入体积分数为5%CO饱和湿度培养箱内。
72h后换液,一般5~7d 可有间充质干细胞爬出。
1.3 脐带间充质干细胞在不同培养体系的体外扩增将原代细胞完全爬出后,在IMDM、DMEM/F1(2 不含酚红)、StemProRMSC SFM 三种培养体系中传代培养,在生长过程中进行形态学观察。
1.4流式细胞仪表型检测取生长状态良好的P4代细胞,消化并计数,以每管1X 106个细胞,分别加入10 u l单克隆抗体CD73 CD34 CD45 CD105 HLA-DRHLA-ABC及阴性对照lgG1 -PE、阳性对照lgG1-FITC,室温避光孵育30min, PBS洗涤两次,室温300g, 5min。
PBS重悬后上流式细胞仪。
1.5 cck-8 法检测细胞活性取生长状态良好的P4 代细胞,调整细胞浓度至0.2 X 105/ml,加入96孔板。
每孔90卩l放在37C、体积分数为5%CO饱和湿度培养箱内培养。
7d内每日上午10:00取出96孔板用与原来孔内相同培养基100卩l换液后加入cck-8溶液,继续孵育1h。
用酶标仪波长450nm测定各孔OD 值。
以OD直代表细胞的相对数量,绘制细胞生长曲线。
脐带间充质干细胞培养方法

(一)1.Sections of 8–10 cm of umbilical cords, which are routinely discarded, were internally washed with phosphate-buffered saline (PBS), supplemented with 3% penicillin/streptomycin (Invitrogen-Gibco, Grand Island, NY, ) and immediately immers ed in Dulbecco ’s modi fied Eagle ’s medium- low glucose (DMEM-LG; Invitrogen-Gibco) supplemented with 10% fetal bovine serum (FBS; Invitrogen-Gibco) and 3% penicillin/streptomycin (Invitrogen-Gibco). All samples were processed within 12 –15 h after collection.2. UCs were fil led with 0.1% collagenase (Sigma-A ldrich, St. L oui s, /sigma-aldrich/home.h tml) in PBS and incuba ted at 37°C for 20 min. Each UC was washed wi th proli feration medium, and the detach ed cell s were harvested after gentl e mass age of the UC. Cells were centr ifuged at 300 g for 10 min, resus -pended in prolifera tion medium, and seeded in 25-cm^ 2 flasks at a densi ty of 5 × 10^7 cells per ml.After 24 h of incubation, non-adherent cells were removed, and culture medi um was replace d every 3 days.(二)HuMSCs were prepared as previously described.8 Wharton's jelly was processed within 24 hours of collection and cut into pieces of about 1 mm3 for culture. These pieces were placed in 24-well plates and cultured in DMEM supplemented with 10% fetal bovine serum (FBS), 5 ng/ml EGF, 5 ng/ml basic fibroblast growth factor, 100 U/ml penicillin and 100 mg/ml streptomycin, and 1 μg/ml amphoterin B. The culture plate was placed in an incubator with saturated humidity at about 37°C containing 5% (v/v) CO2. The medium was changed every three days and the cells were passaged when they reaching 70% confluence. Adherent cells were recovered by treatment with 0.25% trypsin for 3 to 5 minutes then centrifuged.(三) 脐带间充质干细胞的分离:脐带自手术台取下后,浸入含抗生素的生理盐水中,4 ℃保存,在操净台内取出脐带,用D-PBS冲洗净脐动脉和脐静脉内的残余血液,用止血钳和剪刀剔除上述血管,将脐带剪成1 mm^3大小的组织块后放入200 mL 蓝盖试剂瓶,加入质量/ 体积比为0.1%的Ⅱ型胶原酶30 mL,置于恒温振荡仪内持续消化6 h ,100 目筛网过滤收集细胞。
间充质干细胞分离及培养方案
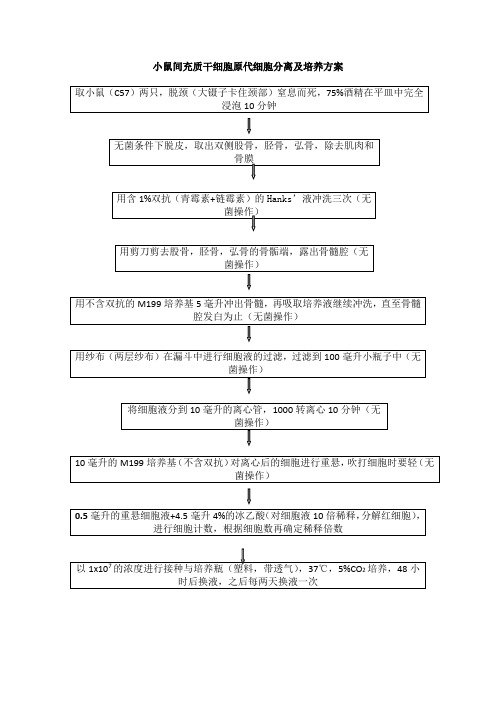
取小鼠(C57)两只,脱颈(大镊子卡住颈部)窒息而死,75%酒精在平皿中完全浸泡10分钟
无菌条件下脱皮,取出双侧股骨,胫骨,弘骨,除去肌肉和骨膜
用含1%双抗(青霉素+链霉素)的Hanks’液冲洗三次(无菌操作)
用剪刀剪去股骨,胫骨,弘骨的骨骺端,露出骨髓腔(无菌操作)
0.5毫升的重悬细胞液+4.5毫升4%的冰乙酸(对细胞液10倍稀释,分解红细胞),进行细胞计数,根据细胞数再确定稀释倍数
以1x107的浓度进行接种与培养瓶(塑料,带透气),37℃,5%CO2培养,48小时后换液,之后每两天换液一次
用不含双抗的M199培养基5毫升冲出骨髓,再吸取培养液继续冲洗,直至骨髓腔发白为止(无菌操作)
用纱布(两层纱布)在漏斗中进行细胞液的过滤,过滤到100毫小瓶子中(无菌操作)
将细胞液分到10毫升的离心管,1000转离心10分钟(无菌操作)
10毫升的M199培养基(不含双抗)对离心后的细胞进行重悬,吹打细胞时要轻(无菌操作)
人脐带华通氏胶间充质干细胞的分离_培养_鉴定及冻存_复苏
见 明显钙结节;成脂诱导 14 d,有明显的脂滴出现,油红 O 染色阳性。 冻 存 再 复 苏 细 胞 活 力 达 80%,细 胞 免 疫 表 型 及 成
骨、成脂诱导显示与冻存前细胞呈相同的特性。 结论:组织块培养法可从人脐带华通氏胶中分离、培养出纯度较高间充
质干细胞,冻存、复苏不改变其特性。
[关键词] 人脐带间充质干细胞;华通氏胶;细胞培养;诱导分化;冻存
定其向成骨、成脂方向诱导分化的能力;将 P1 细胞冻存 6 个月后复苏,鉴定复苏后细胞的特 性。 结果:植块法容易从人
脐带华通氏胶中获得间充质干细胞; 组织块贴壁后 6 d 可见组织 块周围细胞爬出, 原代培养 14~18 d 细胞融合 70%~
80%;P3 代细胞强烈表达 CD73、CD90、CD105,不表达 CD14、CD34、CD45、CD79a 和 HLA-DR;成骨诱导分化后 10 d,可
图 1 剪成 2 cm 脐 图 2 剔 除 脐 静 脉 图 3 剥 离 的 华 通
带小段
及脐动脉
氏胶
1.2.2 脐带华通氏胶 MSCs 表型的测定 用流式细 胞仪对 P3 代 UC-MSCs 表面特异性抗原进行检测。 Tryple 酶消化待检细胞,PBS 洗涤 3 次,制成 1×106/ml 的细胞悬液。 将待检细胞样品分为每管 0.1 ml,加入 CD14 -FITC、CD45 -FITC、CD79a -APC、CD90 -APC、 CD34 -PE、CD73 -PE、CD105 -PE、HLA -DR -PE 一 抗,4 ℃孵育 30 min,流式细胞仪测定各类抗原的阳 性率。 1.2.3 脐 带 华 通 氏 胶 MSCs 诱 导 分 化 向 成 骨 细 胞 诱导分化:将 P3 代细胞消化后,调整细胞密度为 1×105/ml, 接 种 于 24 孔 板 内 ,1~2 d 后 细 胞 融 合 达 70%~80%, 此时以成骨细胞诱导培养液培养, 每 3 天全量换液 1 次,第 10 天茜素红染色;向脂肪细 胞 诱导分化:培养液改为成脂肪细胞诱导培养液,其余 同前,第 14 天油红 O 染色。 1.2.4 脐带华通氏胶 MSCs 的冻存、复苏 将 P1 代
骨髓间充质干细胞培养方法大全
一、四种方法简介及优缺点:骨髓间充质干细胞主要有4种体外分离方法:贴壁筛选法,密度梯度离心法,流式细胞仪分离法和免疫磁珠分离法。
贴壁筛选法是利用细胞贴壁时间及贴壁牢固性的不同逐步将非贴壁细胞和其它杂质细胞去除的一种简单易行的培养MSCS的方法。
贴壁分离培养法分离的MSCS能在体外培养条件下生长良好、可连续传代,体外培养扩增能力较强,其缺点是细胞纯度较低。
此方法简便,冲出骨髓直接培养,然后利用骨髓MSCS 贴壁生长特性,更换培养液逐步去处漂浮生长的造血系细胞即可获得较纯化的MSCS;而且骨髓中的造血干细胞能分泌生长因子和促贴壁物质,可促进MSCS 贴壁生长,因此全骨髓贴壁法更为可取。
密度梯度离心法梯度离心法的核心主要是基于密度梯度离心技术。
梯度离心法是根据骨髓中细胞成分的比重不同,使用淋巴细胞分离液提取单个核细胞,再进行贴壁培养,从而达到分离、纯化MSCS的目的。
Pittenger等的研究发现通过密度梯度离心分离培养的间充质干细胞在第一代时纯度可以达到95%。
常用的分离方法免疫磁珠法,是利用免疫学的技术分离MSCS,分离细胞的纯度高。
Phinney 用一种免疫耗损技术精确地将造血细胞系和内皮细胞系从基质细胞中分离出来,提供了一种能高效的分离纯化间充质干细胞的方法,但目前仍未筛选到真正特异性的细胞表面标记;而且,这两种分离方法的操作对细胞活性都有较大影响,造成MSCS损伤,出现增殖缓慢等问题,这些技术问题很大程度上限制了这两种方法的应用。
因此,如何能简便高效地获得均质性的间充质干细胞和细胞群仍需要继续探索。
分离细疫磁珠分离和流式细胞仪筛选的方法,不仅对细胞活性影响较大,而且操作复杂,价格昂贵。
然而,这些纯化间充质干细胞的方法比较复杂,一般仅限于在各自的实验室应用。
二、具体实验流程1. 免疫磁珠法分离纯化骨髓间充质干细胞:1 实验动物Sd大鼠2 试剂和仪器BSA、荧光标记小鼠抗体x、PE磁珠试剂盒、抗生物素磁珠、MiniMACS分离器及MS分离柱。
大鼠骨髓间充质干细胞的培养与鉴定
大鼠骨髓间充质干细胞的培养与鉴定干细胞研究一直是生物医学领域的前沿热点,其中骨髓间充质干细胞(BMSCs)因其具有多向分化潜能和低免疫原性而备受。
在众多研究中,大鼠BMSCs的体外培养和鉴定方法为其在科研和临床领域的应用提供了基础。
本文将就大鼠BMSCs的培养、鉴定方法进行详细介绍,并结合实验数据进行阐述。
BMSCs是一种成体干细胞,具有自我更新和多向分化潜能,可以分化为多种细胞类型,如成骨细胞、脂肪细胞、肌肉细胞等。
因其来源广泛,免疫原性低,大鼠BMSCs已成为再生医学、免疫调节等领域的重要研究对象。
近年来,随着生物技术的不断发展,BMSCs的培养和鉴定方法也得到了不断优化和改进。
BMSCs的培养需要无菌环境,常用的培养基为DMEM、F12等,添加适量的生长因子和抗生素以维持细胞的生长和存活。
细胞的鉴定主要包括形态学观察、表面标志物检测和多向分化潜能的证实。
其中,表面标志物如CDCD90等可用来区分BMSCs和其他细胞,多向分化潜能的证实包括成骨、成脂和成肌等方向的诱导分化。
本实验采用大鼠BMSCs的常规体外培养方法。
具体步骤如下:采集大鼠骨髓:在无菌环境下,用注射器抽取大鼠股骨和胫骨骨髓,加入肝素抗凝。
细胞分离:将采集的骨髓用密度梯度离心法分离出单个核细胞。
细胞培养:将单个核细胞接种于培养瓶中,用含10%血清、1%抗生素和1%谷氨酰胺的培养基培养。
细胞鉴定:经过约7-10天的培养,细胞达到80%-90%融合时,进行细胞鉴定。
通过形态学观察、表面标志物检测和多向分化潜能的证实,对BMSCs进行鉴定。
通过观察细胞的形态和生长情况,发现培养的BMSCs呈典型的长梭形,且细胞间连接紧密(图1)。
经表面标志物检测,BMSCs表达CD29和CD90等间充质干细胞表面标志物(图2)。
在多向分化潜能的证实中,我们发现BMSCs经成骨、成脂和成肌诱导后,可分别形成矿化结节、脂肪滴和肌纤维(图3)。
这些结果说明所培养的细胞为BMSCs。
骨髓间充质干细胞分离培养鉴定方法
骨髓间充质干细胞(BMSCs)的分离培养鉴定方法主要包括以下步骤:**一、分离方法**1. **差速贴壁法**:利用BMSCs与骨髓中其他细胞的贴壁性能差异及酶消化敏感性差异进行分离。
这种方法快速、简单、经济,但细胞纯度可能相对较低。
2. **密度梯度离心法**:基于骨髓中不同细胞的大小和密度差异进行分选。
通过流式细胞术检测,细胞表面抗原表达CD105,CD73和CD90必须≥95%,同时表达CD45、CD34、CD14或CD11b、CD79α,或CD19和HLA - DR必须≤2%。
**二、培养方法**培养BMSCs的难点在于保持细胞活性。
不同种属来源的BMSCs在体外培养扩增方法基本相似,但细微的营养条件、培养环境等差异都将会对细胞性能产生影响。
**三、鉴定方法**1. **细胞形态学观察**:利用组织块贴壁法、酶消化法或其结合来分离MSC,并通过传代培养进行形态学观察。
几乎所有的MSC都是贴壁生长,具有较强的贴壁能力。
MSC多数呈纤维细胞样生长,少量呈梭形或不规则三角形。
2. **表面标志物鉴定**:采用流式细胞仪对MSC的细胞表型进行鉴定。
MSC的表面抗原具有非专一性,可以同时表达间质细胞、内皮细胞和表皮细胞的表面标志,如粘附因子、生长因子和细胞因子受体以及整合素家族等。
MSC的细胞表面标志物鉴定标准为:CD105、CD73和CD90的阳性率≥90%;而CD45、CD34、CD14、CD19和HLA-DR 呈阴性,阳性率≤5%。
综上所述,骨髓间充质干细胞的分离、培养和鉴定是一个复杂的过程,涉及多个步骤和专业的技术操作。
在进行这些操作时,需要严格遵守实验规程,确保实验的准确性和安全性。
同时,对实验结果的解读也需要具备一定的专业知识和技能。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
间充质干细胞培养方法1. 间充质干细胞MSC基本形态2. 干细胞应用与干细胞调控。
3. 间充质干细胞MSC生长过程4. 间充质干细胞MSC培养的合适气体环境5. 细胞培养板的选择6. 如何选用细胞培养基7. 如何维持培养液p H8. 血清与干细胞的培养9. 胎牛血清(F B S )是否需要灭活10. 细胞的细菌、真菌污染及排除11. 细胞培养污染的预防12. 使用胰蛋白酶时加入E DTA的目的是什么13. 胶原酶的种类和选型14. 胶原酶V S胰酶15. 干细胞的种类和表面标记16. 间质干细胞培养原理概述17. 间质干细胞成脂和成骨诱导分化18. 干细胞老化的表现和处理19. 细胞传代消化过程指导20. 冷冻保护剂作用和选择21. 细胞冻存指导22. 干细胞冷冻和复23. 移植细胞的基因修饰1.间充质干细胞MSC基本形态体外培养细胞根据它们在培养器皿是否能贴附于支持物上生长特征,可分为贴附型生长细胞,常表现为成纤维型细胞和上皮细胞。
悬浮型细胞在培养中悬浮生长。
间充质干细胞MSC基本形态:形态与成纤维细胞类似,细胞在支持物表面呈梭形或不规则三角形生长,细胞中央有卵圆形核,胞质向外伸出2-3 厘米个长短不同的突起。
可看到细胞成螺旋状生长。
2.干细胞应用与干细胞调控干细胞的调控是指给出适当的因子条件,对干细胞的增殖和分化进行调控,使之向指定的方向发展。
2.1源性调控干细胞自身有许多调控因子可对外界信号起反应从而调节其增殖和分化,包括调节细胞不对称分裂的蛋白,控制基因表达的核因子等。
另外,干细胞在终末分化之前所进行的分裂次数也受到细胞调控因子的制约。
(1)胞蛋白对干细胞分裂的调控干细胞分裂可能产生新的干细胞或分化的功能细胞。
这种分化的不对称是由于细胞本身成分的不均等分配和周围环境的作用造成的。
细胞的结构蛋白,特别是细胞骨架成分对细胞的发育非常重要。
如在果蝇卵巢中,调控干细胞不对称分裂的是一种称为收缩体的细胞器,包含有许多调节蛋白,如膜收缩蛋白和细胞周期素A。
收缩体与纺锤体的结合决定了干细胞分裂的部位,从而把维持干细胞性状所必需的成分保留在子代干细胞中。
(2)转录因子的调控在脊椎动物中,转录因子对干细胞分化的调节非常重要。
比如在胚胎干细胞的发生中,转录因子Oct4 是必需的。
Oct4 是一种哺乳动物早期胚胎细胞表达的转录因子,它诱导表达的靶基因产物是FGF-4 等生长因子,能够通过生长因子的旁分泌作用调节干细胞以及周围滋养层的进一步分化。
Oct4 缺失突变的胚胎只能发育到囊胚期,其部细胞不能发育成层细胞团。
另外白血病抑制因子(LIF)对培养的小鼠ES 细胞的自我更新有促进作用,而对人的成体干细胞无作用,说明不同种属间的转录调控是不完全一致的。
又如Tcf/Lef 转录因子家族对上皮干细胞的分化非常重要。
Tcf/Lef 是Wnt 信号通路的中间介质,当与β-Catenin 形成转录复合物后,促使角质细胞转化为多能状态并分化为毛囊。
2.2外源性调控除源性调控外,干细胞的分化还可受到其周围组织及细胞外基质等外源性因素的影响。
(1)分泌因子间质细胞能够分泌许多因子,维持干细胞的增殖,分化和存活。
有两类因子在不同组织甚至不同种属中都发挥重要作用,它们是TGFβ家族和Wnt 信号通路。
比如TGF 家族中至少有两个成员能够调节神经嵴干细胞的分化。
最近研究发现,胶质细胞衍生的神经营养因子(GDNF)不仅能够促进多种神经元的存活和分化,还对精原细胞的再生和分化有决定作用。
GDNF 缺失的小鼠表现为干细胞数量的减少,而GDNF的过度表达导致未分化的精原细胞的累积。
Wnts 的作用机制是通过阻止β-Catenin 分解从而激活Tcf/Lef 介导的转录,促进干细胞的分化。
比如在线虫卵裂球的分裂中,邻近细胞诱导的Wnt 信号通路能够控制纺锤体的起始点和胚层的分化。
(2)膜蛋白介导的细胞间的相互作用有些信号是通过细胞-细胞的直接接触起作用的。
β-Catenin 就是一种介导细胞粘附连接的结构成分。
除此之外,穿膜蛋白Notch及其配体Delta 或Jagged 也对干细胞分化有重要影响。
在果蝇的感觉器官前体细胞,脊椎动物的胚胎及成年组织包括视网膜神经上皮、骨骼肌和血液系统中,Notch 信号都起着非常重要的作用。
当Notch 与其配体结合时,干细胞进行非分化性增殖;当Notch 活性被抑制时,干细胞进入分化程序,发育为功能细胞。
(3)整合素(Integrin)与细胞外基质整合素家族是介导干细胞与细胞外基质粘附的最主要的分子。
整合素与其配体的相互作用为干细胞的非分化增殖提供了适当的微环境。
比如当β1整合素丧失功能时,上皮干细胞逃脱了微环境的制约,分化成角质细胞。
此外细胞外基质通过调节β1整合素的表达和激活,从而影响干细胞的分布和分化方向。
2.3干细胞的可塑性越来越多的证据表明,当成体干细胞被移植入受体中,它们表现出很强的可塑性。
通常情况下,供体的干细胞在受体中分化为与其组织来源一致的细胞。
而在某些情况下干细胞的分化并不遵循这种规律。
1999 年Goodell 等人分离出小鼠的肌肉干细胞,体外培养5 天后,与少量的骨髓间质细胞一起移植入接受致死量辐射的小鼠中,结果发现肌肉干细胞会分化为各种血细胞系。
这种现象被称为干细胞的横向分化(trans-differentiation )。
关于横向分化的调控机制目前还不清楚。
大多数观点认为干细胞的分化与微环境密切相关。
可能的机制是,干细胞进入新的微环境后,对分化信号的反应受到周围正在进行分化的细胞的影响,从而对新的微环境中的调节信号做出反应。
3.间充质干细胞MSC生长过程潜伏期→指数增生期→停滞期(1)潜伏期(latent phase) 细胞接种后,先经过一个在培养液中呈悬浮状态的悬浮期。
此时,细胞质回缩, 胞体呈圆球形,然后细胞贴附于载体表面,称贴壁,悬浮期结束。
细胞贴壁速度与细胞种类, 培养基成分,载体的理化性质等密切相关。
一般情况下,原代培养细胞贴壁速度慢,可达10-24 小时或更多, 而传代细胞系贴壁速度快, 通常10-30分钟即可贴壁。
细胞贴壁后还需经过一个潜伏阶段,才进入生长和增殖期。
原代培养细胞潜伏期长,约24-96 小时或更长, 连续细胞系和肿瘤细胞潜伏期短,仅需6-24 小时。
(2)指数增生期(logarithmic growth phase)这是细胞增殖最旺盛的阶段,分裂相细胞增多。
指数增生期细胞分裂相数量可作为判定细胞生长是否旺盛的一个重要标志。
通常以细胞分裂相指数(Mitotic index, MI )表示,即细胞群中每1000 个细胞中的分裂相数。
一般细胞的分裂指数介于0.1%-0.5% ,原代细胞分裂指数较低,而连续细胞和肿瘤细胞分裂相指数可高达3%-5%。
指数增生期的细胞活力最好时期,是进行各种实验最佳时期,也是冻存细胞的最好时机。
在接种细胞数量适宜情况下,指数增生期持续3-5 天后,随着细胞数量不断增多、生长空间减少,最后细胞相互接触汇合成片。
正常细胞相互接触后能抑制细胞运动,这种现象称接触抑制现象(contact inhibition)。
而恶性肿瘤细胞无接触抑制现象,能继续移动和增殖,导致细胞向三维空间扩展,使细胞发生堆积(piled up)。
细胞接触汇合成片后,虽然发生接触抑制,但只要营养充分,细胞仍能进行增殖分裂,因此细胞数仍然在增多。
但是,当细胞密度进一步增大,培养液中营养成分减少,代产物增多时,细胞因营养枯竭和代产物的影响,导致细胞分裂停止,这种现象称密度抑制现象(Density Inhibition)。
(3)停滞期(Stagnate phase) 细胞数量达到饱和密度后,如不及时进行传代,细胞就会停止增殖,进入停止期。
此时细胞数持平,故也称平台期(Plateau phase)。
停滞期细胞虽不增殖,但仍有代活动。
如不进行分离传代,细胞会因培养液中营养耗尽、代产物积聚、pH 下降等因素中毒,出现形态改变,贴壁细胞会脱落,严重的会发生死亡,因此,应及时传代。
4.间充质干细胞MSC培养的合适气体环境干细胞相关的培养液都必须在5%CO2 的气体环境中培养使用。
否则会对细胞产生影响。
气体是哺乳动物细胞培养生存必需条件之一,所需气体主要有氧气和二氧化碳。
氧气参与三羧酸循环,产生供给细胞生长增殖的能量和合成细胞生长所需用的各种成分。
开放培养时一般把细胞置于95%空气加5%二氧化碳混合气体环境中。
二氧化碳既是细胞代产物也是细胞生长繁殖所需成分,它在细胞培养中的主要作用在于维持培养基的pH 值。
大多数细胞的适宜pH 为7.2-7.4,偏离这一围对细胞培养将产生有害的影响。
一般情况下,细胞耐酸性比耐碱性大一些,在偏酸环境中更利于细胞生长。
5.细胞培养板的选择细胞培养板依底部形状的不同可分为平底和圆底(U 型和V 型);培养孔的孔数有6、12、24、48、96、384、1536 孔等;根据材质的不同有Terasaki 板和普通细胞培养板。
具体选择时根据培养细胞的类型、所需培养体积及不同的实验目的而定。
(1)平底和圆底(U 型和V 型)培养板的区别和选择不同形状的培养板有不同用途。
培养细胞,通常是选用平底的,这样便于镜下观测、有明确的底面积、细胞培养液面高度相对一致。
因此做MTT 等实验时,无论是贴壁和悬浮细胞,一般选用平底板。
测吸光值一定要使用平底的培养板。
要特別注意材质,标示“Tissue Culture (TC) Treated”是养细胞用的。
U 型或V 型板,一般在某些特殊要求時才使用。
如在免疫学方面,当做两种不同淋巴细胞混合培养時,需要二者相互接触刺激,这时一般会选用U 型板,因为细胞会由于重力的作用而聚集在很小的围內。
圆底培养板还会用于同位素掺入的实验,需要用细胞收集仪收集细胞的培养,如“混合淋巴细胞培养”等。
V型板常用做细胞杀伤、免疫学血凝集实验。
细胞杀伤这种实验也可用U 型板替代(加入细胞后,低速离心)。
(2)Terasaki 板和普通细胞培养板的区别Terasaki plate主要是用于晶体学研究,产品设计便于对晶体的观察与结构分析。
有两种sitting 和handing drop 两种方法,两种方法应用产品的外形结构也不同。
材料上选择crystal class polymer ,特殊的材料有利观察晶体结构。
细胞培养板主要是PS 材料,材料是treated sufface,便于细胞贴壁生长与伸展。
当然还有浮游细胞的生长材料,同时还有low binding surface(3)细胞培养板与酶标板的区别酶标板一般要比细胞培养板贵,细胞板主要做细胞培养,也可以用来测蛋白浓度;酶标板包括包被板和反应板,一般不用做细胞培养,它主要做免疫酶联反应后的蛋白检测,需要更高的要求和特定的酶标工作液。
