第六节_α_β-_不饱和醛、酮
第六节_α_β-_不饱和醛、酮.

Nu -
+
C=C C=O
Nu C C=C O -
C=O Nu C C _
H+
Nu C C=C OH
互变异构
Nu C C C=O
H
在酸性条件下加成反应的机制
C C=C OH
C=C C=O
+ H+
+
C=C C OH
+
Z-
C C=C OH Z
互变异构
C C C=O Z
H
共轭加成的立体化学——反型加成
Ph
第六节 α,β- 不饱和醛、酮
一、亲电加成 二、亲核加成 三、插烯反应(羟醛缩合) 四、乙烯酮(自学)
C=C=O CH2=C=O 乙烯酮 不 烯酮 饱 C=C-C=O CH2=CH-C=O 和 α ,β 不饱和醛、酮 醛 C=C与 C=O 组成共轭体系 丙烯醛 H 、 C=C-(CH2)nC=O 酮 孤立不饱和醛、酮 n≥ 1
醌类化合物具有颜色,蒽醌类染料的重要组成部分。
O
OH
OH
O 茜素--1,2二羟基蒽醌(红色) (以糖苷的形式存在于茜草根中)
H+ OH甲基橙
NaO3S-
-N=N黄色
-N(CH3)2
NaO3S-
-NH-N= 红色
=N+(CH3)2
一、醌的化学性质
醌为非芳性的环烯酮,相当于α,β-不饱和酮。
O
◎与NH2OH加成
+
NH2O H
H+
N
OH
互变异构
H
N
பைடு நூலகம்
O
互变异构
NO
O
O 对苯醌单肟
O
不饱和醛与酮

主讲人 钟芳锐 华中科技大学化学与化工学院
主讲内容
• 不饱和醛酮的分类与反应性 • α,β-不饱和醛酮的Michael 加成 • 醌类化合物
不饱和醛酮的分类
* 根据双键和羰基相对位置,醛酮可分为三类:
乙烯酮 ,-不饱和醛(酮 ) 非共轭烯醛(酮)
苯醌
* 乙烯酮羰基碳采取sp杂化,C=C=O呈线型结构,反应活性高; ,-不饱和醛(酮 )的C=C键与C=O处于共轭状态,热稳定性较高; * 非共轭烯醛(酮)分子内C=C键与C=O处于孤立状态,互相影响较小。 * 苯醌是一种特殊的共轭烯酮;
非共轭烯醛转化为 ,-不饱和醛
非共轭烯醛在特定条件下,发生重排反应,形成热力学稳定的共轭烯醛。
乙烯酮的反应
* 与带有活泼氢的化合物H2O、ROH、RCOOH、HX、NH3等加成形成羧酸衍生物; * 与Grignard试剂作用形成酮; * 与亚胺反应形成-内酰胺。
,-不饱和醛、酮
共轭醛酮的共振结构
与有机金属试剂共轭加成的选择性
* C2位阻很大,仅1,2-加成。
,-不饱和醛酮与烷基铜锂的共轭加成
* 有机锂试剂与卤化亚铜复合而成的有机铜锂试剂,一般仅发生1,4-加成。
* 有机铜锂试剂中铜的原子半径较大,烃基的亲核性较弱,被认为是仅发生 1,4-加成的主要影响因素。
Robinson增环(annulation)反应
醌类化合物的特征结构
对苯醌
邻苯醌
1,4-萘醌
蒽醌
* 醌是一类特殊的α,β-不饱和二酮,它们可以由芳香族化合物制备, 但醌环没有芳香族化合物的特性。
醌类化合物的1,2-加成反应
* 对苯醌一肟与对亚硝基 苯酚,已证明是互变异 构体。
α,β-不饱和醛、酮中羰基的选择性还原

α,β-不饱和醛、酮中羰基的选择性还原
王彩兰;王玉炉;王晓阳;李建平;王红
【期刊名称】《合成化学》
【年(卷),期】1998(006)004
【摘要】无
【总页数】7页(P358-364)
【作者】王彩兰;王玉炉;王晓阳;李建平;王红
【作者单位】无
【正文语种】中文
【相关文献】
1.2-(1,3-亚丙二硫)亚甲基-3-羰基丁酸作为硫醇替代试剂在缩硫醛/酮化反应中的应用 [J], 欧阳艳;于海丰;董德文;刘军;王芒;刘群
2.在羰基亲核加成反应活性中醛、酮的结构所起的作用 [J], 陈泽宇
3.NaBH4—BiCl3体系对甾体化合物中α,β—不饱和酮结构的选择性还原 [J], 史建栋;马成禹
4.关于有机化学中醛酮选择性还原教学的建议 [J], 王春艳;王建世;孙忠栋
5.α-羰基烯酮环二硫代缩醛化学(ⅩⅢ)──β,β-1,3-亚丙二硫基-α,β-不饱和酮在镁-甲醇中的还原反应 [J], 刘群;朱再明;胡玉兰;张殊佳
因版权原因,仅展示原文概要,查看原文内容请购买。
第十三章 α,β-不饱和醛酮
N-OH
+ H2N-OH
O O
H2N-OH
N-OH
对苯醌单肟
对苯醌双肟
(2)烯键的加成(卤素、卤化氢等亲电试剂)
O
O Cl
O
+ Cl2
O
Cl2
Cl O
Cl
Cl
Cl O
Cl
(3) 1,4-加成(,-不饱和羰基化合物,亲核加成 )
O
பைடு நூலகம்OH
OH
+ HCl
Cl H
O
Cl OH
O
2、还原反应(易)
第二节 一、醌的结构特点
醌
O
环状不饱和二酮,两个羰基和两个 或两个以上碳碳双键共轭。 但不是芳环类的环闭共轭体系,不 具有芳香性。具有烯烃和羰基化 合物的性质。 二、醌的分类 苯醌、萘醌、蒽醌 三、命名 p319
O O
O
邻苯醌
对苯醌
四、化学性质
1、加成
(1)羰基的加成(羰基试剂、格氏试剂等亲核试剂)
(3) UV 的检测与表示
①检测----分光光度计 ②表示
A
λ
max
图谱: A~λ , ε ~λ , T~λ , log ε ~λ
数据:
λ / nm
λ
CH3OH max
252nm (12300)
二. 常见有机化合物的UV光谱:
1. 饱和有机化合物
σ σ* n σ *
CH3Cl 172 (弱)
CH3OH 183 (150) CH3OCH3 185 (2520)
CH3NH2 215 (600)
2. 不饱和有机化合物
(1) 孤立 C=C , C≡ C, C≡ N
第十三章 不饱和醛酮及取代醛酮

O
例:合成
O
O
O
O
O
O
O
O
O
6. 还原反应
CH3CH CHCHO CH3CH CHCHO
1. LiAlH4 2. H2O
CH2
CH C CH3
CH3CH CHCH 2OH
CH3CH2CH2CHO
19
H2 , Ni 室温
CH3CH CHCHO
O
H2 , Ni 高温
CH3CH2CH2CH2OH
O
例:
O
C6H5CHO +
C
H
O CN CH C CH3
29
例: C6H5CHO + CH2
C6H5
O C
CH2CH2
O C CH3
CN -
例:C6H5CHO
+
CH2 CH C N
O C
C6H5
CH2CH2 C N
CN -
O
C6H5CHO + CH3CH C C OC(CH3)3
CH3
C6H5 O C O
β-碳具有亲电性,容易和亲核试剂发生共轭加成。
碱催化下β,γ-不饱和醛酮的异构化: 酸催化下β,γ-不饱和醛酮的异构化:
5
反应:
O H
CH3 CH CH C
2-丁烯醛 亲电加成:亲电试剂如卤素、次卤酸等,不发
生共轭加成,只是在碳碳双键上发生亲电加成。
1.
C
C
O1
2.
CH CH C 4 3 2
共轭加成 (1, 4-加成)
N(CH3)2
POCl 3
+
H
C N(CH3)2Cl H
有机波谱-习题-第二章:紫外

第二章紫外-可见光谱法一、填空1.紫外-可见光谱统称________。
这类光谱是由分子的________而产生的。
当以一定波长范围的连续光照射样品时,一定波长的光子被吸收,使透射光的强度发生变化,于是产生了以________组成的吸收光谱,以波长为横坐标,________或________为纵坐标即可得到被测化合物的吸收光谱。
2.紫外吸收光谱最大吸收值所对应的波长为________;曲线的谷所对应的波长称为________;峰旁边一个小的曲折称为________;在吸收波长最短一端,吸收相当大但不成峰形的部分为________。
整个吸收光的________、________和________是鉴定化合物的标志。
3.紫外-可见光谱研究的波长范围是________。
紫外-可见光分为三个区域:________的波长范围是10—190nm,________的波长范围是190—400nm,________的波长范围是400—800nm。
一般紫外光谱仪包括紫外光和可见光两部分。
在紫外光谱中,峰最高处的波长记为________。
4.在紫外光谱中,峰的强度遵守________,即A=lg I0/I=εcl。
理论上,该定律只适用于________,而实际上应用的入射光往往有一定的波长宽度,因此要求入射光的波长范围________。
该定律表明,在一定测试条件下,________与溶液________成正比。
5.A=εcl,符号c代表________,单位________,l代表________,单位是________,ε为________。
当c等于________,l等于________,在一定波长下测得的吸光度从数值上就等于________。
6.分子在电子基态和激发态都存在不同的振动能级,通常基态分子多处于________振动能级。
电子跃迁一定伴随能量较小的振动能级和转动能级的跃迁。
一般情况下,激发态键的强度比基态________,所以激发态的平衡核间距比基态的平衡核间距________。
第十二章醛酮不饱和-文档资料

2、共轭醛酮的特殊性质
1)特强的亲和试剂发生1,2-加成 亲核试剂进攻羰基,与饱和共轭醛酮类似。 典型试剂:烃基锂、炔化钠
H3C
O
H3C
Li
CH3
H3C
H3C
OH
CH3
H3C
O HC
CH3
C- Na+
H3C
OH
H3C
C
CH
勤读力耕,立己达人
思考:下列反应得到什么产物
O H3C Li
H3C O
C=C与C=O如果只相差一个CH2,酸、碱催化变成 共轭醛醛酮,E降低。
O
酸催化
H2C
CH3
H3C
O CH3
O
碱催化
H2C
CH3
H3C
O
CH3
勤读力耕,立己达人
碱催化异构机理:通过烯醇盐中间体进行
O
H2C
CH3
H HO-
O-
H2C
CH3
H2C
O
CH-
CH3
H2C-
O CH3
H2O
H3C
O CH3
O
H3C
CH2 O-
H3C
CH3
O
H3C O
H3C
CH3 O-
H2O
H3C O
CH3 Li CH3 H3C
CH3
H3C
H3C O- H3C
SOCl 2 H3C H3C Cl
CH3
Li CH3 H3C
H3C
CH3
H3C
CH3 H3C
勤读力耕,立己达人
第二节 醌 quinone
醌是环状共轭二酮—芳香化合物的衍生物。
不饱和醛酮

2.β-羟基醛酮
易脱水而一般的醇在碱性溶液中是稳定的. 酸催化:通过烯醇脱水 碱催化:通过烯醇盐进行
3. γ-和δ -羟基醛酮
与环状半缩醛形成动态平衡, 既有羟基醛酮的性质,又有环状半缩醛的反应.
CH3CH(OH)CH2COCH3
H2SO4
OH-
CH3CH=CH-COCH3 (比一元醇快)
CH3CH=CHCOCH3
1) RMgX
1,2-加 成 产 物 为 主 不 饱 和 醛 (1,2-加 成 产 物 为 主 )
2)H2O
不 饱 和 酮 甲 基 酮 (1,2-加 成 为 主 )
其 他 酮 (1,4-加 成 为 主 )
例:
KCN ,HOAc
C6H5CH=CHCOC6H5
EtOH
C6H5CH(CN)CH2COC6H5 (93-96%)
反应特点
亲核加成 亲电加成
1,2-加 成 和 1,4-加 成 ( 共 轭 加 成 )
二 反应(Reactions)
通式 C=C C=O + HNu 43 21
1,2-加 成
Nu
C=C CHOH
1,4-加成 [C-C=C-OH]
H
Nu
重排 C-C-C=O 羰基化合物
( 表 现 上 3,4-加 成 )
练习:完成下列转变:
O KOH
+ CH2=CHCOCH3
O
O CH2CH2COCH3
O
O CH2CH2COCH3
NH C6H6
O
分子内缩合
O
+ H2O
O
O
OH-
OH-
or
+
O
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
CH3-CHO + CH3-CH=CH-CHO
OH
-
- H2O /
CH3-CH=CH-CH=CH-CHO
插烯规律
插烯规律:在 H3C-CHO分子的 CH3与CHO
间插入 [CH=CH] n,成为 H3C [CH=CH] n CHO,
反应仍可在共轭体系的两端进行,而共轭体系相
连的两个基团仍保持 [CH=CH] n插入前的关系,
历 程:
+ δ+ H CH =CH-C-H CH2=CH-C-H 2 OH O
Oδ -
+ OH
OH + CH2-CH=C-H + Cl
CH2-CH=C-H Cl
CH2-CH2-C-H Cl
先1,4-加成,生成烯醇重排,相当于1,2-加成。
二. 亲核加成
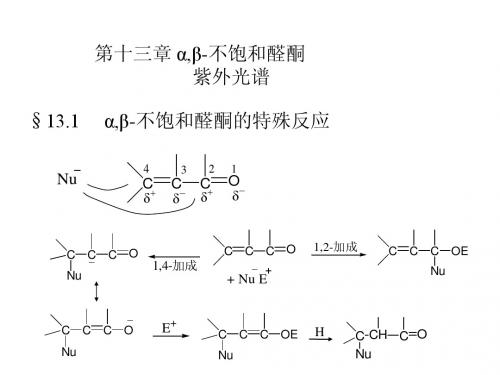
通常情况下,碳碳双键是不会与亲核试剂 加成的。但由于在α,β-不饱和醛、酮中,C=C 与C=O共轭,亲核试剂不仅能加到羰基上, 还能加到碳碳双键上。 以3-丁烯-2-酮与氰化氢的加成为例。
1,2加成 C C C O + Nu 1,4-加成
C C C O Nu C C C O Nu
H
C C C OH Nu C C C OH Nu
H
反应为1,2-加成还是1,4-加成决定于三个方面: 成,强的主要进行1,2-加成。
不稳定(互变) H C C C O Nu
(1)亲核试剂的强弱 弱的亲核试剂主要进行1,4-加
_ 稀OH -H2O
CH3CH=CH-CH=CHCHO
-H2O
CH3CH=CHCH=O +H-CH2CH=CHCHO
稀- OH
CH3CH=CHCH=CHCH=CHCHO
2 CH3-CH=CH-CHO
OH- H2O /
-
CH3-CH=CH-CH=CH-CH=CH-CHO CH2-CH=CH-CHO
OHCH3-CH=CH-CHO - H2O
(3)麦克尔(Michael)反应 活泼亚甲基化合物和 α ,β –不饱和化合物 在碱催化下起1,4-加成。
G C-H B- HB -CN -COG C-
- G = -NO2 G HB
C - + CH2=CH-C
O H OH G
OC -CH2-CH=C H O G C -CH2-CH2=C H
G
C -CH2-CH=C
1) RMgX
2)H2O
,-不饱和醛酮发生加成反应时的选择规律 *1 卤素、HOX不发生共轭加成,只在碳碳双键上 发生1,2-亲电加成。 *2 HX, H2SO4等质子酸以及H2O、ROH在酸催化 下与,-不饱和醛酮的加成为1,4-共轭加成。 *3 HCN、NH3及NH3的衍生物等与,-不饱和醛 酮的加成也以发生1,4-共轭加成为主。 *4 醛与RLi, RMgX反应时以1,2-亲核加成为主。 与R2CuLi反应,以1,4加成为主。 *5 酮与金属有机物加成时,使用RLi,主要得C=O 的1,2-加成产物,使用R2CuLi,主要得1,4-加成产物, 使用RMgX,如有亚铜盐如CuX做催化剂,主要得 1,4-加成产物,如无亚铜盐做催化剂,发生1,2加 成还是1,4-加成,与反应物的空间结构有关,空阻 小的地方易发生反应。
,-不饱和醛酮的加成反应
一般发生1,4-共轭加成,得3,4-产物,H加在-C上。
OH CH2=CH–C–R p-共轭 +
X-
X OH CH2–CH=C–R (烯醇式)
- 1 O CH2=CH–C–R 2 4 3 + - + H–CN 1,4-加成 1,2-加成 CN O H+ CH2–CH–C–R p-共轭
C6H5 OMgBr
(1)
Ph
Ph
(3)
互变异构
COC6H5
H2O
C6H5 O-H
H
O C6H5
(4)
原料应该有一对构象异构体,例如: (1)和(2)。 所以产物应为一对光活异构体,例如: (3)和(4) 。
(2)
2 共轭不饱和醛酮的还原
情况一:只与C=O发生反应,不与C=C发生反应。
麦尔外因-彭杜尔夫还原 克莱门森还原 乌尔夫-凯惜纳-黄鸣龙还原 缩硫醇氢解
醌类化合物具有颜色,蒽醌类染料的重要组成部分。
O
OH OH
O 茜素--1,2二羟基蒽醌(红色) (以糖苷的形式存在于茜草根中)
H+ OHNaO3S-
NaO3S-
-N=N黄色
-N(CH 3)2
-NH-N= 红色
=N+(CH 3)2
甲基橙
一、醌的化学性质
醌为非芳性的环烯酮,相当于α,β-不饱和酮。
O
Br O Br Br O
Br2
Br O O
Br2
Br
(2)发生(Diels-Alder)反应 O
CH2
O
+
CH2
O
O + O O O
O
O
O
3、羰基与双键共同参与的反应——共轭加成
CH2=C O
CH2=C
O
CH2-C=O
CH2=C OH
二乙烯酮
CH3-C =O CH2-C=O Y O O
CH2-C=O
+ H-Y
CH2-C=O Y
H-OH
CH3-C- CH2-C- OH 丁酮酸 O O CH3-C- CH2-C- OR 丁酮酸酯
H-OR
O CH2=C O + AlCl3
OH
O
第六节 α,β- 不饱和醛、酮
一、亲电加成 二、亲核加成 三、插烯反应(羟醛缩合) 四、乙烯酮(自学)
C=C=O CH2=C=O 乙烯酮 不 烯酮 饱 C=C-C=O CH2=CH-C=O 和 α ,β 不饱和醛、酮 醛 C=C与 C=O 组成共轭体系 丙烯醛 H 、 C=C-(CH2)nC=O 酮 孤立不饱和醛、酮 n≥ 1
◎与NH2OH加成
+
H+
N
OH
互变异构
H
N
O
互变异构
NO
NH 2OH O 对苯醌单肟 O OH 对亚硝基苯酚
O
O
N-OH
N-OH
H2N-OH
O
O
H2N-OH
N-OH
(2)羰基的还原
O
H O
OH
OH
O
O
OH 氧化还原偶对
OH
O 氢醌 暗绿色
醌用作氧化脱氢剂
2、C=C双键的反应
(1)与溴加成 O
Br O
(2)反应温度 低温进行1,2-加成,高温进行1,4加成。
(3)立体效应 羰基所连的基团大或试剂体积较大时, 有利于1,4加成。
1.亲核试剂主要进攻空间位阻小的地方;
O (H5C2)2C CH CH Nu: CH2 O C C CH2CH3 CH3
所以,醛基比酮 基更容易被进攻。
2. 强碱性亲核试剂(如RMgX、LiAlH4)主要进 攻羰基(1,2-加成) 。
O
C-CH2-C=CH2
C-CH 2-C-CH 3
CH2-C=O
傅-克酰基化反应
(3)与格氏试剂反应 (羰基性质)
O CH2=C=O + RMgX H2O CH2=C-O H R CH3-C-R 甲基酮
(4)与卤素加成(碳碳双键性质)
CH2=C=O + X-X
CH 2-C=O X X
3、制 备
(1) 热 解 CH3COCH3 CH3COOH
X H O H–X CH2–CH–C–R CN H O CH2–CH–C–R
烯醇式重排
CN OH CH2–CH=C–R(烯醇式)
影响,-不饱和醛酮1,2-和1,4-亲核加成的因素
——羰基端基团、烯基端基团、试剂的体积
–R 1,4-(%)
H 0
Me 60
Et 71
i-Pr 100
t-Bu 100
CH2=C=O 乙酰基化试剂 O CH3–C–OH 乙酸 O CH3–C–Cl 乙酰氯 O CH3–C–OOCCH3 乙酐 O CH3–C–OC2H5 乙酸乙酯 O CH3–C–NH2 乙酰胺 O CH3–C–R 甲基酮
第七节 醌类化合物
在醌型结构中存在-共轭体系,但不是闭 合的共轭体系,因此,醌没有芳香性,它是 一种特殊的不饱和二酮。一般情况下,邻苯 醌为红色,对苯醌为黄色。
即乙醛的CH3与CHO相互关系仍然存在,甲基上
的氢仍然活泼,称为“插烯规律”。
从结构上对比:
+ H C CH O H H + - + H C CH CH CH O H H
实际上,共轭效应沿链传递不减弱
5.Diels-Alder反应
,不饱和醛酮是很好的亲二烯体
+
CHO
CHO
四、乙烯酮(自学)
O
OH
O
CH2 CH-C-CH 3 + CN
- HCN
CH2 CH-C-CH 3 + CH2-CH 2-C-CH 3 CN CN
羰基上的亲 核加成产物 OH
CH2-CH C-CH 3 CN
O
CH2 CH-C-CH 3
HCN 1,4-加成
1,4-加成的历程, 碳碳双键上的加成产物 O CH2-CH 2-C-CH 3 烯醇式重排 CN
H O B-
O G C -CH2-CH2=C H
G
C-H + CH2=CH-C
H
O CH3 + CH2=CH-C O O BCH3 O O CH3 B
