αβ不饱和醛酮
第9章羰基化合物

第9章 羰基化合物大体要求:1. 把握醛和酮的命名(系统命名法,一般命名法)2. 把握醛和酮的结构及对化学性质的阻碍。
3. 了解醛和酮的物理性质和光谱特点。
4. 把握亲核加成的反映类型、机理、应用。
5. α—H 的酸性,α—H 的卤代反映及缩合反映(羟醛缩合)6. 氧化、还原反映及其在有机合成中的应用。
7. α,β—不饱和醛、酮的反映特点。
醛(aldehydes )和酮(ketones )都是分子中含有羰基(碳氧双键)的化合物,因此又统称为羰基化合物。
羰基与一个烃基相连的化合物称为醛,与两个烃基相连的称为酮。
CO R'C RO HC R(H)O羰基 醛 酮醛能够简写为RCHO ,基团—CHO 为醛的官能团,称为醛基,酮能够简写为RCOR ’, 基团—CO —为酮的官能团,称为酮基。
醛和酮是一类超级重要的化合物,这不仅是因为学多化学产品和药物含有醛、酮结构,更重要的是醛、酮能发生许多化学反映,是进行有机合成的重要原料和中间体。
醌(quinone )类是一类特殊的环状不饱和二酮类化合物。
第一节 醛和酮一、羰基的结构羰基是醛、酮的官能团,它与醛、酮的物理化学性质紧密相关。
依照醛、酮分子的结构参数(见表10-1),能够以为羰基碳原子以sp 2杂化状态参与成键,即碳原子以三个sp 2轨道与其它三个原子的轨道重叠形成三个σ键,碳原子上未参加杂化的p 轨道与氧原子上的p 轨道在侧面彼此重叠形成一个π键(见图10-1)。
(请在图左侧第一幅图中,下半个轨道中着淡灰色,如中间那幅图轨道的颜色)表10-1 醛、酮分子的结构参数醛、酮分子 键长(pm ) 键角(0) HCHO C — ∠ ∠ CH 3CHOC — C —∠ ∠ ∠ CH 3COCH 3 C =O 121.4 C —∠ ∠δ-+图10-1 羰基的结构由于氧原子的电负性比碳原子大,因此成键处的电子云就不均匀地散布在碳氧原子之间,氧原子处电子云密度较高,带有部份负电荷,而碳原子处的电子云密度较低,带有部份正电荷。
第六节 α,β- 不饱和醛、酮

C H 3 -C H = C H -C H = C H -C H = C H -C H O C H 2 -C H = C H -C H O
-
- H 2O
OH CH 3 -CHO + C H 3 -C H = C H -C H O
- H 2O /
CH 3 -CH=CH-CH=CH-CHO
插烯规律
插烯规律:在 H3C-CHO分子的 CH3与CHO
H
HB
O G C - C H 2 -C H 2 = C H
G
C - C H 2 -C H = C
H
O G C-H + C H 2 = C H -C H
B
-
O G C - C H 2 -C H 2 = C H
O CH 3 + C H 2 = C H -C O O B
-
O O CH 3 B
-
CH 3 O CH 2 -CH 2 -C O CH 3
间插入 [CH=CH] n,成为 H3C [CH=CH] n CHO,
反应仍可在共轭体系的两端进行,而共轭体系相
连的两个基团仍保持 [CH=CH] n插入前的关系,
即乙醛的CH3与CHO相互关系仍然存在,甲基上
的氢仍然活泼,称为“插烯规律”。
从结构上对比:
H H C H + CH O H H C H + CH CH + CH O
_ 稀 OH
-H 2 O
CH 3 CH=CH-CH=CHCHO
-H 2 O
CH 3 CH=CHCH=O
+ H-CH 2 CH=CHCHO
稀 OH
CH 3 CH=CHCH=CHCH=CHCHO
第六节_α_β-_不饱和醛、酮.

Nu -
+
C=C C=O
Nu C C=C O -
C=O Nu C C _
H+
Nu C C=C OH
互变异构
Nu C C C=O
H
在酸性条件下加成反应的机制
C C=C OH
C=C C=O
+ H+
+
C=C C OH
+
Z-
C C=C OH Z
互变异构
C C C=O Z
H
共轭加成的立体化学——反型加成
Ph
第六节 α,β- 不饱和醛、酮
一、亲电加成 二、亲核加成 三、插烯反应(羟醛缩合) 四、乙烯酮(自学)
C=C=O CH2=C=O 乙烯酮 不 烯酮 饱 C=C-C=O CH2=CH-C=O 和 α ,β 不饱和醛、酮 醛 C=C与 C=O 组成共轭体系 丙烯醛 H 、 C=C-(CH2)nC=O 酮 孤立不饱和醛、酮 n≥ 1
醌类化合物具有颜色,蒽醌类染料的重要组成部分。
O
OH
OH
O 茜素--1,2二羟基蒽醌(红色) (以糖苷的形式存在于茜草根中)
H+ OH甲基橙
NaO3S-
-N=N黄色
-N(CH3)2
NaO3S-
-NH-N= 红色
=N+(CH3)2
一、醌的化学性质
醌为非芳性的环烯酮,相当于α,β-不饱和酮。
O
◎与NH2OH加成
+
NH2O H
H+
N
OH
互变异构
H
N
பைடு நூலகம்
O
互变异构
NO
O
O 对苯醌单肟
O
有机化学第十一章 醛酮

NaCl + SO2↑ + H2O
Na2CO3 NaHCO3 + Na2SO3
(C)转化成α-羟基腈 α-羟基磺酸钠与NaCN作用,其磺酸基则被氰基取代生成α-
羟基腈。如:
CHO NaHSO3
OH C
Na C N
SO3Na
OH C
CN
HCl H2O
OH C
COOH
优点:可以避免使用易挥发、有毒的HCN,且产率较高。
O
O
CH3-C-CH2-C-CH3
2,4 戊二酮
H3C O
3 甲基环戊酮
练习
命名下列化合物。
O CH3 CH3CCH2C=CH2
4-甲基-4-戊烯-2-酮
CH3CHCH2CHO OH
3-羟基丁醛
O CH3CHCH2CCH3
Cl
4-氯-2-戊酮
O CCH3
CHO
CHO
苯乙酮
CH2CHO
苯甲醛
CH3
3-甲基苯甲醛
= = R
++ δ
δ
R δ+ δ
CO >
CO
H
R
羰基碳原子连有基团的体积↑,空间位阻↑,不利于亲核试剂
进攻,达到过渡状态所需活化能↑,故反应活性相对↓。
综上所述,下列醛、酮进行亲核加成的相对活性为:
Cl3C C=O
H
> C=O
> CH3 C=O
R
> C=O
Ar
> C=O
>
H
H
H
H
H
= CH3 C O >
α -二醛或酮:两个羰基直接相连。 β -二醛或酮:两个羰基间隔一个碳原子。
各类化合物的紫外吸收光谱

此外,由于引入含有n电子的N原子的,这类杂环化合物还可 能产生n*吸收带。
24
苯 、萘、蒽、并四苯的吸收光谱
25
直接分析烷烃和卤代烃的紫外吸收光谱,实用价值不大,
但是它们是测定紫外(或)可见吸收光谱的良好溶剂。
1
1.3.2 简单的不饱和化合物
1、烯烃、炔烃化合物
在不饱和烃类分子中,除含有键外,还含有键,它们 可以产生*和*两种跃迁。 例如,在乙烯分子中, *跃迁最大吸收波长为180nm。
22
在气态或非极性溶剂中,
苯及其许多同系物的B谱带有
许多的精细结构,这是由于
当苯环上有取代基时,
振动跃迁在基态电子上的跃 迁上的叠加而引起的。
在极性溶剂中,这些精 细结构消失。
苯的三个特征谱带都会发生 显著的变化,其中影响较大 的是E2带和B带。
23
稠环芳烃及杂环化合物
稠环芳烃,如萘、蒽、芘等,均显示苯的三个吸收带,但是 与苯本身相比较,这三个吸收带均发生红移,且强度增加。随 着苯环数目的增多,吸收波长红移越多,吸收强度也相应增加。
0nm +6nm
10
例3
1 2
3 4
胆甾-3,5-二烯
max=214nm(基数) +3×5nm(烷基取代) +5nm(环外双键)
=234nm 观察值max=235nm
11
例4
1
CH3COO 2
34
56
该化合物在1,4,6位上有三个烷基取代;3, 4位上的双键是环外双键;2位上是酰基取代。
max=254nm(基数)+30(延长一个共轭双键) +3×5nm(烷基取代或环的剩余部分) +5nm(环外双键)
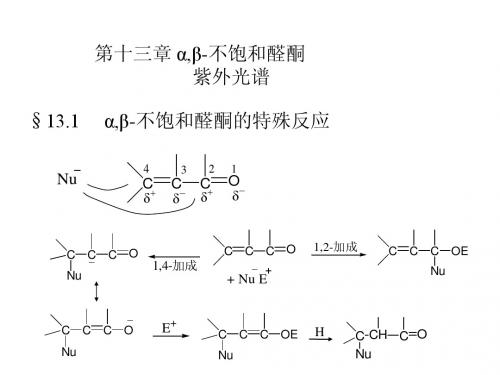
第十三章 α,β-不饱和醛酮
N-OH
+ H2N-OH
O O
H2N-OH
N-OH
对苯醌单肟
对苯醌双肟
(2)烯键的加成(卤素、卤化氢等亲电试剂)
O
O Cl
O
+ Cl2
O
Cl2
Cl O
Cl
Cl
Cl O
Cl
(3) 1,4-加成(,-不饱和羰基化合物,亲核加成 )
O
பைடு நூலகம்OH
OH
+ HCl
Cl H
O
Cl OH
O
2、还原反应(易)
第二节 一、醌的结构特点
醌
O
环状不饱和二酮,两个羰基和两个 或两个以上碳碳双键共轭。 但不是芳环类的环闭共轭体系,不 具有芳香性。具有烯烃和羰基化 合物的性质。 二、醌的分类 苯醌、萘醌、蒽醌 三、命名 p319
O O
O
邻苯醌
对苯醌
四、化学性质
1、加成
(1)羰基的加成(羰基试剂、格氏试剂等亲核试剂)
(3) UV 的检测与表示
①检测----分光光度计 ②表示
A
λ
max
图谱: A~λ , ε ~λ , T~λ , log ε ~λ
数据:
λ / nm
λ
CH3OH max
252nm (12300)
二. 常见有机化合物的UV光谱:
1. 饱和有机化合物
σ σ* n σ *
CH3Cl 172 (弱)
CH3OH 183 (150) CH3OCH3 185 (2520)
CH3NH2 215 (600)
2. 不饱和有机化合物
(1) 孤立 C=C , C≡ C, C≡ N
醛酮反应机理二
醛酮反应机理二(附答案)1.酸性条件下手性醛酮的消旋化RR 12CRR 1HR 2*H+(±)or (+)(-)2. 酸催化卤代碱催化卤代X,X = Cl, Br, I3.卤仿反应机理(碱催化卤代)3C C X 3CRC H X 3CR+OHX = Cl, Br, I4.羟醛缩合机理羟醛缩合产物的分解机理(羟醛缩合的逆反应)5.酸催化下的羟醛缩合机理:CH3CH3O2H3H3CH CH3+2Al[O(CH3)3]3OOOHOClHCl(Lewis 酸催化)6.Mannich反应(胺甲基化反应)CH 2R'+CH2O H+CHR'2NH1酸催化过氧酸氧化 —— 生成酯 ( Baeyer-Villiger 反应)(“O ”如何插入C -C 键)“O ”插入取代基多的基团一边(取代基多的基团易迁移)R 1R2R 1R 2R 122.Wolff-Kishner 还原酮羰基至亚甲基机理RR'O RCH 2R'NH -NH , Na N 2+3. Meerwein-Ponndorf 还原反应(i-PrO)AlCH 3CHOHCH 3(过量)O R'(H)ROH R'(H)4.醛酮被金属还原至醇或二醇Na or LiRR'(H)RC OH R'RC OH R'RR'O2Mg (Hg)5.Cannizzaro 反应(歧化反应)R浓 OHR RCH 2OH+H +R COOH+RCHPhHOO OHPhC O7. Benzoin 缩合反应(安息香缩合反应)8.Wittig 反应:Ph 32+R 2+Ph 32不饱和醛、酮,1. α, β-不饱和醛酮与亲核试剂的亲核加成反应。
1, 2 – 加成为主(Nu - : 强亲核试剂,如 RLi, 炔基钠, LiAlH4等)1β2. 与亲核试剂的1, 4 – 加成机理α, β-不饱和醛酮与亲电试剂的亲电加成反应 3.α, β-不饱和醛酮的羟醛缩合(插烯规则) 4.Michael加成COCC+碱4. Diels-Alder 反应+例 1:写出下列合成的路线1酸性条件下手性醛酮的消旋化RR 12CRR 1R 2*H+(±)or (+)(-)CO RR 1R R 2H H RR 1C RR 2R 1C R 1R2*2+H 3(±)H H2.酸催化卤代O+CXC烯醇化C HH 2O X+H X碱催化卤代X ,X = Cl, Br, IX = Cl, Br, ICHCXOH3.卤仿反应机理(碱催化卤代)3C C X3CR C H X3CR+OH23R3COHC H X3+2RXCHXX3HOR CHRXX4.羟醛缩合机理羟醛缩合产物的分解机理(羟醛缩合的逆反应)CCHH CHOHCOHO5.酸催化下的羟醛缩合机理:CH3O2H 3H 3CHCH 3+23)3]3O OHHCl(Lewis 酸催化)C HH+CHH +烯醇化H 2OCOH HCHHOH 2OH 2O++H +3O8. Mannich 反应(胺甲基化反应)CH 2+CH 2OR"NR"H+CH R'CH 2NR"HRCHR'H RRHC HHCR"NR"HH2CO HNH2NH2R"NR"OHR CHOHR"NR"CHR"NR"R'1酸催化过氧酸氧化——生成酯(Baeyer-Villiger反应)(“O”如何插入C-C键)“O”插入取代基多的基团一边(取代基多的基团易迁移)R1R2R1O R2R1O R2R1R2RCO O H+R1R2HH OR1C R2O HO+ OR1C R2O HOδ+~ R1OR C R2O HOH++OHR1O R2H+R1O R2(来自过氧酸)R迁移2.Wolff-Kishner 还原酮羰基至亚甲基机理R R'OR CH2R'NH-NH, Na~ 200CN2+R R'ONH2-NH2R C R'ONH-NH2R C R'OHN-NH2HOHRCR'HOH RCR'R CH2R' RCHR'N N HOHRCHR'225.Meerwein-Ponndorf 还原反应(i-PrO)AlCH 3CHOHCH3(过量)OR'(H)ROHR'(H)AlOOCHδRCOCH3C CH3+OH+AlO3)2 3333334.醛酮被金属还原至醇或二醇Na or LiR R'(H)R R'(H)e CO NaCORHR'eHO Na HRC OH RC OH RCR'O2Mg (Hg)自由基二聚RC O RC ORC OH RC OH PinacolH ORR'2eMg RC ORC O6. Cannizzaro 反应(歧化反应)RC OROHOHR +~ H ROO +HRC OH负H 迁移练习R浓 OHR RCH 2OH+H +R COOH+RCHPhHOO OHPhC O9. Benzoin 缩合反应(安息香缩合反应)8.Wittig 反应:Ph 32+R 2+Ph 3Ph 3P2R 2+Ph 3Ph 3C C O RPh 3C C R制备烯烃232OH或CH2Ph3P+3+或PPh3CH3I+PPh3+2CH3I(1) PPh32Ph323不饱和醛、酮共振式,OOE ENu Nu2.α, β-不饱和醛酮与亲核试剂的亲核加成反应。
第十二章醛酮不饱和-文档资料
2、共轭醛酮的特殊性质
1)特强的亲和试剂发生1,2-加成 亲核试剂进攻羰基,与饱和共轭醛酮类似。 典型试剂:烃基锂、炔化钠
H3C
O
H3C
Li
CH3
H3C
H3C
OH
CH3
H3C
O HC
CH3
C- Na+
H3C
OH
H3C
C
CH
勤读力耕,立己达人
思考:下列反应得到什么产物
O H3C Li
H3C O
C=C与C=O如果只相差一个CH2,酸、碱催化变成 共轭醛醛酮,E降低。
O
酸催化
H2C
CH3
H3C
O CH3
O
碱催化
H2C
CH3
H3C
O
CH3
勤读力耕,立己达人
碱催化异构机理:通过烯醇盐中间体进行
O
H2C
CH3
H HO-
O-
H2C
CH3
H2C
O
CH-
CH3
H2C-
O CH3
H2O
H3C
O CH3
O
H3C
CH2 O-
H3C
CH3
O
H3C O
H3C
CH3 O-
H2O
H3C O
CH3 Li CH3 H3C
CH3
H3C
H3C O- H3C
SOCl 2 H3C H3C Cl
CH3
Li CH3 H3C
H3C
CH3
H3C
CH3 H3C
勤读力耕,立己达人
第二节 醌 quinone
醌是环状共轭二酮—芳香化合物的衍生物。
第十二章 醛酮(不饱和)
4-nitrosophenol
勤力读耕,立己达人
3)1,4-加成反应
共轭酮与HCN、 HX、 MeOH/ZnCl2发生1,4-加成, 中间体重排取代二酚,一般反应式如下:
HO HX O O OH X HO X
O
O
X=卤素、CN、甲氧基(氯化锌催化)。
HO HCl O OH Cl HO Cl
-
H3C O H3C
CH3
H3C Mg Cl Ag
+
-
H3C Cl Mg O H3C
CH3 CH3
H5C2 O C2H5 CH3
+
H3O
+
H3C H3C CH3 O
勤力读耕,立己达人
合成化合物D
H3C CH3 O
H3C O H2O
CH3
KH
H3C O
-
CH2
H3C O H3C
CH3 O
-
H3C O H3C
C=C与C=O如果只相差一个CH2,酸、碱催化变成 共轭醛醛酮,E降低。
O H2C CH3
酸催化
H3C
O CH3
O H2C CH3
碱催化
H3C
O CH3
勤力读耕,立己达人
碱催化异构机理:通过烯醇盐中间体进行
O H2C CH3 CH
-
O H2C CH3
H HO
-
O H2C
O CH3 H2C
-
CH3
*Fries重排
苯酚在=与酰氯发生反应时先生成酚酯:
O HO
+
Cl
R
ACl 3
R
O
有机化学:第十章 醛 酮(1)
(2) O
O
C OC2H5
H+
O
HOCH2CH2OH
O
O C OC2H5
LiAlH4 (C2H5)2O
O
O
CH2OH H+, H2O
O
CH2OH + HOCH2CH2OH
上海交通大学化学化工学院
(3) 维尼纶:聚乙烯醇含有多个亲水基团,为了提高其耐水性能,可用 甲醛使其部分缩醛化,得到性能优良的合成纤维——维尼纶。
(Ph)3P
- R1 C
R2
上海交通大学化学化工学院
G.Wittg于1953年开始系统研究了它与醛酮的反应,并应用在合 成上。建立了独特的结构和合成方法。
R1 C O + Ph3P C
R2
Ph3P + C
O- C
(Ph)3PO +
R1 CC
R2
缩醛对氧化剂、还原剂、碱稳定,对酸不稳定。
上海交通大学化学化工学院
应用:保护羰基。
(1) CH2 CHCHO
CH2 CH CHO OH OH
2C2H5OH
CH2 CHCH
OC2H5
[O]
OC2H5 H2O
H+, H2O
CH2 CH OH OH
OC2H5 OC2H5
SJTU
第十章 醛 酮
上海交通大学化学化工学院
(一)结构和命名:
1. 结构:
通式:CnH2nO ,醛、酮互为同分异构体。
官能团:
O
O
C H 醛基
C
羰基
碳原子采用sp2 杂化,三个σ键共 平面,羰基碳原子和氧原子上的p轨道 在侧面重叠生成π键 ,氧原子上还有 两对未共用电子。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
O
??
CCC HH
一,α, β-不饱和醛酮的结构与特 性
1. 定义:碳碳双键位于α,β-碳原子间的不饱和醛酮
CH3CH=CH CH=O
O
CH3CH=CHCCH3
2-丁烯醛
O
CH3CCH=CHC 6H5
3-戊烯-2-酮
O
4-苯基-3-丁烯-2-酮
甲基-2-环己烯-1-酮
2.特性:体系稳定 C=C与 C=O 组成共轭 体系
Unsaturated Aldehydes and Ketones
1. α, β-不饱和醛酮的结构与特性 2. 亲电加成 Nucleophilic addition 3. 亲核加成 Electrophilic addition 4. 迈克尔反应 Michael reaction 5. 还原反应 Reduction reaction 6. Diels-Alder 反应 7. 插烯作用
O
OH -
OH -
or
+
O
O
OO
O
O
5.还原反应 Reduction reaction
(1)只 还原C=O 用LiAlH4 或 NaBH4
O LiAlH4 H2O
H OH
Et 2O
(97%)
(2)只还原C=C 用 H2/Pd-C
O H2/Pd-C
or 1)Li,NH3(l),-33℃
2) H3O+ (3) C=C和C=O 同时还原
如 CH2=CHCH2CH=O 3-丁烯醛
OH- CH3CH=CHCH=O
H+ CH3CH=CHCH=O 2-丁烯醛
3.制备:主要由羟醛缩合反应制备
C6H5CHO + CH3COC6H5 OH- C6H5CH=CHCOC6H5
HCHO + CH3COCH3 OH-
O
OH-
2CH3CHO
CHO
二,α, β-不饱和醛酮的化学性质
C2H5
1, 2–加成 40%
O
C6H5CH CH2 C CH3
C2H5
1, 4–加成 60%
O
C6H5CH CH C CH3
C6H5MgX
1. E2tO 2.H2O
C6H5CH
OH
O
CH C + CH3 C6H5CH CH2 C C6H5
C6H5
C6H5
1, 2–加成 88%
1, 4–加成 12%
(1)与HCN,氨和氨的衍生物,H2SO4,
RNH2等质子酸,H2O,ROH在酸催化下的1,
4–加成反应
O
O
R CH CH C H(R,) HCN RCH CH C H(R,)
HCN
CN H
O—H
RCH CH C H(R,)
CN
பைடு நூலகம்
O
例:R CH CH C H(R,) HX
O
RCH CH C H(R,)
CH3CH2CH2CH=C(Et)CHO
O
(95%)
H2,Ni or Pt
CH3(CH2)3CH(Et)CH2OH
O
Zn/HCOONH4/C2H5OH/H2O 饱和酮
R1
查耳酮类 R2
rt 30min
6.Diels-Alder 反应
? ,?? 不饱和醛酮是很好的亲二烯体
CHO
+
CHO
7.插烯作用
1. OH -
HCN
1,4- 加成产物为主
NH
1,4- 加成产物为主
C=C-C=O
1) R 2CuLi 2)H 2O
1,4- 加成产物为主
1) RMgX,CuCl 2)H 3O+ 1) RLi 2) H 2O
1) RMgX
2)H 2O
1,4- 加成产物为主
1,2- 加成产物为主 不饱和醛 (1,2- 加成产物为主 ) 不饱和酮 甲基酮 (1,2- 加成为主 ) 其他酮 (1,4- 加成为主 )
CH3
CH3
90%
3%
存在微量Cu +
1%
95%
4.迈克尔反应 Michael reaction
1.定义:烯醇负离子与α ,β -不饱和羰基化合物在碱性催化剂作用下1, 4-加成。
2.给体:能提供烯醇负离子的化合物: O
O
CH3NO2 CH3C N
CH3C CH2 C OC2H5
3.受体:α ,β -不饱和羰基化合物共轭体系
5.如果的羰基和一个很大的基团如三级丁基相连, 无论哪一种格式试剂都得到 1,4-加成产物
6.为得到1,4-加成产物,有一种常用方法是加入 0.05mol的卤化亚铜或者用二烃基铜锂进行反应
CH3CH
CH
O
C
CH3
CH3MgBr Et2O
H3O+
CH3CH 无Cu +
OH
O
+ CH C CH3
CH3CH CH2 C CH3
+ CH3CHO CH3CHO 2. △ CH3CH CHCHO
CH3CHO CH3CH CH CH CHCHO
在共轭体系中电子的流动性较大,羰基的电子效应可通过共轭体系系传递到碳上 插烯规则:在A-B化合物的A和B之间,插入一个或多个-CH=CH-,生成A(CH=CH)-nB型化合物后,原来A和B之间的相互影响仍然存在的规律
2.亲电加成 electrophilic addition 反应速率比单烯烃及共轭二烯烃慢 ,为什么?
?? ?? CH3CH=CHCOCH3
HCl(g)
CH3CH(Cl)CH2COCH3
Br2 CCl4
CH3CH(Br)CH(Br)COCH3
3.亲核加成 Nucleophilic addition
生1,4-共轭加成,形成加成物从溶剂中夺取一个质子形成烯醇,在互 变异构形成最终产物。
7.用途:用于合成环状化合物,通常用迈克尔反应和羟醛缩合一起合成环
状化合物
O
KOH
+ CH2=CHCOCH 3
O CH 2CH2COCH 3
O
O
O CH2CH 2COCH 3
NH C6H6
O
分子内缩合
O
+ H2O
O
O
O
R CH CH C R R CH CH C OR CH2 CH C N
4.碱性催化剂:三乙胺,六氢吡啶,氢氧化钾,乙醇钠,氨基钠
5.该反应可逆,升温对你反应有利
O
CH3
O
+CH2 CH C CH3
O
O
CH3
O
CH2 CH2 C CH3 KOH
KOH
O
O
O
6.反应机理: 碱夺取碳上的活泼氢,生成一个碳负离子,然后碳负离子与受体发
XH
R CH R CH R CH
O CH C
O CH C
O CH C
H(R,) H2NOH
O
RCH CH2 C H(R,)
H(R,) NaHSO3
NHOH
O
RCH CH2 C H(R,)
SO3Na
H(R,)
NH
O
RCH CH2 C H(R,)
N
+ (C2H5)3Al HCN
O
O
CN
85%
(2)和金属有机化合物反应
1.R2CuLi, RMgX,RLi
2.1,4-加成和1,2-加成均有,取决于羰基旁边的基团大 小,也与试剂的空间位阻有关
3.醛羰基旁边的空间位阻很小,因此与烃基锂,格 氏试剂时主要以 1,2-加成为主
4.与格氏试剂反应要做具体分析
1. C2H5MgBr 2. H3O+
C6H5CH
OH
+ CH C CH3
