晶体结合能的普遍规律 离子晶体-山东大学固体物理
合集下载
固体物理:第二章 晶体的结合

晶体为什么形成这么有序的结构?
7
原子结合成晶体时,原子的外层电子要作重新
分布
不同分布产生了不同类型的结合
力
不同类型的结合力,导致了晶体结合
的不同类型。
+ = 原子
原子核+ 芯电子(稳定、满壳层)
价电子
原子外层的芯电子层对相互作用贡献不大,价电子的
相互作用
决定了原子间的相互作用后的性质。
同一种原子,不同的结合类型中具有不同的电子云分布,因此呈现出
10
我们讲到:
原子外层的芯电子层对相互作用贡献不大,价电子相互
作用
决定了原子间相互作用的性质。
原来中性的原子能够结合成晶体,除了外界的压力和温度 等条件的作用外,主要取决于原子最外层电子的作用。没 有一种晶体结合类型,不是与原子的电性有关的。
下面我们来系统学习一下:18
各壳层容纳的电子数
19
能量最低原理 “电子优先占据最低能态”
20
21
22
原子捕获电子的能力(电性)
一、电离能
定义:使原子失去一个电子所需要的能量称为原子的电离能。 从原子中移去第一个电子所需要的能量为第一电离能,从正1 价离子中再移去一个电子所需要的能量为第二电离能。
Na + 5.14 eV Na+ + e
23
电离能的大小可以用来度量原子对价电子的束缚强弱。 电离能越大,越难失去电子;电离能越小,越易失去电 子,金属性越强。 在一个周期内,从左到右,电离能不断增加。
24
二、电子亲和能
定义:一个中性原子获得一个电子成为负离子所释放出的能 量称为电子亲和能,亲和过程不能看成是电离过程的逆过程。 电子亲和能越大,那么得到电子的能力越大。 电子亲和能一般随原子半径的减小而增大。因为原子半径小, 核电荷对电子的吸引力较强,对应较大的互作用势。
固体物理 第二章 结合能

在两原子间的自旋反向电子对似乎产生吸引力,使两 原 子 键 和 , 从 而 能 量 降 低 , 称 为 成 键 态 ( bonding state)。 能量较高的-态则称反键态(antibonding state),电 子处在-态时,能量高于自由原子情形,不利于原子 间的键和。
固体物理第二章 23
固体物理第二章
17
固体物理第二章
18
3
典型的共价键是氢分子的共价键,两个氢原子 的价电子,围绕着两个氢原子核运动,形成 电子云。在两个氢核之间,为两个氢核所共 有。实际上,共价键的现代理论正是由氢分 子的量子理论开始的。 设想有原子A 和 B ,它们表示互为近邻的一对 原子。当它们是自由原子时,各有一个价电 子,归一化的波函数分别用 A 、 B 表示,即:
这一四体问题迄今还不能严格求解,需作近 似处理,常用的比较成功的做法是分子轨道 法 (Molecular Orbital Method) 。忽略电子 - 电 子间相互作用,且假定 : (r1 , r2 ) 1 (r ) 2 (r )
固体物理第二章 20
2 2 2 2 1 2 VA1 VA 2 VB1 VB 2 V12 2m 2m
* H dr
* H aa * A H A dr B H B dr 0
* H ab * A H B dr B H A dr 0
* dr
2 2C ( H aa H ab )
+态波函数是对称的,可填充两个自旋相反的电子, +态的能量亦低于自由氢原子1s态的能量。较多出现
固体物理第二章 3
2-1 结合力的普遍性质与结合能
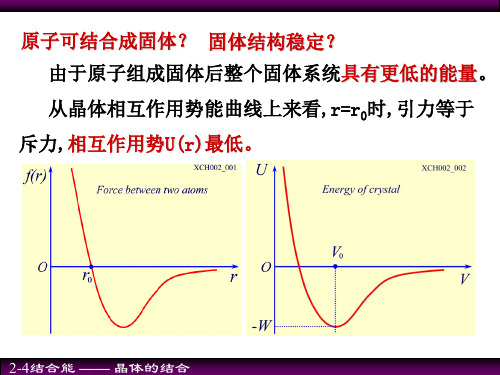
研究组成晶体的原子结构和它们之间的结合力与结 合力的性质,是固体物理中最基本、最重要的问题 之一。 不同的晶体具有不同的结合力类型,但它们的结合力 在定性上具有共同的普遍性质。 在晶体中,粒子的相互作用可分为吸引作用和排斥作 用两类。当粒子间距离较远时(大于几个A),吸引作 用为主;当距离较近时 ( 小于平均粒子间距),排斥 作用为主;当距离适当时,二者相等,相互抵消, 使晶体中的粒子处于平衡状态。 首先研究处于基态的两个相同的原子由相距无穷远处 移到一起时能量和结合能变化的情形。
固体物理第二章 23
固体物理第二章
17
固体物理第二章
18
3
典型的共价键是氢分子的共价键,两个氢原子 的价电子,围绕着两个氢原子核运动,形成 电子云。在两个氢核之间,为两个氢核所共 有。实际上,共价键的现代理论正是由氢分 子的量子理论开始的。 设想有原子A 和 B ,它们表示互为近邻的一对 原子。当它们是自由原子时,各有一个价电 子,归一化的波函数分别用 A 、 B 表示,即:
这一四体问题迄今还不能严格求解,需作近 似处理,常用的比较成功的做法是分子轨道 法 (Molecular Orbital Method) 。忽略电子 - 电 子间相互作用,且假定 : (r1 , r2 ) 1 (r ) 2 (r )
固体物理第二章 20
2 2 2 2 1 2 VA1 VA 2 VB1 VB 2 V12 2m 2m
* H dr
* H aa * A H A dr B H B dr 0
* H ab * A H B dr B H A dr 0
* dr
2 2C ( H aa H ab )
+态波函数是对称的,可填充两个自旋相反的电子, +态的能量亦低于自由氢原子1s态的能量。较多出现
固体物理第二章 3
2-1 结合力的普遍性质与结合能
研究组成晶体的原子结构和它们之间的结合力与结 合力的性质,是固体物理中最基本、最重要的问题 之一。 不同的晶体具有不同的结合力类型,但它们的结合力 在定性上具有共同的普遍性质。 在晶体中,粒子的相互作用可分为吸引作用和排斥作 用两类。当粒子间距离较远时(大于几个A),吸引作 用为主;当距离较近时 ( 小于平均粒子间距),排斥 作用为主;当距离适当时,二者相等,相互抵消, 使晶体中的粒子处于平衡状态。 首先研究处于基态的两个相同的原子由相距无穷远处 移到一起时能量和结合能变化的情形。
第一章(4) 固体物理

键的特性:典型的离子晶体中正负离子的电子壳层都是饱和的,电子云 分布是球状,因此没有方向性。 物性:晶体的物性取决于晶体的结构、结合键的性质、键能等。离子之 间吸引能的数量级为几个eV,离子键是一种强键,因此,离子晶体具有 相当高的强度和硬度,具有很高的熔点;由于离子晶体中没有自由电子, 所以导电和导热性比较差。
2U V P 2 V K V0 V V0
(15)
• 在真空中晶体的体积与1atm下晶体的体积相差无几,这说明当周围环 境的压强不太大时,压强P可视为一个微分小量,因此(15)式可化为
P K V V0
• 因为晶格具有周期性,晶体的体积总可化成如下的形式
(13)
• 将(12)式在平衡点附近做泰勒级数展开,
2U U U P 2 V V V V0 V V0
在平衡点,晶体的势能最小,
(14)
U 0 。若取线性项,结合式(13)则有 V V0
• 于是体积弹性模量表达式(13)化成:
1 U 1 2U r 2 r 2 r r 2 r0 r
在平衡位置处为0
(19)
r02 2U K 9V0 r 2 r 0
(20)
1.24 离子结合
一、离子结合和离子晶体
1.22 基本概念
内聚能Cohesive energy(结合能binding energy):是指 在绝对零度下将晶体分解为相距无限远的、静止的中性自由 原子所需要的能量。 在讨论离子晶体时用晶格能。晶格能是指将组成晶体的离子 分解为相距无限远的、静止的自由离子所需要的能量。
• 惰性气体晶体的结合力较弱,内聚能还不到C、Si、Ge等所在族元素 内聚能的百分之几; • 碱金属晶体具有中等大小的内聚能; • 过渡金属元素(位于元素周期表的中部)的结合力较强。
固体物理-第2章-晶体的结合-2.1
体
或 电负性弱的元素晶体 导
体
第二章 晶体的结合 §2.1原子的电负性
2、电负性变化趋势
(1)同一周期,从左向右电负性渐增; Na.Mg.Al S.Cl
周期表越往下,一个周期内电负性差别越小. 如:过渡元素电负性较接近
(2)同一族元素,从上向下电负性渐减; H.Li.Na
第二章 晶体的结合 §2.1原子的电负性
1.0 1.5 电负性渐弱 0.9 1.2 0.8 1.0
电负性渐强
2.0 2.5 3.0 3.5 4.0 1.5 1.8 2.1 2.5 3.0 1.5 1.8 2.0 2.的电负性
问题4:元素和化合物晶体结合的规律性? 一、元素晶体 1、IA族元素:电负性低,易失电子 金属晶体
2、随电负性增,不易失电子,电子被共有 共价晶体
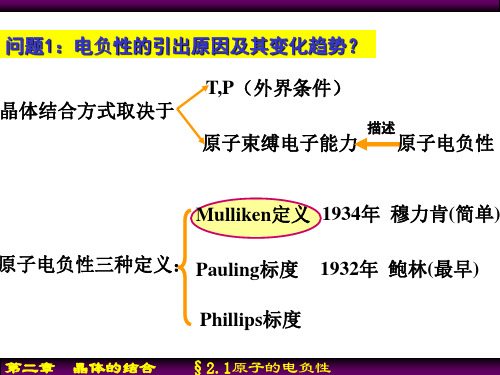
问题1:电负性的引出原因及其变化趋势?
晶体结合方式取决于
T,P(外界条件)
描述
原子束缚电子能力 原子电负性
Mulliken定义 1934年 穆力肯(简单) 原子电负性三种定义: Pauling标度 1932年 鲍林(最早)
Phillips标度
第二章 晶体的结合 §2.1原子的电负性
1、定义(Mulliken) 电负性=0.18×(电离能+亲和能)
3、VIIIA族元素:满壳层,完全靠弱范德瓦尔斯键形成晶体
第二章 晶体的结合 §2.1原子的电负性
二、化合物晶体
(电负性差别大) 离子性结合 随电负性差别减小
IA-VIIA化合物 (碱金属卤化物)
共价性结合 IIIA-VA化合物
(闪锌矿结构)
绝 电负性差别大的化合物晶体 缘 体
电负性强的元素晶体
半 电负性差别小的化合物晶体 导
或 电负性弱的元素晶体 导
体
第二章 晶体的结合 §2.1原子的电负性
2、电负性变化趋势
(1)同一周期,从左向右电负性渐增; Na.Mg.Al S.Cl
周期表越往下,一个周期内电负性差别越小. 如:过渡元素电负性较接近
(2)同一族元素,从上向下电负性渐减; H.Li.Na
第二章 晶体的结合 §2.1原子的电负性
1.0 1.5 电负性渐弱 0.9 1.2 0.8 1.0
电负性渐强
2.0 2.5 3.0 3.5 4.0 1.5 1.8 2.1 2.5 3.0 1.5 1.8 2.0 2.的电负性
问题4:元素和化合物晶体结合的规律性? 一、元素晶体 1、IA族元素:电负性低,易失电子 金属晶体
2、随电负性增,不易失电子,电子被共有 共价晶体
问题1:电负性的引出原因及其变化趋势?
晶体结合方式取决于
T,P(外界条件)
描述
原子束缚电子能力 原子电负性
Mulliken定义 1934年 穆力肯(简单) 原子电负性三种定义: Pauling标度 1932年 鲍林(最早)
Phillips标度
第二章 晶体的结合 §2.1原子的电负性
1、定义(Mulliken) 电负性=0.18×(电离能+亲和能)
3、VIIIA族元素:满壳层,完全靠弱范德瓦尔斯键形成晶体
第二章 晶体的结合 §2.1原子的电负性
二、化合物晶体
(电负性差别大) 离子性结合 随电负性差别减小
IA-VIIA化合物 (碱金属卤化物)
共价性结合 IIIA-VA化合物
(闪锌矿结构)
绝 电负性差别大的化合物晶体 缘 体
电负性强的元素晶体
半 电负性差别小的化合物晶体 导
固体物理 第2章 固体的结合

原子对核外电子的作用和电子所在的轨道有关,内层作用较强, 外层相对作用较弱。对于价电子中的一个,其受到的作用等于其余 电子和原子核的有效电荷和其相互作用,当其余核外电子的荷心和 原子核重合时,有效电荷为1。实际上,两荷心难以保证完全重合, 如果将核外电子分成价电子和非价电子两部分,则非价电子部分的 荷心可以认为和原子核重合,对于具有Z个价电子的原子,考虑价 电子受到的作用时,有效电荷的取值为1~Z。
Hˆ B B
(
2 2 2m
VB ) B
B B
这里, A , B 为原子轨道波函数。当原子靠近时,由于相互作用,
其哈密顿量为:
Hˆ
2 2m
12
V A1
V B1
2 2m
22
V A2
VB2
V12
V AB
VAi为i电子在A原子核中的库仑势能,V12为两电子之间的相互作用 能,VAB为原子核之间的相互作用势能,按Born-Oppenheimer近似, 该量可视为参量而不是动力学变量。
在晶体内部,带正电的原子实浸没在共有化电子形成的电子云中, 负电子云和正原子实之间存在库仑相互作用,显然体积愈小负电子 云愈密集,库仑相互作用的库仑能愈低,表现出使体积尽可能小, 把原子集合起来的作用。而和此集合力相平衡的作用力有:体积缩 小,共有化电子云增加的同时,电子的动能也以正比电子云密度2/3 次方增加;当原子实(离子)相互接近到它们电子云发生显著重叠 时,也将产生强烈的排斥作用。
金属的特性:容易导电、导热,具有金属光泽。金属性结合对原子 的排列没有特别的要求,原子愈紧凑,库仑能愈低,因此,金属性 结合的结构具有较大的配位数;正因为其对原子排列没有特别要求, 因此其晶体容易形成缺陷,导致金属具有较大的范性。
Hˆ B B
(
2 2 2m
VB ) B
B B
这里, A , B 为原子轨道波函数。当原子靠近时,由于相互作用,
其哈密顿量为:
Hˆ
2 2m
12
V A1
V B1
2 2m
22
V A2
VB2
V12
V AB
VAi为i电子在A原子核中的库仑势能,V12为两电子之间的相互作用 能,VAB为原子核之间的相互作用势能,按Born-Oppenheimer近似, 该量可视为参量而不是动力学变量。
在晶体内部,带正电的原子实浸没在共有化电子形成的电子云中, 负电子云和正原子实之间存在库仑相互作用,显然体积愈小负电子 云愈密集,库仑相互作用的库仑能愈低,表现出使体积尽可能小, 把原子集合起来的作用。而和此集合力相平衡的作用力有:体积缩 小,共有化电子云增加的同时,电子的动能也以正比电子云密度2/3 次方增加;当原子实(离子)相互接近到它们电子云发生显著重叠 时,也将产生强烈的排斥作用。
金属的特性:容易导电、导热,具有金属光泽。金属性结合对原子 的排列没有特别的要求,原子愈紧凑,库仑能愈低,因此,金属性 结合的结构具有较大的配位数;正因为其对原子排列没有特别要求, 因此其晶体容易形成缺陷,导致金属具有较大的范性。
固体物理 2.4结合能
2-4结合能 —— 晶体的结合
r
m
r
n
粒子由自由状态结合成晶体释放能量; 稳定的晶体分离为各自由粒子吸收能量。
2-4结合能 —— 晶体的结合
结合能W的数学描述
定义:E0为晶体能量;EN为组成该晶体的N个原子处于 自由状态的总能量,则结合能W可表示为:
W E N E0
(1)晶体能量E0等于组成固体的粒子动能和势能的总和,
在绝对零度下,忽略其动能,则E0为晶体相互作用势能U(r0)
1 2 1 4
2
5
G M
1 2 1 2
4 5
2
8
1 5
1 2
4 2
1 2
1 4
1 . 6069
中性离子组选得越大所得数值越准确。
2-4结合能 —— 晶体的结合
例、NaCl的α=?
解:设r为Na+和Cl-的间距,如图选 O点为中心参考离子。
第n近邻 1 2 原子数 6 12 aj
1
2
3
符号 异 同
贡献因子 1/2 1/4
O
3
8
异
1/8
( NaCl ) 6 1
1 2
12
1 2
1 4
8
1 3
1 8
1 . 457
r
一般
( NaCl ) 1 . 7476 , ( CsCl ) 1 . 7627 , ( ZnS ) 1 . 6381
2-4结合能 —— 晶体的结合
例、二维正方离子交替排列的平面离子晶体的马德隆常数
K E A H N 最近邻 4个 次近邻 4个 G M
r
m
r
n
粒子由自由状态结合成晶体释放能量; 稳定的晶体分离为各自由粒子吸收能量。
2-4结合能 —— 晶体的结合
结合能W的数学描述
定义:E0为晶体能量;EN为组成该晶体的N个原子处于 自由状态的总能量,则结合能W可表示为:
W E N E0
(1)晶体能量E0等于组成固体的粒子动能和势能的总和,
在绝对零度下,忽略其动能,则E0为晶体相互作用势能U(r0)
1 2 1 4
2
5
G M
1 2 1 2
4 5
2
8
1 5
1 2
4 2
1 2
1 4
1 . 6069
中性离子组选得越大所得数值越准确。
2-4结合能 —— 晶体的结合
例、NaCl的α=?
解:设r为Na+和Cl-的间距,如图选 O点为中心参考离子。
第n近邻 1 2 原子数 6 12 aj
1
2
3
符号 异 同
贡献因子 1/2 1/4
O
3
8
异
1/8
( NaCl ) 6 1
1 2
12
1 2
1 4
8
1 3
1 8
1 . 457
r
一般
( NaCl ) 1 . 7476 , ( CsCl ) 1 . 7627 , ( ZnS ) 1 . 6381
2-4结合能 —— 晶体的结合
例、二维正方离子交替排列的平面离子晶体的马德隆常数
K E A H N 最近邻 4个 次近邻 4个 G M
固体物理学:第二章 晶体的结合

Na
Cl
1s22s22p63s23p5
Na
Cl
Cl Na Cl
Na Cl Na Cl Na Cl
Cl
2.1.2 共价晶体
氢气分子是靠共价键结合的典型分子。两个H原子组成 分子时电子云发生重叠,要求这一对电子的自旋反平行, 集中在两个核之间为两个原子共用,形成共价键。
共价键的特点: 1、饱和性:自旋反平行的两个电子形成共价键后不能与第三个电子配对。 2、方向性:按电子云密度最大的方向成键。 3、结合很强,很高的熔点和硬度。 4、导电性弱,属于绝缘体或半导体。
第二章 晶体的结合
晶体中原子的有序排列------原子间相互作用的结果。 原子间键合的性质与规律-----研究晶体结构与物性的基础。
第二章 晶体的结合
§2-1晶体结合的基本类型 §2-2 晶体的结合能 §2-3 非晶态固体 §2-4 准晶体 §2-5 团簇、纳米颗粒
§2-1晶体结合的基本类型
化学键 离子键 共价键 金属键 范德瓦尔斯 键 氢键 混合键
an
j(i) j
(2-23)
称 为马德隆常数,其值决定于晶体结构,B和n由实验数据来 定。 的计算很复杂曾提出多种巧妙的计算方法,可以算出比较精确
的结果。
NaCl 结构: 1.7476,
CsCl 结构: 1.7627,
ZnS 闪锌矿结构: 1.6381
U
N 2
e2
(
4 0r
B rn
)
U r |rr0 0
由K的实验值确定 n,对于NaCl 晶体n 7.7 大多数离子晶体 6 n 9
由r0代入(2.22)且(2.24)代入(2.22)则晶体的总相互作用 能为
N 1 e2
晶体的结合力及结合

它相应于两原子间的互作用力,当
图(a):互作用势能曲线 图(b): 互作用势能曲线的微商曲线
互作用势能达极小值,由此决定原子间的平衡距离r0。 此时的状态称为稳定状态。
(2)有效引力最大位置rm的确定:当r= rm时, 两原子间距离r>r0时 原子间产生吸引力
当r= rm时
当超过 rm
吸引力达极大值
吸引力就逐渐减少
表示晶格所能容耐的在一个方向上的最大张力。
二、结合能 1、结合能的定义:原子结合成晶体后释放的能量
E0:晶体的总能量(内能) EN:是组成该晶体的N个原子在自由状态时的总能量
2、结合能的一般形式 在绝对零度下,除各原子的零点振动外,结合能就是各原子间的互作用势能之和。 N个原子组成的晶体的总相互作用能可表示为:
式中U(r)表示相距r的两个原子之间的互作用势能。
结合能的计算方法: 在平衡态下,晶体势能最低 由组成晶体的原子(离子)的总相互作用能对距离r求微商 得到平衡时的原子(离子)的最近邻距离r0 再代回到晶体的总能量中,就可以求得晶体的结合能。
三、三维晶体参数与结合能的关系 原子相互作用势能的大小由两个因素决定:
双粒子模型 晶体中粒子的相互作用能可以看成是由一对对粒子的相互作用能叠加而得; 先只考虑晶体中一对粒子的相互作用能,然后再对晶体中所有粒子求和,求出晶体的相互作用能。
§2.3 结合力及结合能 一、结合力的共性(两个原子间的相互作用势能)
晶体中粒子的互作用可分为两大类: 吸引作用:是由于异性电荷之间的库仑引力; 排斥作用:来源有两个,一是同性电荷之间的库仑力,另一是泡利原理所引起的排斥。
在近距离:即r/σ <<1.12,势是排斥势,按r-12规律变化
参数σ:具有长度的量纲,反映了排斥力的作用范围; 参数ε:是两原子处于平衡时的结合能,反映了吸引作用的强弱。
图(a):互作用势能曲线 图(b): 互作用势能曲线的微商曲线
互作用势能达极小值,由此决定原子间的平衡距离r0。 此时的状态称为稳定状态。
(2)有效引力最大位置rm的确定:当r= rm时, 两原子间距离r>r0时 原子间产生吸引力
当r= rm时
当超过 rm
吸引力达极大值
吸引力就逐渐减少
表示晶格所能容耐的在一个方向上的最大张力。
二、结合能 1、结合能的定义:原子结合成晶体后释放的能量
E0:晶体的总能量(内能) EN:是组成该晶体的N个原子在自由状态时的总能量
2、结合能的一般形式 在绝对零度下,除各原子的零点振动外,结合能就是各原子间的互作用势能之和。 N个原子组成的晶体的总相互作用能可表示为:
式中U(r)表示相距r的两个原子之间的互作用势能。
结合能的计算方法: 在平衡态下,晶体势能最低 由组成晶体的原子(离子)的总相互作用能对距离r求微商 得到平衡时的原子(离子)的最近邻距离r0 再代回到晶体的总能量中,就可以求得晶体的结合能。
三、三维晶体参数与结合能的关系 原子相互作用势能的大小由两个因素决定:
双粒子模型 晶体中粒子的相互作用能可以看成是由一对对粒子的相互作用能叠加而得; 先只考虑晶体中一对粒子的相互作用能,然后再对晶体中所有粒子求和,求出晶体的相互作用能。
§2.3 结合力及结合能 一、结合力的共性(两个原子间的相互作用势能)
晶体中粒子的互作用可分为两大类: 吸引作用:是由于异性电荷之间的库仑引力; 排斥作用:来源有两个,一是同性电荷之间的库仑力,另一是泡利原理所引起的排斥。
在近距离:即r/σ <<1.12,势是排斥势,按r-12规律变化
参数σ:具有长度的量纲,反映了排斥力的作用范围; 参数ε:是两原子处于平衡时的结合能,反映了吸引作用的强弱。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第i个原子与晶体中所有其它原子
2 34 i
rij
的相互作用势能为:
N
ui ' u(rij )
j 1
则由N个原子组成的晶体的总的相互作用势能为:
u(r )
2 1
i 1
N
ui
2 1
i 1
N
j 1'u( rij
N
)
因为晶体中原子数很多,因此晶体表面原子与晶体内部原 子的差别可以忽略,上式近似为:
r0 a v0
U (v)
v
|vv0 0
v0
2.压缩系数和体积弹性模量(体积压缩模量)
压缩系数: 单位压强引起的体积的相对变化率。
k
1 V
( V P
)T
体积弹性模量是压缩系数的倒数:
K V ( P ) V
由热力学第一定律:
dU pdV TdS pdV
K
构有关的数。
N q2
U
2
4π
0
R
N
)
1 Rn
N
'
j 1
b
a
n j
令
N '
j
1 aj
B
N
j
'b
a
n j
U N ( q2 2 4π0 R
B Rn
)
式中 为马德隆常数,它是仅与晶体几何结构有关的常数。
2.平衡时体积弹性模量K与n的关系及晶体的结合能
§2.2 离子晶体
2.2.1 离子晶体的结构
1.结构
负电性相差较大的原子+库仑作用力
碱金属
卤族
碱土金属
离子晶体 氧族
典型晶体: 氯化钠、氯化铯、硫化锌等 在离子晶体中电子壳层饱和,电子云分布基本上是球对 称的。 2.结合力: 离子键。
3.配位数: 离子晶体中最大的配位数为8。
氯化钠(配位数为6),氯化铯(配位数为8)。离子晶体一定 是复式格子。
假设相距无穷远的两个自由原子间的相互作用能为零,相
互作用力为零。
u(r )
(a)互作用势能和原子间距的关系
(b)互作用力和原子间距的关系
r r
(a)
r r0 , f (r) 0 , 斥力
f (r)
r r0 , f (r) 0 , 引力
r0
r r0 , f (r) 0, u(r)min
2.1.1 两个原子间的相互作用能
1.原子间的相互作用力
吸引力
库仑引力
原子间的相互作用力 排斥力
库仑斥力
泡利原理引起
2.相互作用势能
u(r ) r m r n AB
r 两原子间的距离;
r m
A
吸引能
A、B、m、n>0,
rn
B
排斥能
两原子间的相互作用力
f (r ) du(r ) dr
在三维晶体中,假设晶体的体积为V,包含N个原胞,每个
原胞的体积为v,每个原胞的势能为u (r),U为N个原胞的总的
相互作用能,则有:
U Nu( v ),V Nv
第二节 离子晶体
本节主要内容: 2.2.1 离子晶体的结构 2.2.2 离子晶体结合能 2.2.3 离子晶体的特征 2.2.4 离子半径(泡林半径) 2.2.5 马德隆常数的求法
rm
(b)
r rm , f (rm ) 最大有效引力
u(r)
r r
(a) f (r)
r0
rm
(b)
u(r ) r m r n AB
du ( dr ) |r r0 0
r0
(r0平衡时原子间最近邻的距离。)
d2u ( dr 2 )r0 0
(r=r0处相互作用能有最小值。)
(
U R
)R0
N 2
q2 4π 0 R02
nB R0 n1
0
B
q2 4π 0 n
R0n1
设离子最近邻距离为R,由N个离子组成的晶体的体积:
V Nv NR3 , 体积弹性模量为:
K
V0
2U V 2
V0
1
9N R0
2U ( R 2 ) R0
推导略
K
V0
2U V 2
V0
1
9N R0
2U ( R 2 ) R0
V Nv NR3
(
d2u dr 2
)
m(m 1)(n m)A (m 1)r0m2
0
可知n >m,排斥作用是短程的。
df
d2u
( dr ) ( dr 2 )rm 0
r rm , f (rm )
最大有 效引力
2.1.2 晶体总的相互作用能 1
设晶体中第i个原子与第j个原子之
间的相互作用势能为u(rij ), j
2.2.2 离子晶体结合能
1.结合能
若以u(rij)表示离子i、j 之间的相互作用能,
u(rij ) u1 u2 q2
u1 4π0rij
u1 吸引能, u2
u2
q2
4π 0 rij
b rijn
排斥能,
u(rij )
(
q2
4π 0rij
)
b rinj
同号取“-” 异号取“+”
N
ui ' u(rij ) “'” 表示求和不包括j=i的项。 j 1
若晶体由N个正负离子组成,略去表面离子的特性
U
N 2
ui
N 2
N
' u(rij )
j 1
N
2
N
' (
q2
j1 4π0rij
b rijn
)
设最近邻离子间的距离为R,则 rij a j R, a j 是与晶体结
V
P (
V
)
V
d2U dV 2
V
平衡时体积弹性模量:
p dU dV
2U
K V0 ( V 2 )V0
3. 抗张强度
晶体的抗张强度等于晶体所能承受的最大张力。
u f m ( v )vm
f
2u
( v )vm ( 2v )vm 0 vm
U(r)
N 2
ui
N 2
N 'u(rij )
j 1
原子数目 U(r) 原子间距
晶体体积的函数 U(v)
若取EN=0,则晶体的结合能: Eb EN E0 E0 U ( r0 )
2.1.3 结合能与晶体几个常量的关系
1.原胞体积
U (r ) r |r r0 0
第 一 节 晶体结合能的普遍规律
本节主要内容: 2.1.1 两个原子间的相互作用能 2.1.2 晶体总的相互作用能 2.1.3 结合能与晶体几个常数的关系
§2.1晶体结合能的普遍规律
晶体的结合能: 晶体的结合能就是将自由的原子(离子或分子)结合成晶 体时所释放的能量。
Eb EN E0
E0是晶体的总能量,EN是组成该晶体的N个原子在自由状 态时的总能量,Eb即为晶体的结合能。
2 34 i
rij
的相互作用势能为:
N
ui ' u(rij )
j 1
则由N个原子组成的晶体的总的相互作用势能为:
u(r )
2 1
i 1
N
ui
2 1
i 1
N
j 1'u( rij
N
)
因为晶体中原子数很多,因此晶体表面原子与晶体内部原 子的差别可以忽略,上式近似为:
r0 a v0
U (v)
v
|vv0 0
v0
2.压缩系数和体积弹性模量(体积压缩模量)
压缩系数: 单位压强引起的体积的相对变化率。
k
1 V
( V P
)T
体积弹性模量是压缩系数的倒数:
K V ( P ) V
由热力学第一定律:
dU pdV TdS pdV
K
构有关的数。
N q2
U
2
4π
0
R
N
)
1 Rn
N
'
j 1
b
a
n j
令
N '
j
1 aj
B
N
j
'b
a
n j
U N ( q2 2 4π0 R
B Rn
)
式中 为马德隆常数,它是仅与晶体几何结构有关的常数。
2.平衡时体积弹性模量K与n的关系及晶体的结合能
§2.2 离子晶体
2.2.1 离子晶体的结构
1.结构
负电性相差较大的原子+库仑作用力
碱金属
卤族
碱土金属
离子晶体 氧族
典型晶体: 氯化钠、氯化铯、硫化锌等 在离子晶体中电子壳层饱和,电子云分布基本上是球对 称的。 2.结合力: 离子键。
3.配位数: 离子晶体中最大的配位数为8。
氯化钠(配位数为6),氯化铯(配位数为8)。离子晶体一定 是复式格子。
假设相距无穷远的两个自由原子间的相互作用能为零,相
互作用力为零。
u(r )
(a)互作用势能和原子间距的关系
(b)互作用力和原子间距的关系
r r
(a)
r r0 , f (r) 0 , 斥力
f (r)
r r0 , f (r) 0 , 引力
r0
r r0 , f (r) 0, u(r)min
2.1.1 两个原子间的相互作用能
1.原子间的相互作用力
吸引力
库仑引力
原子间的相互作用力 排斥力
库仑斥力
泡利原理引起
2.相互作用势能
u(r ) r m r n AB
r 两原子间的距离;
r m
A
吸引能
A、B、m、n>0,
rn
B
排斥能
两原子间的相互作用力
f (r ) du(r ) dr
在三维晶体中,假设晶体的体积为V,包含N个原胞,每个
原胞的体积为v,每个原胞的势能为u (r),U为N个原胞的总的
相互作用能,则有:
U Nu( v ),V Nv
第二节 离子晶体
本节主要内容: 2.2.1 离子晶体的结构 2.2.2 离子晶体结合能 2.2.3 离子晶体的特征 2.2.4 离子半径(泡林半径) 2.2.5 马德隆常数的求法
rm
(b)
r rm , f (rm ) 最大有效引力
u(r)
r r
(a) f (r)
r0
rm
(b)
u(r ) r m r n AB
du ( dr ) |r r0 0
r0
(r0平衡时原子间最近邻的距离。)
d2u ( dr 2 )r0 0
(r=r0处相互作用能有最小值。)
(
U R
)R0
N 2
q2 4π 0 R02
nB R0 n1
0
B
q2 4π 0 n
R0n1
设离子最近邻距离为R,由N个离子组成的晶体的体积:
V Nv NR3 , 体积弹性模量为:
K
V0
2U V 2
V0
1
9N R0
2U ( R 2 ) R0
推导略
K
V0
2U V 2
V0
1
9N R0
2U ( R 2 ) R0
V Nv NR3
(
d2u dr 2
)
m(m 1)(n m)A (m 1)r0m2
0
可知n >m,排斥作用是短程的。
df
d2u
( dr ) ( dr 2 )rm 0
r rm , f (rm )
最大有 效引力
2.1.2 晶体总的相互作用能 1
设晶体中第i个原子与第j个原子之
间的相互作用势能为u(rij ), j
2.2.2 离子晶体结合能
1.结合能
若以u(rij)表示离子i、j 之间的相互作用能,
u(rij ) u1 u2 q2
u1 4π0rij
u1 吸引能, u2
u2
q2
4π 0 rij
b rijn
排斥能,
u(rij )
(
q2
4π 0rij
)
b rinj
同号取“-” 异号取“+”
N
ui ' u(rij ) “'” 表示求和不包括j=i的项。 j 1
若晶体由N个正负离子组成,略去表面离子的特性
U
N 2
ui
N 2
N
' u(rij )
j 1
N
2
N
' (
q2
j1 4π0rij
b rijn
)
设最近邻离子间的距离为R,则 rij a j R, a j 是与晶体结
V
P (
V
)
V
d2U dV 2
V
平衡时体积弹性模量:
p dU dV
2U
K V0 ( V 2 )V0
3. 抗张强度
晶体的抗张强度等于晶体所能承受的最大张力。
u f m ( v )vm
f
2u
( v )vm ( 2v )vm 0 vm
U(r)
N 2
ui
N 2
N 'u(rij )
j 1
原子数目 U(r) 原子间距
晶体体积的函数 U(v)
若取EN=0,则晶体的结合能: Eb EN E0 E0 U ( r0 )
2.1.3 结合能与晶体几个常量的关系
1.原胞体积
U (r ) r |r r0 0
第 一 节 晶体结合能的普遍规律
本节主要内容: 2.1.1 两个原子间的相互作用能 2.1.2 晶体总的相互作用能 2.1.3 结合能与晶体几个常数的关系
§2.1晶体结合能的普遍规律
晶体的结合能: 晶体的结合能就是将自由的原子(离子或分子)结合成晶 体时所释放的能量。
Eb EN E0
E0是晶体的总能量,EN是组成该晶体的N个原子在自由状 态时的总能量,Eb即为晶体的结合能。
