镧系元素的通性
镧系元素
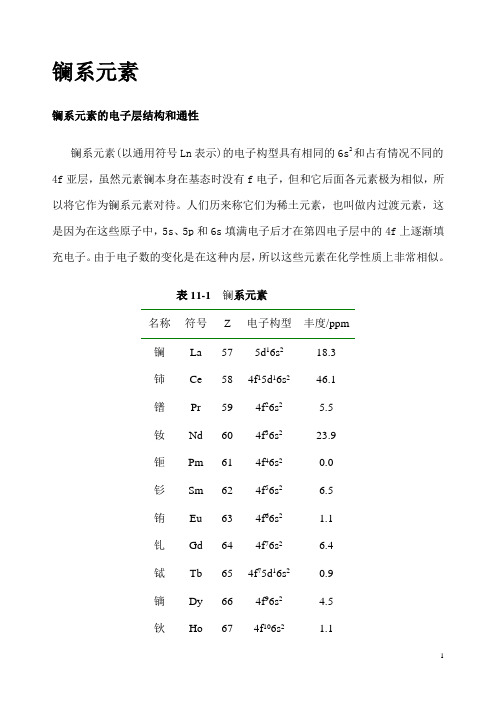
镧系元素镧系元素的电子层结构和通性镧系元素(以通用符号Ln表示)的电子构型具有相同的6s2和占有情况不同的4f亚层,虽然元素镧本身在基态时没有f电子,但和它后面各元素极为相似,所以将它作为镧系元素对待。
人们历来称它们为稀土元素,也叫做内过渡元素,这是因为在这些原子中,5s、5p和6s填满电子后才在第四电子层中的4f上逐渐填充电子。
由于电子数的变化是在这种内层,所以这些元素在化学性质上非常相似。
表11-1 镧系元素名称符号Z 电子构型丰度/ppm镧La 57 5d16s218.3铈Ce 58 4f15d16s246.1镨Pr 59 4f26s2 5.5钕Nd 60 4f36s223.9钷Pm 61 4f46s20.0钐Sm 62 4f56s2 6.5铕Eu 63 4f66s2 1.1钆Gd 64 4f76s2 6.4铽Tb 65 4f75d16s20.9镝Dy 66 4f96s2 4.5钬Ho 67 4f106s2 1.1铒Er 68 4f116s2 2.5铥Tm 69 4f126s20.2镱Yb 70 4f136s2 2.7镥Lu 71 4f145d16s20.8它们性质上的微小差别,主要是由“镧系收缩”引起的。
因为核内每增加一个质子,相应进入4f亚层的电子却太分散,不象定域程度更高的内层电子那样能有效地屏蔽核电荷,所以随着镧系元素原子序数的增加,原子核对最外层电子的引力就不断地增大,这就使得原子体积从镧到镥依次减小。
三价阳离子的收缩是十分规则的,从La3+的106pm收缩到Lu3+的35pm。
图11.1A所示金属半径,虽然总的趋向是减小,但Eu和Yb的半径比其余原子的要大得多。
它们是形成二价阳离子的倾向最大的两个镧系元素。
在固体中,这两种原子可能只将两个电子给予导带,而所形成的2+离子和其余镧系金属的3+离子相比,其半径较大、离子间的结合力较弱。
金属铕(Eu)和镱(Yb),与表中相邻的金属比,显然具有较低的密度,较低的熔点(图11.1B)和较低的升华能。
稀土元素

15
2L11n10原5 子Ln半原离径子和半离径子半径
Eu
200
210150
128000
105
La Ce
La
Pr
Nd
Pm
Sm Eu
Eu
Sm
Gd Tb
Dy
Ho
Yb
Ln(+II) Ln Er LnTm(+III) Lu
Ce
Ln(+IV)
116905
100
Pr Nd
Yb
190
14905
185
11289000 11078055
1 、氧化物
19
4 19 K 20 Ca 21 Sc 22 Ti 23 V 24 Cr 25 Mn 26 Fe 27 Co 28 Ni 29 Cu 30 Zn 31 Ga 32 Ge 33 As 34 Se 35 Br 36 Kr
钾钙 钪钛 钒 铬锰铁钴镍 铜 锌镓锗砷硒 溴氪
5 37 Rb 38 Sr 39 Y 40 Zr 41 Nb 42 Mo 43 Tc 44 Ru 45 Rh 46 Pd 47 Ag 48 Cd 49 In 50 Sn 51 Sb 52 Te 53 I 54 Xe
97.9
-2.29
96.4
-2.30
95.0
-1.99
93.8 -2.28
92.3
-2.31
90.8
-2.29
89.4
-2.33
88.1
-2.32
86.9
-2.32
85.8
-2.22
8
84.8
-2.30
从上图中可以看出,镧系元素的原子半径和
离子半径在总的趋势上都随着原子序数的增加而
镧系元素和锕系元素性质

◆ 离子半径缩小的快
离
子
Ln3+
◆ 镧系收缩是无机化学的重要现象之一 半
径
● 钇成为稀土元素的成员 Y常与重稀土元素共生
原子序数
● Zr Nb Mo Hf Ta W
半径相近 化学性质相似
分离困难
离子颜色
● 一些氧化数为+Ⅲ的镧系离子有很漂亮的颜色
离子 La3+ Ce3+ Pr3+ Nd3+ Pm3+ Sm3+ Eu3+ Gd3+
无机化学课件
第21章 镧系元素 锕系元素
第21章 镧系元素 錒系元素 本章主要内容
● (一) 镧系元素的电子构型与性质的关系 ● (二) 镧系收缩的实质及对其他元素的影响 ● (三) 镧系元素重要的单质和化合物
f 区元素 内过渡元素
IIIB 族
◆ 镧系元素:La(57) ------Lu(71),共15种元素(Ln) 钇(Y) + 镧系元素 稀土元素(RE) (性质相似,自然界共生)
①从空气中吸收二氧化碳形成碳酸盐 性 质 ② Ln2O3与水剧烈化合,生成氢氧化物
③ Ln2O3易溶于酸
● 氢氧化物 Ln3 3OH Ln(OH )3
① 水中的溶解度很小
② 氢氧化物显碱性 La(OH )3 Lu(OH )3 碱性减弱 ● 碱性与碱土金属氢氧化物相近 溶于酸而形成盐
盐类
+IV (Ce,Pr,Tb,Dy) Ce(4f0),Pr(4f1),Tb(4f7),Dy(4f8)
原子和离子半径
半 Sc
径
增Y 大 La ----- Lu
原
子
镧系收缩
半 径
镧系元素

广西大学化学化工学院
无机化学
产生结果: 1、Y成为稀土元素的成员 2、Zr和Hf,Nb和Ta,Mo和W原子半径和离子半 径也较接近,化学性质也相似。 3、ⅧB族中两排铂系元素在性质上极为相似, 也是镧系收缩所带来的影响。
2019/11/21
广西大学化学化工学院
无 机 化 学 22.2.3 镧系元素的氧化态
为4fn6s2。
2019/11/21
但在固态下主要为 4fn-15d16s2, 例外:Eu 4f76s2
Yb 4f146s2
广西大学化学化工学院
无机化学
由于4f 轨道被外层电子有效地屏蔽着, 且由于E4fE5d, 因而在结构为 4fn6s2 的情况下, f 电子要参与反应,必须 先得由4f 轨道跃迁到5d 轨道。这样,由于电子构型不 同,所需激发能不同,元素的化学活泼性就有了差异。
2019/11/21
广西大学化学化工学院
无 机 化 学 22.3.2 镧系元素离子和化合物的磁性
双峰形状是由于镧系离 子的总角动量呈现周期 性变化所致。除Sm3+和 Eu3+外,其他离子的计 算值和实验值都很一致, Sm3+和Eu3+的不一致被 认为是在测定时包含了 较低激发态的贡献。
良好磁性材料,把它们制成稀土合金后可作为
2019/11/21
广西大学化学化工学院
无机化学
2019/11/21
22.2.2 镧系收缩
镧系元素原子半径和离子半径: • 原子半径:
大于相应的第五周期元素; 总趋势是逐渐减小,在Eu 和Yb处有两个峰值 • 离子半径: 半径递减,没有峰值 递减程度比原子半径递减 程度大
广西大学化学化工学院
无机化学
第25章 f区金属 镧系元素和锕系元素 镧系元素符号:Ln(Lanthanides)

25-1-1 镧系元素的通性
一、电子层结构
见书815页表25-1。
两类:4fn6s2、4fn-15d16s2。
洪特规则:元素原子的价电子构型趋于形成 或接近全空、半满、全满的较为稳定状态 。 二、氧化态 见书901页表23-2。 特征氧化态:+Ⅲ。 第1-3电离势之和较低。
2
其它氧化态一般可由洪特规则解释。
“锕系收缩”。
22
四、离子的颜色 多数的Ann+有成单的f电子,若吸收可见光电 子则显示出一定的颜色;若吸收的不是可见光区 的光则无色。 见书835页表25-12。 25-3-2 锕系金属 一、存在与分布
二、锕系金属的制备与用途
三、锕系金属的性质
见书836。
23
25-3-3 钍及其化合物 氧化物及其水合物、硝酸钍。
25-2-4 稀土元素及其化合物的应用(自学)
25-3 锕系元素
An:Ac、Th、Pa、U、Np、Pu、Am、Cm、 Bk、Cf、Es、Fm、Md、No、Lr。
U铀之后的元素称为超铀元素(人工合成)。 25-3-1 锕系元素的通性 一、价电子结构 见书834页表25-9。
21
两类:5fn7s2、5fn-16d17s2。 相比于镧系元素,锕系元素的后一种价电子结 构更多(锕系的5f、6d轨道能量更相近)。 二、氧化态 见书834页表25-9。 Th→Am存在多种氧化态。 原因:Th→Am的5f电子未达半满, 5f、6d轨 道能量相对镧系更相近,相对易于参与成键。 三、原子半径和离子半径
制备: Ln3+ + 3OH- → Ln(OH)3↓ 性质: 难溶于水(Ksp见书822页表25-7)。
10
碱性:与碱土金属氢氧化物碱性相近,从 La(OH)3 到Lu(OH)3 碱性减弱(半径减小,离子势增 大)。 Yb(OH)3 和Lu(OH)3 显出微弱两性,在高压釜 中与浓碱反应生成Na3Ln(OH)6。
镧系元素

原子半径/pm
187.7 182.4 182.8 182.1 181.0 180.2 204.2 180.2 178.2 177.3 176.6 175.7 174.6 194.0 173.4
Ln3+半径 /pm E q /V
106.1 -2.38
103.4 -2.34
101.3 -2.35
99.5 -2.32
97.9
-2.29
96.4
-2.30
95.0
-1.99
93.8 -2.28
92.3
-2.31
90.8
-2.29
89.4
-2.33
88.1
-2.32
86.9
-2.32
85.8
-2.22
84.8
-2.30
7Hale Waihona Puke 从上图中可以看出,镧系元素的原子半径和
离子半径在总的趋势上都随着原子序数的增加而
缩小的幅度很小,这叫做
2
3 Li
锂
4 Be
铍
5 B 6 C 7 N 8 O 9 F 10 Ne
硼 碳 氮氧 氟 氖
3
11 Na
钠
12 Mg
镁
IIIB
IVB
VB
VIB VIIB
VIII
13 Al 14 Si 15 P 16 S 17 Cl 18 Ar
IB IIB 铝 硅 磷 硫 氯 氩
4 19 K 20 Ca 21 Sc 22 Ti 23 V 24 Cr 25 Mn 26 Fe 27 Co 28 Ni 29 Cu 30 Zn 31 Ga 32 Ge 33 As 34 Se 35 Br 36 Kr
整个电子壳层依次收缩的积累造成总的镧系收缩
镧系元素

镧系元素在周期系中,你知道什么是镧系元素?什么是稀土元素吗?它们的电子层结构和性质有什么特点?它们在科学技术和生产中扮演了什么样的角色?“镧系元素”在周期表中从原子序数为57号的镧到原子序数为71号的镥共15种元素,它们的化学性质十分相似,都位于周期表中第ⅢB族,第6周期镧的同一格内,但它们不是同位素。
同位素的原子序数是相同的,只是质量数不同。
而这15种元素,不仅质量数不同,原子序数也不同。
称这15种元素为镧系元素,用Ln表示。
它们组成了第一内过渡系元素。
“稀土元素”镧系元素以及与镧系元素在化学性质上相近的、在镧系元素格子上方的钇和钪,共17种元素总称为稀土元素,用RE表示。
按照稀土元素的电子层结构及物理和化学性质,把钆以前的7个元素:La、Ce、Pr、Nd、Pm、Sm和Eu称为轻稀土元素或铈组稀土元素;钆和钆以后的7个元素:Gd、Tb、Dy、Ho、Er、Tm、Yb、Lu,再加上Sc和Y共10个元素,称为重稀土元素或钇组稀土元素。
“稀土”的名称是18世纪遗留下来的。
由于当时这类矿物相当稀少,提取它们又困难,它们的氧化物又和组成土壤的金属氧化物Al2O3很相似,因此取名“稀土”。
实际上稀土元素既不“稀少”,也不像“土”。
它们在地壳中的含量为0.01534,其中丰度最大的是铈,在地壳中的含量占0.0046,其次是钇、钕、镧等。
铈在地壳中的含量比锡还高,钇比铅高,就是比较少见的铥,其总含量也比人们熟悉的银或汞多,所以稀土元素并不稀少。
这些元素全部是金属,人们有时也叫它们稀土金属。
我国稀土矿藏遍及18个省(区),是世界上储量最多的国家。
内蒙包头的白云鄂博矿是世界上最大的稀土矿。
在我国,具有重要工业意义的稀土矿物有氟碳铈矿Ce(CO3)F,独居石矿RE(PO4),它们是轻稀土的主要来源。
磷钇矿YPO4和褐钇铌矿YNbO4是重稀土的主要来源。
我们从以下几个方面来讨论镧系元素的通性:1、价电子层结构2、氧化态3、原子半径和离子半径4、离子的颜色5、离子的磁性6、标准电极7、金属单质电子层结构这是目前根据原子光谱和电子束共振实验得到的镧系元素原子的电子层结构:根据电子填充的一般规律,由于4f能级的能量介于6s和5d之间,由表Ln-1中可见,从第57号元素镧开始,新增加的电子填充在4f能级上,应该4f能级充满后再填充到5d能级上去。
镧系和锕系——精选推荐

第二十三章镧系元素和锕系元素周期表中,ⅢB 族有32 种元素,包括钪、钇、镧、锕,其中镧这一格代表15 种镧系元素( 71 ~ 57 = Z ),锕这一格代表15 种锕系元素( 103 ~ 89 = Z ),下面分别讨论镧系和锕系元素。
23-1 镧系元素1、通性:(1)概念:镧系包括从Lu La ~ 的15 种元素,用Ln 表示,又由于Y 在矿物中的与镧系共生,其原子半径和离子半径与镧系元素接近,所以又把Y 和镧系元素合称希土元素,用RE 表示。
(2)电子层结构镧系内,自La 以后,增加的电子填充在f 4 亚层上, f 有t 个轨道,共可容纳14个电子,所以La 后出现14 种元素,称为第一内过渡系。
锕系后14 种元素称第二内过渡元素,92 号U 以后的元素又叫超铀元素。
镧系元素原子的最外面两层的电子结构相似,不同在于f 4 内层,因此化学性质非常相似,在周期表中占一格。
(3)氧化态:主要价态为+Ⅲ,+Ⅳ,但不及+Ⅱ稳定,+Ⅱ价态为很强的还原剂+ 2 Sm (钐),+Ⅳ为很强的氧化剂如: + 4 Ce (铈)(能存在于溶液中), + 2 Eu (铕), + 2 Yb (镱)能存在于溶液中。
它们的氧化态与电子层的构型有关,如14 7 0 , , f f f 特别稳定,另外还与其热力学和动力学因素有关。
(4)原子半径和离子半径:镧系元素的原子半径和离子半径随着原子序数的增加而逐渐减小的现象称为镧系收缩。
随着原子序数的增加,电子填入f 4 层,而f 4 电子对核的屏蔽不如内层电子,因而随着原子序数的增加,对外层电子吸引力增加,原子半径、离子半径逐渐减小。
其中铕(Eu )和镱(Yb )的原子半径变化趋势反常,是因为它们分别具有7 4 f 和14 4 f 的稳定结构,对原子核有较大的屏蔽作用。
另外,在它们的金属晶体中它们仅能给出2 个s 电子形成金属键,原子之间的结合力不像其他镧系元素那样强,所以金属铕和镱的密度较低,熔点也较低,升华能也比相邻的元素低。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
