分子结构与性质PPT教学课件
合集下载
高二化学分子空间结构与物质性质PPT精品课件

配合物的组成
(1) 内界与外内界界: 是配位单元,外界是简单 离子。内外界之间是完全电离的。
[Co(NH3)6]
K3[Cr(CN)
C内l3界
外界 外界6] 内界
内界又由中心原子和配 [Co (NH3)6]3+
位体及配位数构成: 中 配 配
心 原 子
位位 体数
[ Cu ( N H3 ) 4 ]2+ SO42-
BF3中的B是sp2杂化,BeCl2 中的Be是sp杂化。
杂化轨道的空间取向
杂化类型
sp sp2
sp3
杂化轨道夹角 180º 120º 109.5º
杂化轨道 空间取向
直线
平面 三角形
正四面体
实例
BeCl2 BF3
CH4
挑战自我:NH3、H2O分子分别是三角 锥形分子、V形分子,如何用杂化轨道的 知识解释。
• 当作为中心原子的金属离子相同时, 配合物的稳定性与配体的性质有关。
配合物的稳定性
(1)中心离子的影响 简单阳离子,半径越小稳定性越强。
(2)配位原子电负性的影响 配位原子的电负性越大,配合物越稳定;配
位原子电负性越小,配合物越不稳定。 (3)配位体碱性越强,配合物越稳定。
THANKS
FOR WATCHING
[Cu(NH3)4]2+的成键情况和空间结构
Cu2+形成dsp2杂化轨道,接受4个NH3 分子提供的孤电子对,形成平面正方形 的[Cu(NH3)4]2+ 。
[Pt(NH3)2Cl2]的成键情况和空间结构
Pt2+形成dsp2杂化轨道,接受2个NH3 和2个Cl-离子提供的孤电子对,形成平 面正方形的[Pt(NH3)2Cl2] 。
乙炔的分子结构和化学性质PPT教学课件

乙烯
KMnO4褪色 火焰明亮、带浓烟
溴水褪色
乙炔
KMnO4褪色 火焰明亮、带浓烟
溴水褪色
练习
1.下列物质中,碳元素的质量分数最大的是[ C ]
A.乙烷 B.乙烯 C.乙炔
2.请选择图中的仪器装配成一套制备乙炔 的装置[ B、C ]
3.用电石、水、氯化氢为原料,制备聚 氯乙烯,写出反应的化学方程式。
x
0
2
3
2
2
sinx 0 1 0 -1 0
1+sinx 1 21 Nhomakorabea0
1
y
2
●
y=1+sinx x [0, 2 ]
1●
●
●
●
o
3
2
x
2
2
(2)按五个关键点列表
x
0
2
3
2
2
cosx 1 0 -1 0 1
-cosx -1 0
1
0 -1
y
y=-cosx x [0,2 ]
1
●
o
●
3●
2
x
2
2
-1 ●
●
思考:
sin( x+ )= cosx
2 y
余弦曲线 正弦曲线
x
-2
-
o 3 2
3
4
2
2
余弦函数的图象可以通过将正弦曲线向左 平行移动/2个单位长度而得到
正弦函数y=sinx(x R)的图象与
余弦函数y=cosx(x R)的图象的
对比
y
y=sinx的图象
1
2 0 3 2 3
2 -1 2
与x轴的交点
人教版高中化学选择性必修2:分子结构与性质【精品课件】

∶N⋮⋮N∶
(2)结构式:用一条短线表示一对共用电子。
化学式
N2
NH3
结构式
N≡N
化学式
CH4
CO2
结构式
O==C==O
HCl H—Cl HClO
H—O—Cl
• 4.共价键存在的范围
• (1)共价化合物中。如SO2、CO2、CH4、H2O2、CS2、 H2SO4等。 • (2)非金属单质分子中。如O2、F2、H2、C60、单质硫、 白磷(P4)等(稀有气体为单原子分子,不存在化学键)。 • (3)部分离子化合物的原子团中。如NH、OH-、SO。
键参数 :键能 、键长与 性等
多样的分子空 间结构
键角 分子结构的测定
价层电子对互斥模型
3.利用价层电子对互斥模型、 杂化轨道理论判断分子的空间 构型、中心原子杂化类型
杂化轨道理论简介 4.根据空间构型、共价键的极
分子结构与物 质的性质
共价键的极性 分子间的作用力
分子的手性
性比较键角大小 5.氢键对分子性质的影响 6.手性碳原子的判断
微思考
• 根据元素周期律可知,NH3的稳定性强于PH3,你能 利用键参数进行解释吗?
【答案】N原子的半径比P原子的半径小,故键长N—H键比P—H 键小,则N—H键的键能比P—H键的键能大,N—H键更难被破坏, NH3更难分解。
•
判断正误。(正确的画“√”,错误的画“×”)
• (1)键角是描述分子空间结构的重要参数。
___0_._9___
CO _2_._5_ _3_._5_
___1_.0____
结论:当成键原子的电负性相差很大时,形成的电子对不会被共 用,形成的将是离子键;而共价键是电负性相差不大的原子之间形成的 化学键。
人教版化学高中选择必修二《分子结构与物质的性质》课件PPT

【提示】C和O均位于第二周期,原子半径差别不大。而Si与O之间并不能像C与O之间形成稳定的双键, 这是因为Si的原子半径(0.117 nm)是O的原子半径(0.066 nm)的1.8倍 ,Si的3p轨道不能和O的2p轨道 进行有效的重叠。
C的2p轨道与O的2p 轨道形成的π键
Si的3p轨道与O的 2p轨道难以成键
H2SO3 = (HO)2SO HClO2 = (HO)ClO HClO4 = (HO)ClO3
HNO3 = (HO)NO2
知识海洋
无机含氧酸的结构
按可以电离出的H+的个数分类:
一元酸
(HO)NO (HO)NO2 (HO)Cl (HO)ClO2 (HO)ClO3
m=1
二元酸 (HO)2SO2 (HO)2SO
H++H3PO2- (3)正盐
知识海洋
思考:Si与C是同一主族,H2SiO3的结构与H2CO3相似吗? H2SiO3的结构式与碳酸H2CO3相同吗?
O
C
H2CO3= HO
OH
O H2SiO3= HO Si OH
知识海洋
思考:Si与C是同一主族,H2SiO3的结构与H2CO3相似吗? H2SiO3的结构式与碳酸H2CO3相同吗?
知识海洋
你能试着书写以下含氧酸的结构式吗?
H2SO4,H2SO3; HClO,HClO2,HClO3,HClO4; H3PO4; HNO2,HNO3。
知识海洋
你能试着书写以下含氧酸的结构式吗?
【答案】
O
O
H2SO4 HO S OH
H2SO3 HO S OH
O
O
O
HClO HO
Cl
HClO2 HO
n=1
强酸
C的2p轨道与O的2p 轨道形成的π键
Si的3p轨道与O的 2p轨道难以成键
H2SO3 = (HO)2SO HClO2 = (HO)ClO HClO4 = (HO)ClO3
HNO3 = (HO)NO2
知识海洋
无机含氧酸的结构
按可以电离出的H+的个数分类:
一元酸
(HO)NO (HO)NO2 (HO)Cl (HO)ClO2 (HO)ClO3
m=1
二元酸 (HO)2SO2 (HO)2SO
H++H3PO2- (3)正盐
知识海洋
思考:Si与C是同一主族,H2SiO3的结构与H2CO3相似吗? H2SiO3的结构式与碳酸H2CO3相同吗?
O
C
H2CO3= HO
OH
O H2SiO3= HO Si OH
知识海洋
思考:Si与C是同一主族,H2SiO3的结构与H2CO3相似吗? H2SiO3的结构式与碳酸H2CO3相同吗?
知识海洋
你能试着书写以下含氧酸的结构式吗?
H2SO4,H2SO3; HClO,HClO2,HClO3,HClO4; H3PO4; HNO2,HNO3。
知识海洋
你能试着书写以下含氧酸的结构式吗?
【答案】
O
O
H2SO4 HO S OH
H2SO3 HO S OH
O
O
O
HClO HO
Cl
HClO2 HO
n=1
强酸
分子结构与性质精品课件

分子结构的重要性
分子结构决定了分子的物理性质 、化学性质以及生物学活性等方 面,因此对于分子结构的理解和 研究是化学和生物学领域的基础 。
分子结构的层次
分子结构可以分为原子、共价键 、分子构型、电子分布等不同层 次。
分子结构的类型
共价键的分类
共价键可以分为极性共价键和非极性共价键,其中极性共价键又可以分为σ键和π键,非 极性共价键又可以分为δ键和π键。
化学活性的影响因素
分子的化学活性受到许多因素的影响,如键能、键的极性、立 体构型等。
常见的分子化学性质
了解和掌握常见的分子化学性质,如加成反应、取代反应、氧 化还原反应等。
分子在特定环境中的表现
总结词
了解分子在特定环境中的表现对于理解和预测分子在不 同环境中的性质和行为具有重要意义。
环境对分子性质的影响
实验研究的基本原则
实验目的明确
进行实验研究前,需要 明确实验目的和研究问 题,以选择合适的实验 方法和手段。
数据处理规范
实验数据是研究的基础 ,必须进行规范的数据 处理和解析,以获得准 确可信的结果。
实验操作严格
实验操作需严格遵守实 验室规范和安全要求, 确保实验结果的可靠性 和安全性。
现代谱学技术在分子结构与性质研究中的应用
计算机模拟在分子结构与性质研究中的应用
计算化学
通过计算机模拟,可以进行计算化学研究,预测分子的化学性 质和反应行为。
量子化学
量子化学方法可以模拟分子的电子结构和化学性质,为研究分子 结构和性质之间的关系提供理论支持。
分子力学方法
分子力学方法可以模拟分子的构型和构象变化,以及分子在环境 中的行为和相互作用。
06
分子结构与性质研究的挑战和未来发 展
分子结构与性质经典课件人教版
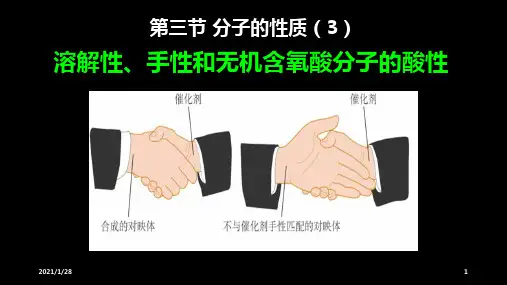
3. 实验表明碘在四氯化碳溶液中的溶解性较好。这是因为碘和 四氯化碳都是非极性分子,非极性溶质一般能溶于非极性溶剂,而 水是极性分子。
4.怎样理解低碳醇与水互溶,而高碳醇在水中的溶解度却很小?
2021/1/28
6
“相似相溶”还适用于分子结构的相似性。例如,乙 醇的结构简式为CH3CH2—OH,其中的—OH 与水分子中 的 —OH相似 ,因而乙醇能与水互溶(当然,乙醇分子由
2021/1/28
17
试简要回答下列问题: (1)按此规则判断,H3AsO4、H2CrO4、HMnO4 酸性由弱到 强的顺序为__H__3_A_s_O_4_<_H__2C__r_O_4_<_H_M__n_O__4________。 (2)H3PO3 和 H3AsO3 的形式一样,但酸性强弱相差很大。 已知 H3PO3 为中强酸,H3AsO3 为弱酸,试推断 H3PO3 和 H3AsO3
(1)如果存在氢键,则溶剂和溶质之间的氢键作用力越大, 溶解性越___好____。相反,无氢键相互作用的溶质在有氢键 的水中的溶解度就比较__小_____。 (2)“相似相溶”还适用于分子结构的_相__似___性___。
(3)如果溶质与水发生化学反应可_增___大_____其溶解度。
2021/1/28
酸性:HClO4>HBrO4>HIO4 酸性:HClO>HBrO>HIO
酸性:H3PO4 < H2SO4 < HClO4
2021/1/28
14
3.把含氧酸的化学式写成 (HO)mROn ,一般非羟基氧原子 数n值越大,则酸性越 强 。
如果成酸元素R相同,则n值越大,R的正电性高,导致R—O—H中的O的电 子向R偏移,因而在水分子的作用下,也就越容易电离出H+,即酸性越强。
4.怎样理解低碳醇与水互溶,而高碳醇在水中的溶解度却很小?
2021/1/28
6
“相似相溶”还适用于分子结构的相似性。例如,乙 醇的结构简式为CH3CH2—OH,其中的—OH 与水分子中 的 —OH相似 ,因而乙醇能与水互溶(当然,乙醇分子由
2021/1/28
17
试简要回答下列问题: (1)按此规则判断,H3AsO4、H2CrO4、HMnO4 酸性由弱到 强的顺序为__H__3_A_s_O_4_<_H__2C__r_O_4_<_H_M__n_O__4________。 (2)H3PO3 和 H3AsO3 的形式一样,但酸性强弱相差很大。 已知 H3PO3 为中强酸,H3AsO3 为弱酸,试推断 H3PO3 和 H3AsO3
(1)如果存在氢键,则溶剂和溶质之间的氢键作用力越大, 溶解性越___好____。相反,无氢键相互作用的溶质在有氢键 的水中的溶解度就比较__小_____。 (2)“相似相溶”还适用于分子结构的_相__似___性___。
(3)如果溶质与水发生化学反应可_增___大_____其溶解度。
2021/1/28
酸性:HClO4>HBrO4>HIO4 酸性:HClO>HBrO>HIO
酸性:H3PO4 < H2SO4 < HClO4
2021/1/28
14
3.把含氧酸的化学式写成 (HO)mROn ,一般非羟基氧原子 数n值越大,则酸性越 强 。
如果成酸元素R相同,则n值越大,R的正电性高,导致R—O—H中的O的电 子向R偏移,因而在水分子的作用下,也就越容易电离出H+,即酸性越强。
高中化学第二章分子结构与性质复习课件新课标人教选修3.ppt
知识体系
l 共价键(及配位键)形成、特点、键参数 l 分子的空间结构 常见空间构型及理论解释 l 分子的性质 分子与分子之间的关系(等电子
原理、手性异构)、分子本身的性质(极性与 非极性、含氧酸的酸性)、分子与分子之间的 作用(范德华力、氢键)及对分子性质的影响
共价键—共价键的形成
l 共价键的形成: 共用电子对 未成对电子——成对(饱和性)
分子的性质—分子与分子之间的作用
l 范德华力——只存在于分子之间 ——作用弱 ——影响物质的物理性质(范德华力
越大,熔沸点越高,硬度越大) 比较规律 1、极性越大,范德华力越大 2、组成结构相似,相对分子质量越大,范德 华力越大
分子的性质—分子与分子之间的作用
l 氢键(一种特殊的分子间作用力) *形成条件 (N、O、F)—H┈( N、O、F )
sp 直线形 sp2 平面正三角形 sp3 正四面体形
分子的性质——分子与分子的关系
1、等电子体: 等电子体具备条件:等原子数和等价电子总数 等电子体具备性质:物理性质具有相似性 2、手性异构:组成相同,分子结构不同,但互
为镜像,这两种分子互为异构体。 手性分子必须存在手性原子——与四个互不 相同的原子或原子团相连。 思考:如何消除手性分子的手性?
l 1、常见分子的空间构型: 三原子分子:直线形,V形 四原子分子:平面(正)三角形,三角锥形 五原子分子:正四面体形,四面体形 六原子分子:双三角锥形 七原子分子:正八面体形
空间构型的理论模型——价层电子对互斥
l 价层电子对互斥理论:
ABn型分子(A:中心原子,B不一定为同一元素原 子)
A原子: 价电子都参与成键 有孤对电子
(类似于配位键,也有方向性) *存在 分子内 ;分子间, *作用强弱 化学键>氢键>范德华力 键长越短,氢键键能越大 *对物理性质的影响:分子间氢键越强,熔沸点 越高,硬度越大;溶质与溶剂分子间能形成氢 键,则能增加溶质的溶解度。
l 共价键(及配位键)形成、特点、键参数 l 分子的空间结构 常见空间构型及理论解释 l 分子的性质 分子与分子之间的关系(等电子
原理、手性异构)、分子本身的性质(极性与 非极性、含氧酸的酸性)、分子与分子之间的 作用(范德华力、氢键)及对分子性质的影响
共价键—共价键的形成
l 共价键的形成: 共用电子对 未成对电子——成对(饱和性)
分子的性质—分子与分子之间的作用
l 范德华力——只存在于分子之间 ——作用弱 ——影响物质的物理性质(范德华力
越大,熔沸点越高,硬度越大) 比较规律 1、极性越大,范德华力越大 2、组成结构相似,相对分子质量越大,范德 华力越大
分子的性质—分子与分子之间的作用
l 氢键(一种特殊的分子间作用力) *形成条件 (N、O、F)—H┈( N、O、F )
sp 直线形 sp2 平面正三角形 sp3 正四面体形
分子的性质——分子与分子的关系
1、等电子体: 等电子体具备条件:等原子数和等价电子总数 等电子体具备性质:物理性质具有相似性 2、手性异构:组成相同,分子结构不同,但互
为镜像,这两种分子互为异构体。 手性分子必须存在手性原子——与四个互不 相同的原子或原子团相连。 思考:如何消除手性分子的手性?
l 1、常见分子的空间构型: 三原子分子:直线形,V形 四原子分子:平面(正)三角形,三角锥形 五原子分子:正四面体形,四面体形 六原子分子:双三角锥形 七原子分子:正八面体形
空间构型的理论模型——价层电子对互斥
l 价层电子对互斥理论:
ABn型分子(A:中心原子,B不一定为同一元素原 子)
A原子: 价电子都参与成键 有孤对电子
(类似于配位键,也有方向性) *存在 分子内 ;分子间, *作用强弱 化学键>氢键>范德华力 键长越短,氢键键能越大 *对物理性质的影响:分子间氢键越强,熔沸点 越高,硬度越大;溶质与溶剂分子间能形成氢 键,则能增加溶质的溶解度。
分子结构与性质复习ppt课件演示文稿
3.杂化轨道理论简介 (1)sp杂化 1个s轨道 和_______________ 1个p轨道 sp杂化轨道由__________ 组合而成, 直线 180° 杂化轨道间夹角为__________, 呈__________ 形 ,如
HCCH 。 __________
(2)sp2杂化 1个s轨道 和__________ 2个p轨道 组合而成,杂化轨 sp2杂化轨道由__________ 平面三角形 如__________ 120° 呈__________, HCHO 道间夹角为__________, 。
2.等电子原理 原子总数 相同、__________ 价电子总数 相同的分子具有相似的 __________ 化学键特征 它们的许多性质__________, 相似 __________, 如CO和 N2 __________ 。
三、分子的立体结构 1.常见分子的立体结构
2.价层电子对互斥模型 (1)中心原子上的价电子都用于形成共价健
(3)影响因素 相对分子质量 ①_______________ 越大,则范德华力越大。 分子极性 越大,则范德华力越大。 ②__________ (4)对物质性质的影响
物理 范德华力主要影响物质的__________ 性质,化学性质的影响 (1)概念 除范德华力之外的另一种分子间作用力 氢键是一种_____________________________________, 它是由已经与电负性很强的原子形成共价键的氢原子与另一
(3)sp3杂化 1个s轨道 和__________ 3个p轨道 组合而成,杂化轨 sp3杂化轨道由__________ 正四面体 形,如__________ 109° 28′ 呈__________ CH4 道间夹角为__________, 。
物质结构与性质全套完整(第二章分子结构与性质)PPT课件
·维特里希“发明了利用核磁共振技术测定溶液中
生物大分子三维结构的方法”。质子核磁共振
(PMR)是研究有机物结构的有力手段之一,在
所有研究的化合物分子中,每一结构中的等性氢原
子在PMR中都给出了相应的峰(信号),谱中峰
的强度与结构中的等性H原子个成正比。例如乙醛
的结构简式为CH3—CHO,在PMR中有两个信号,
▪ PCl5 ▪ PCl3 ▪ SO3 ▪ SiCl4
三角双锥形
三角锥形 平面三角形 正四面体
值得注意的是价层电子对互斥模型只能解释化合物分子 的空间构形,却无法解释许多深层次的问题,如无法解释甲 烷中四个 C---H的键长、键能相同及H—C —H的键角为109
28′。因为按照我们已经学过的价键理论,甲烷的4个C — H
.
17
课堂反馈
1、σ键与π键的形成方式有何不同,有何形象的比喻? 2、σ键与π键在对称上有何不同? 3、σ键与π键谁更牢固? 4、形成共价键的电子云是指成对电子还是未成对电子? 5、哪些共价键是σ键,哪些共价键是π键?
.
18
二、键参数:键长、键能、键角
键能: 气态基态原子形成1mol化学键 释放的最低能量
p-p σ键 (如Cl2)
.
14
π键:“肩并肩” 电子云形状呈镜像对称
.
15
科学探究
2、键的类型与成键原子电负性的关系:
0.9 3.0 2.1 3.0 2.5 3.5
2.1
0.9
1.0
离子
共价
.
16
科学探究
3、乙烷、乙烯、乙炔分子中的共价键分
别是由几个σ键和几个π键组成。
乙烷:7个σ键 乙烯 :5个σ键一个π键 乙炔:3个σ键两个π键
