第一章 光化学基本原理
光催化原理

光催化原理光催化是一种利用光照和催化剂来促进化学反应的方法。
它是一种高效、可持续的反应方式,可以应用于环境保护、能源转换和有机合成等领域。
在光催化过程中,光子激活催化剂,使得催化剂能够与反应物发生反应,从而提高反应速率和效果,减少能量消耗和环境污染。
光催化反应的原理基于以下几个方面:1.光能转换:光催化反应需要外界的光源提供能量。
当光线照射到催化剂表面时,光子与催化剂相互作用,将光能转化为催化剂的激发能量。
这种激发能量可以用来激活催化剂,使其能够与反应物发生反应。
2.电子转移:在光催化反应中,光子激发了催化剂的电子,使其跃迁到更高能级。
这种电子激发可以分为可见光催化和紫外光催化两种。
可见光催化通常利用过渡金属离子的电子跃迁,而紫外光催化则利用有机染料或半导体材料的电子跃迁。
激发的电子可以在催化剂表面上发生一系列反应,如电子传递和能量转移等。
3.化学反应:催化剂激发的电子在表面上与反应物接触后,引发一系列化学反应。
通过自由基生成、电荷转移和分子吸附等方式,催化剂能够改变反应物的能垒,降低活化能,从而提高反应速率和选择性。
4.复合物解离:光催化反应的最后一个步骤是复合物的解离。
在反应完成后,产物和催化剂之间形成的复合物需要解离,使得催化剂重新恢复到最初的状态,以便继续参与下一轮的催化反应。
基于以上几个方面,光催化的过程可以总结为以下几个步骤:1.光吸收:光线照射到催化剂表面,并被催化剂吸收。
2.电子激发:光能激发催化剂中的电子,使其跃迁到更高能级。
3.电子传输:激发的电子在催化剂表面上发生电子传输过程,与反应物接触并引发化学反应。
4.反应过程:催化剂通过吸附,催化活化、表面电子转移等方式,促进反应物转化为产物。
5.复合物解离:反应完成后,产物和催化剂之间形成的复合物需要解离,使得催化剂重新恢复到最初的状态。
光催化的经典理论主要关注光催化剂与反应物的电子传输和能量转移等过程,目前已提出多种理论模型进行解释。
化学发光检测
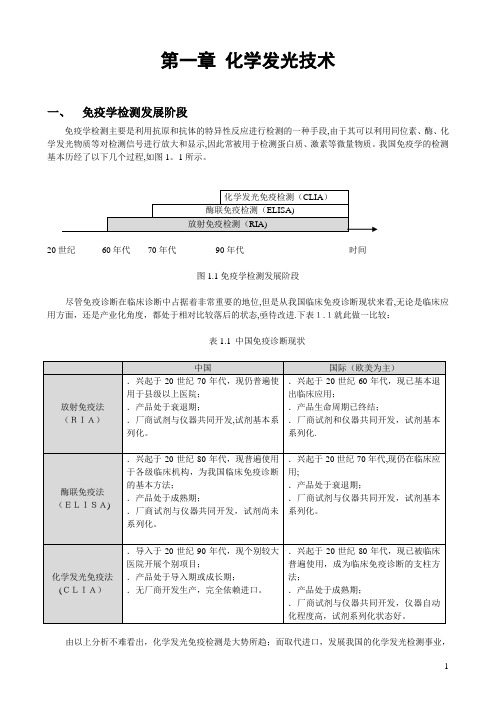
第一章化学发光技术一、免疫学检测发展阶段免疫学检测主要是利用抗原和抗体的特异性反应进行检测的一种手段,由于其可以利用同位素、酶、化学发光物质等对检测信号进行放大和显示,因此常被用于检测蛋白质、激素等微量物质。
我国免疫学的检测基本历经了以下几个过程,如图1。
1所示。
20世纪60年代70年代90年代时间图1.1免疫学检测发展阶段尽管免疫诊断在临床诊断中占据着非常重要的地位,但是从我国临床免疫诊断现状来看,无论是临床应用方面,还是产业化角度,都处于相对比较落后的状态,亟待改进.下表1.1就此做一比较:表1.1 中国免疫诊断现状由以上分析不难看出,化学发光免疫检测是大势所趋;而取代进口,发展我国的化学发光检测事业,正是临床检验界着手发展的方向。
由此,我公司自1998年立项至今,致利于化学发光检测方案设计,自行开发了具有国内领先水平的化学发光底物,与国外知名检测仪器生产商联合开发了化学发光全自动、半自动检测仪,并自行设计开发了化学发光管理软件,而今形成了仪器、试剂、软件全面配套,为我国的临床检验界提供了一套完善的解决方案。
二、化学发光免疫分析技术【概述】本世纪70年代中期Arakawe首次报道用发光信号进行酶免疫分析,利用发光的化学反应分析超微量物质,特别是用于临床免疫分析中检验超微量活性物质.目前,这一技术已从实验室的稀有技术过渡到临床医学的常规检测手段.化学发光免疫分析(Chemiluminescence Immunoassay,CLIA)是将化学发光或生物发光体系与免疫反应相结合,用于检测微量抗原或抗体的一种新型标记免疫测定技术.其检测原理与放射免疫(RIA)和酶免疫(EIA)相似,不同这处是以发光物质代替放射性核素或酶作为标记物,并藉助其自身的发光强度直接进行测定。
化学发光免疫分析既具有放射免疫的高灵敏度,又具有酶联免疫的操作简便、快速的特点,易于标准化操作。
且测试中不使用有害的试剂,试剂保持期长,应用于生物学、医学研究和临床实验诊断工作,成为非放射性免疫分析法中最有前途的方法之一。
《光学》全套课件 PPT

τ
cosΔ
dt =0
τ0
I = I1 +I2
叠加后光强等与两光束单独照射时的光强之和,
无干涉现象
2、相干叠加 满足相干条件的两束光叠加后
I =I1 +I2 +2 I1I2 cosΔ 位相差恒定,有干涉现象
若 I1 I2
I =2I1(1+cosΔ
)
=4I 1cos2
Δ 2
Δ =±2kπ I =4I1
r2
§1-7 薄膜干涉
利用薄膜上、下两个表面对入射光的反射和 折射,可在反射方向(或透射方向)获得相干光束。
一、薄膜干涉 扩展光源照射下的薄膜干涉
在一均匀透明介质n1中
放入上下表面平行,厚度
为e 的均匀介质 n2(>n1),
用扩展光源照射薄膜,其
反射和透射光如图所示
a
n1
i
a1 D
B
n2
A
n1 C
2、E和H相互垂直,并且都与传播方向垂直,E、H、u三者满 足右螺旋关系,E、H各在自己的振动面内振动,具有偏振性.
3、在空间任一点处
εE = μH
4、电磁波的传播速度决定于介质的介电常量和磁导率,
为
u= 1 εμ
在真空中u= c =
1 ≈3×108[m ε0μ0
s 1]
5、电磁波的能量
S
=E
×H ,
只对光有些初步认识,得出一些零碎结论,没有形
成系统理论。
二、几何光学时期
•这一时期建立了反射定律和折射定律,奠定了几何光学基础。
•李普塞(1587~1619)在1608年发明了第一架望远镜。
•延森(1588~1632)和冯特纳(1580~1656)最早制作了复 合显微镜。 •1610年,伽利略用自己制造的望远镜观察星体,发现了木星 的卫星。 • 斯涅耳和迪卡尔提出了折射定律
简述光化学反应的过程

简述光化学反应的过程
光化学反应是指在光的作用下, 分子或离子之间发生光吸收、电子转移或键断裂等化学反应,具有很高的反应速度和选择性。
光化学反应可以分为光离解、光引发链反应、光化合反应和光敏反应等类型。
光离解是指物质分子吸收光能后, 光子的能量被离子或原子吸收而发生离解,生成新的离子或游离基。
光离解反应的典型实例是照射溴化乙烷(CH3CH2Br) 能产生溴游离基和乙烯(C2H4)。
光引发链反应是指在光的作用下,反应中间体吸收光子能量形成自由基,然后自由基参与另一个反应环节生成新的自由基,因此引发反应链,最终生成产物。
光引发链反应是一些对荧光材料的关键反应,例如激发气体放电灯、荧光粉和其他发光材料。
光化合反应是指分子吸收光子后,电子的能量随后再次被释放,这些能量可以用于好多种不同的反应类型。
光化合反应为许多工业过程起到了至关重要的作用,例如光氧化和光氧化加氯等反应。
光敏反应是指光吸收后发生的化学反应,其中的反应物和产物不一定包括自由基和游离基,它们所生成的化合物具有较高的能量并且具有化学活性。
光敏反应的基本原理就是吸引光子的能量使化合物在发生化学反应。
在例如照片和激光的电子设备中,光敏反应都发挥着关键性的作用。
总之,由于光化学反应的高适用性和高速反应特性,它们在化学反应和产能方面具有无限的潜力。
化学反应中的发光原理

化学反应中的发光原理发光是一种精彩绝伦的现象,可以带给人们极大的惊喜和震撼。
自从人类探索科学以来,发光一直是一个重要的研究话题。
在物理学、化学和生物学等领域中,发光都有着广泛的应用。
其中,化学反应中的发光原理无疑是最受瞩目的。
本文将对于化学反应中的发光原理进行探讨。
发光现象是原子或分子内部电子能级变化的结果。
当电子跃迁到更低的能级时,会释放能量并发射光子,产生发光现象。
虽然发光现象普遍存在于许多物质中,但需要符合特定条件才能实现。
一般来说,分子和原子都是由带正电荷和带负电荷的粒子组成。
正电荷吸引负电荷,使它们在分子中稳定地相互作用。
在这种相互作用中,分子或原子的电子被束缚在原子或分子中。
这些电子只能在限制性地能级中运动。
当电子从一个能级跃迁到另一个能级时,必须吸收或释放能量。
当原子或分子在限制性的能级中允许电子从一个能级到另一个能级时,发生发光反应。
具体地说,化学反应中的发光反应是通过激发的电子从一个高能级到一个低能级跃迁来实现的。
这种过程中释放的能量通常以光的形式发射出来。
在化学反应中,少数物质能够释放和转换能量,从而发出可见的光。
同样地,这些光是由于电子从高能态跃迁到低能态而产生的。
发光反应需要具备三个基本条件:光的发射、激发剂和荧光物质。
光的发射是发光反应的重要特征之一。
光是一种电磁辐射,可以是紫外线、可见光、红外线等。
激发剂是发光反应中的重要贡献者之一,为反应提供能量,并帮助分子在激发态和基态之间跃迁。
荧光物质是反应中的最后组成部分。
它是在反应后发出光的分子。
当激发剂吸收了光时,它处于一个激发态。
由于激发态不稳定,因此处于这种状态的分子通常很快会降级到基态。
在这个降级过程中,激发态分子释放出的能量以光子的形式释放出来。
这些光子几乎在每个方向上发射出去,因此观察到的光亮度较暗、比较混乱。
化学反应中的发光原理可以应用到各个领域。
在医学、环境和化学等领域中,它们有着重要的应用。
例如,在医学中,应用发光原理制备了一些诊断试剂盒用于检测人体血液中的病原体;在环境中,利用发光原理研究环境中的污染物;在化学领域中,发光技术被广泛应用于工业反应中的催化合成和纳米材料的制备等方面。
五大化学发光标记材料原理详解及检测应用

化学发光及生物发光的原理及其应用第一部分概述化学发光 (ChemiLuminescence ,简称为 CL) 分析法是分子发光光谱分析法中的一类,它主要是依据化学检测体系中待测物浓度与体系的化学发光强度在一定条件下呈线性定量关系的原理,利用仪器对体系化学发光强度的检测,而确定待测物含量的一种痕量分析方法。
化学发光与其它发光分析的本质区别是体系产生发光 ( 光辐射 ) 所吸收的能量来源不同。
体系产生化学发光,必须具有一个产生可检信号的光辐射反应和一个可一次提供导致发光现象足够能量的单独反应步骤的化学反应。
化学发光体系用化学式表示为:依据供能反应的特点,可将化学发光分析法分为: 1 )普通化学发光分析法 ( 供能反应为一般化学反应 ) ; 2 )生物化学发光分析法 ( 供能反应为生物化学反应;简称 BCL) ; 3 )电致化学发光分析法 ( 供能反应为电化学反应,简称ECL) 等。
根据测定方法该法又可分为:1 )直接测定 CL 分析法;2 )偶合反应 CL 分析法 ( 通过反应的偶合,测定体系中某一组份;3) 时间分辨 CL 分析法 ( 即利用多组份对同一化学发光反应影响的时间差实现多组份测定 ) ;4 )固相、气相、掖相 CL 。
分析法;5 )酵联免疫 CL 分析法等。
化学发光的系统一般可以表示为:在整个的检测系统中其关键的部分为 PMT ,其直接影响到仪器的检测性能,其最高检测极限为 10 - 22 mol/L 。
不同型号的仪器其检测技术不一样,但基本原理都是利用待测组份与体系的化学发光强度呈线性定量关系,而化学发光强度随体系反应进行的速度增强或衰弱。
记录仪记录峰形,以峰高定量,也可以峰面积定量。
因化学发光多为闪烁式发光 (1—2s 左右 ) ,故进样与记录时差短,分析速度快。
第二部分、化学发光常用的化学试剂及其原理化学发光是某种物质分子吸收化学能而产生的光辐射。
任何一个化学发光反应都包括两个关键步骤,即化学激发和发光。
化学中的光催化反应原理
化学中的光催化反应原理随着科学技术的不断进步,化学反应中的光催化反应越来越受到了人们的关注。
光催化反应是指利用光的能量使得化学反应发生,其中光催化反应原理是光的能量被转化为化学能,从而使得反应发生的方式。
本文将重点探讨光催化反应原理。
光催化反应的基本原理光催化反应是在外界照射光的作用下,通过光催化剂与反应物发生作用,从而使得化学反应发生的一种反应。
在光催化反应当中,光是一个非常关键的因素。
因为光的特殊性质,它的能量可以被催化剂吸收并转化为化学能,从而使得反应发生。
这个过程被称为光催化反应。
光催化反应的过程在光催化反应过程中,催化剂吸收的光能被转化为电子能,这个电子能使得催化剂的电子跃迁到高能态。
在催化剂高能态的状态下,它会与周围的分子发生作用,从而使得反应发生。
比方说,在陶瓷催化剂的光催化反应当中,陶瓷催化剂的表面会与氧分子发生反应,从而分解氧分子并产生自由基氧分子。
自由基氧分子会与带有氢离子的分子发生反应,产生亲氢基,进而催化氧化反应的发生。
光催化反应的优点与传统的催化反应相比,光催化反应有着很多的优点。
第一,光催化反应可以使得反应速率更快,因为催化剂能够利用光能进行电子激发。
第二,光催化反应可以使得反应在较宽的温度和压力条件下发生。
第三,光催化反应可以使得反应的选择性更高,因为光催化剂的选择性更好。
总结总的来说,光催化反应原理是利用光的能量将化学反应发生的一种现象。
在光催化反应过程中,催化剂吸收的光能被转化为电子能,从而使得反应发生。
与传统的催化反应相比,光催化反应具有更快的反应速率、更宽的温度和压力条件以及更高的选择性。
因此,掌握光催化反应原理对于化学反应的研究和实践有着极其重要的意义。
化学选修第一章全课件
配合反应
酸碱之间还可以形成配 合物,如CuSO4 + 4NH3 = [Cu(NH3)4]SO4。
盐类水解原理及应用
盐类水解原理
盐在水溶液中发生电离,生成金属阳离子和酸根阴离子,这些离子与 水分子发生作用,生成弱电解质的过程称为盐类的水解。
水解类型
根据盐类组成的不同,水解可分为强酸弱碱盐、强碱弱酸盐、弱酸弱 碱盐等类型。
化学反应速率定义:单位时间内反应 物或生成物浓度的变化量。
01
影响因素
02
反应物浓度:浓度越高,反应速率越快 。
03
06
光照、超声波、电磁波等物理因素也能 影响反应速率。
05
催化剂:能降低反应的活化能,从而加 快反应速率。
04
温度:温度越高,反应速率越快。
化学平衡状态判断与特征
• 化学平衡状态定义:在一定条件下,可逆反应的正 反应速率和逆反应速率相等,反应物和生成物的浓 度不再改变的状态。
同分异构体现象
分子式相同,结构不同的化合物
判断方法
构造异构、立体异构等
实例分析
丁烷、戊烷等同分异构体
有机合成路线设计策略
逆合成分析法
从目标分子出发,逆向分析合成路线
绿色合成策略
原子经济性、环境友好性等
实例分析
阿司匹林等药物的合成路线设计
08 实验探究与创新能力培养
化学实验基本操作技能训练
01
熟练掌握常见仪器的使用方法:例如烧杯、 试管、滴定管、容量瓶等;
B
C
章节设置
每章都设有学习目标、知识点讲解、例题解 析、思考与练习等栏目,方便学生自主学习 和巩固所学知识。
实验与探究
结合课程内容设置实验和探究活动,让学生 在实践中体验化学的魅力和乐趣。
光动力学化学动力学和光热治疗的原理
光动力学化学动力学和光热治疗的原理光动力学化学动力学是一种利用特定的荧光染料来激活光敏分子,进而引发光动力学反应,实现疾病治疗的方法。
这种治疗方法的基本原理包括三个步骤:染料吸收光能量、能量转移至光敏分子并产生激发态光敏分子、激发态光敏分子与周围环境进行反应。
在光动力学化学动力学中,首先需要选择合适的荧光染料。
荧光染料是能够吸收光的其中一频率的物质,其吸收光谱与激发光的波长相匹配。
当患处或病变区域被加入荧光染料后,荧光染料分子能够吸收激光或其他特定频率光的能量。
这个过程是一个光学激发的过程,荧光染料在这一过程中吸收了光子能量,从基态跃迁到激发态。
接下来,吸收能量的激发态光敏分子会与周围环境发生反应。
这个反应过程是选择性作用于病变区域的关键步骤。
激发态光敏分子能够与周围的氧分子进行化学反应,形成高度活性的氧自由基(ROS),如单线态氧(¹O₂)。
最后,ROS会导致局部氧的耗尽,进而产生光动力学效应。
这些活性氧会破坏细胞膜、蛋白质和DNA,抑制或杀死病变细胞。
光动力学效应与病变区域的选择性染色有关,因为只有在染料存在的地方,荧光染料才会被激发,进而产生光动力学效应。
与光动力学化学动力学不同,光热治疗是一种利用光热效应来治疗疾病的方法。
光热治疗的基本原理是将光敏分子或光敏剂引入体内,通过吸收外部激光的能量,产生热量以实现治疗目标。
在光热治疗中,光敏剂是一种可以吸收特定波长光能量的物质。
当患处或病变区域被加入光敏剂后,该光敏剂分子能够吸收激光的能量并发生光热效应。
光热效应通过激光能量在特定时间内转化为热能,进而产生高温。
这个高温能够杀死病变细胞或损伤病变组织,实现治疗效果。
光热治疗可以通过调节激光的参数,如功率、持续时间和照射面积,来控制治疗效果。
光热治疗在很多疾病治疗中都有应用,包括肿瘤治疗、静脉瘤治疗、白内障手术等。
光热治疗具有无创伤、可控制性、选择性等特点。
总之,光动力学化学动力学和光热治疗是两种常见的光学疗法,分别基于光动力学效应和光热效应来治疗疾病。
20154-20光化学原理与应用 激发态的产生与失活 第二章 第一节--激发态的产生 已讲 4-22
光化学第一定律 光化学第二定律 Franck-Condon 原理 Lambert-Beer
24
1、光化学第一定律
Grotthus-Draper-The first law of photochemistry - only that light which is absorbed by a system can bring about a photochemical change.
∆E = N hv (per mole)
0
26
3、Franck-Condon 原理
相对于分子振动周期(约10-13 s),电子跃迁所需的时 间极短 (10-15 s)。因此在电子跃迁的瞬间,分子内的核 间距不变。 在势能对核间距的关系图上,电子跃迁可用一条垂直 的直线来表示。 按照该原则,分子被由基态激发至第一激发态时,必 然沿着垂直于核间距坐标的线跃迁,这种跃迁称为 Franck-Condon 跃迁。其概率最大,谱带强度最强
烯烃 π轨道
u
烯烃 π*轨道 g
羰基n轨道 u
π→π*, u→g, 跃迁允许; n→π* , u→u, 跃迁禁阻 σ →π*, g→g, 跃迁禁阻
36
4、轨道重叠
电子跃迁涉及的两个轨道在空间的同一区域, 即相互重叠。 轨道重叠,跃迁允许,反之禁阻
烯烃 π轨道
烯烃 π*轨道
羰基n轨道
羰基化合物的π →π * 跃迁 允许,因在同一 平面,重叠程度大;而 n →π * 禁阻,因两 个轨道不在同一平面,重叠程度低
分子跃迁发生的几率受以下几个因素制 约,这些制约因素称为选择定则。 是由量子学理论得出的。 哪些因素决定光照时跃迁发生的概率?-选择定则要回答的问题 选择定则包括: Franck-Condon 原理, 自旋选择定则,轨道对称性及轨道重叠
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1.5.7 Jablonski图解
上述激发态失活的过程可总结在Jablonski图中, 该图表示出体系状态转变时可能出现的光化学和光物 理过程。
a,吸收; f,荧光; p,磷光; ic, 内转换; isc, 系间窜越; ET,能量传递; ELT,电子转移; chem, 化学反应
1.6 光化学发展的趋势
1.4.6 自旋选择定则
在电子跃迁过程中电子的自旋不能改变,符合这 一规则的跃迁,如单重态→单重态、三重态→三重态 跃迁是允许的,违背这一规则的跃迁,如单重态→三 重态和三重态→单重态跃迁是禁阻的。
1.4.7 宇称禁阻
宇称禁阻有跃迁所涉及的轨道的对称性决定,分 子轨道的对称性取决于所描述分子轨道的波函数在通 过一个对称中心反演时符号是否改变。波函数分为对 称的(g)和反对称的(u)两类。通过对称中心反 演,分子轨道的波函数改变符号,称为反对称的;如 果不改变符号,称为对称的。选择规则指出u→g和 g→u的跃迁是允许的,而g→g和u→u的跃迁是禁阻
1.5.2 辐射跃迁
分子由激发态回到基态或由高级激发态到达低级 激发态,同时发射一个光子的过程称为辐射跃迁,包
括荧光和磷光。
荧光 荧光是多重度相同的状态间发生辐射跃迁所产生 的光,这个过程速度很快。有机分子的荧光通常是 S1→S0跃迁所产生的,虽然有时也可以观察到S2→S0 (例如某些硫代羰基化合物)的荧光。当然由高级激 发三重态到低级激发三重态的辐射跃迁也产生荧光。
1.3.3 激发态的能量
激发态的能量是决定激发态的化学和物理性质的另 一个最重要的因素。对于同一电子组态的激发态,单重 激发态的能量比三重激发态的能量要高,这是因为自旋 相同的电子间的排斥力比自旋不同的电子间的排斥力 小,这和洪特规则——原子的电子组态应具有最大的多 重度——是一致的。单重和三重激发态的能量差值的大 小取决于所涉及轨道的空间重叠程度。
能量传递过程也要求电子自旋守恒,因此只有下述 两种能量传递具有普遍性:
单重态-单重态能量传递
D*(S1) + A(S0)
三重态-三重态能量传递
D(S0) + A*(S1)
D*(T1) + A(S0)
D(S0) + A*(T1)
能量传递的机制分为两种――共振机制和电子交 换机制。前者适用于单重态-单重态能量传递,后者既 适用于单重态-单重态能量传递,又适用于三重态-三 重态能量传递。
的。
1.4.8 轨道重叠
如果电子跃迁所涉及的两个轨道在空间的同一区 域,即相互重叠,这种跃迁是允许的,否则是禁阻 的。 一种电子跃迁,只有被上述所有选择定则允许, 这种跃迁才是允许的;如果其中一个选择定则禁阻,
这种跃迁发生的可能性就很小。
1.5 激发态的衰减
1.5.1 Kasha规则
基态分子吸收一个光子生成单重激发态,依据吸收 光子的能量大小,生成的单重激发态可以是S1,S2, S3…,由于高级激发态之间的振动能级重叠,S2、S3 等会很快失活到达最低单重激发态S1,这种失活过程一 般只需1013S,然后由S1再发生光化学和光物理过程。 同样,高级三重激发态(T2,T3…)失活生成最低三重 激发态T1也很快。所以一切重要的光化学和光物理过程 都是由最低激发单重态(S1)或最低激发三重态(T1) 开始的,这就是Kasha规则。 激发态分子失活回到基态可以经过下述光化学和光 物理过程;辐射跃迁、无辐射跃迁、能量重叠、电子转 移和光化学反应。
1.5.5 电子转移
激发态的分子可以作为电子给体,将一个电子给予 一个基态分子,或者作为受体从一个基态分子得到一个 电子,从而生成离子自由基对。
D* + A
或
D+ + AD+ + A-
D + A*
1.5.6 化学反应
激发态分子失活的另一条最重要的途径是发生化 学反应生成基态产物,这一过程是光化学研究的主要 内容。
系间窜越
系间窜越是不同多重度的能态之间的一种无辐射 跃迁。跃迁过程中一个电子的自旋反转,例如,
S1 →T1或T1 →S0。
能量传递
激发态分子另一条失活的途径是能量传递,即一 个激发态分子(给体D*)和一个基态分子(受体A) 相互作用,结果给体回到基态,而受体变成激发态的 过程。
D* + A
D + A*
磷光 磷光是不同多重度的状态间辐射跃迁的结果,典型 跃迁为T1→S0;Tn→S0则很少见。这个过程是自旋禁 阻的,因此和荧光相比,其速度常数要小得多。
1.5.3 无辐射跃迁
激发态分子回到基态或者高级激发态到达低级激 发态,但不发射光子的过程称为无辐射跃迁。这种过
程包括内转换和系间窜越。
内转换
内转换是相同多重度的能态之间的一种无辐射跃 迁,跃迁过程中电子的自旋不改变,例如Sm→ Sn 或Tm → Tn,这种跃迁是非常迅速的,只需10/-12s。
国际上光化学的研究已经进入一个新的阶段,光 化学发展的新趋势是:第一,在研究的时间尺度上, 使用的手段正由稳态向瞬态发展,时间分辨技术的出 现和普及,使人们更深刻地认识光化学和光物理的机 制已成为可能。第二,在研究的空间尺度上,正由分 子层次向分子以上层次发展,分子光化学和超分子光 化学紧密的相结合。第三,有应用前景的基础研究正 在加强,光化学在理论上的研究成果加速向高技术转 化。今后光化学的重点研究内容将是: 超分子光化学和光物理;生物光化学;合成光化 学;光电化学和光催化。
如果分子中一个电子激发到能级较高的轨道上 去,并且被激发的电子仍然保持其自旋方向不变,这 时S仍等于零,体系处在激发单重态。如果被激发的电 子在激发时自旋方向发生了改变,不再配对,(↑↑)或 (↓↓),由于两个电子不在同一条轨道,不违背Pauli 原理,这时自旋量子数之和S=1, 2S+1=3,体系处在 三重态,用符号T表示之。
1.4.3 吸收光谱
有机分子在溶液中的吸收光谱是在紫外-可见光谱 仪上测定的。紫外光谱仪记录谱带强度和波长(nm) 或波数(cm﹣1)的函数关系。最大吸收波长的摩尔消光
系数是吸收带强度的一个量度。
1.4.4 选择定则
一种电子跃迁是允许的还是禁阻的决定于跃迁过 程中分子的几何形状和动量是否改变,电子的自旋是 否改变,描述分子轨道的波函数是否对称以及轨道空 间重叠程度。
1.4.5 Frank-Condon原理
由于质量的差别,组成分子的原子核的运动比电 子的运动要慢得多,电子跃迁一般在10-15S完成, 在这个时间间隔内,原子核可以看做是不动的,即电 子跃迁过程中,分子的几何形状和动量不变,这就是 Frank-Condon原理。符合这个原理的跃迁是允许的, 违背这个原理的跃迁是禁阻的。
1.3.2 激发态的多重态
分子或原子的多重态是在强度适当的磁场影响 , 化合物在原子吸收和发射光谱中谱线的数目。分子或原 子光谱中呈现(2S+1)条谱线。这里,S是体系内电子 自旋量子数的代数和。一个电子的自旋量子数可以是 +1/2或﹣1/2。根据Pauli不相容原理,两个电子在同一 个轨道里,必须是自旋配对的,也就是一个电子的自旋 量子数是+1/2(用↑表示),另一个一定是﹣1/2(用↓ 表示)。如果分子轨道里所有电子都是配对的(↑↓), 自旋量子数的代数和等于零,(2S+1)为1。多重态是 1的分子状态称为单重态,用符号S表示之。大多数分子 的基态都是单重态,但也有例外,最明显的是氧分子的 基态是三重态。
两个p轨道的线性组合产生两个分子轨道,一个是 成键轨道(π),一个是反键轨道(π*)。反键轨道能量比 成键轨道能量高。反键轨道有两个节面,一个在分子 的平面(x,y)中,另一个在以π键相连的两个原子 之间,与分子骨架(y,x平面)成垂直。 与烯烃类似,羰基的π和π*轨道如下图所示,π 轨道电荷密度转向电负性比较强的氧原子,π*键中电 子转向碳原子。
第一章 光化学基本原理
1.1 1.2 1.3 1.4 1.5 1.6 概述 分子轨道 6.1 概述 电子激发态 激发态的产生 激发态的衰减 光化学的发展趋势
1.1 概 述
光化学是研究处于电子激发态的原子分子的结构及 其物理化学性质的科学。现代分子光化学是一门多学科 交叉的边缘学科,包括有机光化学、无机光化学、高分 子光化学、生物光化学、光电化学和光物理等门类。现 代光化学对电子激发态的研究所建立的新概念,新理论 和新方法大大开拓了人们对物质认识的深度和广度,对 了解自然界的光合作用和生命过程、对太阳能的利用、 环境的保护、开创新的反应途径、寻求新的材料提供了 重要基础,在新能源、新材料和信息处理新技术等高薪 技术领域中发挥着越来越重要的作用。
ψ1=ΦA+ΦB ψ2=ΦA-ΦB
n轨道:
在含有杂原子的分子中,杂原子的未共用电子对在 未成键轨道中,这种轨道不参与分子的成键体系,例 如,在羰基化合物中,氧原子的未成键2p轨道(n轨 道)上有两个电子。P轨道是哑铃式的,在中心原子那 里有一个节面。
π轨道和π*轨道
原子的2p轨道边靠边(平行)重叠,形成π轨道。 通常这种轨道用图像表示为p轨道的线性组合,在分子 平面上有一个节面。在烯烃中,π键电子在分子平面两 侧对称分布。与π轨道想对应的是反键π*轨道。
1.2 分子轨道
按LCAO-MO法,分子轨道是由构成的原子价壳层 的原子轨道线性组合形成的。原子轨道和分子轨道可以 用原子波函数描述。例如,两个相等的原子轨道ΦA和 ΦB相互作用产生两个分子轨道:
ψ1=ΦA+ΦB ψ2=ΦA-ΦB
其中一个分子轨道是成键的,它比原来的原子轨道 更稳定,另外一个分子轨道是反键的,它比原来的原子 轨道能量高。 分子光化学中主要涉及五种类型的分子轨道:未成 键电子n轨道、成键电子σ和π轨道,反键电子σ*和π*轨道
上式中每个括号右上脚的数字表示该轨道上电子数 目,由于与化学反应最有关的是最到占有轨道和最低空 轨道,上式可以简化为:
