无血清细胞培养
细胞适应无血清培养基的方法

细胞适应无血清培育基的方法目前,血清仍是动物细胞培育中最基本的的添加物,尤其是在原代培育或者细胞生长情形不良时,常常会先使用有血清的培育液进行培育,待细胞生长旺盛以后,再换成无血清培育液。
细胞转入无血清培育基培育要有一个适应过程,一般要渐渐降低血清浓度,从10%削减到5%,3%,1%,直至无血清培育。
在降低过程中要注意察看细胞形态是否发生变更,是否有部分细胞死亡,存活细胞是否还保持原有的功能和生物学特性等。
在试验后这些细胞一般不再连续保管,很少有细胞能够长期培育于无血清培育基而不发生更改的。
细胞转入无血清培育之前,要留有种子细胞,种子细胞按常规培育于含血清的培育基中,以保证细胞的特性不发生变更。
为了使细胞适应无血清培育,关键的是使所培育细胞:1.处于对数生长中期2.90%活细胞率3.适应时以较高的起始细胞接种细胞适应无血清培育基的方法:1. 直接适应细胞从添加血清的培育基转换到无血清培育基(SFM)中。
一些类型细胞可直接从包含血清的培育基适应无血清培育基。
对于直接适应,接种细胞密度应当:2.5105~3.5105细胞/ml。
当细胞密度实现1106~3106细胞/ml时,传代培育细胞。
当细胞密度在培育4到7天后实现2106~4106细胞/ml时,细胞wan全适应了无血清培育基。
每隔3~5天,当细胞密度实现1106~3106细胞/ml,细胞活率在90%时,储备的适应了无血清培育基的细胞培育物应当再次传代培育。
2. 连续适应分好几步把细胞从添加血清的培育基转换到无血清培育基(SFM)中,与直接适应相比较,连续适应趋向对于细胞更加不冷不热一些。
(1)、以2倍正常接种密度接种生长活跃的细胞培育物到75%有血清培育基:25%SFM混合培育基中,传代培育。
(2)、当细胞密度5105细胞/ml时,以2105到3105细胞/ml细胞密度,在有血清培育基:SFM为50∶50的混合培育基中传代培育。
(3)、以2106到3106细胞/ml细胞密度,25%有血清培育基和75%SFM中传代培育。
NK细胞无血清培养套装使用说明书——脐血2L体系
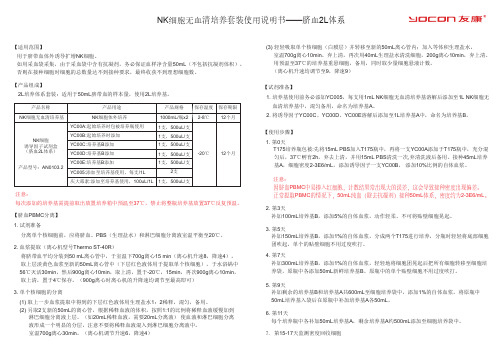
NK 细胞无血清培养套装使用说明书——脐血2L 体系【适用范围】【试剂准备】【使用步骤】【产品组成】【脐血PBMC 分离】用于脐带血体外诱导扩增NK 细胞。
如用采血袋采集,由于采血袋中含有抗凝剂,务必保证血样净含量50mL (不包括抗凝剂体积),否则在接种细胞时细胞的总数量达不到接种要求,最终收获不到理想细胞数。
2L 培养体系套装:适用于50mL 脐带血的样本量,使用2L 培养基。
分离单个核细胞前,应将脐血、PBS (生理盐水)和淋巴细胞分离液室温平衡至20℃。
将脐带血平均分装到50 mL 离心管中,于室温下700g 离心15 min (离心机升速8,降速4), 取上层淡黄色血浆至新的50mL 离心管中(下层红色液体用于提取单个核细胞),于水浴锅中 56℃灭活30min ,然后900g 离心10min ,取上清,置于-20℃,15min ,再次900g 离心10min , 取上清,置于4℃保存。
(900g 离心时离心机的升降速均调节至最高即可) 1. 第0天T175培养瓶包被:先将15mL PBS 加入T175瓶中,再将一支YC00A 添加于T175瓶中,充分混 匀后,37℃孵育2h ,弃去上清,并用15mL PBS 清洗一次,弃清洗液后备用。
接种45mL 培养 基A ,细胞密度2-3E6/mL ,添加诱导因子一支YC00B , 添加10%比例的自体血浆。
2. 第3天补加100mL 培养基B ,添加5%的自体血浆,动作轻柔、不可将贴壁细胞晃起。
3. 第5天补加150mL 培养基B ,添加1%的自体血浆,分成两个T175进行培养,分瓶时轻轻将底部细胞 团吹起,单个的贴壁细胞不用过度吹打。
4. 第7天补加300mL 培养基B ,添加1%的自体血浆,轻轻地将细胞团晃起后把所有细胞转移至细胞培 养袋,原瓶中各添加50mL 新鲜培养基B 。
原瓶中的单个贴壁细胞不用过度吹打。
(1) 取上一步血浆提取中得到的下层红色液体用生理盐水1:2稀释,混匀,备用。
CHO细胞无血清培养基技术手册

(1)无血清培养基,为一般意义上无血清培养基,用各类可替代血清功能的生物材料配制细胞培养基,如牛血清白蛋白(BSA)、转铁蛋白、胰岛素等生物大分子物质,以及从血清中提取的去除蛋白质的混合脂类以及水解蛋白等。其特点是培养基中的蛋白含量较高,添加物质的化学成分不明确,其中含有大量的动物来源蛋白。
5 CHO细胞无血清无动物组分培养基(SAF-CHO-G-004)
其实个性化培养基并不新鲜,在国外生物制药企业普遍采用个性化培养基,世界著名的生物制药公司(如Amgen、Genetech)往往和培养基企业合作,通过细胞培养基的客户定制方式,研制最适合自身细胞特点的个性化细胞培养基应用于生产实践,用于提高细胞产率和生产效率。另有数据显示,国际上的细胞培养基生产企业,个性化、定制培养基占其培养基业务的90%以上,目录培养基不足10%。
ATCC提供的CHO/dhfr-细胞照片
2 CHO细胞表达系统的优势与特点
由于哺乳动物细胞结构、功能和基因表达调控的复杂性,外源基因在哺乳动物细胞中的表达与在原核生物中的表达存在较大差异,因而外源基因在哺乳动物细胞中高效表达所需的元件也不同于在原核生物细胞中的表达所需的元件。外源基因在哺乳动物细胞中的表达包括基因的转录、mRNA翻译及翻译后蛋白质的加工等过程,如蛋白质的糖基化、磷酸化、寡聚体的形成以及蛋白质分子内或分子间二硫键的形成等比较复杂,要表达具有生物学功能的蛋白质如膜蛋白、抗体和具有特异性催化功能的酶需要在哺乳动物细胞中进行。
其它
无水葡萄糖、HEPES、丙酮酸钠、亚油酸、硫辛酸、胰岛素、亚硒酸钠、植物蛋白等
动物细胞无血清培养基团体标准

动物细胞无血清培养基团体标准
《动物细胞无血清培养基团体标准》
一、定义
动物细胞无血清培养基团体标准是指经过医药品监督管理局批准,由生物制药企业研发生产的,满足过敏原性和病原性安全要求,具备良好的培养细胞生长效果,符合国家监督管理部门要求的,用于动物细胞培养的无血清培养基产品集合。
二、统一标准
1、细胞壳物质:
需要满足AHG良好质量控制,无害性,无病原体残留,包装完整和干燥。
2、培养基中的营养物质:
必须具有良好的可溶性,符合规定的营养成分,并具有良好的生长效果。
3、无血清培养基的质量:
材料按照标准要求,经质量检测符合国家监督管理部门的要求,使用安全可靠。
4、培养基的操作性能:
必须符合国家监督管理部门的要求,具有良好的操作性能,操作简便,满足细胞生长的需要,保证实验数据的准确性。
5、多元化配方:
根据实验要求,将培养基以多元、多样的配方提供,根据细胞
个体的特性,提供相应的配方,满足细胞的培养需求。
三、使用规范
1、根据用途选择正确的培养基:
根据实验要求,选择合适的培养基,满足实验需要,有效防止实验失败。
2、遵循正确的操作方式:
按照培养基的使用说明正确操作,以防出现不可预料的意外。
3、注意保存培养基:
将培养基储存在室温下,避免阳光直射,注意防止污染。
4、正确处理培养基:
使用完的培养基应及时处理,以免造成环境污染。
动物细胞无血清培养基的优势、特点与实验研究

动物细胞无血清培养基的优势、特点与实验研究摘要:动物细胞无血清培养基相比天然培养基、合成培养基等传统培养基有无可比拟的优势,其组成成分相对清楚,制备过程简单,日益得到生物技术界的重视。
运用统计学实验方法,可科学有效地考察细胞培养基中多因素、多水平间的交互作用。
应用新型蛋白质组分分析技术及生物芯片技术定位胞浆信号通路相关蛋白、膜表面的生长因子受体、激素受体、细胞因子受体、粘附分子等,用以确定细胞培养基中调控分子的添加组合。
对无血清培养基的优势特点及常用的实验研究进行概述。
以期为动物细胞无血清培养基的研究与研制提供参考。
关键词:动物细胞;无血清培养基;实验设计动物细胞培养技术是当今生物工程领域中的前沿研究课题之一,无论是在基础研究还是生产实践方面都得到生物技术界的重视。
随着哺乳动物细胞培养规模的扩大和生物药物需求的增长,基于细胞及产品特性的无血清培养基的研制已成为细胞工程领域的重要课题。
无血清细胞培养技术的研究日益得到人们的重视。
近年来,有关无血清培养基的研制和开发得到了迅速发展,推动了基因工程产品及产业的发展。
1 无血清培养基的优势特点及分类细胞培养基是细胞体外培养的最重要因素。
无血清培养基是继天然培养基、合成培养基之后的第三类培养基。
与传统的培养基相比,无血清培养基是一种不含有动物血清或其他生物提取液,但仍可以维持细胞在体外较长时间生长、繁殖的一种培养基。
无血清培养基由于其组成成分相对清楚,制备过程简单,在现代生物技术学领域得到广泛应用。
无血清培养技术也是阐明细胞生长、增殖、分化及基因表达调控的基础研究问题的有力工具。
常规细胞培养基的制备方法是在基础培养基中添加相应量的血清或组织提取物,其中最常用于培养基的血清是一种组分很不明确的混合物。
所以常规血清细胞培养基存在以下缺点:(1)血清来自于动物体,其对细胞在体外培养时的主要作用是提供生长因子、激素、结合蛋白,并提供保护作用,但同时也有细胞生长抑制因子和毒性因子,所以存在潜在毒性。
一种无血清细胞培养基制备方法

一种无血清细胞培养基制备方法
无血清细胞培养基制备方法
无血清细胞培养基是一种新兴的培养基类型,相较于传统的含血清培养基,无血清细胞培养基具有更好的稳定性和适应性。
本文介绍一种简易的无血清细胞培养基制备方法。
材料准备:
1. 高糖DMEM培养基
2. Pen/Strep 抗生素
3. L-谷氨酸
4. 精胺
5. 尿素
6. FBS-游离的胎牛血清
步骤:
1. 取一烧杯,将200 mL高糖DMEM培养基倒入其中。
2. 向培养基中加入100 μg/mL的Pen/Strep 抗生素,混匀。
3. 加入L-谷氨酸至最终浓度为 4 mM,混匀。
4. 加入精胺至最终浓度为 0.8 mM,混匀。
5. 加入尿素至最终浓度为 0.4 mM,混匀。
6. 加入2 mL FBS-游离的胎牛血清,混匀。
7. 倒入含有过滤器的瓶中,高温高压灭菌后即可使用。
值得注意的是,该培养基不宜长时间存储,需每周更换一次。
通过以上步骤,即可制备一种简易的无血清细胞培养基。
该培养基适用于多种常见细胞系的培养,具有较好的生长效果和细胞活力。
同时,由于不含血清成分,可以避免因批次不同导致的影响,保证实验的重复性和可靠性,具有一定的应用前景。
无血清培养基介绍

无血清培养基介绍无血清培养基是一种无需添加动物血清的培养基,适用于细胞的体外培养。
相较于传统的含有动物血清的培养基,无血清培养基具有许多优势,如避免了潜在的传染病传播风险、提高了细胞培养的一致性和可重复性,同时也降低了培养的成本。
本文将介绍无血清培养基的成分、制备方法以及应用领域等方面的内容。
无血清培养基的基本成分包括碳源、氮源、微量元素、维生素、生长因子、胶原蛋白和附加物等。
碳源常用的有葡萄糖、果糖等,氮源常用的有谷氨酸、天冬酰胺等。
微量元素是重要的细胞营养物质,包括铁、锌、铜、锰等,其浓度一般较低。
维生素在细胞的代谢过程中起到重要的辅酶和辅因子的作用,为细胞的正常生长提供必需物质。
生长因子是一类具有特定生物活性的蛋白质,能够直接影响细胞的增殖和分化。
胶原蛋白是一种结构性蛋白质,可以提供细胞粘附的基质支持。
其他附加物如氨基酸、核酸、脂质等也可以根据具体需要添加到培养基中。
无血清培养基的制备过程主要包括消毒、配制、滤过、灭菌等步骤。
消毒包括培养器皿、玻璃棒、试剂瓶等的高压蒸汽灭菌,确保杂菌的清除。
配制过程中需要将不同成分按照一定比例配制成培养基液。
滤过是为了除去微生物和大分子物质,常用的有0.22μm的滤膜过滤。
灭菌是一种无菌操作,可以使用高压蒸汽灭菌器或者紫外线灭菌器,确保培养基的无菌性。
无血清培养基在许多领域具有广泛的应用。
在生物医学研究领域,无血清培养基可以用于细胞培养、细胞扩增和细胞实验等。
细胞培养是生物医学研究中非常重要的实验手段,可以用于研究细胞的生理和病理功能,评估药物的毒性和疗效等。
在生物制药领域,无血清培养基可以用于生产重组蛋白、疫苗和细胞疗法等。
传统的生物制药方法中,常使用含有动物血清的培养基,但是这种方法存在一些问题,如潜在的传染病传播风险、批次差异大等。
无血清培养基不仅可以提高生产一致性和控制性,还可以降低成本和生产风险。
总结来说,无血清培养基是一种无需添加动物血清的培养基,具有许多优势,如避免了传染病传播风险、提高了培养一致性和可重复性,降低了培养的成本。
ksr细胞培养浓度范围

ksr细胞培养浓度范围
KSR细胞培养液是一种无血清培养液,通常用于体外培养干细胞和诱导多能干细胞分化。
在使用KSR细胞培养液时,对于浓度的范围需要根据具体的细胞类型和实验要求来确定。
一般来说,KSR 细胞培养液的浓度通常在5%到20%之间。
对于干细胞的培养,一般建议使用10%到20%的KSR浓度,以提供细胞生长和分化所需的适当营养物质和因子。
在进行多能干细胞的诱导分化时,可以根据特定的实验方案来确定KSR的最佳浓度,通常在5%到15%之间。
需要注意的是,不同细胞系可能对KSR的浓度有不同的需求,因此在使用KSR细胞培养液时,最好根据文献资料或者先前的实验经验来确定最适合特定细胞类型和实验条件的最佳浓度范围。
此外,还需要注意到KSR细胞培养液的浓度也会受到其他培养条件的影响,比如细胞密度、培养基成分等。
因此,在确定KSR细胞培养液的最佳浓度时,需要综合考虑多种因素,进行实验优化和验证,以获得最佳的培养效果。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
无血清细胞培养
摘要:本文综述了动物和昆虫细胞培养对细胞培养基的要求,并且在总结细胞培养基化学成分的基础上归纳了细胞无血清培养的条件和目前的研究现状。
关键词:细胞培养无血清
细胞培养是从生物体内取出细胞, 模拟其体内的生理环境, 在无菌、适温和丰富的营养条件下, 使细胞生存、生长并维持结构和功能的技术。
细胞培养基成分要求
在动物和昆虫细胞培养中,培养基是细胞培养的关键, 培养基是细胞赖以生长、增值、分化的重要因素。
不同种类的昆虫细胞对氨基酸有不同的要求, 至少有14种必需的氨基酸是细胞本身不能合成而必须由培养基提供的。
细胞需要谷氨酰胺合成核酸和蛋白质, 维生素对促进昆虫细胞生长、促进细胞贴附有作用, 泛酸、异已酸、乙酸及核黄素等对细胞的存活是有利的,胆碱、吡哆醇、硫胺素、尼克酰胺等可促进细胞增殖, 无机盐在培养基中维持昆虫细胞生长的渗透压。
水解乳蛋白和酵母提取物是昆虫细胞培养基中最常用的添加物。
缺少谷氨酰胺会影响到细胞的生长速度,细胞需要谷氨酰胺合成核酸和蛋白质,几乎所有的昆虫细胞对谷氨酰胺都有较高的要求。
因此,昆虫细胞自身合成谷氨酰胺不如直接在培养基中摄取有效,所以各类培养基中都含有较高浓度的谷氨酰胺。
有机酸,单独测试时只有苹果酸有生长促进作用。
联合使用时,则对细胞生长有显著的促进作用。
一般认为,泛酸、异己酸、乙酸及核黄素等对细胞的存活是有利的,而胆碱、吡哆醇、硫胺素、尼克酰胺等可促进细胞增殖。
在昆虫细胞培养基中无机盐浓度略高,这是因为昆虫细胞要在高于哺乳动物细胞生长的渗透压中生长,并且各无机盐离子之间需要平衡,其中Na+/K+比例在某些细胞系中有严格的要求。
某些微量元素如Fe2+、Mn2+、Cn2+、Zn2+、A13+等能促进细胞贴附和增加产量,其中A13+和Zn2+还可以促进病毒的感染和复制。
在昆虫细胞悬浮培养中还需添加一些多聚物如甲基纤维素,聚乙烯吡咯烷酮和聚丙二醇与环氧乙烷的加聚物等,以保护细胞免受机械剪切力的损伤和降低细胞聚集程度。
大部分鳞翅目昆虫细胞在25~30℃之间生长最佳。
培养基pH保持在6.2左右。
多数昆虫细胞倍增时间为16-24 h。
血清的作用及其缺点
动物血清对细胞生长和促进细胞分裂有非常重要的作用。
血清能够提供促进细胞生长、
分裂和分化的激素物质;血清中含有携带激素、矿物质、微量元素和脂类物质的转运蛋白;血清能够提供细胞贴壁因子和扩散因子;血清中含有起稳定作用和解毒的因子,能够维持培养基的pH值并抑制蛋白酶直接或间接的酶解。
目前,昆虫细胞一般是在含有昂贵的哺乳动物血清的培养基中培养,成本高,限制了昆虫细胞大规模培养技术的发展。
同时,血清来源困难,质量不稳定,批量之间的差异大,重复性差;血清是异源病毒污染的重要来源;动物血清成分复杂,各种生物大小分子混合在一起, 很多成分至今不明, 这对后期培养产物的分离、提纯以及检测造成困难,也极大的限制了基因工程表达产物的纯化。
因此,人们努力开发无血清培养基。
无血清培养基
如果基础培养基中很少或者没有氮基酸,蛋白胨能够起到营养的作用。
有实验表明,蛋白胨对哺乳动物细胞有一定的营养作用。
同时基于表达产物的安全考虑不提倡使用肉类水解产物,大豆水解产物可以用于配制昆虫无血清培养基。
水解乳蛋白和酵母提取物是不定成分氪基酸的主要来源。
其中含有l1种必需氯基酸和7种非必需氨基酸。
水解乳蛋白和酵母提取物中含有胞生长因子能够部分替代血清中的生长因子。
无血清培养基中要添加微量元素Fe2+、Mn2+、Cn2+、Zn2+、A13+等。
因为在有血清培养基中,这些微量元素主要由血清提供。
维生素的添加,在基础培养基中一般已含有维生素,但研究无血清培养基时仍常常增加维生素的量,维生素对促进细胞生长,增加细胞密度,促进细胞贴附都有作用。
一般认为,泛酸,异已醇。
叶酸,核黄素等对细胞的存活是有利的,而胆碱,吡哆醇,硫胺素,尼克酰胺等会促进细胞增殖。
添加脂类,一般情况下,培养基中不直接加入脂类,而由血清提供。
无血清培养基中因无脂类物质供应。
许多研究者加入脂类复合物代替游离的脂肪酸。
脂类是细胞膜的主要成分,加入脂类物质可促进细胞增殖。
无血清培养基的优点和不足
无血清培养基的优点:化学成分明确,培养条件容易控制;除去病毒污染的来源;消除了不同批次培养基之间在数量和质量上的差异;便于细胞培养产物的分离等下游的操作;大大降低成本,提供研究细胞的生理代谢,细胞信号的优良平台。
但目前无血清培养基只能支持某一种或少数几种细胞的生长,并且,细胞对无血清培养基有一个较长的适应期,较有血清培养基中的细胞,无血清培养基中的细胞其膜易碎。
这些结果揭示,所加因子并不能完全替代血清中有用因子,这给无血清培养基的研究和应用带来局限性。
因此,更加广泛寻找能促进细胞生长,增殖.消除或缩短细胞对无血清培养基的适应期,以及保护膜的因子是发展无血清培养基的关毽。
参考文献:
[1]戴琥,赵佼,谭文橙. 无血清培养昆虫细胞(BTI-Tn-5B1-4)的适应过程[J ]. 生物工程学报,2000, 16(2).
[2] 曹翠平,吴小峰,鲁兴萌. 昆虫细胞无血清培养[J].细胞生物学杂志,2005,27(127-132).
[3] 余泽化,刘冬连,陈趣候. 昆虫细胞无血清培养基研究进展[J]. 生物工程进展,1996,16(1).
[4] 张佑红,朱雄伟,陈燕. 昆虫细胞无血清培养及其应用进展[J].2006,28(5).。
