判断物质熔沸点高低的方法
物质熔沸点的比较
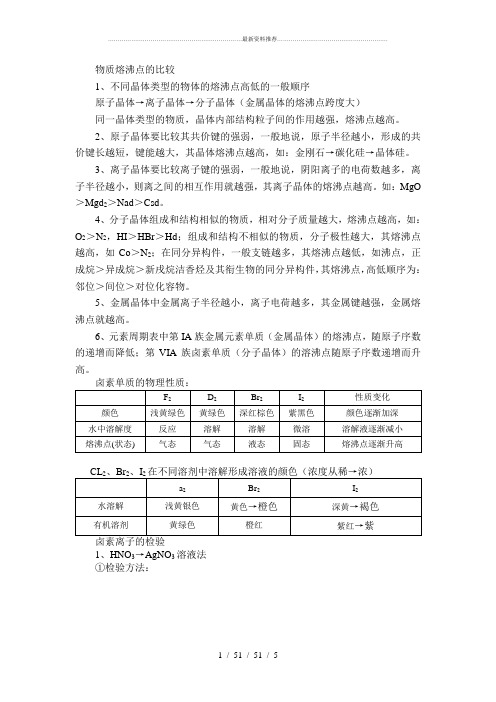
物质熔沸点的比较1、不同晶体类型的物体的熔沸点高低的一般顺序原子晶体→离子晶体→分子晶体(金属晶体的熔沸点跨度大)同一晶体类型的物质,晶体内部结构粒子间的作用越强,熔沸点越高。
2、原子晶体要比较其共价键的强弱,一般地说,原子半径越小,形成的共价键长越短,键能越大,其晶体熔沸点越高,如:金刚石→碳化硅→晶体硅。
3、离子晶体要比较离子键的强弱,一般地说,阴阳离子的电荷数越多,离子半径越小,则离之间的相互作用就越强,其离子晶体的熔沸点越高。
如:MgO >Mgd2>Nad>Csd。
4、分子晶体组成和结构相似的物质,相对分子质量越大,熔沸点越高,如:O2>N2,HI>HBr>Hd;组成和结构不相似的物质,分子极性越大,其熔沸点越高,如Co>N2;在同分异构件,一般支链越多,其熔沸点越低,如沸点,正成烷>异成烷>新戌烷洁香烃及其衔生物的同分异构件,其熔沸点,高低顺序为:邻位>间位>对位化容物。
5、金属晶体中金属离子半径越小,离子电荷越多,其金属键越强,金属熔沸点就越高。
6、元素周期表中第IA族金属元素单质(金属晶体)的熔沸点,随原子序数的递增而降低;第VIA族卤素单质(分子晶体)的溶沸点随原子序数递增而升高。
1、HNO3→AgNO3溶液法①检验方法:表明存在cl表明存在Br表明存在I②反应原理反应①:Ag+d-=Agd↓反应②:Ag+Br-=AgBr↓反应③:Ag+I-=AgI↓2、氯水—CdH法①检验方法加适量新朱子饱和氯水加Cll H 未知液混合液分层振荡振荡橙红色表明有Br-有机层紫红色表明有I-②原理:D2+2Br-=Br2+2a-d2+2I-=I2+2d-,因Br2、I2在ccl4中的溶解度大于在水中的溶解度。
3、检验食盐是否加碘(1:Io3)的方法①检验方法变蓝:加碘盐食盐未变蓝:无碘盐②反应原理:IO3-+SI-+6H+=3I2+3H2O(淀粉遇I2变蓝色)常见的放热反应与吸热反应一、放热反应(1)燃烧都是放热反应;(2)中和反应都是放热反应;(3)化合反应都是放热反应;(4)置换风应多为放热反应;(5)生石灰与水的反应、铝热反应等。
物质熔点和沸点高低的比较
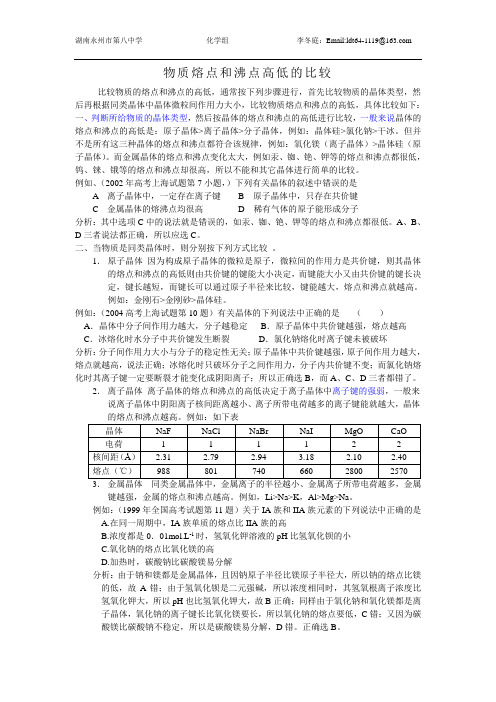
物质熔点和沸点高低的比较比较物质的熔点和沸点的高低,通常按下列步骤进行,首先比较物质的晶体类型,然后再根据同类晶体中晶体微粒间作用力大小,比较物质熔点和沸点的高低,具体比较如下:一、判断所给物质的晶体类型,然后按晶体的熔点和沸点的高低进行比较,一般来说晶体的熔点和沸点的高低是:原子晶体>离子晶体>分子晶体,例如:晶体硅>氯化钠>干冰。
但并不是所有这三种晶体的熔点和沸点都符合该规律,例如:氧化镁(离子晶体)>晶体硅(原子晶体)。
而金属晶体的熔点和沸点变化太大,例如汞、铷、铯、钾等的熔点和沸点都很低,钨、铼、锇等的熔点和沸点却很高,所以不能和其它晶体进行简单的比较。
例如、(2002年高考上海试题第7小题,)下列有关晶体的叙述中错误的是A离子晶体中,一定存在离子键 B 原子晶体中,只存在共价键C 金属晶体的熔沸点均很高D 稀有气体的原子能形成分子分析:其中选项C中的说法就是错误的,如汞、铷、铯、钾等的熔点和沸点都很低。
A、B、D三者说法都正确,所以应选C。
二、当物质是同类晶体时,则分别按下列方式比较。
1.原子晶体因为构成原子晶体的微粒是原子,微粒间的作用力是共价键,则其晶体的熔点和沸点的高低则由共价键的键能大小决定,而键能大小又由共价键的键长决定,键长越短,而键长可以通过原子半径来比较,键能越大,熔点和沸点就越高。
例如:金刚石>金刚砂>晶体硅。
例如:(2004高考上海试题第10题)有关晶体的下列说法中正确的是()A.晶体中分子间作用力越大,分子越稳定B.原子晶体中共价键越强,熔点越高C.冰熔化时水分子中共价键发生断裂D.氯化钠熔化时离子键未被破坏分析:分子间作用力大小与分子的稳定性无关;原子晶体中共价键越强,原子间作用力越大,熔点就越高,说法正确;冰熔化时只破坏分子之间作用力,分子内共价键不变;而氯化钠熔化时其离子键一定要断裂才能变化成阴阳离子;所以正确选B,而A、C、D三者都错了。
熔、沸点高低的比较

熔、沸点高低的比较作者:柳鸿飞来源:《成才之路》2008年第31期如何比较物质熔、沸点高低呢?笔者试总结如下:一、由晶体结构来确定首先分析物质所属的晶体类型,其次抓住决定同一类晶体熔、沸点高低的决定因素。
(1)一般规律:原子晶体>离子晶体>分子晶体。
如:Si02>NaCl>CO2(干冰) 。
(2)同属原子晶体,一般键长越短,键能越大,共价键越牢固,晶体的熔沸点越高。
比如:金属石>金刚砂>晶体硅,原因: rc-c<rc-si<rsi-si。
(3)同类型的离子晶体,离子电荷数越大,阴、阳离子核间距越小,则离子键越牢固,晶体的熔、沸点一般越高。
可根据F=K q1 q2/ (r1+r2)2进行判断。
如:MgO>NaCl。
(4)分子晶体,分子间范德华力越强,熔、沸点越高。
a.分子组成和结构相似的分子晶体,一般分子量越大,分子间作用力越强,晶体熔、沸点越高。
如:F2 <Cl2 <Br2 <I2 ,丙烷>乙烷>甲烷。
b.若分子量相同,如互为同分异构体,则支链数越多,沸点越低,分子越对称,则熔点越高。
比如,沸点:正丁烷>异丁烷;熔点:新戊烷>异戊烷>正戊烷。
因而应注意,并非外界条件对物质熔、沸点的影响总是一致的。
熔点常与晶体中微粒排布对称性有关。
c.若分子间有氢键,则分子间作用力比结构相似的同类晶体强,故熔、沸点特别高。
比如,氢化物的沸点如下图所示:从上图中看出,H2Te、H2Se、H2S的沸点都依次降低,按此变化趋势。
H2O的沸点应为193K左右,但实际上为373K,此种“反常”的升高,就是因为H2O分子间存在氢键。
对比同主族氢化物的沸点,从中可清楚看到NH3、HF的沸点高得“反常”,也是因为分子间存在氢键。
HF分子间氢键 H2O分子间氢键氢键的生成对化合物性质有显著影响,一般分子间形成氢键时,可使化合物的熔、沸点显著升高。
在极性溶剂中,若溶质分子和溶剂分子间形成氢键,则可使溶解度增大,如NH3极易溶于水就与此有关。
判断熔沸点高低的方法

判断熔沸点高低的方法
判断熔沸点高低的方法
熔沸点是物质的物理性质之一,它是指在常压下,物质从固态转化为液态或从液态转化为气态时所需要的温度。
熔沸点高低直接影响着物质的应用价值和用途。
因此,判断熔沸点高低是非常重要的。
下面是几种判断熔沸点高低的方法:
1. 比较不同物质的熔沸点
通过比较不同物质的熔沸点可以初步判断它们的高低。
通常来说,分子量大、分子间力强、分子形状复杂、分子极性大等因素都会导致物质的熔沸点升高。
例如,水的分子量较小,分子间力相对较弱,因此其熔沸点比较低;而氢氧化钠(NaOH)则具有更大的分子量和更强的分子间力,因此其熔沸点比水高得多。
2. 利用实验测定
实验测定是一种准确可靠的判断方法。
可以采用差示扫描量热法(DSC)、升华法、沸点测定法等方法来测定物质的熔沸点。
其中,差示扫描量热法是一种常用的方法。
它通过对样品和参比样品同时进行加热,测量两者之间的温度差异,得出物质的熔沸点。
3. 利用理论计算
利用理论计算也是一种判断熔沸点高低的方法。
可以采用分子动力学模拟、量子化学计算等方法来预测物质的熔沸点。
其中,分子动力学模拟主要基于牛顿运动定律和分子间相互作用力,通过模拟分子在不同温度下的运动状态来预测其熔沸点;而量子化学计算则是基于量子力学原理,通过计算分子内部能级和外部相互作用能来推导出物质的性质,包括熔沸点。
综上所述,判断熔沸点高低可以采用比较不同物质、实验测定和理论计算等多种方法。
在实际应用中需要结合具体情况选择合适的方法进行判断。
单质熔沸点高低的判断规律

单质熔沸点高低的判断规律1. 单质的基础知识说到单质,大家可能会想:这玩意儿到底是啥?简单来说,单质就是由同一种元素组成的物质。
比如,金子、氧气、氮气这些都是。
就像一个专注的小伙伴,只和自己同类打交道。
可是,单质之间可大不相同,熔点和沸点也是差别很大。
熔点是物质变成液体的温度,而沸点则是它变成气体的温度。
咱们今天就来聊聊,怎么判断单质的熔沸点高低,看看这背后的规律。
1.1. 原子结构的重要性首先,原子结构就像单质的“身份证”。
每个元素都有自己特定的原子构造,这决定了它的性质。
有些元素原子大,有些小。
原子越大,通常会有更多的电子层,这就意味着它们之间的相互作用力会更复杂。
你想啊,像铅这样的重金属,原子结构复杂,熔点和沸点自然就高;而氦这种轻飘飘的小家伙,原子小,结果熔沸点低,简直像在开派对一样,随时准备逃跑!1.2. 化学键的影响然后,咱们得聊聊化学键。
化学键就像是元素之间的小纽带,能把它们紧紧地绑在一起。
比如,金属键特别强大,像个铁钳,铝和铁都很容易维持稳定状态,所以它们的熔沸点也相对较高。
而像氢气这样的小分子,只有弱弱的范德华力,就跟飘在空中的气球似的,随时可能破裂,熔沸点就很低。
2. 典型单质的熔沸点对比好啦,咱们再来看几个典型的单质,看看它们的熔沸点是咋回事儿。
这里就像美食广场,各种单质琳琅满目,大家都在争着出头。
2.1. 金属类单质先来说说金属类的单质。
金属们个个都是有实力的家伙,像铁、铜、银、金,熔沸点都很高。
尤其是金子,熔点高达1064°C,沸点更是达到2856°C,仿佛在说:“我就是要高冷!”金属的强大来源于它们之间牢不可破的金属键,就像铁哥们儿之间的情谊,牢牢地捆绑在一起。
2.2. 非金属类单质再看看非金属,像氮、氧、氦、碘这些。
氮气(196°C)和氧气(218°C)都是气体,沸点低得让人吃惊。
和金属比起来,简直就是在参加清凉派对。
而碘,虽然是非金属,但熔点却不低,达到了113.7°C,沸点也有184.3°C,像个看似温和,实则很有存在感的角色。
物质的熔沸点怎么看

在我们现行的教科书中并没有完整总结物质的熔沸点的文字,在中学阶段的解题过程中,具体比较物质的熔点、沸点的规律主要有如下:根据物质在相同条件下的状态不同1.一般熔、沸点:固>液>气,如:碘单质>汞>CO22. 由周期表看主族单质的熔、沸点同一主族单质的熔点基本上是越向下金属熔点渐低;而非金属单质熔点、沸点渐高。
但碳族元素特殊,即C,Si,Ge,Sn越向下,熔点越低,与金属族相似;还有ⅢA族的镓熔点比铟、铊低;ⅣA族的锡熔点比铅低。
3. 同周期中的几个区域的熔点规律①高熔点单质 C,Si,B三角形小区域,因其为原子晶体,故熔点高,金刚石和石墨的熔点最高大于3550℃。
金属元素的高熔点区在过渡元素的中部和中下部,其最高熔点为钨。
②低熔点单质非金属低熔点单质集中于周期表的右和右上方,另有IA的氢气。
其中稀有气体熔、沸点均为同周期的最低者,如氦的熔点(-272.2℃,26×105Pa)、沸点(268.9℃)最低。
金属的低熔点区有两处:IA、ⅡB族Zn,Cd,Hg及ⅢA族中Al,Ge,Th;ⅣA族的Sn,Pb;ⅤA族的Sb,Bi,呈三角形分布。
最低熔点是Hg(-38.87℃),近常温呈液态的镓(29.78℃)铯(28.4℃),体温即能使其熔化。
4. 从晶体类型看熔、沸点规律晶体纯物质有固定熔点;不纯物质凝固点与成分有关(凝固点不固定)。
非晶体物质,如玻璃、水泥、石蜡、塑料等,受热变软,渐变流动性(软化过程)直至液体,没有熔点。
①原子晶体的熔、沸点高于离子晶体,又高于分子晶体。
在原子晶体中成键元素之间共价键越短的键能越大,则熔点越高。
判断时可由原子半径推导出键长、键能再比较。
如键长:金刚石(C —C)>碳化硅(Si—C)>晶体硅(Si—Si)。
熔点:金刚石>碳化硅>晶体硅②在离子晶体中,化学式与结构相似时,阴阳离子半径之和越小,离子键越强,熔沸点越高。
反之越低。
如KF>KCl>KBr>KI,ca*>KCl。
高中化学如何判断晶体熔沸点高低

如何判断常见晶体物质熔点高低一般来说:原子晶体>离子晶体>分子晶体
如果为同一种晶体如何判断
1、如果都是原子晶体就按照已有顺序排
2、如果都是离子晶体则:
第一步如果电荷量相同,则比较不通的晶体的库仑力,简单的说就是比较他们原子半径的大小,第二部,如果他们的电荷量不同,一般来说电荷量大的离子晶体熔沸点高
3、如果是同为分子晶体
看分子量一般来说分子量大的高但是也要需要考虑分子的对称性及有无氢键,一般来说有对称性的有氢键的高,
掌握了这几个小点一般啊高中不会出一些让你分辨不清的,呵呵。
这是本人高中学习化学心得,不过现在忘得很多,如有不足还请谅解。
高考化学溶沸点比较

主要方法有如下几种(1)由周期表瞧主族单质的熔、沸点同一主族单质的熔点基本上就是越向下金属熔点渐低;而非金属单质熔点、沸点渐高。
但碳族元素特殊,即C,Si,Ge,Sn越向下,熔点越低,与金属族相似。
还有ⅢA族的镓熔点比铟、铊低,ⅣA族的锡熔点比铅低。
(2)同周期中的几个区域的熔点规律①高熔点单质 C,Si,B三角形小区域,因其为原子晶体,熔点高。
金刚石与石墨的熔点最高大于3550℃,金属元素的高熔点区在过渡元素的中部与中下部,其最高熔点为钨(3410℃)。
②低熔点单质非金属低熔点单质集中于周期表的右与右上方,另有IA的氢气。
其中稀有气体熔、沸点均为同周期的最低者,而氦就是熔点(-272、2℃,26×105Pa)、沸点(268、9℃)最低。
金属的低熔点区有两处:IA、ⅡB族Zn,Cd,Hg及ⅢA族中Al,Ge,Th;ⅣA族的Sn,Pb;ⅤA族的Sb,Bi,呈三角形分布。
最低熔点就是Hg(-38、87℃),近常温呈液态的镓(29、78℃)铯(28、4℃),体温即能使其熔化。
(3)从晶体类型瞧熔、沸点规律原子晶体的熔、沸点高于离子晶体,又高于分子晶体。
金属单质与合金属于金属晶体,其中熔、沸点高的比例数很大(但也有低的)。
在原子晶体中成键元素之间共价键越短的键能越大,则熔点越高。
判断时可由原子半径推导出键长、键能再比较。
如熔点:金刚石>碳化硅>晶体硅分子晶体由分子间作用力而定,其判断思路就是:①结构性质相似的物质,相对分子质量大,范德华力(分子间作用力指存在于分子与分子之间或惰性气体原子间的作用力,又称范德华力)大,则熔、沸点也相应高。
如烃的同系物、卤素单质、稀有气体等。
②相对分子质量相同,化学式也相同的物质(同分异构体),一般烃中支链越多,熔沸点越低。
烃的衍生物中醇的沸点高于醚;羧酸沸点高于酯;油脂中不饱与程度越大,则熔点越低。
如:油酸甘油酯常温时为液体,而硬脂酸甘油酯呈固态。
上述情况的特殊性最主要的就是相对分子质量小而沸点高的三种气态氢化物:NH3,H2O,HF比同族绝大多数气态氢化物的沸点高得多(主要因为有氢键)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
判断物质熔沸点高低的方法
判断物质熔沸点高低的方法主要有以下几种:
1. 实验测定法:通过实验将要研究的物质加热或降温,观察其是否发生熔化或沸腾,从而确定其熔沸点。
常用的实验方法包括差热分析法、升华法、液压法等,其中差热分析法是一种常用的测定熔沸点的方法。
2. 文献查询法:通过查阅相关的文献或数据库,寻找已有的熔沸点数据,比较不同物质的熔沸点大小。
常用的文献和数据库有化学手册、化学期刊、化学数据库等。
3. 理论计算法:通过分子结构或化学键的性质,利用物质的理论计算方法,如量子力学计算等,推测物质的熔沸点。
4. 结构性质关系法:通过研究物质的结构特征和其它物化性质,如分子大小、分子间作用力、极性等,推测物质的熔沸点。
这种方法常用于有机化合物和溶液的研究中。
需要注意的是,以上方法都有一定的局限性,无法得到绝对准确的熔沸点数值。
因此,一般情况下,使用多种方法相互印证,才能得到更可靠的结果。
