质量守恒定律与化学方程式辅导练习
专题08 质量守恒定律和化学方程式-2021年中考化学真题分类训练(第01期)(教师版含解析)
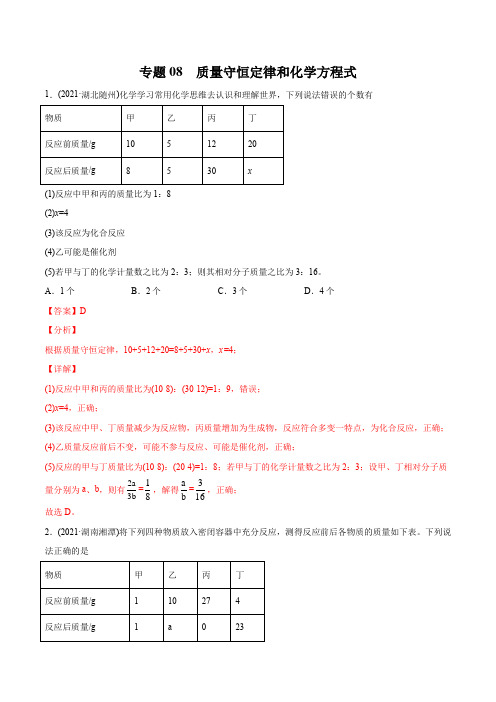
专题08 质量守恒定律和化学方程式1.(2021·湖北随州)化学学习常用化学思维去认识和理解世界,下列说法错误的个数有(1)反应中甲和丙的质量比为1:8(2)x=4(3)该反应为化合反应(4)乙可能是催化剂(5)若甲与丁的化学计量数之比为2:3;则其相对分子质量之比为3:16。
A.1个B.2个C.3个D.4个【答案】D【分析】根据质量守恒定律,10+5+12+20=8+5+30+x,x=4;【详解】(1)反应中甲和丙的质量比为(10-8):(30-12)=1:9,错误;(2)x=4,正确;(3)该反应中甲、丁质量减少为反应物,丙质量增加为生成物,反应符合多变一特点,为化合反应,正确;(4)乙质量反应前后不变,可能不参与反应、可能是催化剂,正确;(5)反应的甲与丁质量比为(10-8):(20-4)=1:8;若甲与丁的化学计量数之比为2:3;设甲、丁相对分子质量分别为a、b,则有2a3b=18,解得ab=316,正确;故选D。
2.(2021·湖南湘潭)将下列四种物质放入密闭容器中充分反应,测得反应前后各物质的质量如下表。
下列说法正确的是A .a 的值是8B .甲物质一定是该反应的催化剂C .该反应属于分解反应D .反应过程中乙、丁的质量比是5:2 【答案】C 【分析】 本题考查计算。
【详解】根据表格信息可知,丙从27g 变成0g ,是反应物,丁从4g 增加到23g ,是生成物,由于反应前后物质的质量是守恒的,所以推算出乙的质量应该是27g -19g=8g ,写出该反应的方程式为:+ 丙丁乙。
A 、因为生成乙的质量为8g ,所以a 应该是8+10=18,故A 不符合题意;B 、甲反应前后质量不变,可能是催化剂,也可能是不参与反应的杂质,故B 不符合题意;C 、该反应由一种物质生成两种物质,是分解反应,故C 符合题意;D 、反应中乙生成了8g ,丁生成了19g ,所以质量比为8:19,故D 不符合题意; 故选C 。
质量守恒定律和化学方程式练习题(无答案)

关于质量守恒定律和化学方程式的练习一选择题1.根据质量守恒定律,电解NaCl的水溶液,不可能得到的生成物是()A. KNO3B. C12C. H2D. NaOH2.某物质在隔绝空气的情况下加热,生成了二氧化碳和水,推断该物质的元素组成为()A.由碳元素和氢元素组成 B.由碳、氢、氧三种元素组成C.一定有碳、氢元素,可能有氧元素 D.无法判断3.下列说法能用质量守恒定律解释的是()A.mg水受热变为mg的水蒸气 B.62g磷和80g的氧反应生成142g五氧化二磷C.20g食盐溶于80g水得到100g的食盐水 D.拧开盛酒精的瓶盖一段时间后质量变小4.工业上常用乙炔燃烧产生的高温火焰来切割金属。
若用R表示乙炔,其燃烧的化学方程式,则乙炔的化学式是( )A.C2H4B.C2H2C.CH3COOHD.C2H65.在A2 +2B2= 2X的反应中,X的化学式是()A.AB B.A 2B C.AB2D.A2B26.化学反应前后,下列各项中,肯定没有变化的是()①原子数目②原子的种类③分子数目④分子的种类⑤元素的种类⑥物质的总质量⑦物质的种类A.①②⑤⑥ B.①②③⑤ C.①②⑤⑦ D.③④⑥⑦7.红磷在耐高温的密闭容器中(内含空气)加热,能正确表示容器里所盛物质总质量变化的图象是()8. 某化合物完全燃烧,需要4.8 g氧气,同时只生成4.4 g二氧化碳和2.7g 水,则该化合物中()A.只含有碳、氢两种元素B.只含有碳、氧两种元素C.含有碳、氢、氧三种元素D.无法确定9.右图是“尾气催化转换器”将汽车尾气中有毒气体转变为无毒气体的微观示意图,其中不同的园球代表不同原子。
下列说法错误的是A.此反应有单质生成 B.原子在化学变化中是不可分的C.图中生成物全部是化合物 D.参加反应的两种分子的个数比为1∶110.右图形象地表示某反应前后反应物与生成物分子及其数目的变化,其中分别表示A、B、C三种不同的分子。
该反应的化学方程式中A、B、C前的化学计量数之比为()A.4∶1∶3B.3∶1∶2C.4∶1∶2D.3∶1∶311.将25克甲物质,5克乙物质,10克丙物质混合加热发生化学反应,经分析知反应后混合物中含有10克甲,21克丙,还含有一种新物质丁,则丁物质的质量为()A.40克 B.20克 C.11克 D.9克12.4gA物质与5gB物质混合反应,能生成6gC物质,剩余3gB。
质量守恒定律习题(附答案)

质量守恒定律习题(附答案)1.某同学用在空气中燃烧镁带的实验来探究质量守恒定律镁带完全燃烧后,称量剩下固体的质量比反应前镁带的质量还轻,联系实验过程,分析:原因可能有______,改进措施是______。
2.为防止煤气泄漏使人中毒,常在煤气中加入少量的有特殊气味的乙硫醇(C 2H 5SH )乙硫醇在煤气燃烧过程中也可以充分燃烧,其化学方程式为:2C 2H 5SH+9O 24CO+2x+6H 2O 则x 的化学式为( )3.为研究化学反应后反应物与生成物之间的质量关系,三位同学分别做了如下三个实验:实验一:称量镁条,点燃,待反应结束后,再称量;实验二:将盛有稀盐酸的小试管放入装有锌粒的烧杯中,称量,然后将盐酸与锌粒接触,充分反应后再称量;实验三:将盛有氢氧化钠溶液的试管放入盛有硫酸铜溶液的烧杯中,称量,然后设法使两种溶液混合,充分反应后再称量。
三位同学得到的实验数据如下表:(1)从表面上看,这三个实验中发生化学反应前后物质的质量(填“增大”、“减小”或“不变”):实验一______,实验二_______,实验三______。
(2)造成上述结果的原因可能是____________。
(3)在三个实验中,实验______正确反映了反应物与生成物之间的质量关系; (4)由此可得结论:用实验研究化学反应前后反应物与生成物之间的质量关系时,必须在______体系中进行。
4.2002年12月,广西某地一辆满载砒霜(剧毒物质)的卡车发生交通事故,致使三十余桶砒霜散落在河床和河水中,有关部门采取了紧急有效的措施,防止了大规模污染的发生。
已知氢氧化钠能与砒霜发生如下反应(砒霜的化学式用X 表示):X+6NaOH=2Na 3AsO 3+3H 2O ,则砒霜的化学式为______。
5.著名的发明家诺贝尔经过长期的研究与试验,终于发明了安全炸药──三硝酸甘油脂,三硝酸甘油酯的化学式为C 3H 5N 3O 9,这种炸药发生爆炸的反应方程式为:4C 3H 5N 3O 912CO 2↑+10H 2O ↑+6X ↑+O 2↑ (1)X 的化学式是______。
质量守恒定律和化学方程式

化学方程式的专项练习一、写出下列反应的化学方程式:1、镁在空气中燃烧:______________________ _____2、铁在氧气中燃烧:____________________ _______3、铜在空气中受热:______________ _____________4、铝在空气中燃烧:_________________ __________5、氢气中空气中燃烧:__________ _______________6、红磷在空气中燃烧:_______________ ___ ______7、硫粉在空气中燃烧:__________________ _______8、碳在氧气中充分燃烧:______________________ _ _9、碳在氧气中不充分燃烧:____________________________________10、葡萄糖缓慢氧化(呼吸作用):___________________________ _____11、利用过氧化氢和二氧化锰的混合物制氧气:_________________________________12、水在直流电的作用下分解:_______________________________________________13、加热氯酸钾:___________________________________________________________14、加热高锰酸钾:_________________________________________________________二、配平下列化学方程式:(一) 最小公倍数法:(找出两边同种原子的个数最多的原子,然后求最小公倍数,得原子个数。
)1、Al + O2——Al2O32、Al + Fe3O4——Fe + Al2O33、Fe + O2——Fe3O44、Al + MnO2——Mn + Al2O35、N2+ H2——NH36、Al + H2SO4——Al2(SO4)3 + H2(二) 观察法:(观察顺序:从复杂入手,推导其它)(具体观察顺序——O、C、Fe)1、CO + Fe2O3 ——Fe + CO22、C + Fe2O3——Fe + CO23、CO + Fe3O4 ——Fe + CO24、C + Fe3O4——Fe + CO25、H2 + Fe2O3——Fe + H2O6、H2 + Fe3O4——Fe + H2O10、H2 + WO3——W + H2O 11、CO + O2 ——CO212、Fe + H2O——H2 + Fe3O413、Al(OH)3+ HCl ——AlCl3 + H2O(三) 奇数配偶法:(找出左右两边出现次数较多的元素,该元素的原子个数在两边为一基数一偶数)1、FeS2 + O2 ——Fe2O3 + SO22、C2H2 + O2——CO2+ H2O3、C + Fe2O3——Fe + CO24、MnO2 + HCl——MnCl2 + Cl2 + H2O5、Cl2 + Ca(OH)2——CaCl2 + Ca(ClO)2 + H2O(四) 归一法:(找出化学式中原子数目最多的化学式,使其化学计量数为“1”,观察配平,若是分数再进行通分去掉分母,保证最后得到最简整数比)1、C2H2 + O2——CO2 + H2O2、C6H6 + O2——CO2 + H2O3、C22H46 + O2——CO2 + H2O4、NH3 + Cl2 ——NH4Cl + N25、As2O3+ Zn + HCl——AsH3+ ZnCl2+ H2O6、C X H Y+ O2——CO2+ H2O三、题型变化:1、3Cu+8HNO3 ==3Cu(NO3)2+2X↑+4 H2O,求X的化学式为。
质量守恒定律经典练习题40道

质量守恒定律经典练习题40道1、哪个图像能够反映加热高锰酸钾时剩余固体质量与反应时间的关系。
2、碱式碳酸铜受热分解成CuO、CO2和H2O三种物质,它的组成是什么。
3、在方程式CxHyOz + 5O2 = 4CO2 + 4H2O中,x、y、z的值是什么。
4、mg的硫在ng的氧气中燃烧,生成的二氧化硫的质量最合理的答案是什么。
5、镁在空气中燃烧时,生成氧化镁和氮化镁(Mg3N2)。
12g的镁在空气中燃烧后,产生的产物质量是多少。
6、在化学反应aA + bB = cC + dD中,哪个说法是正确的。
7、关于质量守恒定律,哪个叙述是正确的。
8、根据反应3NO2 + H2O = 2HNO3 + X,推断X的化学式是什么。
9、黑火药爆炸的反应主要是2KNO3 + 3C + S = K2S +3CO2↑ + X↑,则X的化学式是什么。
10、哪个现象不能用质量守恒定律解释?11、瑞奥汀河是一条酸河,其中含有硫酸和硫酸亚铁。
研究表明,酸河的形成是由于上游河床含有某种物质R,在水中氧气的作用下发生反应所致。
反应方程式为2R+2H2O+7O2→2FeSO4+2H2SO4.因此,R的化学式为FeS。
12、在实验中,某纯净物X在密闭中稍加加热就分解为NH3、H2O和CO2.根据这一实验事实,无法得出X由四种元素组成、X是化合物、X中有水或X不稳定这些结论。
13、根据化学方程式CxHyOz+5O2→4CO2+4H2O,可以得出x、y、z的值分别为4、8、2.14、在反应2H2O2→2H2O+O2中,肯定发生变化的是各种原子的数目。
15、能够用质量守恒定律解释的说法是:B。
62g磷和80g氧反应生成142g五氧化二磷。
16、某物质在纯氧中燃烧生成氮气和水蒸气,因此该物质一定含有氮元素和氧元素。
17、根据质量守恒定律,铁丝在氧气中完全燃烧后,生成物的质量一定等于铁丝的质量。
18、化学反应前后没有发生改变的是:①原子的数目③元素的种类④物质的总质量⑥原子的种类。
专题02 质量守恒定律 化学方程式(练习)(原卷版)

专题02 质量守恒定律化学方程式目录考点过关练2考点01 质量守恒定律2考点02 化学方程式3考点03 根据化学方程式的计算4真题实战练5重难创新练9考点01 质量守恒定律1. 超氧化钾(KO2)常备于急救器和消防队员背包中,能迅速与水反应放出氧气:2KO2+2H2O===2KOH+X+O2↑,关于此反应的说法不正确...的是()A. X的化学式为H2O2B.反应前后元素种类发生变化C.反应前后氧元素化合价发生变化D.反应前后物质状态发生变化2. 科学家研制出一种新型催化剂,可用于去除装修残留的甲醛(化学式为CH2O),该反应过程的微观示意图如下。
下列说法正确的是()A.物质甲为甲醛,其分子由碳原子和水分子构成B.物质乙中氧元素的化合价为-2 价C.该反应前后原子种类和数目均发生改变D.该反应消耗物质甲和生成物质丁的质量比为5﹕33. 甲、乙、丙、丁四种物质在一定的条件下反应,测得反应前后各物质的质量分数如图所示,则有关说法中正确的是()A.该反应为分解反应B.甲可能是单质C.丙、丁两物质变化的质量比为9:10D.乙一定是这个反应的催化剂4. 在一个密闭容器中放入X、Y、Z、M四种物质,使之在一定条件下发生化学反应。
一段时间后,测得有关数据如下表:物质X Y Z M反应前的质量/g 20 5 3 28反应后的质量/g 待测值30 3 8关于此反应的认识不正确的是()A.物质Z可能是该反应的催化剂B.该反应一定是化合反应C.参加反应的Y、M的质量比为5∶4 D.待测值为135. 在“宏观一徽观”之间建立联系是化学学科特有的思维方式。
下图为二氧化碳用于生产甲醇(CH3OH)的微观示意图,有关说法正确的是()A.该反应中,四种物质均为化合物B.反应前后氢元素的化合价不变C.参加反应的甲、乙分子个数之比为1:3D.反应前后氢原子个数之比为1:3考点02 化学方程式6. 下列化学方程式书写正确的是()A.Mg+O2点燃=======MgO B.4Fe+3O2点燃=======2Fe2O3C.2KClO3=2KCl+3O2↑D.S+O2点燃=======SO27. 关于化学方程式的意义的说法不正确的是()A.表示各物质之间的质量比B.表明了反应的条件C.表明了反应的速率D.表明化学反应的反应物、生成物8. 化学方程式2Mg+O2点燃=========2MgO可读作()A.镁加氧气等于氧化镁B.2个镁加1个氧气等于2个氯化镁C.镁和氧气在点燃条件下生成氧化镁D.镁加氧气点燃等于氧化镁9. 下列有关叙述对应的化学方程式都正确的是()A.镁在空气中燃烧:Mg+O2点燃=======MgO2B.过氧化氢分解:H2O2═H2↑+O2↑C.铁在氧气中燃烧:Fe+O2═Fe2O3D.铝具有很好的抗腐蚀性:4Al+3O2═2Al2O310. 下列说法正确的是()A.符号↑:表示在生成物中有气体产生 B.配平时可以改动化学式右下角表示的小数字C.符号△:表示点燃D.化学方程式中的等号表示反应物与生成物的分子数相等11. 配平下列反应的化学方程式:(1) NH3+ Cl2= N2+ HCl(2) C2H2+ O2= CO2+ H2O(3) Fe2O3+ CO= Fe+ CO2(4) C2H6O+ O2= CO2+ H2O考点03 根据化学方程式的计算12.我国核工业技术世界领先,现已出口到西方发达国家。
考点 质量守恒定律和化学方程式
考点19 质量守恒定律和化学方程式一、选择题1、浓硝酸和锌的反应的化学方程式为:Zn + 4HNO 3 = Zn(NO 3)2 + 2H 2O + 2X ↑,则X 为 A.H 2 B.NH 3 C.NO D.NO 22、 NH 4ClO 4(高氯酸铵)可用作火箭推进剂,当它发生分解反应时,不能生成的物质是 ( ) A. CO 2 B. Cl 2 C. O 2 D. N 23、将一定量的乙醇(C 2H 6O )和氧气置于一个封闭的容器中引燃,测得反应前后各物质的质下列判断正确的是 ( ) A .表中a 的值为2.6 B .X 一定是该反应的催化剂C .X 可能含有氢元素D .若起始时氧气的质量是9.6g ,则无X 生成 4、 甲、乙两物质发生反应的微观示意图如下,下列说法正确的是A.该反应属于化合反应B.该反应前后原子个数保持不变C. 甲和乙的相对分子质量一定相等D.该反应可示意H 2与O 2的反应5、示模型理解正确的是A .该反应属于化合反应B .反应物和生成物中只有一种单质C .反应物和生成物中共含有三种元素D .参加反应的两种物质分子个数之比为1:1 6、下列物质受热分解时没有氧气生成的是( )A.氯化铵B.氯酸钾C.高锰酸钾D.氧化汞7、某有机物在空气中完全燃烧,测得生成物中含有二氧化碳、水蒸气、二氧化硫,下列对该有机物的推断正确的是( )A .一定含有碳、氢、硫元素B .一定含有碳、氢、氧元素B .只含有碳、氢元素 D .一定含有碳、氢、氧,可能含有硫元素8、 在一个密闭容器中放入X 、Y 、Z 、W 四种物质,在一定条件下发生化学反应,一段时间后,50第5题图A.m的数值为64B.若W为水,则X或Y必定为酸或碱C.参加反应的X与Y的质量比为1︰4D.若X为化合物,Y为单质,则该反应一定为置换反应9、思波曼等科学家用转基因的方法培育出一种“食电”细菌,它“吃进”电能,把二氧化碳和水合成甲烷,能量转化率高达80%。
质量守恒定律和化学方程式
质量守恒定律和化学方程式一、质量守恒定律1、定义:参加化学反应的各物质质量总和等于反应生成的各物质质量总和,这个规律叫质量守恒定律。
注意:①必须是实际参加反应的物质:已知3g 碳可以与8g 氧气恰好完全反应,生成11g 二氧化碳。
请你考虑:将3g 碳放在10g 氧气中充分燃烧后,能生成多少克二氧化碳? 【强调:参加化学反应的物质质量】②质量守恒定律只适用于化学变化:[练习]:不能用质量守恒定律现象是( )A.蜡烛燃烧越来越短,最终消失B.铁丝燃烧,其固体总质量逐渐增加C.潮湿的衣服在太阳下晒干D.碳在氧气中燃烧后,生成二氧化碳的质量比参加反应的碳的质量大 ③质量总和相等[练习]:判断说法的正误:说法一:10g 过氧化氢溶液完全分解后所得液体的质量小于10g ,所以在该实验中生成物质量减少。
( ) 说法二:镁条完全燃烧后生成物的质量大于反应前镁条的质量,所以在该实验中生成物质量增加。
( )2、微观实质:在一切化学反应中,反应前后①原子的 没有改变,②原子的 没有增减,③原子的 也没有变化,所以反应前后各物质的质量总和相等。
[小结]:在化学反应中:一定不变的是:①各物质的质量总和②元素的种类③元素的质量④原子的种类⑤原子的数目⑥原子的质量;一定改变的是:①物质的种类②分子的种类;可能改变的是:①分子的数目.[练习]:1.由质量守恒定律可知,化学反应前后,一定不变的是 (填序号)。
①原子种类 ②原子数目 ③分子种类④分子数目 ⑤元素种类 ⑥物质种类2.硝酸在工业生产中且有广泛的应用.工业上制取硝酸的关键反应为:4NH 3+5O 2==4NO+6R ,其中R 的化学式为 。
[专题练习]:1. 红磷在密闭容器(含有空气)内燃烧,容器内有关的量随时间变化的图象正确的是AB C D2、火箭发射升空是件不容易的事,常用一种固体燃料燃烧的化学方程式:3A1+3NH 4ClO 4 ══ Al 203+AlCl 3+3X ↑+6H 2O ↑,则物质X 的化学式为 ( ) A.NH 3 B.HCl C.NO 2 D.NO[变型题]:①发射“嫦蛾一号”的火箭用偏二甲肼(C 2H 8N 2)和四氧化二氮(N 2O 4)作常规推进荆,其完全反应的化学方程式:C 2H 8N 2+2 N 2O 4=3X+2CO 2+4H 2O ,则X 的化学式为A .N 2B .H 2C .O 2D .CO②下列四个反应的生成物都是C,如果C 的化学式为A 2B 5,则该反应的化学方程式为A . 2AB 2 + B 2 == 2C B . 3AB 2 + B 2 == 2CC . 4AB 2 + B 2 == 2CD . AB 2 + 4B 2 == 2C③4K 2FeO 4+10H 2O=4Fe(OH)3↓+8KOH+□____↑3.在一个密闭容器内有X 、Y 、Z 、Q 四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下:下列说法中不正确的是( )元素种类 物质总质量A .该反应为分解反应B .该反应遵守质量守恒定律C【变式题】在一密闭容器中,盛放A 、B 、C 三种物质各30g ,经电火花引燃,充分反应后,各物质质量变化如下:关于此反应,下列认识不正确的是A .C 物质中所含有的元素种类是A 、B 、D 三种物质中所有元素种类之和D .A 物质有可能是单质4.燃烧法是测定有机物组成的常用方法。
考点19 质量守恒定律和化学方程式
考点19质量守恒定律和化学方程式一、选择题23.(2014年苏州,第23题)工业上煅烧硫铁矿用来生产硫酸,用X表示硫铁矿中的主要成分。
煅烧反应的化学方程式为:4X +11O 2高温2Fe 2O 3+8SO 2,则x为A.FeS 2B.Fe 2S 3C.FeSO 4D.FeS【答案】A【解析】依据质量守恒定律:化学变化前后元素种类不变,原子个数、原子种类不变可知,反应后Fe、O、S的原子个数分别为4、22、8,反应前已知O的原子个数为22,故4X中含Fe、S的原子个数分别为4。
故X的化学式为FeS。
18.(2014年江苏扬州,18题)甲、乙两物质发生反应的微观示意图如下,则说法正确的是()A.该反应前后原子个数保持不变B.该反应属于化合反应C.甲和乙的相对分子质量之和等于丙的相对分子质量D.甲和丙中同种元素的化合价均相等【答案】AB【解析】化学反应前后原子的种类和个数不变,A 正确;反应前是两种分子,反应后是一种分子,所以是化合反应,B 正确;2个甲分子和1个乙分子的相对分子质量之和等于2个丙分子的相对分子质量之和,C 错误;甲和丙中同一种原子结合另一种原子的个数不同,故同种元素的化合价不一定相等,D 错误。
5.(2014年江苏扬州,5题)制备氟化镁(MgF 2)时有如下反应:X+6HF=H 2SiF 6+2H 2O,则X 的化学式为()A.SiF 4 B.SiH 4 C.SiHF 3 D.SiO 2【答案】D【解析】依据反应前后原子的种类和个数不变,反应前缺少1个硅原子和2个氧原子,所以X 的化学式为SiO 2。
14、(2014年江西,14题)下图是氢气在氯气中燃烧反应的微观示意图。
下列说法正确的是()A .图中反应物和生成物分子个数比为1:1:1B .HCl中氢元素和氯元素的质量比为2:71C .图中表示了4种物质的分子D .反应前后不变【答案】B ;原子种类(或原子数目等)【解析】由图可知参加反应的微粒个数比为:1:1:2;化学式中的质量比相对原子质量乘以原子个数的比=1:35.5;图中有三种分子就有三种分子;化学反应前后原子的数目、种类保持不变。
2021年中考化学考点练习:质量守恒与化学方程式
考点一:质量守恒定律1.下列现象不能用质量守恒定律解释的是( )A.煤燃烧后留下的灰烬质量比煤的质量减少了B.镁条在密闭的锥形瓶中燃烧,反应前后质量相等C.100g 糖溶于300g 水中,制得400g 溶液D.加热高锰酸钾制氧气后,剩余固体物质的质量比高锰酸钾质量减少了2.下列各项:①原子的数目;②分子的数目;③元素的种类;④物质的种类;⑤物质的分子个数;⑥各种原子的总数;⑦反应物和生成物的总质量。
在化学反应前后,肯定没有变化的是( )A.①③⑥⑦B.①⑥C.②③⑤D.①③⑥3.下列现象不能用质量守恒定律解释的是( )A.将2g氢气在20g氧气中燃烧,生成18g水B.将20mL酒精与20mL水混合,总体积小于40mLC.将3克的木炭在10克氧气中充分燃烧,生成二氧化碳的质量为11克D.铁丝在氧气中燃烧后质量增加4.在一个密闭容器内有a、b、c、d四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下表所示,则下列说法不正确的是( )A.该反应可能是化合反应 B.表中待测值应为5C.物质a与b变化的质量比为3:8 D.物质d可能是该反应的催化剂5.下列遵守质量守恒定律的是( )A.10g冰加热变为10g水B.水电解时,产生20毫升氢气和10毫升氧气C.8g硫与8g氧气反应生成16g二氧化硫D.8g硫与9g氧气反应生成17g二氧化硫6.以下说法正确的是( )A.原子核是由质子和中子构成的,所以所有的原子中都含有质子和中子B.氧化物中含有氧元素,而含氧元素的化合物不一定是氧化物C.CO2可以使燃着的木条熄灭,所以可以使燃着的木条熄灭的气体一定是CO2D.化学反应前后原子总数不变,所以化学反应前后分子总数也不变7.日常生活中常用的洁厕剂与“84”消毒液不能混合用,否则会造成中毒。
洁厕剂与“84”消毒液混合会发生如下反应:2HCl+NaClO=X+H2O+Cl2↑,X的化学式为________,对人体造成伤害的物质是_______,NaClO中氯的化合价为________。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1
质量守恒定律与化学式计算辅导
1.下列关于化学反应2X +Y ==2Z 的叙述,错误..
的是( ) A .Z 一定是化合物 B .在反应中X 、Y 、Z 三种物质的粒子数目比为2:1:2 C .若X 和Y 的相对分子质量分别为M 和N ,则Z 的相对分子质量为(M+N ) D .若ag X 完全反应生成bgZ ,则同时消耗(b —a )gY
2. 某物质在空气中完全燃烧生成8.8g 二氧化碳和5.4g 水,则关于这种物质的组成描述正确的是( )
A.该物质只含有碳元素和氢元素
B.该物质中碳元素与氯元素的质量比为12︰1
C.该物质一定含有碳元素和氢元素,可能含有氧元素
D.该物质的分子中碳原子与氢原子的个数比为1︰2
3.将一定量的丙醇(C 3H 8O )和氧气置于一个封闭的容器中引燃,测得反应前后各物质的质量如下表:
A .表中a 的值为2.8
B .X 一定是该反应的催化剂
C .X 可能含有氢元素
D .若起始时氧气的质量是14.4g,,则无X 生成
4、在一个密闭的钢筒内有甲、乙、丙、丁四种物质,在电火花作用下,发生充分反应,测得反应前后各物质的质量如下:
A .1∶2
B .1∶1
C .2∶ 1
D .2∶3
5、CO 和O 2的混合气体48g ,在一定条件下充分反应后,生成44g CO 2,则原混合气体中CO 和O 2的质量比可能是( ) A 、2∶1 B 、7∶4 C 、7∶5 D 、7∶8
6. 将一定量的丙醇(C 3H 8O )和氧气置于一个密闭的容器中引燃并充分反应,测得反应前后各物质的质量如下:
下列判断不正确...
的是 A .表中a 的值一定是2.8 B .若2.0g 丙醇完全反应,则生成2.4g 水
C .生成物X 中一定含有氢元素
D .若6.0g 丙醇与14.4g 氧气充分反应,则无X 生成
7、将一定质量的a 、b 、c 、d 四种物质放入一密闭容器中,在一定条件下反应一段时间后,测得反应后各物质的质量如下:
2 ② ③
④ ⑤
A.a 和b 是反应物,d 可能是催化剂。
B.反应后a 物质的质量为4.64g
C.c 物质中元素的种类,一定等于a 、b 二种物质中元素的种类
D.若物质a 与物质b 的相对分子质量之比为2:1,则反应中a 与b 的化学计量数之比为2:1
8. 1909年化学家哈伯在实验室首次合成了氨。
2007年化学家格哈德·埃特尔在哈伯研究所证实了氢气与氮气在固体催化剂表面合成氨的反应过程,获得诺贝尔化学奖。
(1)将氢气和氮气在高温、高压和催化剂的条件下合成氨(NH 3)。
反应的化学方程式为
_____________________________________________________。
(2)用
分别表示N 2、H 2、NH 3。
观察下图,写出符合在催化剂表面合成氨反应过程的顺序________________________(将下面五张图按反应过程顺序用序号排列)。
9.TiO 2的“纳米材料”有广泛的应用,工业上制取TiO 2的方法是:2 FeTiO 3 + 7 Cl 2 + 3 C == 2 X + 2 FeCl 3 + 3 CO 2 ,X 的化学式是 ;X 再与氧气反应生成TiO 2和氯气,该反应的化学方程式是: 。
10、汽车尾气净化装置里装有Pd 等过渡元素的催化剂,气体在催化剂表面吸附与解吸作用的机理如图所示。
尾气净化装置中发生总反应的化学方程式为___________ ________________。
11、 下图表示某化学反应的微观示意图,其中“○”和“●”分别代表不同元素的原子。
(1)该反应的基本反应类型是 ;
(2)由图可获得的信息是 ;
(3)已知‘‘○”的相对原子质量是“●”的m 倍,则由该反应所生成的 和 的质量比 ;
11.质量守恒定律对科学发展具有重大意义。
(1)用如下图所示的3个实验验证质量守恒定律,其中不能..达到实验目的的是 (填序号),理由是 ________________________________________________ 。
小气球
玻璃管 白磷
稀盐酸 碳酸钠固体
硫酸铜溶液
铁钉
A B C
3
(2)由质量守恒定律可知,化学反应前后一定不变的是 (填序号)。
① 原子种类 ② 原子数目 ③ 分子种类 ④ 分子数目
⑤ 元素种类
⑥ 物质种类
(3)下图是某反应的微观示意图(其中“
”分别表示不同的原子)。
① 反应后方框内应再填入 个“
② 请从微观的角度.....
分析化学变化的实质是 _____________________________________。
(4)在一密闭容器内有4种物质A 、B 、C 、D ,它们在一定条件下发生化学反应。
其中A 、B 、C 的微观示意图和反应前后各物质的质量如下表所示。
① x 的值为 。
②若D 的相对分子质量为46,该反应的化学方程式是_____________________________________。
(5)根据以上实验探究,某同学想用铁与盐酸反应来验证质量守恒定律,经查阅资料后得知,铁与稀盐酸反应可生成氯化亚铁和氢气,下列装置中,他可选择用于实验的有_____________。
12.氧原子个数相等的SO 2和SO 3的质量比是多少?
13. 由乙醛(CH 3CHO),乙炔(C 2H 2),苯(C 6H 6)组成的混合物中,碳的质量分数为72%,则氧的质量分数为 。
14.在CO 和CO 2的混合气体中,碳元素与氧元素的质量比是5:12,则混合气体中CO 和CO 2的分子个数比是( ) A .1:4 B.2:3 C.3:2 D.4:1
15.10gA 元素与适量氧气可形成34g 氧化物甲或66g 氧化物乙,则甲、乙的化学式分别为( ) A .A 2O 、A 2O 3 B.AO 、AO 2 C.A 2O 3、A 2O 7 D.A 2O 3、A 2O 5
16.某不纯的二氧化锰粉末,测知其含氧的质量分数为38.5%,且其中只含一种杂质,则这种杂质可能是( ) A .氧化镁 B.铁粉 C.二氧化硅(SiO 2) D.氧化铜(CuO )
17、山茶油中含柠檬醛.现从山茶油中提取一定质量的柠檬醛,将它在56克氧气中完全燃烧,生成44g 二氧化碳和27g 水,则柠檬醛中含有的元素是 .(填元素符号), 各元素质量之比是。
