慢病毒载体的构建模板
过表达慢病毒载体构建和包装手册 version1

过表达慢病毒载体构建和包装手册Version1.0吉凯基因二零一一年五月目录简介 (3)第一部分过表达慢病毒载体的制备实验流程 (4)实验材料 (5)过表达克隆制备 (6)第二部分慢病毒包装与滴度检测实验流程 (17)实验材料 (18)L e n t i v i r u s病毒包装 (21)病毒的收获及浓缩 (22)L e n t i v i r u s滴度测定 (24)参考文献 (33)简介慢病毒(Lentivirus)载体是以人类免疫缺陷型病毒(HIV)为基础发展起来的基因治疗载体,它对分裂细胞和非分裂细胞均具有感染能力,并可以在体内较长期的表达且安全性高。
吉凯基因提供的慢病毒为“自杀”性病毒,即病毒感染目的细胞后不会再感染其他细胞,也不会利用宿主细胞产生新的病毒颗粒。
慢病毒中的毒性基因已经被剔除并被外源性目的基因所取代,属于假型病毒。
但该病毒仍然具有可能的潜在的生物学危险,吉凯基因建议不要使用编码已知或可能会致癌的基因的假型病毒,除非已经完全公认某个基因肯定没有致癌性,否则均不建议采用假型病毒进行生物学实验。
吉凯基因慢病毒载体系统由GV慢病毒载体系列、pHelper 1.0载体和pHelper 2.0载体三质粒组成。
GV慢载体中含有HIV的基本元件5’LTR和3’LTR以及其他辅助元件,例如WRE (woodchuck hepatitis virus posttranscriptional regulatory element)。
通常根据不同的实验目的针对GV载体改造以进行基因功能研究。
pHelper 1.0载体中含有HIV病毒的gag基因,编码病毒主要的结构蛋白;pol基因,编码病毒特异性的酶;rev基因,编码调节gag和pol基因表达的调节因子。
pHelper 2.0载体中含有单纯疱疹病毒来源的VSV-G基因,提供病毒包装所需要的包膜蛋白。
吉凯基因过表达慢病毒产品可通过对GV慢病毒载体的改造和病毒包装,获得带有特定基因序列的慢病毒颗粒,以满足不同的实验需求。
细胞转染实验报告模板(3篇)

第1篇一、实验目的本实验旨在通过慢病毒转染技术将目的基因导入细胞内,观察并分析转染效率及基因表达情况,为后续实验研究提供基础。
二、实验材料1. 细胞株:293T细胞(慢病毒包装细胞)、靶细胞(如HEK293、NIH3T3等)2. 慢病毒载体:pLVX-IRES-ZsGreen1/pLVX-shRNA23. 试剂:DMEM培养基(含10%胎牛血清)、胰蛋白酶、PBS缓冲液、慢病毒转染试剂(如Lipofectamine 3000)、质粒提取试剂盒、DNA纯化试剂盒、PCR仪、电泳仪、凝胶成像系统、荧光显微镜等三、实验方法1. 细胞培养:将293T细胞接种于培养皿中,置于37℃、5%CO2的培养箱中培养,待细胞长至80%融合时,用于慢病毒包装。
2. 慢病毒包装:a. 制备慢病毒穿梭质粒:按照质粒提取试剂盒说明书提取pMD2G、pspax2、pLVX-IRES-ZsGreen1/pLVX-shRNA2质粒,并纯化。
b. 将纯化后的质粒与293T细胞共转染,转染后6小时更换为完全培养基,培养24小时后收集细胞上清液。
c. 将收集到的细胞上清液通过0.45μm滤膜过滤,并超速离心浓缩病毒颗粒。
3. 细胞转染:a. 将靶细胞接种于培养皿中,待细胞长至80%融合时,按照说明书进行慢病毒转染。
b. 转染后6小时更换为完全培养基,继续培养48小时。
4. 转染效率检测:a. 采用荧光显微镜观察绿色荧光蛋白(GFP)的表达情况,计算转染效率。
b. 对转染细胞进行PCR扩增,检测目的基因的表达情况。
四、实验结果1. 转染效率:通过荧光显微镜观察,大部分细胞呈现绿色荧光,表明转染效率较高。
2. 目的基因表达:a. PCR扩增结果显示,转染组细胞中目的基因表达水平显著高于未转染组。
b. Western Blot检测结果进一步证实了目的基因的表达。
五、实验讨论1. 本实验采用慢病毒转染技术,成功将目的基因导入细胞内,为后续实验研究提供了基础。
慢病毒载体的构建

慢
慢病毒载体是一种常用的基因转移工具,其安全性评估主要 包括对病毒的毒力、致病性和传播性的评估。在构建慢病毒 载体时,应确保所选用的慢病毒毒株无致病性,且不具有传 播性。
慢病毒载体的生物安全性
在构建慢病毒载体时,应确保载体无外源污染,如细菌、真 菌、支原体等污染。同时,应进行逆转录酶活性检测,以确 保载体无逆转录酶活性,从而避免潜在的基因重组和插入突 变风险。
慢病毒载体的构建流程
01
02
03
04
目的基因的克隆
将目的基因克隆到慢病毒载体 中,常用的克隆方法包括限制
性酶切、连接和转化等。
慢病毒载体的包装
将目的基因与包装信号共同转 染包装细胞,包装细胞能够产 生具有感染力的慢病毒颗粒。
慢病毒的纯化
通过离心、过滤等方法将慢病 毒颗粒从包装细胞中分离出来
,并进行纯化。
生物学功能分析
对目的基因进行生物学功能分析, 如报告基因实验、细胞活性实验、 动物模型实验等,以评估慢病毒 载体对目的基因功能的改善效果。
安全性评估
对慢病毒载体进行安全性评估, 包括对宿主细胞的毒性、免疫反 应、致瘤性等方面进行检测,以 确保慢病毒载体的应用安全可靠。
05
慢病毒载体的安全性与伦理问题
慢病毒的滴度测定
测定纯化后慢病毒的滴度,即 每毫升或每毫克病毒颗粒的数
量。
02
慢病毒载体的设计
包装元件的选择
01
02
03
包装元件
选择合适的包装元件是构 建慢病毒载体的关键步骤, 包括病毒的复制酶、转录 酶和整合酶等。
安全性
确保所选的包装元件无致 病性,不会对宿主细胞造 成不良影响。
兼容性
确保所选的包装元件与载 体的其他元件兼容,能够 实现有效转导和表达。
慢病毒载体包装构建过程
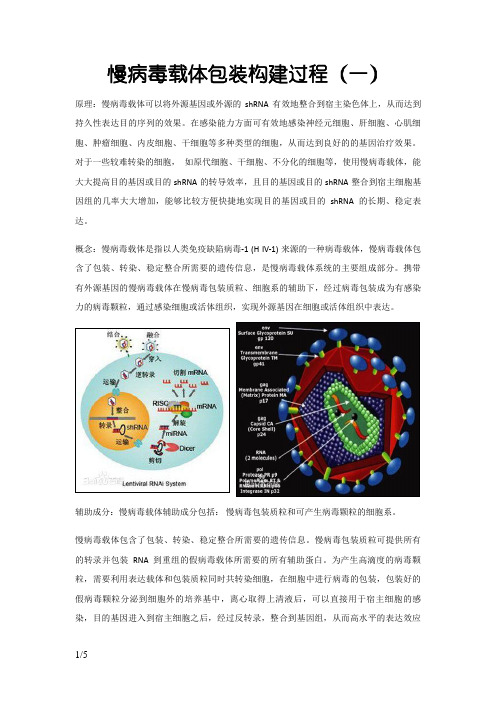
慢病毒载体包装构建过程(一)原理:慢病毒载体可以将外源基因或外源的shRNA有效地整合到宿主染色体上,从而达到持久性表达目的序列的效果。
在感染能力方面可有效地感染神经元细胞、肝细胞、心肌细胞、肿瘤细胞、内皮细胞、干细胞等多种类型的细胞,从而达到良好的的基因治疗效果。
对于一些较难转染的细胞,如原代细胞、干细胞、不分化的细胞等,使用慢病毒载体,能大大提高目的基因或目的shRNA的转导效率,且目的基因或目的shRNA整合到宿主细胞基因组的几率大大增加,能够比较方便快捷地实现目的基因或目的shRNA的长期、稳定表达。
概念:慢病毒载体是指以人类免疫缺陷病毒-1 (H IV-1) 来源的一种病毒载体,慢病毒载体包含了包装、转染、稳定整合所需要的遗传信息,是慢病毒载体系统的主要组成部分。
携带有外源基因的慢病毒载体在慢病毒包装质粒、细胞系的辅助下,经过病毒包装成为有感染力的病毒颗粒,通过感染细胞或活体组织,实现外源基因在细胞或活体组织中表达。
辅助成分:慢病毒载体辅助成分包括:慢病毒包装质粒和可产生病毒颗粒的细胞系。
慢病毒载体包含了包装、转染、稳定整合所需要的遗传信息。
慢病毒包装质粒可提供所有的转录并包装RNA 到重组的假病毒载体所需要的所有辅助蛋白。
为产生高滴度的病毒颗粒,需要利用表达载体和包装质粒同时共转染细胞,在细胞中进行病毒的包装,包装好的假病毒颗粒分泌到细胞外的培养基中,离心取得上清液后,可以直接用于宿主细胞的感染,目的基因进入到宿主细胞之后,经过反转录,整合到基因组,从而高水平的表达效应分子。
基本原理:慢病毒载体系统由两部分组成,即包装成分和载体成分。
包装成分:由HIV-1基因组去除了包装、逆转录和整合所需的顺式作用序列而构建,能够反式提供产生病毒颗粒所必需的蛋白。
包装成分通常被分开构建到两个质粒上,一个质粒表达Gag和Pol蛋白,另一个质粒表达Env蛋白,其目的也是降低恢复成野生型病毒的可能。
将包装成分与载体成分的3个质粒共转染细胞(如人肾293T细胞),即可在细胞上清中收获只有一次性感染能力而无复制能力的、携带目的基因的HIV-1载体颗粒。
USP22 ShRNA慢病毒载体的构建及鉴定

USP22 ShRNA慢病毒载体的构建及鉴定目的构建并鉴定USP22基因ShRNA慢病毒载体,为进一步研究USP22基因在鼻咽癌中的作用机制奠定基础。
方法针对USP22基因的编码序列设计并合成2条特异性干扰序列,序列两端含有限制性内切酶位点HpaⅠ和XhoⅠ。
寡核苷酸链退火生成寡核苷酸双链,5′端磷酸化后将含有酶切位点的寡核苷酸双链克隆到pLL3.7慢病毒表达载体。
连接产物经转化、培养,提取其质粒,提取出来的质粒经HpaⅠ和XhoⅠ酶切电泳鉴定,鉴定正确的质粒进行测序。
构建成功的慢病毒表达载体pLL-USP22-shRNA與包装载体质粒混匀共转染于293T细胞。
通过荧光显微镜下观察绿色荧光蛋白(GFP)情况,对病毒滴度和感染效率进行检测。
结果成功构建慢病毒表达载体pLL-USP22-shRNA。
与包装载体质粒共转染293T细胞后测定慢病毒滴度为4×107 TU/ml。
结论本实验应用相关技术成功构建USP22 ShRNA慢病毒载体,为进一步研究USP22基因的生物学功能奠定了基础。
标签:USP22;慢病毒载体;构建;鉴定肿瘤细胞中基因表达具有组织特异性,USP22泛素水解酶属去泛素化酶DUB基因家族成员,其普遍表达表明其功能的保守性,因此,USP22被归类为肿瘤干细胞的标记基因而引起高度关注[1]。
国内外学者研究发现,USP22基因过表达与结直肠癌[2]、肺癌[3]、胃癌[4]、食管癌[5]、乳腺癌[6]等恶性肿瘤的浸润、转移和预后差高度相关。
沉默USP22基因表达,能显著抑制膀胱癌[7]、结直肠癌[8]细胞增殖,由此推测USP22基因可能成为肿瘤治疗的一个新靶点。
本研究通过基因工程技术构建USP22 ShRNA慢病毒载体,为进一步研究USP22基因在人鼻咽癌细胞中的作用机制提供实验基础。
1 材料与方法1.1 实验材料、试剂及仪器pLL3.7慢病毒表达载体及包装载体质粒购自广州永诺生物科技有限公司。
慢病毒载体构建和包装操作手册

慢病毒载体构建及包装操作手册目录慢病毒收到后的注意事项一、整体实验流程二、实验材料三、慢病毒包装和浓缩四、感染目的细胞附1. 汉恒生物慢病毒质粒列表附2. 慢病毒滴度测定方法简介附3. 慢病毒MOI感染参数附4. 汉恒生物各病毒载体感染目的细胞比较慢病毒安全使用和注意事项➢慢病毒安全使用注意事项(*非常重要!!!*)1)慢病毒相关实验请在生物安全柜(BL-2级别)内操作。
2)操作病毒时请穿实验服,佩戴口罩和手套,尽量不要裸露双手及手臂的皮肤。
3)操作病毒时特别小心病毒溅出。
如果操作时超净工作台有病毒污染,请立即用70%乙醇加1%的SDS溶液擦拭干净。
接触过病毒的枪头,离心管,培养板,培养液请于84消毒液浸泡后统一处理。
4)如需要离心,应使用密封性好的离心管,如有必要请用封口膜封口后离心。
5)病毒相关的废弃物需要特殊收集,统一经高温灭菌处理。
6)实验完毕用香皂清洗双手。
➢慢病毒收到后的注意事项1)慢病毒的储存用户收到病毒液后在短期内即使用慢病毒进行实验,可以将病毒暂时放置于4 ℃保存(尽量一周内用完);如需长期保存请分装后放置于-80℃。
注:a.反复冻融会降低病毒滴度(每次冻融会降低病毒滴度10%-50%);在病毒使用过程中应尽量避免反复冻融,所以我们前期对病毒进行了分装(200 l/tube),收到后直接放置-80℃保存即可。
b.如果病毒储存时间超过6个月,我们建议在使用前重新测定病毒滴度。
2)慢病毒的稀释用户需要稀释病毒时,请将病毒取出置于冰浴融解后,使用培养目的细胞用PBS或无血清培养基(含血清或含双抗不影响病毒感染)混匀分装后置于4℃保存(请尽量一周内用完)。
一、整体实验流程二、实验材料(一)慢病毒载体、包装细胞和菌株该病毒包装系统为三质粒系统,组成为psPAX2, pMD2.G, pHBLV TM系列质粒。
1、载体信息(见附表1)2、细胞株:我们采用293T作为慢病毒的包装细胞。
该细胞系为贴壁依赖型成上皮样细胞,生长培养基为DMEM+10% FBS+双抗。
重组SV40大T抗原慢病毒表达载体的构建
郑州大学2008届硕十丁学位沦文敢组S v40大T抗原慢病毒表达载体的构建们朋材翻佃:B日m H I肋O I图2pL enti G F P亚克隆载体结构示意图2.4主要试剂2.4.1普通试剂冰乙酸、无水乙醇、甘油、E D TA、Tri S、嗅酚兰、琼脂糖、琼脂粉、胰蛋l匀月东、酵母提取物、L一谷氨酞胺、N aH C O3、N助H P O4、K H ZP O4、K C I、N aC I、N a0H、H CI、c aCI:等分析纯、化学纯、优质纯的普通试剂购自国内各大试剂公司、厂一家。
2.4.2主要分子生物学试剂l)T aq D N A聚合酶、4xdN T P、T4n N A连接酶、l艰制性内切酶B am H I均购于p ro m eg a公司。
2)Q I A G E N一T i p50M i n i p l asm i d p uri fy K i t质粒小量提取试剂盒、Q u i ek G elE xtract i o n Ki t胶回收试剂盒和R N A提取试剂盒均购自QI A G E N公司。
3)X一g al和Ip T G购自p ro m eg a公司。
4)M盯ke r D L2000购自大连宝生物工程公司。
5)青霉素、链霉素和氨节青霉素购自华北制药公司。
2.4.3主要细胞培养试剂l)优质胎牛血清购自H yc lone公司。
2)胰蛋自酶购自Sig m a公司。
郑州大学2008届硕L 学位论文重组SV 40人T 抗原慢病毒表达载体的构建4实验结果4.1目的基因S V 40大T 抗原基因的扩增结果以含有SV 4O 全基因的质粒为模板,以针对大T 抗原基因的T l/T2为引物进行P C R 扩增得到与sv 40大T 抗原基因相符的大小约为2154b p 片段(见图3)。
n 丫0.认︺﹂口n 丫P ︵入日﹄曰认︺八日自﹀0八日门︶亡JO 勺‘,上r /气︶一250匕p 一100b P图3S V 40大T 抗原基因的琼脂糖凝胶电泳结果1:大T 抗原基因的扩增产物;M :M arker4.2重组质粒p G E M 一T-Ta g 的鉴定提取转化细菌JM 109中的重组质粒pG E M 一T-Ta g ,以T 7/SP 6为引物进行P C R扩增,得到约233ob p 的扩增产物(2154+176一2330),即为阳性克隆(见图4)。
慢病毒载体的构建
慢病毒载体的构建一.构建原理:慢病毒属于逆转录病毒科, 但其基因组结构复杂, 除gag 、po l 和env 这3 个和单纯逆转录病毒相似的结构基因外, 还包括4 个辅助基因, vif 、vp r 、 nef 、vpu 和2 个调节基因tat 和rev 。
H IV 21 是慢病毒中最具特征性的病毒, 第一个慢病毒载体系统即以此病毒为基础进行构建的。
慢病毒载体的构建原理就是将H IV 21 基因组中的顺式作用元件(如包装信号、长末端重复序列) 和编码反式作用蛋白的序列进行分离。
载体系统包括包装成分和载体成分: 包装成分由H IV 21 基因组去除了包装、逆转录和整合所需的顺式作用序列而构建, 能反式提供产生病毒颗粒所需的蛋白; 载体成分与包装成分互补, 含有包装、逆转录和整合所需的H IV 21 顺式作用序列。
同时具有异源启动子控制下的多克隆位点及在此位点插入的目的基因。
为降低两种成分同源重组产生有复制能力的病毒(RCV ) 的可能性, 将包装成分的5′ L TR 换成巨细胞病毒(CMV ) 立即早期启动子, 3′ L TR 换成SV 40 po lyA 位点等。
将包装成分分别构建在两个质粒上, 即一个表达gag 和po l 、另一个表达env 。
二.实验操作举例:一)磷酸钙法转染HEK293T 细胞1. 试剂配制:无菌水ddw: 高温灭菌; 分装;2XHBS: 280mM NaCl10mM KCl1.5 mM Na2HPO412 mM glucose50 mM HEPESAdjust the pH , every 0.05pH from 7.00 to 7.45 using 10N NaOH, then add ddw. to the final volume. 过滤灭菌,分装;2M CaCl2: 过滤灭菌,分装.2. 实验过程:1. 铺细胞: 选择状态良好的293T 细胞传代, 2-3x105个细胞/35mm dish.2. 20-24h 后,待细胞长至铺满瓶底约50-70%的时候,进行转染.下面就35mm dish 为例,采用以下转染体系:ddw: 105ulplasmid: 2 ug (如0.5ug/ul, 即用4ul)2M CaCl2: 16.5ul2XHBS: 125ul按上述顺序,往eppendorf管中依次加入上述四种试剂.先将前三者混匀,最后加2XHBS.一种方法是,加2XHBS时要逐滴加入,吹打至微现乳白色,立即均匀滴入培养皿,轻轻摇匀后置于培养箱中,6-8h后换液.另一种方法是,加入2XHBS后立即吹打约40下(不过这个要根据每个人的力道和吹打的频率而定,建议做一个梯度实验,吹打不同的次数看哪次的转染效率高以后就按这个次数来吹打),之后步骤同上,立即均匀滴入培养皿,轻轻摇匀后置于培养箱中,6-8h后换液.二)转染方法2-Fugene转染病毒包装1.传293T细胞,将T75用明胶包被,每瓶T75加1.5-2mL明胶,置于37度培养箱10min。
New慢病毒载体构建.output
1、购入入门载体(1) Plasmid 32220: pENTR/U6 HDAC4 shRNA; 细菌抗性:Kanamycin(2) Plasmid 32222: pENTR/U6 HDAC5 shRNA; 细菌抗性:Kanamycin2、购入慢病毒表达载体Plasmid 19732: pLenti CMV GFP DEST (736-1) 细菌抗性:Ampicillin and Chloramphenicol3、购入慢病毒包装质粒(那边实验室或许有这三种质粒)(1) Plasmid 12251: pMDLg/pRRE 细菌抗性:Ampicillin(2) Plasmid 12253: pRSV-Rev 细菌抗性:Ampicillin(3) Plasmid 12259: pMD2.G 细菌抗性:Ampicillin属于第三代慢病毒包装系统,很多慢病毒都可以通过这个系统进行包装。
4、Addgene质粒已被转化至细菌,以穿刺培养的形式配送(figure 1)。
4度可存放2周。
长期保存需要进行甘油冻存。
Figure 15、质粒购入后,单克隆的筛选1.Obtain an LB agar plate with the appropriate antibiotic.bel the bottom of the plate with the plasmid name and the date. It is also a goodidea to add the antibiotic resistance and your initials.ing a sterile toothpick or pipette tip, touch the bacteria growing within thepunctured area of the stab culture.4.Run this tip lightly over a section of the plate to spread the bacteria overapproximately one-third of the surface area of the plate, as shown in Figure 2, to create streak #1.ing a fresh sterile pipette tip, pass through streak #1 and spread the bacteriaover the next one-third section of the plate, to create streak #2.ing a third sterile pipette tip, pass through streak #2 and spread the bacteriaover the last one-third section of the plate, to create streak #3.7.Incubate the plate overnight (12-18 hrs) at the designated growth temperature.Note: Although the growth temperature is often 37oC, some plasmids require a different temperature or growth condition. See your plasmid's information page for specific growth conditions. Figure 1 illustrates where this information can be found.8.Check for single colonies. A single colony should appear as a white dot growingon the solid medium (Figure 3).Note: If the bacterial growth is too dense to locate a single colony, re-streak onto a new agar plate to obtain single colonies.9.Once you have single colonies, proceed to Inoculating an Overnight LiquidCulture.6、摇菌、菌液冻存及质粒DNA纯化1. Prepare liquid LB. For example, to make 400mL of LB:2. When ready to grow your culture, add liquid LB to a tube or flask and add the appropriate antibiotic to the correct concentration (see table below).3. Using a sterile pipette tip or toothpick, select a single colony from your streaked LB agar plate.4. Drop the tip or toothpick into the liquid LB + antibiotic and swirl.5. Loosely cover the culture with sterile aluminum foil or a cap that is not air tight.6. Incubate bacterial culture at 37o C for 12-18hr in a shaking incubator.7. After incubation, check for growth, which is characterized by a cloudy haze in the media.8. (Optional ) For long term storage of the bacteria, you can proceed with Creating a Glycerol Stock.9. You can now isolate your plasmid DNA from the bacterial culture by the instructions for Isolating Your Plasmid DNA.7、质粒鉴定1. Perform a Diagnostic Digest - verify backbone and insert sizes2. Sequence your Plasmid - verify key regions of the plasmid using DNA sequencing and compare these to sequences those Addgene has performed on the plasmid.8、LR反应需要的材料a. Purified plasmid DNA of your pENTR ™ /U6 entry clone (50–150 ng/μL in TE Buffer)b.TE Buffer, pH 8.0 (10 mM Tris-HCl, pH 8.0, 1 mM EDTA)c. Sterile 0.5 mL microcentrifuge tubesd. pLenti CMV GFP DEST vector (150 ng/μL in TE Buffer, pH 8.0)e. Gateway ® LR Clonase ® II enzyme mixf. 2 μg/μL Proteinase K solution (thaw and keep on ice until use)1.Add the following components to 0.5 mL microcentrifuge tubes at roomtemperature and mix.Component SampleEntry clone (50-150ng/reaction) 1-7 uLpLenti CMV GFP DEST vector 1uLTE Buffer, pH 8.0 To 8uL2. Remove the Gateway ® LR Clonase ® II enzyme mix from −20°C and thaw on ice (~ 2 minutes).3. V ortex the Gateway ® LR Clonase ® II enzyme mix briefly twice (2 seconds each time).4. To the samp le above, add 2 μL of Gateway ® LR Clonase ® II enzyme mix. Mix well by pipetting up and down.Reminder: Return Gateway ® LR Clonase ® II enzyme mix to −20°C i mmediately after use.5. Incubate the reaction at 25°C for 1 hour.Note: Extending the incubation time to 18 hours typically yields more colonies.6. Add 1 μL Proteinase K (2 μg/μL) to each reaction. Incubate for 10 minutes at 37°C.7. Proceed to Trans forming One Shot ® Stbl3 ™ Competent E. coli.Note: You may store the LR reaction at −20°C for up to 1 week before transformation.9、LR反应产物转化细菌需要试剂:<1> One Shot ® Stbl3 ™ Chemically Competent E. coli<2> S.O.C. Medium.ProtocolUse this procedure to transform the LR recombination reaction into One Shot ® Stbl3 ™ Chemically Competent E. coli.1. Thaw, on ice, one vial of One Shot ® Stbl3 ™ chemically competent cells for each transformation.2. Add 2 to 3 μL of the LR recombination reaction (from Step 7, page 17) into a vial of One Shot ® Stbl3 ™ cells and mix gently. Do not mix by pipetting up and down.3. Incubate the vial(s) on ice for 30 minutes.4. Heat-shock the cells for 45 seconds at 42°C without shaking.5. Remove the vial(s) from the 42°C water bath and place them on ice for 2 minutes.6. Add 250 μL of pre-warmed S.O.C. Medium to each vial.7. Cap the vial(s) tightly and shake horizontally at 37°C for 1 hour at 225 rpm in a shaking incubator.8. Spread 25–100 μL of the transformation mix on a pre-warmed selective plate and incubate overnight at 37°C. We recommend plating two different volumes to ensure that at least one plate will have well-spaced colonies.9.质粒鉴定。
一种新型慢病毒载体制备体系的初步建立
第一军医大学硕士学位论文一种新型慢病毒载体制备体系的初步建立姓名:***申请学位级别:硕士专业:免疫学指导教师:***20060609一种新型慢病毒载体制各体系的初步建立图1-1.生产系统示意图,sD/sA表示剪接位点,V表示包装信号,gag,polSi表示相应编码序列。
主框架质粒pVECRNA含有T7启动子和终止子控制下的载体RNA的DNA模板,包装质粒pGAGPOL含有克隆于痘苗病毒早/晚期启动子和终止子之间gag--pol编码区,包膜质粒含有克隆痘苗病毒早/晚期启动子和终止子之间的vsv—G编码区,辅助痘苗病毒含有痘苗病毒启动子控制下噬菌体RNA聚合酶编码序列。
Fig.1-1therepresentationofourthree-plasmidexpressionsystemusedforgeneratingapseudotypedHIV-1basedvectorbytransienttransfection.theessentialviralcis·actingelememsandtrails-actfacmrshavebeenindicatedsuchasthesplicesignals(SD,SA),thepackagingsignal(Y),Thereadingframesofgagandp01.InthetransducingvectorpVECRNA,thetransducingvectorbackboneisflankedbyabacteriophageT7promoter(PT7)andabacteriophageT7terminator(TrT).InthepackagingvectorpGAGPOL,thegag/polflankedbyavacciniaearly/laterpromoter(PvacE/L)andapolyprotein·codingregionisvacciniaterminator(Tvac).IntheenvelopvectorpVSVG,thevesicularstomatitisvirusG(VSV-G)protein-codingregionisflankedbyavacciniaearly/laterpromoter(PvacE/L)andavacciniaterminator(Tvac)ThehelpervirusvacciniaviruscontainsthebacteriophageRNApolymerasegenedrivenbyavacciniapromoten一种新型慢病毒载体制各体系的初步建立800ml去离子水中,用NaOH调pH至7.5,加去离子水至总体积lL,高压下蒸气灭菌20min。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
PACKAGING CONSTRUCT
VECTOR CONSTRUCT
ENVELOPE CONSTRUCT
1. HIV-1-Derived lentiviral vector production & titration
Tri-Transfection (CaPO4) Pseudoparticles Recovery (filtration 0.45µm)
Lentiviruses life cycle
慢病毒通过病毒衣壳糖蛋白与细胞膜上的特异受体结合而 进入易感靶细胞。一旦与细胞膜上的特异受体结合,慢病 毒膜和细胞膜融合后病毒核心释放入细胞浆里。病毒RNA 逆转录合成双链线性DNA而转运之细胞核。线性病毒 DNA永久性的整合入染色体DNA(宿主基因组)中,形 成前病毒,成为永久的遗传成分,在细胞周期中与靶细胞 基因一样进行复制,转给子代细胞。前病毒DNA转录成 RNA后再转运至胞浆,在胞浆里RNA翻译成病毒蛋白。病 毒前结构蛋白和复制酶与病毒RNA组装成新的病毒核心, 从包装细胞获得病毒包膜蛋白后以出芽的方式从细胞膜上 释放出。病毒前结构蛋白经进一步处理而最终形成成熟的 具有感染性的子代病毒颗粒。这些特性是慢病毒成为基因 治疗转运工具的重要原因 。
Components of the lentiviral system
Expression vector
Packaging vector
Envelop/Host Range vector
五 包装系统的设计
----- HIV-1-Derived lentiviral vector production ,concentration & titration
二 HIV-1病毒颗粒结构
三 载体系统构建的基本原理
• HIV-1基因组中如包装信号、长末端重复序列的顺式作用元件与编码 反式作用蛋白的序列进行分离。即从病毒基因组中将反式gag, pol, and env基因(其他辅助基因省去)从病毒中分离出而用我们感兴趣的外源性 目的基因代替,剩下的顺式作用元件在病毒复制周期中------逆转录、 整合、转录和包被--------可以被其它病毒或细胞蛋白识别。
Fig.1 慢病毒载体的顺式作用元件
四 载体系统的设计
• 慢病毒载体系统由三种不同的组成部分:包装结构、转移载体成分和包膜 蛋白成分(Env表达结构)。 • 包装部分由去除了包装、逆转录和整合所需的顺式作用元件的HIV-1基因 组而构建,能反式提供产生病毒颗粒所需的蛋白; • 载体部分与包装成分互补,仅含有包装、逆转录和整合所需的HIV-1顺式作 用元件,同时具有异源启动子控制下的MCS及在此位点插入的目的基因。 • 三种表达结构均以细菌质粒的形式保存,能转染到哺乳动物细胞内产生复 制缺陷性病毒原种。为降低包装成分和载体成分同源重组产生有复制能力 的慢病毒(RCL) 的可能性, 将包装成分的5ˊLTR 换成巨细胞病毒(CMV ) 立 即早期启动子, 3′LTR 换成猿猴空泡病毒40(SV 40)polyA 位点等,而将 包装成分分别构建在两个质粒上, 即一个表达gag 和po l、另一个表达env。 以HIV-1为基础的慢病毒载体而言,病毒颗粒的核心和酶成分来自于HIV-1, 而包膜蛋白来自于异源性病毒, 大多是水泡性口炎病毒(VSV-G)--- •
慢病毒载体的构建
--Gateway to lentiviral vector
------献给勇敢的斗士
January 2007
Introduction
慢病毒(Lentiviruses)属于逆转录病毒科。慢病毒核蛋 白质前整合复合物具有噬核特性,病毒基因组运输至细胞核, 从而使慢病毒可以感染和在非有丝分裂细胞中复制。这一特性 使慢病毒成为基因治疗的转移载体。 HIV (Human immunodeficiency virus) 、EIAV (Equine infectious anemia virus) 、 FIV (Feline immunodeficiency virus) 、 SIV (Simian immunodeficiency virus) 。其中研究最多最为透彻 的是HIV。
The Development of LV Vectors The 2nd Generation
Biosafety issue: Additional accessory genes were deleted (vif, vpu, vpr and nef) The generation of RCL (replication competent lentiviruses) was reduced
The Development of LV Vectors The 3rd Generation
Self-inactivating (SIN) vectors Further improvement in biosafety Tat was deleted Rev was put into a separate plasmid U3 of the 5’ LTR was replaced by the CMV IE promoter/enhancer The possibility of generating RCL is further reduced
Packaging Construct Transfer Vector Construct Envelope Construct All plasmids contain a SV40 replication origin --> Episomal status
293T cells
Supernatants at 48h and 72h p.t. Concentration by Ultracentrifugation
一 HIV-1 life cycle
二 HIV-1基因结构
• • • • • • • •
gag, -----群抗原基因,编码核心蛋白p24 pol -----多聚酶基因,编码多聚酶; env-----包膜蛋白基因,编码包膜蛋白gp120 及gp41; tat ----- 基因反式激活因子对HIV-1基因其正调控作用 rev,----- 病毒蛋白表达调节因子,能增加gag和env基因对结构蛋白的表达 vif,----- 病毒感染因子, 其作用是在一些细胞因子的协下促进HIV-1在细胞内复 Vpr,----- R蛋白能使HIV在巨噬细胞中增殖 vpu,----- U蛋白,能促进HIV从细胞膜上释放 nef,----负因子,具有抑制HIV-1增殖作用
Mitrophanous K, Gene Ther 5(11):1481–1487(1999)
Lentiviral Vector Systems Under Development
• Primate – Human immunodeficiency virus (HIV) – Simian immunodeficiency virus (SIV)
D0
293T producer cells
Tri-transfection
D1
In the evening
பைடு நூலகம்
Medium D2 & D3 exchange
Supernatant harvests
Aliquots
Aliquots
Filtration 0.45µ m
1
D3 supernatants
1
D2 supernatants SW28
七 The Development of LV Vectors The 1st Generation
CMV (cytomegalovirus) immediate-early enhancer/promoter VSV-G (Vesicular stomatitis virus glycoprotein envelope) A cellular polyA was used to replace the 3’ LTR vpu from HIV was deleted
重组慢病毒的产生:瞬时转染法,即将包装结构和载体结构瞬时共转染法如
293T 高表达细胞系而产生重组慢病毒。此法非常成功,大多实验室采用此法。包膜 质粒、包装质粒与载体质粒共转(多用磷酸钙共沉淀法)染293T细胞直接产生生产细胞。 最后重组慢病毒分泌到培养基中进行培养而得到大量载体慢病毒。 例如用以下三质粒来包装产生重组慢病毒:
2
Pool 2
2
Store at 4°C
SW55
SW28
Pool 1
Concentration by ultracentrifugation
Pool 1 & Pool 2
3
Pool 3 Aliquots
六 The difference of Packaging Cells for LVV with other retroviruses
八 Advantages and Disadvantages of Lentiviral vectors
1.Potential for long term therapeutic expression: incorporates into the genome of target cells 2.High efficiency gene transduction 3.Transduce several nondividing cells 4.Broad application in vivo / ex vivo 1.Potential for insertional mutagenesis 2.Unable to transduce all nondividing cells (e.g. Hepatocytes) 3.Safety issues 1).HIV-based vectors must overcome a great social barrier 2).Limited knowledge of other lentivirus poses a risk for recombination
