甲烷、乙烯、乙炔的实验室制取共26页
选修5 烃类

CH3 [ CH—CH2 ]n (聚丙烯)
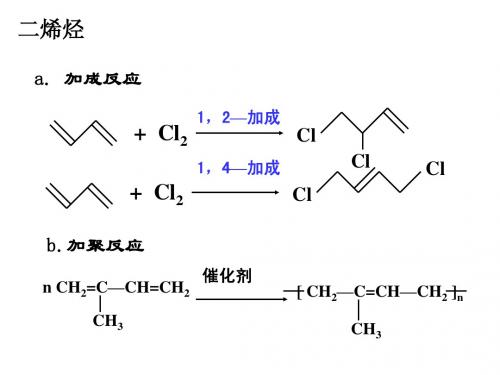
(4).共轭二烯烃的加成反应
①二烯烃的种类: 两个双键在碳链中的不同位置: C—C=C=C—C a.累积二烯烃(不稳定)
C=C—C=C—C b.共轭二烯烃
C=C—C—C=C c.孤立二烯烃
②二烯烃的加成反应:
+ Cl2
1,2—加成
Cl Cl Cl
+ Cl2
CH4
Cl 2
CH3 Cl
Cl 2
CH2 Cl2
Cl 2
CCl4
Cl 2
CHCl3
光照
CH3CH3+Cl2
CH3CH2Cl+HCl
取代反应:有机物分子中某些原子或原子团被其它 原子或原子团所代替的反应。
(2).燃烧(彻底氧化)
燃烧: CH4 +
燃烧 2O2
CO2 + 2H2O
淡蓝色火焰
注意:烷烃不能使酸性高锰酸钾褪色。
不能与溴水发生加成反应,但可以萃取。 ③氧化反应
(产生明亮火焰,浓黑烟)
不能使MnO4-(H+ aq)褪色
2. 苯的同系物:
(1).定义:
苯环上的氢原子被烷基取代的产物。
通式: CnH2n-6(n≥6)
(2).物理性质: 与苯相似,都是较好的有机溶剂,有毒。 (3).化学性质: ①氧化反应
a.可燃性
①与酸性KMnO4的作用:使KMnO4溶液褪色 5CH2=CH2 + 12KMnO4 +18H2SO4 10CO2 ↑+ 12MnSO4+ 6K2SO4+ 28H2O ②燃烧:
火焰明亮,冒黑烟,因其含碳量较高。
(3).加聚反应
有机化学实验现象-断键规律-制取等(最全版)

中学有机化学“断键”全解一.取代反应1.卤代反应:C—H键断裂①烷烃的卤代:CH4 + Cl2CH3Cl + HCl反应条件:光照、纯卤素②苯的卤代:反应条件:液溴、催化剂(FeBr3) ③苯的同系物的卤代:反应条件:液溴、催化剂(FeBr3)④酚的卤代:反应条件:浓溴水⑤醇的卤代:C2H5O H + HBr C2H5Br + H2O反应条件:浓硫酸作催化剂、脱水剂,加热2.硝化反应:C—H键断裂①苯的硝化反应条件:浓硫酸作催化剂、脱水剂,水浴加热55—60℃②苯的同系物的硝化反应条件:浓硫酸作催化剂、脱水剂,加热③酚的硝化反应条件:浓硫酸作催化剂、脱水剂3.酯化反应:羧酸中的C—O键、醇中的O—H键断裂CH3C OO H + C2H5OH CH3C OO CH2CH3 + H2O反应条件:浓硫酸作催化剂、脱水剂,加热4.水解反应①卤代烃的水解:C—X断裂C2H5Br + H2O C2H5OH + HBr反应条件:强碱NaOH的水溶液,加热②酯的水解:C—O键断裂反应条件:稀硫酸作催化剂,水浴加热70—80℃③蛋白质的水解:酰氨键中C—N键断裂5.醇与醇分子间脱水:醇分子中的的C—O键与另一醇分子中与羟基相连碳原子上的C—H键发生断裂2 CH3CH2OH CH3CH2OCH2CH3 + H2O反应条件:浓硫酸作催化剂、脱水剂,加热140℃6.置换反应:①醇的置换反应:O—H键断裂2 CH3CH2OH + 2 Na →2CH3CH2ONa + H2↑反应条件:活泼金属(K、Ca、Na、Mg、Al、Li等)②酚的置换反应:O—H键断裂反应条件:活泼金属(K、Ca、Na、Mg、Al、Li等),熔化的苯酚③羧酸的置换反应:O—H键断裂2CH3COOH + Zn →(CH3COO)2Zn + H2↑反应条件:氢以前的活泼金属7.羧酸盐的脱羧反应:C—C键断裂CH3C OO Na + Na O H CH4↑+ Na2CO3反应条件:羧酸盐无水,加热8.复分解反应:C—H键断裂①中和反应:R COOH + NaOH → R COONa + H2O②羧基的检验:R COOH + NaHCO3→ R COONa + H2O + CO2↑1.烯烃的加成反应:断裂中的一个键①与水的加成:CH2=CH2 + H2O CH3CH2OH②与卤素的加成:CH2=CH2 + Br2 →CH2BrCH2Br③与卤代烃的加成:CH2=CH2 + HCl CH3CH2Cl④与氢气的加成:CH2=CH2 + H2CH3CH32.炔烃:断裂中的一个键或二个键①与水的加成:②与卤素的加成:③与卤代烃的加成:④与氢气的加成:3.苯及苯的同系物的加成:断裂苯环上的特殊化学键4.醛的加成:断裂碳氧双键中的一个键三.消去反应:1.醇的消去反应:羟基与碳相连的C—O键及与羟基所在碳原子相邻的碳上的C—H键断裂CH3CH2OH CH2==CH2↑+ H2O反应条件:浓硫酸作催化剂、脱水剂,加热170℃2.卤代烃的消去反应:卤代烃C—X键及与卤素原子所在碳原子相邻的碳上的C—H键断裂CH3CH2Cl + NaOH CH2==CH2↑+ NaCl + H2O反应条件:强碱NaOH的醇溶液,加热1.剧烈氧化(有机物的燃烧):断裂分子中所有化学键CH3CH2OH + 3O22CO2 +3 H2O2.控制氧化①醇的催化氧化:醇羟基上的C—H键及与羟基所在碳原子相邻的碳上的C —H键断裂2 CH3CH2OH + O22CH3CHO + H2O②醛的催化氧化:断裂醛基上的C—H键2R—CHO + O2RCOO H③醛的银镜反应:断裂醛基上的C—H键R—CHO + 2Ag(NH3)2OH RCOONH4 + 3NH3 +2Ag↓+H2O反应条件:现配的银氨溶液,水浴加热④醛与新制的Cu(O H)2反应:断裂醛基上的C—H键R—CHO +2Cu(O H)2 RCOOH + Cu2O↓+ 2H2O反应条件:新配的Cu(O H)2悬浊液,加热⑤苯的同系物与酸性KMn O4反应:断裂苯环侧链上的C—H、C—C键⑥烯烃的催化氧化:断裂中的一个键断裂CH2=CH2 +O2CH3CHO⑦丁烷的催化氧化:C—C断裂CH3CH2 CH2CH3 + 5O2 4 CH3COOH + 2 H2O五、聚合反应:1.加聚反应:断裂中的一个键断裂①烯烃的加聚:②卤烯烃的加聚:③不饱和羧酸的加聚:①酚醛缩聚:酚羟基上的C—H与醛基上的C==O键断裂②氨基酸缩聚:羧基中C—O键与氨基中N—H键断裂③脂化缩聚:醇羟基上的O—H与羧基上的C—O键断裂六、分解与裂化、裂解1.分解反应①甲烷的分解:断裂C—H键反应条件:隔绝空气,加热到1000—1500℃②烯烃的臭氧分解:中的二个键全断裂③炔烃的臭氧分解:中的三个键全断裂2.裂化与裂解:C—C键断裂CH3CH2 CH2CH3 C2H4 + C2H6七、颜色反应酚遇Fe3+显蓝色:酚羟基上的O—H键断裂高中有机化学中的实验现象及注意事项1.光照甲烷与氯气的混合气体:黄绿色逐渐变浅,时间较长,(容器内壁有液滴生成)。
有机化学实验汇总

有机物的检验
常 用 试 剂
1. 2. 3. 4. 的Cu(OH)2
5.FeCl3
几种重要有机物的检验
有 机 物 质 苯 甲苯 卤代烃 乙醇 苯酚 使 用 试 剂 1.液溴,铁屑;2.混酸 液溴,铁屑; 混酸 液溴 酸性高锰酸钾溶液 NaOH,AgNO3,HNO3 铜丝 1.浓溴水;2.氯化铁溶液 浓溴水; 氯化铁溶液 浓溴水
四、常见有机物的鉴别
(1)鉴别乙烷和乙烯 ) (2)鉴别乙烯和乙炔 ) (3)鉴别己烷和己烯 ) (4)鉴别己烯和苯 ) (5)鉴别苯和甲苯 ) (6)鉴别直馏汽油和裂化汽油 )
四、常见有机反应条件
(1)需加热的反应
水浴加热:银镜反应、酯的水解等 酒精灯直接加热:乙烯、酯化反应及与新制氢氧化铜悬浊 液反应
乙炔的实验室制法: 乙炔的实验室制法:
1.发生装置:“固+液 1.发生装置: 发生装置 2.收集方法:排水法; 2.收集方法:排水法; 收集方法 3.注意事项: 3.注意事项: 注意事项 (1)可用饱和食盐水代替水,以得到平稳气流. (1)可用饱和食盐水代替水,以得到平稳气流. 可用饱和食盐水代替水 (2)不能使用启普发生器, (2)不能使用启普发生器, 不能使用启普发生器 (3)产物气体中因含有AsH3,PH3而有特殊气味. 而有特殊气味. (3)产物气体中因含有AsH 产物气体中因含有 气”的制取装置; 的制取装置;
有机实验复习(四)
一、关于温度计的实验
(1)使用了温度计的实验 )
①实验室制乙烯 ②实验室制硝基苯 ③实验室制苯磺酸 ④石油的分馏
(2)温度计的位置与作用 ) ①实验室制乙烯:液面以下——测定并控制反应混合液的温度 实验室制乙烯:液面以下 测定并控制反应混合液的温度 ②实验室制硝基苯:水浴的水中——测定并控制水浴的温度 实验室制硝基苯:水浴的水中 测定并控制水浴的温度 ③实验室制苯磺酸:水浴的水中——测定并控制水浴的温度 实验室制苯磺酸:水浴的水中 测定并控制水浴的温度 测定蒸气的温度, ④石油的分馏:蒸馏烧瓶的支管处——测定蒸气的温度,控制各 石油的分馏:蒸馏烧瓶的支管处 测定蒸气的温度 种馏分的沸点范围
必修二有机化学方程式
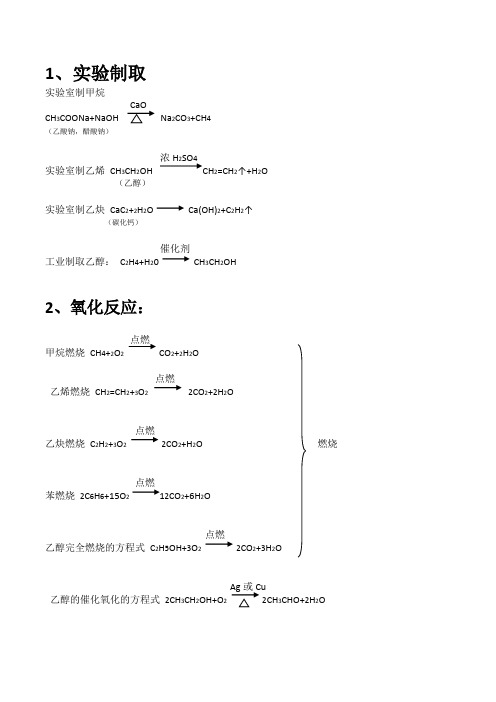
1、实验制取实验室制甲烷CH3COONa+NaOH Na2CO3+CH4(乙酸钠,醋酸钠)浓H2SO4实验室制乙烯CH3CH2OH CH2=CH2↑+H2O(乙醇)实验室制乙炔CaC2+2H2O Ca(OH)2+C2H2↑(碳化钙)催化剂工业制取乙醇:C2H4+H20 CH3CH2OH2、氧化反应:点燃甲烷燃烧CH4+2O2CO2+2H2O点燃乙烯燃烧CH2=CH2+3O22CO2+2H2O点燃乙炔燃烧C2H2+3O22CO2+H2O 燃烧点燃苯燃烧2C6H6+15O212CO2+6H2O点燃乙醇完全燃烧的方程式C2H5OH+3O22CO2+3H2O乙醇的催化氧化的方程式2CH3CH2OH+O22CH3CHO+2H2O甲烷和氯气发生取代反应光照CH4+Cl2CH3Cl+HCl光照CH3Cl+Cl2CH2Cl2+HCl光照CH2Cl2+Cl2CHCl3+HCl光照CHCl3+Cl2CCl4+HCl(注:反应物是卤素单质的蒸汽)苯和浓硫酸浓硝酸C6H6+HNO3C6H5NO2+H2O(硝基苯)FeBr3苯与溴在FeBr3催化作用下反应C6H6+Br2C6H5Br+HBr浓硫酸乙酸乙酯的水解:CH3COOC2H5+H2O CH3COOH+C2H5OH (注:苯的同系物也可以发生取代反应)4、加成反应:乙烯和溴水CH2=CH2+Br2CH2Br-CH2Br催化剂乙烯和水CH2=CH2+H20 加热加压CH3CH2OH催化剂乙烯和氯化氢CH2=H2+HCl CH3-CH2Cl乙烯和氢气CH2=CH2+H2CH3-CH3苯和氢气C6H6+3H2C6H12催化剂乙烯聚合nCH2=CH2-[-CH2-CH2-]n- (条件为催化剂)催化剂氯乙烯聚合nCH2=CHCl -[-CH2-CHCl-]n- (条件为催化剂)6、酯化反应:浓硫酸乙醇乙酸反应的方程式CH3CH2OH+CH3COOH CH3COOC2H5 +H2O (酸脱羟基,醇脱氢)(乙酸乙酯)7、补充:乙醇与钠反应2C2H5OH+2Na 2C2H5ONa+H2↑。
乙炔实验

乙炔实验的改进
1、用球行干燥管代替烧瓶, 发生装置容积减小;当把干燥管 往上提起,让电石与水相离,反 应即会停;乙炔的发生容易控制。 2、把几个分散的性质实验 改成连续实验;将15%的NaOH 溶液代替饱和食盐水,减少了因 电石中杂质产生的H2S、PH3等 有毒恶臭气体对师生健康的危害。
实验操作
点燃
2HCl
催化剂 催化剂 加温、加压
CHCH + HCl
CH2=CHCl
nCH2=CH
Cl
CH2CH Cl
n
聚氯乙烯在使用的过程中,易发生老化,会变硬、发 脆、开裂等,并释放出对人体有害的氯化氢,故不宜 使用聚氯乙烯制品直接盛装食物。
阅读:
制少量乙炔时,可用实验室制取乙炔的装 置,但工业上大量制取乙炔,除了采用从石油 化工产品中制得以外,还是利用电石生产,目 前世界先进的电石生产,已经向节能和无污染 方向迈进了一大步。我国虽从旧中国的没有乙 炔化工发展到现在年产电石228万吨以上,但我 们国家的电石生产技术还比较落后,小型开放 炉居多,能耗高,污染比较严重。要利用国外 先进技术改造我国的电石生产,希望同学们现 在努力学习, 为我们国家的化工事业做贡献。
CH2=CH2 CH3CH3
制聚乙烯塑料
CH2=CH2+ H2 CHCH + HCl
催化剂 催化剂
炔烃
②煤的气化
煤的气化是在一定条件下将其转化为可燃性气 体的过程。 C(s)+H2O(g)
高温
CO(g)+H2(g)
③煤的液化
2. 石油
主要成分:烷烃、环烷烃、芳香烃 ①石油的分馏 定义:石油分馏是利用原油中各组分沸点的不 同,将复杂的混合物分离成较简单和更有用的混合 物的过程。
分为常压分馏和减压分馏
CaS + 2H2O = Ca(OH)2 + H2S ↑
H2S +CuSO4 =CuS ↓+ H2SO4 用硫酸铜溶液除去H2S、PH3等杂质气体。
思考:能否用启普发生器制取乙炔? 1.因为碳化钙吸水性强,与水反 应剧烈,启普发生器难以控制 反应速率,不能随用、随停。 2.反应放出的热量较多,易使启普 发生器炸裂。 启普发生器 3. 生成的Ca(OH)2呈糊状,易堵塞球型漏斗。
二、烯烃的顺反异构
定义:由于碳碳双键不能旋转而导致分子中原子或 原子团在空间的排列方式不同所产生的异构现象, 称为顺反异构。
两个相同的原子或原子团排列在双键的同一侧的 称为顺式结构。 两个相同的原子或原子团排列在双键的两侧的称 为反式结构。
产生顺反异构体的条件:
1.具有碳碳双键。
2.组成双键的每个碳原子必须连接两个不同的原子 或原子团。即a’ b’ 且a b 。
随堂练习
2. 在标准状况下将11.2升乙烯和乙炔的混合气通入到 溴水中充分反应,测得有128克溴参加了反应,测乙 烯、乙炔的物质的量之比为( B )
A.1∶2
B.2∶3
C.3∶4
D.4∶5
随堂练习
3. CaC2和ZnC2、Al4C3、Mg2C3、Li2C2等都同属离子 型碳化物,请通过对CaC2制C2H2的反应进行思考,从 中得到必要的启示,写出下列反应的产物:
高中有机化学基础实验总结

高中有机化学基础实验总结(一) 烃1.甲烷的制备与氯代(必修2、P56)(性质)(1)甲烷的制备:药品:无水醋酸钠固体(CH3COONa)和碱石灰装置:固体+固体气体(可制取O2、NH3、CH4 )注意:i、必须用无水醋酸钠:①有水会使NaOH和CaO板结,不利于CH4的逸出;②可使NaOH形成强碱浓溶液腐蚀试管;水气化会吸收热量,不利于CH4的生成;③有水时,反应物的断键方式会不一样,造成无法生成CH4ii、生石灰的作用:疏散反应物,CaO为颗粒状,多孔,有利于CH4的逸出;减少NaOH与试管的接触;NaOH吸湿性很强,CaO可起到干燥NaOH的作用(2)甲烷的氯代:实验:取一个100mL的大量筒(或集气瓶),用排水的方法先后收集20mLCH4和80mLCl2,放在光亮的地方(注意:不要放在阳光直射的地方,以免引起爆炸),等待片刻,观察发生的现象。
现象:大约3min后,可观察到混合气体颜色变浅,气体体积缩小,量筒壁上出现油状液体,量筒内饱和食盐水液面上升,可能有晶体析出【会生成HCl,增加了饱和..食盐水】解释:生成卤代烃2.石油的分馏(必修2、P57,重点)(分离提纯)1)两种或多种沸点相差较大且互溶的液体混合物,要进行分离时,常用蒸馏或分馏的分离方法。
2)分馏(蒸馏)实验所需的主要仪器:铁架台(铁圈、铁夹)、石棉网、蒸馏烧瓶、带温度计的单孔橡皮塞、冷凝管、牛角管、锥形瓶。
3)蒸馏烧瓶中加入碎瓷片的作用是:防止爆沸4)温度计的位置:温度计的水银球应处于支管口(以测量蒸汽温度)5)冷凝管:蒸气在冷凝管内管中的流动方向与冷水在外管中的流动方向下口进,上口出6)用明火加热,注意安全3. 石蜡油分解实验(必修2、P62)实验:将浸透了石蜡油的石棉放置在硬质试管的底部,试管中放入碎瓷片,给碎瓷片加强热;石蜡油蒸汽通过碎瓷片表面发生反应,生成一定量的气体。
生成的气体分别通入酸性高锰酸钾溶液、溴的四氯化碳溶液中,观察;用排水集气法收集一试管气体,点燃,现象:酸性高锰酸钾溶液、溴的四氯化碳溶液褪色,火焰明亮产生黑烟结论:①石蜡油在此条件下发生了化学变化,生成的气体中含烯烃②碎瓷片的作用是催化作用3.乙烯的性质实验(必修2、P59)现象:乙烯使KMnO4酸性溶液褪色(氧化反应)(检验)乙烯使溴的四氯化碳溶液褪色(加成反应)(检验、除杂)乙烯的实验室制法:(1)反应原料:乙醇、浓硫酸(2)反应原理:CH3CH2OH CH2=CH2↑ + H2O 副反应:2CH3CH2OH CH3CH2OCH2CH3 + H2O C2H5OH + 6H2SO4(浓)6SO2↑+ 2CO2↑+ 9H2O (3)浓硫酸:催化剂和脱水剂(混合时即将浓硫酸沿容器内壁慢慢倒入已盛在容器内的无水酒精中,并用玻璃棒不断搅拌)(4)碎瓷片,以防液体受热时爆沸;石棉网加热,以防烧瓶炸裂。
乙炔

乙炔
一.乙 炔 的 结 构
分子式
电子式 结构式 结构简式
C2H2 H C
C H
H-CC-H
CH≡CH
从乙炔的结构分析可知: 乙炔属于 不饱和烃 (填“饱和烃”或“不饱和烃”); 直线型 180° 其分子的形状属于 ;健角为_______ 它是 非极性 分子(填“极性”或“非极性”)
一乙炔的实验室制法
CnH2n-2(n≥2)
2.炔烃的通式:
但符合这个通式的却不一定是炔烃
3. 炔烃的命名 炔烃的命名和烯烃相似,例如:
2,2,5-三甲基-3-己炔
炔烃C6H10
4 、含一叁键的炔烃,氢化后的产物结构简式 为
此炔烃可能有的结构有( B A.1种 C.3种 B.2种 D.4种
)
4.炔烃的物理性质变化规律:
当前治理白色污染主要使用:可降解塑 料、以纸代塑、生物全降解等新技术 中,以纸代塑被认为是目前综合评价最 好的替代技术。用这种方法制作的塑料 袋、餐具因其无毒无害、易回收、可再 生利用、可降解等优点而被冠以“环保 产品”的称号
绝缘体变导体
一般在人们的印象中,塑料是不导电的,通常用于普 通的电缆中作导电铜丝外面的绝缘层。但是,2000年3 名诺贝尔化学奖获得者勇敢地向传统观念提出了挑 战。他们通过长期精心地研究,经过对聚合物特殊的 改性,使塑料能够表现得像金属一样,具有导电性。 这不能不说是一种原创性的开发。 2000年的诺贝尔化学奖授予了美国加利福尼亚大 学的物理学家黑格、美国宾夕法尼亚大学的化学家马 克迪亚米德和日本筑波大学的化学家白川英树,因为 他们发现了导电塑料。
实验探究:
为探究乙炔与溴的加成反应,甲同学设计并进行
了如下实验:先取一定量电石与水反应,将生成的
