有机合成化学(叶非)第1章 绪论
有机化学 第1章 绪论

第一章 绪 论
【本章重点】
共价键的形成及共价键的属性、诱导效应。 【必须掌握的内容】 1. 有机化合物及有机化学。 2. 有机化合物构造式的表示方法。 3. 共价键的形成——价键法(sp3、sp2 sp杂化、σ键与π 键)和分子轨道法。 4. 共价键的基本属性及诱导效应。 5. 共价键的断键方式及有机反应中间体。 6. 有机化合物的酸碱概念。
2Cl·
△H = +242kJ / mol (
双原子分子键能也就是键的离解能;多原子分子 同类型共价键的键能,是各个键离解能的平均值。
如: CH4 +435.1 ·CH +443.5 ·CH2 +443.5 ·CH +338.9 而CH
4 3
离解能△H(kJ / mol) ·CH3 + H· ·CH2 ·CH ·C ·C + H· + H· +物通过蒸馏、结晶、吸附、
萃取、升华等操作孤立出单一纯净的有机物。
[结构] 对分离出的有机物进行化学和物理行为的了解
,阐明 其结构和特性。
[反应和合成] 从某一有机化合物(原料)经过一系列反
应转化成一已知的或新的有机化合物(产物)。
§有机化合物的特点
有机化合物的特点通常可用五个字概括: “多、燃、低、难、慢”。
△H = (435.1 + 443.5 + 443.5 + 338.9)= 1661 kJ / mol 故甲烷C-H 键的键能为:1661 / 4 = 415.3 kJ / mol 键能是指破坏或形成某一个共价键所需的平均能量。 一般来说,有机分子的键能越小,键就越活泼;键能越 大,键就比较稳定。
4. 键的极性与偶极矩 由两个电负性不同的原子组成共价键时,由 于成键的两个原子对价电子的吸引力不同,使成 键电子云在两个原子间的分布不对称,造成共价 键的正负电荷中心不重合形成极性键。
《有机化学》第1章 绪论
1.2 有机化合物的特点
1.组成上的特点:
构成有机化合物的元素种类少 主要有:C、H、O、S、N、P…… 结合方式不一,能组成约几千万种 有机物,无机物仅有十万余种
21
(1)主要元素C:
在周期表中第二周期第四主族,外围有4个 电子,排布为1S22S22P2,形成化合物时,不易得失 电子。
①在化合物中显四价,并主要以共价键相结合。
(3)难溶于水,易溶于有机溶剂
26
4.化学性质上的特点:
(1)多数有机物易燃烧。
原因: CH4 O2 注:CCl4可灭火。
CO2 + H2O
(2)反应速度慢,产物复杂。
27
1.3 有机化合物的分类
1.根据碳架不同分类
(1)开链化合物:分子中碳原子间相互结合而 成首尾不相连的碳链。
HH HC C H
15
第1章 绪论
1.1 有机化合物与有机化学 1.2 有机化合物的特点 1.3 有机化合物的分类 1.4 学习有机化学的重要性
16
1.1 有机化合物与有机化学
什么是有机 化合物
有机化合物:
碳氢化合物(烃) 及其衍生物。
17
烃: CH4 H2C = CH2 HC≡CH
衍生物:
CH3NH2
HOCH3 CH4
4 了解有机化学的新知识、新进展
学以致用,利用有机化学的知识 来认识世界、改造世界!!! 6
教学方法: 课堂学习、练习;课堂讨论、 测验、课下作业;期末考试
考核方法: 平时成绩(30%)+期末成绩(70%)
7
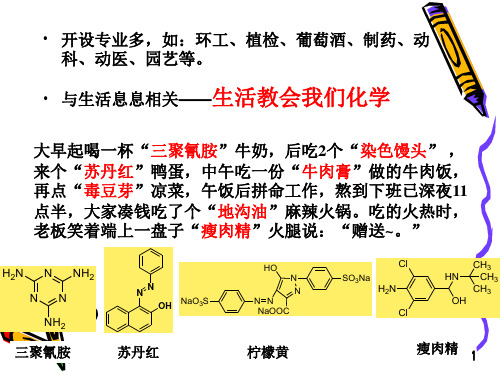
三 有机化学的应用举例
★ 应用早,两千多年前就开始应用有机物 ★ 应用广,与人们的生产生活息息相关 ★ 有机化学的知识是我们认识世界、改
有机化学 第1章 绪论

2024/11/30
10
碳原子的三种杂化轨道
1. sp3杂化 Tetrahedron
2s 2px 2py 2pz
C: 1s22s22p2
2s电子 跃迁
2s 2px
原子轨道重组
2py 2pz
109o48'
4个sp3轨道
2024/11/30
四面体型
11
2. sp2杂化
2s电子 跃迁
2s
2px 2py 2pz
配位键 金属键:自由电子与金属离子作用;多原子键, 无方向性和饱和性
2024/11/30
7
有机化合物结构的常用表达方式
甲烷 乙烯
Lewis 电子式
H HC H
H
++ +
+
H
H
++
CC
H
H
价键式
H HCH
H
H C
H
H C
H
缩写式
CH4
单键
H 2C C H 2 双键
乙炔 H C C H
HCC H
H C C H 叁键
举例
CH3CH3 CH2=CH2 HCCH CH2=CHCH=CH2
CH3CH2Cl
CH3CH2NH2 CH3CN C6H5NO2
名称
乙烷 乙烯 乙炔 丁二烯 苯 氯乙烷
乙腈 硝基苯
典型反响
自由基取代 亲电加成 亲电加成 〔共轭〕亲电加成 芳香亲电取代 亲核取代、消除
碱或亲核试剂 亲核加成 复原
2024/11/30
O HC
O
O HC O
1
O2
HC
2024/11/30
有机化学-第一章-绪论

sp2杂化的碳原子的几何
构型为平面三角形。
sp2杂化的碳原子 有机化学 第一章
24
sp1杂化
sp杂化轨道 形状:梨形
成分: 1/2 s + 1/2 P 夹角: 180° 碳原子构型:直线型
未参与杂化的两个 p 轨道的对 称轴相互垂直,且均垂直于sp 杂化轨道对称轴所在直线。
可形成两个 键和两个π键
19
杂化轨道理论 (hybrid orbital theory) 碳原子在基态时的价电子层电子构型
C : 2s2 2px1 2py1 2pz0
吸收能量
C*: 2s1 2px1 2py1 2pz1
sp3杂化
重新 分配
sp2杂化
sp杂化
有机化学 第一章
20
sp3杂化
可形成四 个 键
有机化学 第一章
21
ψ*
能
1
2
量
ψ
原子轨道组合成分子轨道必备条件: ① 能量相近 ② 最大重叠 ③ 对称性相同
有机化学 第一章
27
分子轨道理论(molecular orbital theory)
电子在分子轨道中的填充顺序
能量最低原理 泡利不相容原理 洪特规则(兼并轨道规则)
最大重叠 此外还遵循成键三原则: 能量相近
1.1 有机化合物和有机化学
•有机化学是研究有机化合物的组成、结构、性质 、合成、应用及相关理论的一门科学。
那么,什么是有机物呢?
十七世纪中叶,据物质来源分为:动物、植物 和矿物
有机——“有生命的物质”
有机化学 第一章
3
有机化学发展的历史
十九世纪初瑞典化学家 柏齐利乌斯(Berzelius)把动物物质和 植物物质合并称有机化合物,把矿物物质称为无机化合物。
有机化学课件 第1章 绪论

C H 3 C H 2 C H 2 C H 2 C l
诱导效应的特点: ① 由电负性的不同而引起。
吸电子诱导效应— -I;给电子诱导效— +I; ② 沿σ-键传递,且随着碳链增长迅速减弱;
2~3 个C以后,诱导效应几乎为零。 ③ 用直箭头表示诱导效应引起的电子云的转移方向。
1.6 有机反应的基本类型
1.3.1 按碳链分类
开链化合物:CH3CH2CH2CH3 CH2=CH-CH=CH2 CH3(CH2)16COOH 等
脂环族化合物:
O
OH
等
有机化合物 碳环化合物 芳香族化合物
CH3
OH
COOH
等
杂环化合物: ONS NhomakorabeaN
N等
1.3 有机化合物的分类
1.3.2 按官能团分类
官能团——决定化合物典型性质的原子或原子团。 ❖ 含有相同官能团的化合物具有相似的化学性质,是同类化合物。 ❖ 按官能团分类可将有机物分为: 烷、烯、炔、卤代烃、芳香烃、醇、酚、醚、醛、酮、醌、羧酸、
① sp杂化轨道的s成分更大,电子云离核更近! ②两个sp杂化轨道取最大键角180°。所以:
sp杂化碳为直线构型
HC
CH
乙炔分子的σ骨架
1.5 共价键
1.5.2 共价键的属性
1.5 2.1 键长
成键原子的平衡核间距。以nm(10-9m)表示。 ❖ 不同的共价键有不同的键长;
例如: C—C 键长0.154nm C—H 键长0.109nm C=C 键长0.133nm C—O 键长0.143nm
1.5 共价键
(2) sp2杂化 ❖ 乙烯分子中的碳原子采取sp2杂化。 ❖ 杂化的结果:
sp 2
《有机化学》第一章绪论

《有机化学》第一章绪论一、教学内容本节课的教学内容来自于《有机化学》第一章绪论。
这部分内容主要包括有机化学的基本概念、有机化合物的分类、有机化学反应类型以及有机化合物的结构和性质。
具体内容包括:1. 有机化合物的定义和特点:介绍有机化合物的概念,解释有机化合物的特点,如碳氢化合物的存在、有机化合物的命名规则等。
2. 有机化合物的分类:介绍烷烃、烯烃、炔烃、芳香烃等有机化合物的分类和特点,解释它们的结构差异和性质特点。
3. 有机化学反应类型:介绍加成反应、消除反应、取代反应等有机化学反应类型,解释反应机理和反应条件。
4. 有机化合物的结构和性质:介绍有机化合物的结构特点,如碳原子的四价键、有机化合物的同分异构现象等,解释有机化合物的物理性质和化学性质。
二、教学目标1. 学生能够理解有机化学的基本概念和特点,掌握有机化合物的分类和命名规则。
2. 学生能够了解有机化学反应的类型和机理,理解反应条件和反应产物的关系。
3. 学生能够分析有机化合物的结构和性质,运用有机化学的基本原理解决实际问题。
三、教学难点与重点重点:有机化合物的分类和特点、有机化学反应类型和机理、有机化合物的结构和性质。
难点:有机化合物的结构和性质的理解和应用、有机化学反应机理的掌握。
四、教具与学具准备教具:黑板、粉笔、多媒体教具、有机化合物的模型或图示。
学具:笔记本、笔、有机化合物的结构模型或图示、有机化学反应机理的图示。
五、教学过程1. 引入:通过展示有机化合物的实际例子,如糖类、脂肪、蛋白质等,引起学生对有机化学的兴趣,引出本节课的主题。
2. 讲解:在黑板上用粉笔写出有机化合物的定义和特点,引导学生理解有机化合物的概念和特点。
然后,通过图示和模型,讲解有机化合物的分类和结构特点,如烷烃、烯烃、炔烃、芳香烃等。
3. 示例:通过具体的有机化学反应实例,讲解加成反应、消除反应、取代反应等有机化学反应类型,解释反应机理和反应条件。
4. 练习:给出一些有机化合物的结构和性质的题目,让学生通过观察和分析,回答题目,巩固对有机化合物的结构和性质的理解。
有机化学 第一章 绪论共40页文档
有机化学绪论
22
五、有机化合物的一般特点
1、有机物中液体较多,固体有机物的晶体也较 软、熔点较低、水溶性较差。
晶体较软、熔点较低的原因:
质点(分子)间的作用力,克服起来比离子型 化合物容易。
2020/5/27
有机化学绪论
23
水溶性差的原因: 物质溶解的经验规律是:相似者相溶。非极性 有机物与水的分子结构相差甚远,分子与水的 结合力差。
2020/5/27
有机化学绪论
24
2、有机反应速度慢,反应副产物多
在有机反应中主要涉及断裂旧键形成新键,这 都需要一定的时间。有机物的结构比较复杂, 在同样的条件下可断裂的键不止一处,组成新 键也其不确定性。所以有许多副产物生成。
共价键断裂和形成不象离子键那样快,故其反 应速度往往进行是很慢。
2020/5/27
的氢带强正电,H原子与带孤对电子的原子形成的特殊 作用,被称为氢键。
2020/5/27
21
氢键实际上也是偶极-偶极间作用力,它是分子 间作用力最强的,但最高不过约25kJ•mol-1。 在特定的情况下也能形成氢键。
H FH FH F
三种作用力的大小比较:
氢键>偶极-偶极间的作用力>色散力
2020/5/27
19
分子间的作用力本质上说都是静电作用力。主 要来自于分子的偶极间的相互作用。分成三种:
2020/5/27
有机化学绪论
20
偶极-偶极作用力;具有极性的分子间主要作用力,又
叫做定向力。
色散力;非极性分子间的瞬间偶极产生的作用。极性
分子也存在着色散力。
氢键。O、N、F等原子的强拉电子作用,使与其结合
2020/5/27
有机化学 第一章 第1章 绪 论
第1章绪论一、有机化学和有机化合物人类对有机化合物(organic compound)的认识,最初主要基于实用的目的。
例如,用谷物酿酒和食醋;从植物中提取染料、香料和药物等。
到18世纪末,已经得到了一系列纯粹的化合物,例如酒石酸、柠檬酸、乳酸、苹果酸等。
这些从动植物来源得到的化合物具有许多共同的性质,但与当时从矿物来源得到的化合物相比,则有明显的区别。
由于受到生产力水平的限制,在18世纪末到19世纪初,曾认为这些化合物是由动植物有机体内的“生命力”影响而形成的,故有别于从没有生命的矿物中得到的化合物。
将前者称为有机化合物,后者称为无机化合物。
“生命力”学说曾一度阻碍了有机化学的发展,尤其是减缓了有机合成的前进步伐。
给予“生命力”学说的第一次沉重打击是1928年德国年轻的化学家乌勒(Friedrich Wöhler,1802~1882)首次从无机化合物氰酸铵合成了有机化合物尿素,这也是有机合成的开端。
NH4OCN-→NH2CONH2氰酸铵尿素尿素的人工合成,突破了无机化合物与有机化合物之间的绝对界限,不仅动摇了“生命力”学说的基础,开创了有机合成的道路,而且启迪了人们的哲学思想,有助于生命科学的发展。
德国化学家拜尔(Adolf von Beyer,1835~1917)与他人合作,1870年首次合成了靛蓝。
由于他对靛蓝及其衍生物的深入研究而荣获1905年诺贝尔化学奖。
与此同时,人们又合成了大量的有机化合物。
至此,“生命力”学说彻底破产了。
此后,人们还合成了成千上万种与日常生活密切相关的染料、药品、香料、炸药等有机物。
在一个“老的自然界”旁,再放上一个远远超过它的“新的自然界”。
这也是为什么要将有机化学(organic chemistry)单独作为一个化学分支的原因之一。
因此,有机化学是直到18世纪末才开始发展起来的一门科学。
在19世纪初期,由于测定物质组成的方法的建立和发展,在测定许多有机化合物的组成时发现,它们都含有碳,是碳的化合物。
有机化学.绪论ppt课件
有机化合物为碳化合物(CO,CO2,碳酸盐等 例外),或碳氢化合物及其衍生物。(还有一些不
含碳元素的有机化合物,如硅氧烷等有机硅类化合
物。)
可编辑课件PPT
6
▪1806年,瑞典化学家J.Berzelius首次提出了“有机 化学”这个名词,
有机化学的研究内容:
来源和制备
有机化合物
组成和结构 性质及变化规律
价键理论不能解释分子的空间结构,如CH4分子。 (1) 杂化和杂化轨道
同 一 原 子 中 几 个 能 量 相 近 的 原 子 轨 道 ( 混 合 杂 , 化 重 组 ) 杂 化 轨 道
(2) 杂化轨道数目 = 参加杂化的原子轨道数目
(3) 杂化轨道具有更强的成键能力,形成的分子更 稳定。
(4) 杂化轨道成键时要满足原子轨道最大重叠原理 和化学键间最小斥力原则。
以甲烷分子的形成为例讲解
可编辑课件PPT
26
碳原子在基态时的电子构型:
C:1s2 2s2 2px1 2py1 2pz0
原子中电子排布规则: 保里不相容原理,能量最低原理,洪特规则。
基态
激发态
sp3-杂化态
2p
电子 2p
跃迁
2s
应用、有关理论和方法学
研究的重点是结构与性质之间的关系
可编辑课件PPT
7
二、有机化学的产生和发展
1. 1828年以前的有机化学
( 称为前期有机化学,或有机化学童年期)
• “生命力”论 支配有机化学,有一种蒙 昧感,神秘感。
2•. 1停82留8年在~提1取94、5年分离、提纯阶段
(称为有机化学的青年期)
键角与键长决定分子的空间结构
可编辑课件PPT
36
第1章 有机化学绪论
(3)sp杂化轨道 杂化轨道
杂化 2px 2py 2pz sp杂化态 2s 激发态碳原子 2py 2pz
sp杂化轨道的形状: 与sp3和sp2相似 两个sp杂化轨道在空间的分布: 直线形 两个sp杂化轨道的对称轴处于以碳原子为中心的同一 直线上,相互成 180°角. 另两个未参加杂化的2p轨道相 互垂直,并垂直于此直线. sp杂化轨道一般用于形成叁键(包括1个σ键和2个π键). 例: 乙炔 CH≡CH 的结构 杂化轨道: 杂化轨道 在形成共价键的过程中,同一个原子中参与成键 的几个能量相近的原子轨道重新组合,重新分配能量和空 间方向,组成数目相等的成键能力更强的新的原子轨道.
[补充 共价键理论 补充] 共价键理论: 补充
1. 价键理论 1927年 (德)Heitler and London 提出 利用量子力学中的Schrdinger方程近似处理氢分子 结果的推广. (薛定锷方程) 成键电子的运动定域于成键原子之间. 一个原子有几 个未成对电子, 就可与几个自旋相反的电子配对,其原子 轨道相互重叠成键. 重叠的部分越大,体系能量降低越多, 所形成的共价键越牢固. 一个原子的化合价就是这个原 子的未成对电子数. 共价键的饱和性 共价键的方向性 : 只有两个原子轨道以某一方向接近, 相互间有最大重叠时,才能形成稳定的共价键. (各原子轨道形状: S:球形 P:反八字形)
2. 有机化学的课程内容和特点
内容: 包括有机物的结构、命名、制备、物理性质与化 学性质、官能团之间的相互转化, 以及在此基础之上建 立起来的规律和理论. 特点: 基础课
4. 学习方法和要求
(1)以课件为纲, 紧扣教材内容, 既要注意保持学科知识的 完整性、连贯性和系统性, 又要结合专业特点有所侧重. (2)坚持听课, 课后自觉复习, 按时独立完成作业. (3)注意对相关知识的归纳和总结, 在理解的基础上记忆. (4)不耻下问, 注意与老师和同学的沟通和交流.
