2016春北京课改版化学九下10.3《金属的冶炼与防护》精品课件
北京版化学九年级下册《金属的冶炼与防护》教案(第二课时)

九年级 10.3.2金属的冶炼与防护教案【学习目标】1、了解金属锈蚀的条件以及防止金属锈蚀的简单方法2、知道废旧金属对环境的污染,认识回收利用废旧金属等金属资源保护的重要性。
【重点和难点:】1、了解金属锈蚀的条件以及防止金属锈蚀的简单方法2、认识回收利用废旧金属等金属资源保护的重要性。
【教学方法】探究,讲练结合,自学【教学设计】一、情境引入:据有关资料报道,现在世界上每年因腐蚀而报废的金属设备和材料相当于年产量的20% ~ 40%。
金属腐蚀的条件是什么?如何防腐?二、预习检测:1.铁制品锈蚀的过程,实际上是与、水蒸气等发生的过程。
2.铝不易被锈蚀原因是在空气中与氧气反应,形成致密的,而铁锈的主要成分是,很疏松,不起保护作用。
3.保护金属资源除防止外,另一条重要的有效途径是。
三、新知新解:教师活动学生活动设计意图据有关资料报道,现在世界上每年因腐蚀而报废的金属设备和材料相当于年产量的20% ~ 40%。
观看资料、思考通过具体数字,让学生清楚地认识到金属资源保护的重要性。
提问:金属资源短缺对人类社会发展意味着什么?引入:人类需要保护金属资源铁生锈条件的探究:现有洁净无锈的铁钉、试管、经煮沸迅速冷却的蒸馏水、植物油。
试设计实验以证明铁制品锈蚀的条件。
与学生探讨设计的目的并对学生的设计给予评价。
小结:在水、氧气同时存在的环境中铁能锈蚀铁锈的主要成分是Fe2O3 · xH2O提问:1、试管Ⅱ中为什么要用煮沸过的蒸馏水,且要加入植物油?2、试管Ⅲ中为什么要将空气干燥?提问:铝与氧气反应生成的氧化铝能起保护里层铝的作用。
铁锈是否也能保护里层的铁呢?提前一星期设计准备铁的锈蚀条件的“活动与探究”,完成实验报告。
在课堂上回顾实验步骤,汇报实验结果:为了防止蒸馏水中溶有氧气。
为了去掉空气中原有的水蒸气小结:1.导致铁制品锈蚀的因素是:水和氧气同时存在;。
小结:铁锈具有疏松多孔的结构,易吸水和氧气,从而加速铁的生锈。
金属资源的利用和保护课件九年级下册化学人教版

小林同学发现铜制眼睛框表面出现了绿色物质,通过化学学习知道该物质为 铜锈,俗称铜绿,主要成分是Cu2(OH)2CO3 [提出问题]铜在什么条件下锈蚀的? [猜想]根据铜锈的化学式,猜想铜生锈可能是铜和水、_____、_____ 共同作 用的结果. [设计与实验]借鉴“铁钉锈蚀条件的探究”实验,小林设计了“铜片锈蚀条 件的探究”实验如图所示.
知识点讲解
1.原料:铁矿石、焦炭、石灰石、空气 2.原理:
3.设备:高炉 4.产品:生铁 5.注意事项: 焦炭的作用:生成还原剂CO;产生热量提 高高炉的温度。 石灰石作用:将铁矿石中的二氧化硅转化 为炉渣除去
知识点讲解
6.高炉内有关反应
(1).产生CO,提供能量 C + O2 ——点—燃— CO2 (2).在高温下,CO还原Fe2O3
随堂练习
某同学根据铜绿Cu2(OH)2CO3的成分作出猜想:金属铜锈蚀 的条件除有氧气和水外,还必须有二氧化碳。为证明“必须 有二氧化碳”,需要进行如图所示实验中的( )
A.甲和乙
B.甲和丁
C.乙和丁
D.丙和丁
知识点讲解
1.原理:(1)隔绝空气或氧气 (2)隔绝水 2.改变金属的内部结构:制成合金,如不锈钢 3.形成保护层: (1)刷油漆、涂油、烧制搪瓷(物理方法) (2)电镀上一层耐腐蚀的金属(镀铬、锌、锡),通过化 学反应使表面形成致密得到氧化物薄膜等。 (3)改善腐蚀环境等,如保持铁制品表面干燥和洁净(食 盐水和酸碱等会加快金属的腐蚀)
2.CO要“早出晚归”,酒精喷灯要“迟到早退” 实验开始时先通入CO,排尽装置内的空气,防止CO与空气 混合,加热时发生爆炸 实验完毕后要继续通入CO气体,直到玻璃管冷却,防止高温 下的铁与空气接触,被氧化
北京版化学九年级下册《金属的冶炼与防护》教案(第一课时)
九年级 10.3.1金属的冶炼与防护教案【学习目标】1、知道一些常见金属如铁、铝、铜等的矿物,了解从铁矿石中将铁还原出来的方法。
2、会根据化学方程式对含有某些杂质的反应物或生成物进行有关计算。
【重点和难点:】1、知道一些常见金属如铁、铝、铜等的矿物,了解从铁矿石中将铁还原出来的方法。
2、会根据化学方程式对含有某些杂质的反应物或生成物进行有关计算。
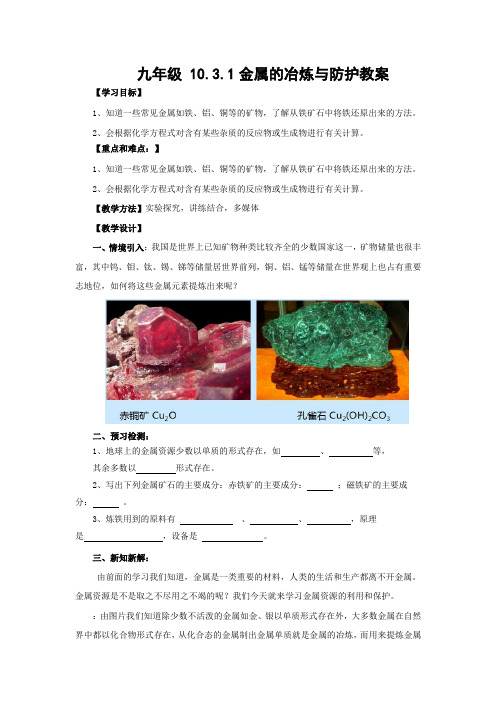
【教学方法】实验探究,讲练结合,多媒体【教学设计】一、情境引入:我国是世界上已知矿物种类比较齐全的少数国家这一,矿物储量也很丰富,其中钨、钼、钛、锡、锑等储量居世界前列,铜、铝、锰等储量在世界观上也占有重要志地位,如何将这些金属元素提炼出来呢?二、预习检测:1、地球上的金属资源少数以单质的形式存在,如、等,其余多数以形式存在。
2、写出下列金属矿石的主要成分:赤铁矿的主要成分:;磁铁矿的主要成分:。
3、炼铁用到的原料有、、,原理是,设备是。
三、新知新解:由前面的学习我们知道,金属是一类重要的材料,人类的生活和生产都离不开金属。
金属资源是不是取之不尽用之不竭的呢?我们今天就来学习金属资源的利用和保护。
:由图片我们知道除少数不活泼的金属如金、银以单质形式存在外,大多数金属在自然界中都以化合物形式存在,从化合态的金属制出金属单质就是金属的冶炼,而用来提炼金属的矿物就是矿石。
我们也知道世界上产量最大的金属是铁,那么铁是如何从铁矿石中冶炼出来的呢?现在,人类每年都要向地壳和海洋索取大量的金属矿物资源,以提取数以吨计的金属。
其中,提取量最大的是铁。
把金属矿物变成金属的过程,叫做金属的冶炼。
炼铁的过程称之为铁的冶炼。
下面,我们就来学习有关铁的冶炼的知识。
:1.我国古代炼铁图——了解我国炼铁的悠久历史2.新中国成立后钢铁工业的发展——上海宝山钢铁公司炼铁高炉;为纪念1996年中国钢产量突破1亿吨而发行的邮票。
人们是如何把铁矿石炼制成铁的呢?教师可引导学生从金属冶炼的一般条件、生成物的证明、尾气的处理等角度进行考虑。
北京课改版-化学-九年级下册-《金属的冶炼与防护》随堂练习

6.下列关于回收铝饮料罐说法不正确的是( D ) A.回收铝饮料罐可以节约金属资源 B.回收铝饮料罐可以节约能源 C.回收铝饮料罐可以减少对环境的污染 D.回收一个铝饮料罐比制造一个铝饮料罐要贵
第三节 金属的冶要成分是 Fe2O3 ;磁铁矿,主 要成分是 Fe3O4 ;菱铁矿 FeCO3 。
2.工业炼铁使用的设备是 炼铁高炉 ;
原料为:铁矿石、 焦炭 、石灰石 ;
主要的化学反应为:
Fe2O3+3CO
高温
===
2Fe+3CO2 。
3.铁制品锈蚀的过程,实际上是铁与空气中的 氧气 、水蒸气等
发生化学反应的过程。
4.保护金属资源的途径有:
① 防止金属的腐蚀
。
② 废旧金属的回收与利用
。
③ 有计划、合理地开采矿物 。
④ 其他途径:寻找金属的代用品 等
5.下列铁制品在使用和保存时的注意事项,不正确的是 (B ) A.避免长期接触潮湿空气 B.用铁制品盛装食醋 C.应保持铁制品表面洁净、干燥 D.为防止机床生锈,在机床表面涂油
北京版化学九年级下册《金属的冶炼与防护》教案

10.3金属的冶炼与防护学习目标1.知识与技能知道一些常见的金属(铁)矿物;知道从铁矿石中将铁还原出来的方法,掌握冶炼原理;了解防止金属生锈的简单方法,知道废弃金属对环境的污染,认识回收金属的重要性。
2.过程与方法通过收集材料、查阅资料、讨论交流等具体探究活动培养学生的良好学习习惯和学习方法。
3.情感态度与价值观增强热爱祖国的情感,树立为民族振兴、社会进步学习化学的志向,使学生体会学习化学的价值;树立珍惜资源、爱护环境、合理使用化学物质的观念。
4.教学重点难点炼铁的原理;金属腐蚀的条件;炼铁的原理和钢铁腐蚀条件的探究。
5.考点有关炼铁的实验;金属腐蚀条件的探究及防锈措施;金属资源的保护及合理利用等。
知识图解知识全解知识要点1 金属的冶炼1.概念:使金属矿物变成金属单质的过程,叫做金属的冶炼。
2.方法:火法(碳还原法):如在加热条件下,用碳或氢气还原氧化铜可以得到金属铜。
电解法:如电解熔融氯化钠可以得到金属钠。
热分解法:如加热氧化汞可以得到金属汞。
知识要点2 铁的冶炼1.铁矿物自然界存在多种含铁物质,铁以化合态形式存在于地壳中。
常用来炼铁的铁矿石有赤铁矿(主要成分是Fe2O3)、磁铁矿(主要成分是Fe3O4)、菱铁矿(主要成分是FeCO3)等。
2.一氧化碳还原氧化铁【仪器药品】一氧化碳、氧化铁、澄清石灰水、酒精喷灯、硬质玻璃管、铁架台、导管、单孔橡皮塞、双孔橡皮塞、试管、酒精灯。
【实验装置】【探究操作】(1)按照上图所示连接好装置,并检验装置气密性。
(2)开始实验①先通入一氧化碳片刻,再点燃尾气处的酒精灯。
②点燃酒精喷灯,对氧化铁进行加热。
(3)停止实验①熄灭酒精喷灯,停止加热,并继续通入一氧化碳。
②待玻璃管冷却后,停止通入一氧化碳,熄灭尾气处的酒精灯。
【探究结论】工业上炼铁的主要反应原理是:在高温下,用一氧化碳与铁的氧化物发生反应,使铁被还原出来:3CO+Fe2O3 高温2Fe+3CO2。
3.工业炼铁工业炼铁是一个复杂的过程。
京改版化学九年级(下册)10.3学案-金属的冶炼与防护

金属的冶炼与防护【学习目标】1.认识常见的金属矿物;2.金属资源的利用与保护。
【学习重难点】1.铁的冶炼;2.铁生锈的实验。
【学习过程】(一)新知学习1.工业上把能用来提炼金属的矿物叫做__________2.常见的矿石及主要成分__________3.高炉炼铁反应原理(化学方程式)__________4.除去铁锈的方法:(1)物理方法(2)化学方法5.金属资源的保护措施(二)达标检测1.下列有关铁的叙述中,正确的是()A.铁在氧气中燃烧生成黑色的氧化铁B.铁是地壳中含量最多的金属元素C.用盐酸与铁反应可得浅绿色的氯化亚铁溶液D.经常用水冲洗铁器表面,可以防止铁生锈2.通常铝制品很耐腐蚀的原因是()A.铝的化学性质很不活泼B.铝的化学性质很活泼C.铝的表面有一层致密的氧化铝薄膜D.铝的密度较小3.将一根用砂纸打磨过的铝丝浸入硫酸铜溶液中,能观察到的现象为写出反应的化学方程式:5.化学是一门以实验为基础的科学,下面是初中化学中几个重要的对比实验。
(1)实验1中,观察到铜片上的白磷燃烧而红磷不燃烧,可得出可燃物燃烧的一个条件为___________________________________________________________________________ (2)实验2中,观察到A烧杯中的现象是__________,由此可验证分子的性质。
(3)实验3中,对此铁钉表面的不同现象,可推知防止铁生锈的原因是__________。
(4)实验4中,对比两支试管内液面高低的不同,可说明氢氧化钠能与二氧化碳发生反应,该反应的化学方程式为__________。
北京课改版-化学-九年级下册-《金属的化学性质》名校课件

3. A、B、C三种金属,根据下列反应式中的关系: ① A+B(NO3)2 = A (NO3)2 + B
② C+ B(NO3)2 = C (NO3)2 + B
③ A+ H2SO4 (稀硫酸)= ASO4 + H2↑
④ C+ H2SO4 (稀硫酸) 不反应
试推断三种金属的活动顺序为
( B)
A.A>B>C B. A>C>B C.B>C>A D.C>A>B
4、用实验证明Zn、Cu、Mg这三种金属的活动性顺序,
选用的试剂是
(D )
A.MgCl2溶液 C.CuSO4溶液 D.稀硫酸
Fe + CuSO4 FeSO4 + Cu
金属活动顺序性顺序及其应用 置换反应
可以判断反应能否发生和金属活动性的强弱
练习
1.《齐鲁晚报》一篇文章报道:有 人利用照相馆废弃的定影液,每月可回 收20万元的银。
其回收的原理是:
Fe+2AgNO3 = 2Ag+Fe(NO3)2
这个反应属于( C )
A 化合反应 B 分解反应 C 置换反应
实验现象
化学方程式
推测
实验 铝丝表面出现红色
1
物质,溶液由蓝色变 为无色
2Al + 3CuSO4 = Al2(SO4)3 + 3Cu
Al>Cu
实验 铜丝表面出现银白
2
色物质,溶液由无色 变为蓝色
Cu +2AgNO3 = Cu(NO3)2 + 2Ag
Cu>Ag
实验
无
3
无
Cu<Al
归纳Al、Cu、Ag三种金属活动性:Al>Cu>Ag
北京课改版化学九年级下册《金属的冶炼与防护》名师教案2

第三节金属的冶炼与防护【教学目标】知道一些常见的金属(铁)等矿物,了解从铁矿石中将铁还原出来的方法;了解防止金属生锈的简单方法,知道废弃金属对环境的污染,认识回收金属的重要性。
通过收集材料、查阅资料、讨论交流等具体探究活动培养学生的良好学习习惯和学习方法。
增强热爱祖国的情感,树立为民族振兴、社会进步学习化学的志向,使学生体会学习化学的价值;保持和增强对生活中化学现象的好奇心和探究欲,培养学习化学的兴趣,树立珍惜资源、爱护环境、合理使用化学物质的观念。
【教学重点】了解从常见铁矿石中提炼铁的原理。
了解金属锈蚀的条件和金属资源的保护方法,激发学生的探究欲。
【教学难点】如何使学生解决生活中金属锈蚀的问题。
【教学准备】教师:多媒体课件(内容为常见矿石的图片、我国钢铁冶炼厂的简介、一氧化碳还原氧化铁的实验模拟演示、根据化学方程式计算的例题讲解幻灯片等);金、银戒指;镊子;酒精灯;火柴等。
生锈的铁锁、因锈蚀穿孔的铜壶、长期未用的菜刀、几段生锈的铁丝、不能用的水龙头等。
学生:课外收集的我国钢铁厂情况简介材料;重晶石等矿石样品。
在一周前做好的铁钉锈蚀条件探究的对比实验。
【教学方法】收集资料,指导阅读,动画演示,讨论交流,拓展探究,实验展示,自主评价。
【教学过程】【板书设计】第三节金属的冶炼与防护一.铁的冶炼1.原料:铁矿石、焦炭、石灰石2.设备:高炉3.原理:3CO+Fe2O3高温2Fe+3CO24.现象:红色变黑色,石灰水变浑浊。
二、金属的腐蚀与防护1.铁制品锈蚀的条件:水和氧气2.防止铁制品锈蚀的方法:保持干燥,隔绝氧气3有效保护金属资源的途径:①.防止金属的腐蚀;②.金属的回收利用;③.有计划合理的开采矿物;④.寻找金属的代替品。
