HPLC中的手性固定相
HPLC手性固定相色谱法拆分新型钙拮抗剂MN9201

第8 卷
第2 2期
20 0 8年 1 1月
科
学
技
术
与
工
程
V0. No 2 NO . 18 .2 V
2 08 0
17 —89 20 )26 0 -4 6 11 1 (0 8 2 —04 0
S inc c n l g nd Engn e i g ce e Te h o o y a ie rn
柱, 以正 己烷 . 异丙 醇 一 乙胺 ( 1 :9 :0 1V :V :V) 流 动相 , 速 为 0 5m / i , 测 波 长 为 27n M 90 对 映体 三 9 ., 为 流 . L m n 检 3 m, N 2 1
可达到基 线分离。本研 究为 MN 2 1单一对映异构体的分离、 90 制备及含量测定 等提供 了简单 、 快捷 的方法。 关键词 钙拮抗剂 手性拆分 手性 固定相 A 高效液相色谱
图 1 MN 2 1的结 构 90
1 材料与方法
1 1 仪 器 .
( N 2 1 结 构 如 图 1所 示 ) 本 实 验 室 设 计 、 M 90 , 是 合 成、 筛选 而得 的一 种新 的二 氢 毗 啶类 钙 拮抗 剂 。本
研 究采用 D ie O — a l JH柱 , c— 实现 了 MN 2 1 映体 的 90 对 拆 分 , 进一步 深 入 评 价 M 9 0 为 N 2 1单 一 异构 体 的手 性 药理学 研究奠 定 了基础 。
液相高效色谱仪原理

液相高效色谱仪原理液相高效色谱仪(High Performance Liquid Chromatography,HPLC)是一种分析仪器,主要用于分离、纯化和定量分析复杂的混合物样品。
其原理基于液相色谱技术,通过样品在流动相(溶液或气体)中的溶解度差异、分配系数差异或化学相互作用的差异,使样品组分在固定相上产生分离。
液相高效色谱仪的主要原理包括以下几个方面:1. 手性固定相:液相高效色谱仪通常使用手性固定相,在其表面上负载具有手性结构的配体或有机小分子。
当样品中的手性分子与手性配体发生相互作用时,会产生分离。
这种原理被广泛应用于药物分离和手性分析领域。
2. 反相色谱:该原理基于样品组分在非极性液相中的溶解度差异。
液相高效色谱仪使用非极性固定相(如疏水的C18链)和极性流动相(如乙腈-水混合溶液)进行分离。
具有较强亲水性的样品成分会更多地溶解于流动相中,而疏水性较强的样品成分则会更多地吸附在固定相上,从而实现样品的分离。
3. 离子交换色谱:该原理基于样品中带电离子与离子交换固定相间的离子交换作用。
液相高效色谱仪使用具有电荷的交换基团(如阴离子交换基团或阳离子交换基团)作为固定相,并通过调节溶液pH值和离子强度来控制样品成分的分离。
4. 尺寸排除色谱:该原理基于样品分子的尺寸差异。
液相高效色谱仪使用具有特定孔径的凝胶固定相,通过排除较大尺寸的样品分子,使较小尺寸的分子优先进入凝胶孔隙并被有效分离。
5. 亲和色谱:该原理基于样品与亲和固定相之间的特异性相互作用。
液相高效色谱仪使用具有特定亲和性的固定相,如亲和树脂或亲和柱,使样品中的目标分子与固定相间的特异亲和作用发生并得到分离。
液相高效色谱仪原理的选择和优化,取决于待分离的样品的特性和目标。
不同的原理可根据样品的需求进行选择,以实现高效、精确和准确的分离和分析。
手性固定相

手性固定相手性HPLC中,手性固定相是实现对映体拆分的基础,并有多种类型。
手性固定相可以根据其化学类型分类为:①“刷型”手性固定相;②手性聚合物固定相;③环糊精类手性固定相;④大环抗生素手性固定相;⑤蛋白质手性固定相;⑥配体交换手性固定相;⑦冠醚手性固定相等。
手性固定相也可以根据它们与被拆分的对映异构体间的作用机制进行分类:第一类是通过氢键、π—π或偶极吸引等相互作用与对映异构体形成配合物进行拆分的手性固定相,N—硝基苯甲酰基氨基酸或N—萘基氨基酸酯手性固定相属于该类;第二类是通过吸引和包合作,用进行拆分的手性固定相,纤维素衍生物手性固定相大都属于该类;第三类是具有手性空穴的手性固定相,对映异构体进入手性空穴后形成包合配合物被拆分,这类手性固定相主要为环糊精,冠醚手性固定相和螺旋型聚合物(如三苯甲基丁烯酸酯)也属于该类;第四类是通过对映异构金属配合物进行拆分的手性固定相,也称为手性配体交换色谱(chiral ligand exchange chromatography,CLEC);第五类是通过疏水和极性相互作用进行手性拆分的蛋白质手性固定相。
手性固定相的分类手性固定相按其分离机理分为以下几类:含有手性空腔的手性固定相:其中包括衍生化纤维素手性固定相、环糊精手性固定相、冠醚手性固定相、合成手性聚合物、手性印迹凝胶相。
纤维素是纯天然高聚物,具有高度有序螺旋状结构。
这种结构可对对映体有一定的识别作用。
将其羟基衍生化后,降低了它的极性,增加了手性固定相与被拆分分子的作用点处的空间位阻,从而改善了它的色谱行为和选择性。
将纤维素衍生化后涂覆或键合于硅胶微球上,增加其机械稳定性。
目前大赛路公司(Daicel)的手性固定相制备技术很成熟。
它现有的商品柱及其性质见下表:其中O系列的都是涂覆型手性固定相;I系列的都是键合型手性固定相。
环糊精为D-吡喃葡萄糖单元以α-1,4-糖苷键相互结合互为椅式构象的环状低聚糖,通常含有6~12个吡喃葡萄糖单元,其中有实用意义的是含有6、7、8个单元的α-CD, β-CD, γ-CD。
高效液相色谱法及其在药物分析中的应用(最新整理)

高效液相色谱法及其在药物分析中的应用以液体为流动相的色谱法称为液相色谱法。
用常压输送流动相的方法为经典液相色谱法,这种色谱法的柱效能低、分离周期长。
高效液相色谱法(highperformanceliquidchromatography,简称HPLC)是在经典液相色谱的基础上发展起来的一种色谱方法。
与经典的液相色谱法相比,高效液相色谱法具有下列主要优点:①应用了颗粒极细(一般为10µm以下)、规则均匀的固定相,传质阻抗小,柱效高,分离效率高;②采用高压输液泵输送流动相,流速快,一般试样的分析需数分钟,复杂试样分析在数十分钟内即可完成;③广泛使用了高灵敏检测器,大大提高了灵敏度。
目前,已经发展了多种不同的固定相,有多种不同的分离模式,使高效液相色谱法的应用范围不断扩大。
下面介绍高效液相色谱法的有关知识,新的方法和技术以及在药物分析中的应用。
一、分类高效液相色谱法按分离机理的不同可分为以下几类:(一)吸附色谱法(adsorptionchromatography)以吸附剂为固定相的色谱方法称为吸附色谱法。
使用最多的吸附色谱固定相是硅胶,流动相一般使用一种或多种有机溶剂的混合溶剂。
在吸附色谱中,不同的组分因和固定相吸附力的不同而被分离。
组分的极性越大、固定相的吸附力越强,则保留时间越长。
流动相的极性越大,洗脱力越强,则组分的保留时间越短。
(二)液-液分配色谱法(liquid-liquidchromatography)液-液分配色谱的固定相和流动相是互不相溶的两种溶剂,分离时,组分溶入两相,不同的组分因分配系数(K)的不同而被分离。
目前广泛使用的化学键合固定相是将固定液的官能团键合在载体上而制成的,使用化学键合固定相的色谱方法(简称键合相色谱法)可以用分配色谱的原理加以解释。
键合相色谱法在HPLC中占有极其重要的地位,是应用最广的色谱法。
按照固定相和流动相极性的不同,分配色谱法又可分为正相色谱法和反相色谱法两类。
高效液相色谱手性固定相法拆分betti碱及其衍生物对映体

浙 Байду номын сангаас 大 学 学 报(理学版)
(
)
Journal of Zhejiang University Science Edition
: http ///sci
Vol. 47 No. 1 Jan. 2020
DOI:10.3785/j.issn.1008⁃9497.2020.01.014
高效液相色谱手性固定相法拆分 碱及其衍生物对映体
BETTI
支 明 玉 1,2,朱 岩 2*
(1. 杭州职业技术学院,浙江 杭州 310018; 2. 浙江大学 化学系,浙江 杭州 310028)
摘 要 :在 纤 维 素 三 (3,5-二 甲 基 苯 基 氨 基 甲 酸 酯)(Chiralcel OD-H) 和 Pirkle 型 (R, R)-Whelk-O1 手 性 柱 上 对 手性氨基酚 1-(α-氨基苄基)-2-萘酚 (Betti 碱) 及其衍生物 1-(α-苄氨基苄基)-2-萘酚和 1-(α-哌啶基苄基)-2-萘酚 对映体分离进行了研究,分别考察了在正己烷流动相中,碱性添加剂、醇类添加剂的种类和浓度对手性拆分的影 响。结果表明:溶质在 Chiralcel OD-H 柱上的分离效果好,而在(R, R)-Whelk-O1 手性柱上只有 1-(α-苄氨基苄 基)-2-萘酚部分分离。研究了空间立体结构因素对手性分离的影响,初步探讨和比较了溶质在这 2 种手性柱上的 手性识别机理。发现对(R, R)-Whelk-O1 柱,溶质与固定相之间的吸引作用很小,而对于 Chiralcel OD-H 柱,溶 质在手性空腔中的空间适应性很可能是手性识别的关键。
关 键 词:Betti 碱;1-(α-苄氨基苄基)-2-萘酚;1-(α-哌啶基苄基)- 2-萘酚;手性固定相;对映体分离
手性药物的拆分——高效液相色谱(HPLC)
其它类型的旋光性聚合物CSPs还包含旋光性聚酰 胺、聚氨酯类、含有轴手性联萘基的旋光性聚合物、 (+)-聚-N-二苯甲基马来酰亚胺等。
2.手性拆分实例
2.1 高效液相色谱手性固定相法分离酸性化合物对 映体
手性柱 涂敷型CDMPC(20 nm, 300 mm×4.0 mm) Pirkl(S,S)WhelkO1(12mm,250mm×4.0mm )
1.4 多模式环糊精固定相
环糊精衍生化固定相既可以用于反相分离又可以用于正相分 离,因而称为多模式手性固定相。手性识别作用既有包容络 合,又有π-π电荷转移,氢键和立体排斥相互作用等多种作 用,应用范围广泛。
制备过程有四个步骤:
(1)硅胶上键合N-(2-氨乙基-3-氨丙基)基团 (2)用对甲苯磺酰氯专一性的磺化环糊精的羟基 ( 3)2-氨乙基-3-氨丙基键合硅胶与甲苯磺酰氯-β-环糊精反应;通
淀粉手性固定相的制备方法与纤维素手性固定相相似,首先 用淀粉与相应的有机化合物,如苯甲酰氯,苯基异氰酸酯等 反应,得到淀粉衍生物,再将这种衍生物涂敷在氨丙基键合 硅胶上,便可以得到淀粉类手性固定相。
1.3 环糊精手性固定相
OH
HO O OHOHO
OHO OH O
HO
OH
OOH
O
OH
O
HO
OH
+
SiO2
O O Si O
CH2CH2CH2NHCOCH2CH2CONHCH2CH2NH
3.碳氧键连接 醚基键合相与环糊精反应,:
O
SiO2
O
HO
O Si
+ (CH2)3oCH2CHCH2
O
SiO2
O O Si O
手性药物的分离在色谱法中的应用

手性药物的分离在色谱法中的应用手性药物是指具有手性结构的药物。
它们可以分为左旋和右旋两种类型,两者化学性质相同,但左右旋异构体对生物系统的影响却截然不同,这种现象被称为手性诱导失活效应。
因此,在制药过程中需要对手性药物进行分离,以确保药效和安全性。
色谱法是分离手性化合物的主要方法之一,其基本原理是利用不同化合物的物理、化学性质差异,通过分离柱将混合物中的目标物分离出来。
以下是一些色谱法在手性药物分离中的应用。
手性高效液相色谱法(HPLC)手性HPLC是目前最常用于手性药物分离的方法之一,它是利用手性固定相在悬浊液中对手性化合物进行分离。
具有手性结构的固定相与目标分子相互作用,从而实现分离。
手性HPLC可以分别采用手性固定相或手性混合物来进行分离。
此外,在手性HPLC中,主要可以采用簇列技术或化学反应转化手性方法来提高分离效率和选择性。
毛细管电泳(CE)毛细管电泳是一种基于电化学原理的分离技术,它利用电场将样品中的分子分离。
在毛细管电泳中,可以采用手性高分辨涂层来进行手性药物的分离。
在此基础上,还可以采用手性化合物作为毛细管填充剂,进一步提高分离效率和分离度。
气相色谱法(GC)气相色谱法是一种利用气体作为流动相的色谱法。
在处理手性药物时,通常需要使用手性柱和手性混合物。
与HPLC不同,该方法的分离依赖于分子间的“挤压”力。
因此,手性柱具有不同的式样,以保证灵敏度和选择性。
超临界流体色谱法(SFC)SFC是一种介于HPLC和GC之间的色谱法。
它使用超临界流体作为移动相,可以在温度和压力条件下实现高效率的手性药物分离。
通常使用手性柱和手性对映异构体混合物进行分离。
此外,还可以应用具有特定分子功能的催化剂来提高分离效率。
总之,手性药物分离是一项非常复杂的任务,需要使用不同的色谱技术和方法来实现。
无论是HPLC、CE、GC还是SFC,它们都有各自的优缺点和适用范围,因此在选择分离方法时需要综合考虑样品特性,实验设备和分离效率与成本等因素。
HPLC中的手性固定相

经典手性固定相
• 配体交换型手性固定相:
经典手性固定相
• 配体交换型手性固定相:
– 配体结合型的手性固定相主要用于生物相关性 物质的手性分离,如氨基酸和羟基酸。只有那 些具有2个或以上可供螯合的基团的对映体, 才能在这一类固定相上分离。 – 常见的金属离子,有Cu(II)、Zn(II)、Ni (II)等,其中以Cu(II)为多用,Zn(II)分 离含羟基的氨基酸效果最好。 – 如分子结构中含有芳香基团或杂原子时,分离 情况会有所不同。
经典手性固定相
• 环糊精型手性固定相:
经典手性固定相
• 环糊精型手性固定相:
– 大多数环糊精手性固定相只适用于反相色谱, 分可以被用于正 相色谱,如Cyclobond I RN或SN,因其可作为 π电子供体,具有π电子接受能力的被分析物可 以正相色谱的方式保留在这种手性固定相上。
经典手性固定相
• 人工合成多聚体型手性固定相:
– 通过加聚反应制备的含手性基团的线性聚合单 螺旋聚丙烯酸酯和聚(甲基)丙烯酰胺,是这 类手性固定相的主要代表,最早的该类手性固 定相是1979年合成的单螺旋三苯甲基-甲基丙 烯酸酯。 – 螺旋形是该类固定相产生手性识别能力的主要 原因,碳水化合物、醚类、胺类、卤化物和有 机含磷化合物都有在该类固定相上分离的成功 例子。
经典手性固定相
• Pirkle型手性固定相:
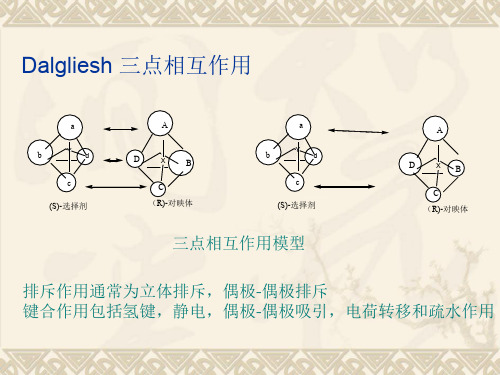
– Pirkle型手性固定相最早于1970年代末由Pirkle课题组 研制。该类手性固定相是将小分子手性选择物质键合 到固体载体(如硅胶)上得到,通常被称作Pirkle型、 刷型或π电子给予或π电子接受型手性固定相。 – 刷型固定相的手性分子主要分布在惰性基质的表面, 容易接触到被分析物质。在被分离物与固定相间的主 要相互作用是π-π相互作用,同时也存在其他类型的相 互作用,如氢键、偶极-偶极作用、空间位阻等。 – 由于良好的载样能力,Pirkle型固定相非常适用于临床 前少量药物的HPLC手性分离制备。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
经典手性固定相
• 蛋白质类手性固定相:
– 最早的基于牛血清白蛋白的色谱柱,曾被成功 用于N-衍生化氨基酸、芳香氨基酸、不带电荷 物等。 – α-酸性糖蛋白类手性固定相则被报道用于青霉 胺类对映体的制备和分析。
– 基于人血清白蛋白的手性固定相,则被用于分 离布洛芬、酮洛芬和苯并二氮杂卓类药物的分 析。
经典手性固定相
• 人工合成多聚体型手性固定相:
– 通过模仿天然多聚物的手性识别原理,某些人工合成 的化学物质也成功具备了天然多聚物的手性识别能力。 人工合成多聚物具有高柱容量、高柱效和对流动相的 广泛适应性等优点。 – 有3类不同的多聚物被使用,分别是加聚物、缩聚物和 交联聚合物。螺旋状聚丙烯酸酯、聚丙烯酰胺和聚甲 基丙烯酰胺、聚烯烃、聚苯乙烯衍生物、聚乙烯基醚、 聚醚等都曾被用于手性分析。 – 基于分子印迹技术得到的采用模板聚合方式的交联胶 类,因为其所具有的诸多优点,如易于制备、易于扩 展、低成本、稳定性和相对于溶剂的广泛适用性,而 尤其受人关注。
经典手性固定相
• 环糊精型手性固定相:
– 多类化合物通过环糊精得以成功完成手性分离,如β-阻 断剂、生物碱、羧酸及其他中性分子等。 – β-阻断剂类药物,可以直接在天然β-环糊精或γ-环糊精 固定相上分离。 – 将环糊精进行磺基化后,可以利用其多重相互作用 (如疏水性或静电力),分离中性物质、阴离子或阳 离子,该类手性固定相在生物医药领域的应用非常广 泛。 – 氨基甲酰化或二醇化的环糊精固定相,用于分离环己 烯巴比妥、氯苯吡胺(扑尔敏)等
经典手性固定相
• 人工合成多聚体型手性固定相:
经典手性固定相
• 人工合成多聚体型手性固定相:
– 通过交联聚合凝胶得到的具有手性识别能力空洞的分 子印迹手性固定相,最早见于1972年。 – 分子印迹多聚物的制备,常被分为2部分(功能性单体 的聚合反应和围绕印迹分子的交联单体聚合反应,微 粒的磨碎及被印迹分子的提取)。最被广泛使用的功 能性单体是甲基丙烯酸,而最普遍使用的交联单体是 乙二醇二甲基丙烯酸酯(EDMA)。 – 分子印迹聚合物用作手性固定相还面临着制备出一致 性、均匀性和稳定性固定相颗粒方面的诸多问题,而 且该类固定相还存在传质阻力大而导致的分离效能问 题。
经典手性固定相
• 多糖类手性固定相:
– 在2003年统计的文献中,85%的手性HPLC使用多糖类 手性固定相;而2005年的文献统计中,90%的手性 HPLC固定相为多糖类。 – 大约200种不同的基于纤维素、直链淀粉、几丁质、壳 聚糖、半乳糖胺、凝乳、右旋糖酐、木聚糖和菊糖等 的衍生物被用于制备具有手性识别能力的HPLC固定相。 纤维素和直链淀粉衍生物,体现了更高的手性识别能 力,尤其是苯基氨基甲酸酯和安息香酸酯类衍生物。 – 1970年,微晶纤维素三醋酸酯成为第一个被用于实践 的多糖类手性固定相,并在1984年采用表面涂覆在大 孔二氧化硅基质上的方式,制备了首个商品化多糖类 手性固定相。
经典手性固定相
• 多糖类手性固定相:
经典手性固定相
• 蛋白质类手性固定相:
– 用于手性分析的蛋白质,通常都来源于自然界。由于 氨基酸的排列顺序和糖基化程度的不同,蛋白质具有 不同的三维结构,并在三维结构的不同位点上,存在 着各类相互作用的位点,这一结构特点是蛋白质具备 手性识别能力的主因。 – 牛血清白蛋白是最早用于手性分离的蛋白质,之后出 现了固定化的牛血清白蛋白和α-酸性糖蛋白HPLC固定 相。 – 尽管易于获得,蛋白质类手性固定相存在载样量小、 低分离效能、容易变性等特点,同时其流动相的pH值、 离子强度和有机相组成等也受到限制。
经典手性固定相
• 环糊精型手性固定相:
– 环糊精从1970年代开始被尝试用于手性分离。 – 环糊精是一类由环形低聚糖构成的杯状化合物, 通常由淀粉经环糊精转糖基酶催化得来,含有 6(α-环糊精)、7(β-环糊精)或8(γ-环糊精) 个经α-(1,4)-糖苷键连接而得到的吡喃型葡 萄糖单位。 – 环糊精杯状结构的腔内部,不含有羟基,呈疏 水性,而杯状的外沿则是亲水性的。
经典手性固定相
• 人工合成多聚体型手性固定相:
– 通过加聚反应制备的含手性基团的线性聚合单 螺旋聚丙烯酸酯和聚(甲基)丙烯酰胺,是这 类手性固定相的主要代表,最早的该类手性固 定相是1979年合成的单螺旋三苯甲基-甲基丙 烯酸酯。 – 螺旋形是该类固定相产生手性识别能力的主要 原因,碳水化合物、醚类、胺类、卤化物和有 机含磷化合物都有在该类固定相上分离的成功 例子。
经典手性固定相
• 环糊精型手性固定相:
经典手性固定相
• 环糊精型手性固定相:
– 大多数环糊精手性固定相只适用于反相色谱, 分析极性有机化合物。
– 部分改性后的环糊精手性固定相可以被用于正 相色谱,如Cyclobond I RN或SN,因其可作为 π电子供体,具有π电子接受能力的被分析物可 以正相色谱的方式保留在这种手性固定相上。
经典手性固定相
• 冠醚类手性固定相:
– 冠醚手性固定相主要用于分离含初级胺基手性中心的 物质,如氨基酸及其衍生物。主要有2种冠醚类固定相 被广泛应用,而且有商品化的供应,如下表。 – 一个结合了3,3’-联苯-1,1’-联萘,其他的结合了酒石酸。 前者曾被用于分离α-氨基酸、1-苯基-乙胺及3-氨基己 内酰胺、β-氨基酸、芳基-α-氨基酮及氟代喹诺酮等, 而后者则被用于分离α-氨基酸、丙氨酸-β-萘胺、氨基 醇、1-(1-ห้องสมุดไป่ตู้基)乙胺、α-甲基-色胺等。
概述
• 常见商业来源的HPLC中手性固定相的主要结构、 识别机理、限制与应用,将是本节主要内容。 • 经典的手性固定相通常被分为配基交换、环糊精、 Pirkle型、合成多聚物、多糖、蛋白质、大环抗生 素和冠醚类。除此之外,还有许多其他的具有潜 在发展前景的手性固定相,但还未达到前述的商 业化程度,如环果聚糖、金属复合物、硼包含物 等。 • 色谱手性分离技术的合理设计,以及基于高通量 筛选与计算化学的新技术在HPLC手性固定相研 制中,极有可能成为未来发展的方向。
经典手性固定相
• 大环抗生素类手性固定相:
– 大环抗生素类光谱特性使得其可适应几乎所有 的色谱模式。
– 安莎霉素类和糖肽类是使用最多的手性选择体。
经典手性固定相
• 冠醚类手性固定相:
– 冠醚最早用于1967年,是一种大环聚醚,其分子立体 结构中具有一个特定大小的空腔。冠醚结构上的氧, 作为受电子基团,分布在空腔的内侧壁,使得金属或 铵离子可以进入到该空腔内。 – 1979年,有人将双(1,19-联萘)-22-冠-6固定化到聚 苯乙烯和硅胶基体上,得到首个基于冠醚的手性 固定 相。 – 通过将多种手性芳香环连接到冠醚骨架上形成手性屏 障,可以得到多种手性冠醚,如含联萘、联菲单位、 手性螺旋衍生,以及某些自然产生的手性分子,如酒 石酸或碳水化合物。
经典手性固定相
• Pirkle型手性固定相:
– 由于Pirkle型固定相的主要相互作用是π-π相互 作用,因而其主要用于分离含芳香基团的对映 体。 – Pirkle型固定相大都适用于正相HPLC。 – 大多Pirkle型固定相用于分离氨基酸、氨基醇、 胺类及某些酸性手性化合物时,可得到较好的 拆分能力。
经典手性固定相
• 环糊精型手性固定相:
– 环糊精类的手性识别能力,不仅与外沿的亲水 性基团有关,而且与被分析物的疏水性基团 (尤其是芳香疏水基团)被杯腔包含有关。 – 在环糊精杯腔外沿的C-2、C-3上的羟基,差异 性产生氢键、偶极-偶极作用,也是手性识别的 因素。通过对羟基进行化学改性,可以增强环 糊精的手性分离能力。 – β-环糊精是HPLC中使用最多的手性分离物质。
经典手性固定相
• Pirkle型手性固定相:
– Pirkle型手性固定相最早于1970年代末由Pirkle课题组 研制。该类手性固定相是将小分子手性选择物质键合 到固体载体(如硅胶)上得到,通常被称作Pirkle型、 刷型或π电子给予或π电子接受型手性固定相。 – 刷型固定相的手性分子主要分布在惰性基质的表面, 容易接触到被分析物质。在被分离物与固定相间的主 要相互作用是π-π相互作用,同时也存在其他类型的相 互作用,如氢键、偶极-偶极作用、空间位阻等。 – 由于良好的载样能力,Pirkle型固定相非常适用于临床 前少量药物的HPLC手性分离制备。
经典手性固定相
• 多糖类手性固定相:
– 该类手性固定相可以通过连接各种取代基团到 羟基上,而得到各种不同手性识别能力的 HPLC固定相。 – 该类物质的手性识别能力,被归因到具有手性 的碳水化合物单体及其很长的螺旋形二级结构。 – 多糖含有众多的可能作用位点,因而可用于分 析种类众多的待测物。多糖使用非常广泛,在 所有手性固定相中,其可分离物质的种类仅次 于蛋白质,但其载样量远大于蛋白质类固定相。
经典手性固定相
• 配体交换型手性固定相:
经典手性固定相
• 配体交换型手性固定相:
– 配体结合型的手性固定相主要用于生物相关性 物质的手性分离,如氨基酸和羟基酸。只有那 些具有2个或以上可供螯合的基团的对映体, 才能在这一类固定相上分离。 – 常见的金属离子,有Cu(II)、Zn(II)、Ni (II)等,其中以Cu(II)为多用,Zn(II)分 离含羟基的氨基酸效果最好。 – 如分子结构中含有芳香基团或杂原子时,分离 情况会有所不同。
经典手性固定相
• 大环抗生素类手性固定相:
– 1994年,大环抗生素类首次作为手性固定相,用于分 离氨基酸类对映体。大环抗生素类手性固定相也是常 用固定相之一,次于多糖类和环糊精类。
– 与其他手性选择体不同,大环抗生素类在结构上具有 显著的多样性,如大环多烯-多羟基化合物、柄状化合 物、大环糖肽、多肽和肽杂环类化合物。结构上的多 样性,使得该类固定相有可能提供多种相互作用方式, 如疏水作用、偶极-偶极作用、π-π相互作用、氢键连 接及立体位阻等。
