北师大版无机化学课件第二章分子结构
合集下载
无机化学课件9-分子结构
分子轨道理论(20世纪20年代末)
§9.1 Lewis理论
电子配对理论——共用电子对成键。 • 八隅体规则
• Lewis结构式
H—H
: Cl : C
: Cl
Cl :
O = C= O
:N N:
: Cl :
违背八隅体规则的例子:BF3,PCl5,SF6等。
_ 109 28’ _ _ _ + +
+
轨道重叠
杂化轨道与其它原子轨道重叠 形成化学键时,要满足原子轨道最
H
大重叠原理。原子轨道重叠越多,
形成的化学键越稳定。由于杂化轨 道的电子云分布更集中,所以杂化 轨道成键能力比未杂化的各原子轨 道的成键能力强。化合物的空间构 型是由满足原子轨道最大重叠的方 向决定的。
NH3分子形成时的轨道杂化。
H2O:几何构型为V型。 键角为:104.5 © O: 2s22p4
2p 2s
sp3杂化
sp3不等性杂化
两个杂化轨道 能量较低,被两对 孤对电子占据。
小结:杂化轨道的类型与分子的空间构型
杂化轨道类型 杂化轨道数 分子空间构型
直线形 三角形 四面体 三角锥 V型
sp
sp2
C
2
CO
2
O
2s 2p
2 4
2s 2p
HF
HBF4
BF3
价键理论的局限性
价键理论能较好地说明一些双原子分子价键的 形成 为解决价键理论的局限性,鲍林在价键理 不能很好地说明多原子分子的价键形成和几何 论中引入了杂化轨道的概念 构型
如 CH4 实际测定→
按价键理论
C 2s
无机化学@5 分子结构

+
+
-
±
•+ •
p-p原子轨道组合成σ分子轨 道
+
•
+
-
•
+
-
-
+
-
+
-
+
•
•
+
±
•
-•
+
•-
•+
E E
•-
+
+
•
p-p原子轨道组合成π分子轨 道
•
•
-
•
+
-
•
•
•
+
-
+
+
-
-
•
E E
-
+
+
+
•
+
±
•
2.5 .3.1 F2和O2分子轨道的 能级图
σ2s*
2s 2s
σ2s
K
σ1s*
1s 1s
σ1s
诱导力:极性分子与非极性分子相互靠近时
极性分子固有偶极产生的电场,会诱使非极
性分子产生诱导偶极。诱导偶极反过来使极性分
子的偶极增大,产生相互作用。
+
非极性 分子
极性分子对非极 性分子产生诱导
-
+
-
+
极性分子
诱导力还存在于极性分子之间。 诱导力的大小与分子的极性和
-
+
-
+
诱导力
变形性以及分子间距离有关。
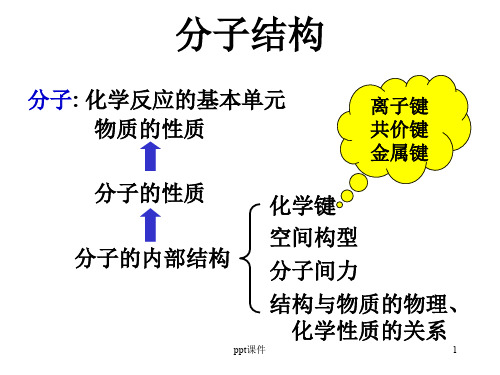
第二章 分子结构
2.3.2.3 sp3杂化
无机化学_分子结构共55页

•
26、我们像鹰一样,生来就是自由的 ,但是 为了生 存,我 们不得 不为自 己编织 一个笼 子,然 后把自 己关在 里面。 ——博 莱索
•
27、法律如果不讲道理,即使延续时 间再长 ,也还 是没有 制约力 的。— —爱·科 克
•
28、好法律是由坏风俗创造出来的。 ——马 克罗维 乌斯
•
29、在一切能够接受法律支配的人类 的状态 中,哪 里没有 法律, 那里就 没有自 由。— —洛克
END
•
30、风俗可以造就法律,也可以废除 法律。 ——塞·约翰逊
无机化学_分子结构
16、业余生活要有意义,不要越轨。——华盛顿 17、一个人即使已登上顶峰,也仍要自强不息。——罗素·贝克 18、最大的挑战和突破在于用人,而用人最大的突破在于信任人。——马云 19、自己活着,就是为了使别人过得更美好。——雷锋 20、要掌握书,莫被书掌握;要为生而读,莫为读而生。——布尔沃
26、我们像鹰一样,生来就是自由的 ,但是 为了生 存,我 们不得 不为自 己编织 一个笼 子,然 后把自 己关在 里面。 ——博 莱索
•
27、法律如果不讲道理,即使延续时 间再长 ,也还 是没有 制约力 的。— —爱·科 克
•
28、好法律是由坏风俗创造出来的。 ——马 克罗维 乌斯
•
29、在一切能够接受法律支配的人类 的状态 中,哪 里没有 法律, 那里就 没有自 由。— —洛克
END
•
30、风俗可以造就法律,也可以废除 法律。 ——塞·约翰逊
无机化学_分子结构
16、业余生活要有意义,不要越轨。——华盛顿 17、一个人即使已登上顶峰,也仍要自强不息。——罗素·贝克 18、最大的挑战和突破在于用人,而用人最大的突破在于信任人。——马云 19、自己活着,就是为了使别人过得更美好。——雷锋 20、要掌握书,莫被书掌握;要为生而读,莫为读而生。——布尔沃
大学无机化学-分子结构

价键理论简明的描述了共价键的本质和特点,但在解 释分子的空间构型时遇到了困难。
例如:甲烷,有四个等同的C-H键,正四面体构型。 但C原子只有两个未成对电子,根据VB法,只能形成两个 共价单键。
(五)杂化轨道理论 (Hybrid Obital Theory)
CH4 形成的过程中, C 原子的电子曾有过如下的 激发步骤,以得到4 个单电子。
P222,图9-8
N: 2s2 2px1 2py1 2pz1
键: 肩并肩方式重叠 p-p
键
键: 肩并肩方式重叠 p-d 键 d-d 键
(四) 键参数bond parameter
(1)键能 bond energy
AB ( g ) —— A ( g ) + B ( g ) H = EAB
px x x
+
键轴
+
z
绕键轴旋转
180°
+
+
N2 分子中两个原子各有三个单电子 px
py pz
沿 z 轴成键时, px 与 px “ 头碰头” 形成一个 键 。此时, pz 和 pz , py 和 py 以 “ 肩并肩 ”
形式重叠,形成两个 键。
N2 分子的 3 键中,有 1 个 键, 2 个 键 。 价键结构式:N N
2s 2p 电子激发 2p
2s
显然,这 4 个单电子所在原子轨道不一致。利用这些原 子轨道与 4个H 原子形成的化学键,应该不完全相同,也不 应该指向正四面体的四个顶点。CH4为什么是正四面体结构? AlCl 3 键角 120°, NH4+ 键角 109°28 ′。在成键
重叠部分越大,键越牢固,分子越稳定。
大学无机化学《分子结构》 ppt课件
19
sp3杂化轨道示意图
CH4分子的空间结构
ppt课件
20
④ sp3d2杂化 1 ns + 3 np + 2 nd 6 sp3d2 六个sp3d2杂化轨道指向正八面体的六个顶点 sp3d2杂化轨道间的夹角 = 180或90
ppt课件
21
3p 3s
激发态
激发
SF6分子形成
杂化
3d
sp3d2杂化态
② 杂化前后轨道数目不变。
③ 杂化轨道可分为等性和不等性杂化轨道。 采用sp3杂化轨道成键的分子,其空间构型可 能为四面体型,V型或者三角锥型。
③ 单电子键 (如 H2+p)p,t课O件 2具有磁性
6
1927年, Heitler 和 London 应用量子力学研究 H2分子结构, 初步解答了共价键的本质.
1930年, Pauling 和 Slater 等发展出现代价键 理论(电子配对理论)、杂化轨道理论、 价层电子对互斥理论
1932年, 美国化学家密立根和德国化学家洪特 提出分子轨道理论
ppt课件
10
8.2.2 共价键的类型
(1)σ键:两原子的成键轨道沿键轴(或两 核间的连线)的方向,以“头碰头”的方式 发生轨道重叠,轨道重叠部分是沿着键轴呈 圆柱型对称,这样形成的共价键叫σ键。
++
x
s-s
—
++
x
px-s
—
++
—
x
ppt课件
px- px
11
(2)π键:两个原子轨道沿键轴的方向,通过键轴的
另一方有空轨道。
例:NH
4
H
HNH
H
BF4
CO
2024版大学无机化学完整版ppt课件

离子键。
离子晶体的结构
02
离子晶体中正负离子交替排列,形成空间点阵结构,具有高的
熔点和沸点。
离子键的强度
03
离子键的强度与离子的电荷、半径及电子构型有关,电荷越高、
半径越小,离子键越强。
12
共价键与分子结构
2024/1/29
共价键的形成
原子间通过共用电子对形成共价键,共价键具有方向性和饱和性。
分子的极性与偶极矩
大学无机化学完整版ppt课件
2024/1/29
1
目录
2024/1/29
• 无机化学概述 • 原子结构与元素周期律 • 化学键与分子结构 • 化学反应基本原理 • 酸碱反应与沉淀溶解平衡 • 氧化还原反应与电化学基础 • 配位化合物与超分子化学简介
2
01
无机化学概述
Chapter
2024/1/29
反应机理
基元反应和复杂反应、反应机理的推导和表示 方法
反应速率理论
碰撞理论、过渡态理论和微观可逆性原理
2024/1/29
影响反应速率的因素
浓度、温度、催化剂和光照等外部条件对反应速率的影响
18
05
酸碱反应与沉淀溶解平衡
Chapter
2024/1/29
19
酸碱反应概述
酸碱定义及性质
介绍酸碱的基本概念、性质和分类,包括阿累尼乌斯 酸碱理论、布朗斯台德酸碱理论等。
配位化合物的组成 中心原子或离子、配体、配位数、配位键等。
配位化合物的分类
3
根据中心原子或离子的性质可分为金属配位化合 物和非金属配位化合物;根据配体的性质可分为 单齿配体和多齿配体等。
2024/1/29
28
第二章 分子结构.ppt

※
2.1 杂化轨道理论--价键理论(二) --泡林以量子力学为基础提出 中心原子能量相近的不同轨道在外界的影响下会发生 杂化,形成新的轨道,称杂化原子轨道,简称杂化轨道。这 种原子轨道重新组合行为称为杂化 原子在形成分子时,为了增强成键能力和分子的稳定性, 趋向于将不同类型的原子轨道重新组合成能量、形状和方向 与原轨道不同的新原子轨道。这是原子形成共价分子时的普
CO的分子轨道能级图
CO的总电子数为10,N2分子的价电子总数也为10,CO与 N2 为等电子体,其结构应该相似。但是,C原子和O原子的电 负性差较大(△=3.5-2.5=1)。能量上,O的2s 轨道的能量低 于C 的2s 轨道的能量12.92 eV,而C 原子的2s 轨道比O原子的2p 轨道能量仅差3.54 eV,前者低仅3.54 eV。
四. 含氧酸、含氧酸根 二周期(sp2): H3BO3 (s)(无π) H2CO3
HNO3 HNO2
三周期及以下(sp3): Al(OH) 3 H4SiO4
4
H3PO4 H2SO4 HClO1-
H5IO6 H3BO3 (l)
配 位 数 2 3 4 4 5 5 6
6
空间构型
杂化轨 道类型 sp sp2 sp3 dsp2 dsp3 d 4s Sp3d2
三 多原子分子的分子轨道
多原子分子的分子轨道也可用原子轨道线性组合而形成。 但是
在组合成分子轨道时,必须先将配位体原 子 轨 道 进 行 组 合 得 到 配 体 群 轨 道 “ group orbits”,然后将这种群轨道当作单个原子的原
子轨道,使之与中心原子相同对称性的原子轨道
组合得到成键和反键的分子轨道,其余对称性不 匹配的轨道则成为非键轨道。
分子中又有了π键的结构)
2.1 杂化轨道理论--价键理论(二) --泡林以量子力学为基础提出 中心原子能量相近的不同轨道在外界的影响下会发生 杂化,形成新的轨道,称杂化原子轨道,简称杂化轨道。这 种原子轨道重新组合行为称为杂化 原子在形成分子时,为了增强成键能力和分子的稳定性, 趋向于将不同类型的原子轨道重新组合成能量、形状和方向 与原轨道不同的新原子轨道。这是原子形成共价分子时的普
CO的分子轨道能级图
CO的总电子数为10,N2分子的价电子总数也为10,CO与 N2 为等电子体,其结构应该相似。但是,C原子和O原子的电 负性差较大(△=3.5-2.5=1)。能量上,O的2s 轨道的能量低 于C 的2s 轨道的能量12.92 eV,而C 原子的2s 轨道比O原子的2p 轨道能量仅差3.54 eV,前者低仅3.54 eV。
四. 含氧酸、含氧酸根 二周期(sp2): H3BO3 (s)(无π) H2CO3
HNO3 HNO2
三周期及以下(sp3): Al(OH) 3 H4SiO4
4
H3PO4 H2SO4 HClO1-
H5IO6 H3BO3 (l)
配 位 数 2 3 4 4 5 5 6
6
空间构型
杂化轨 道类型 sp sp2 sp3 dsp2 dsp3 d 4s Sp3d2
三 多原子分子的分子轨道
多原子分子的分子轨道也可用原子轨道线性组合而形成。 但是
在组合成分子轨道时,必须先将配位体原 子 轨 道 进 行 组 合 得 到 配 体 群 轨 道 “ group orbits”,然后将这种群轨道当作单个原子的原
子轨道,使之与中心原子相同对称性的原子轨道
组合得到成键和反键的分子轨道,其余对称性不 匹配的轨道则成为非键轨道。
分子中又有了π键的结构)
无机化学ppt课件

命名方法
配位化合物的命名遵循一定的规则,包括确定中 心原子和配体的名称、标明氧化态和配位数等。
金属有机化合物类型、合成方法和应用前景
01
类型
金属有机化合物包括金属烷基化合物、金属芳基化合物、金属羰基化合
物等,它们在结构和性质上具有多样性。
02
合成方法
金属有机化合物的合成方法包括金属与有机物的直接反应、金属卤化物
离子键和共价键的强度
决定物质的化学性质,如稳定性、反 应活性等。离子键较强,共价键有强 弱之分。
氢键
一种特殊的分子间作用力,存在于含 有氢原子的分子之间,对物质的熔沸 点、溶解度等性质有显著影响。
04
晶体结构与性质
晶体类型及结构特点
01
02
03
04
离子晶体
由正负离子通过离子键结合而 成,具有高熔点、高硬度等特
原子结构模型及发展历程
道尔顿实心球模型
认为原子是坚硬的、不可再分的 实心球体。
汤姆生枣糕模型
发现电子,提出原子像枣糕一样, 电子像枣子一样镶嵌在原子中。
卢瑟福核式结构模型
通过α粒子散射实验,提出原子 的中心有一个带正电的原子核, 电子绕核旋转。
波尔分层模型
引入量子化概念,解释氢原子光 谱,提出电子在特定轨道上运动。
沉淀溶解平衡原理及应用
沉淀溶解平衡定义
在一定条件下,难溶电解质在溶液中的离子浓度达到平衡状态。
沉淀溶解平衡应用
通过控制溶液中的离子浓度,可实现难溶电解质的分离、提纯和制 备。
溶度积常数(Ksp)
表达难溶电解质在溶液中离子浓度平衡关系的常数,可用于判断沉 淀的生成和溶解条件。
难溶电解质溶解度和溶度积常数计算
化学键类型及形成条件
配位化合物的命名遵循一定的规则,包括确定中 心原子和配体的名称、标明氧化态和配位数等。
金属有机化合物类型、合成方法和应用前景
01
类型
金属有机化合物包括金属烷基化合物、金属芳基化合物、金属羰基化合
物等,它们在结构和性质上具有多样性。
02
合成方法
金属有机化合物的合成方法包括金属与有机物的直接反应、金属卤化物
离子键和共价键的强度
决定物质的化学性质,如稳定性、反 应活性等。离子键较强,共价键有强 弱之分。
氢键
一种特殊的分子间作用力,存在于含 有氢原子的分子之间,对物质的熔沸 点、溶解度等性质有显著影响。
04
晶体结构与性质
晶体类型及结构特点
01
02
03
04
离子晶体
由正负离子通过离子键结合而 成,具有高熔点、高硬度等特
原子结构模型及发展历程
道尔顿实心球模型
认为原子是坚硬的、不可再分的 实心球体。
汤姆生枣糕模型
发现电子,提出原子像枣糕一样, 电子像枣子一样镶嵌在原子中。
卢瑟福核式结构模型
通过α粒子散射实验,提出原子 的中心有一个带正电的原子核, 电子绕核旋转。
波尔分层模型
引入量子化概念,解释氢原子光 谱,提出电子在特定轨道上运动。
沉淀溶解平衡原理及应用
沉淀溶解平衡定义
在一定条件下,难溶电解质在溶液中的离子浓度达到平衡状态。
沉淀溶解平衡应用
通过控制溶液中的离子浓度,可实现难溶电解质的分离、提纯和制 备。
溶度积常数(Ksp)
表达难溶电解质在溶液中离子浓度平衡关系的常数,可用于判断沉 淀的生成和溶解条件。
难溶电解质溶解度和溶度积常数计算
化学键类型及形成条件
