根据化学方程式的简单计算
初中利用化学方程式的简单计算(共31张PPT)

56
2
65
2
m
x
m
y
7、加热15.8g高锰酸钾,当产生1.6g氧气时,固体剩余物的成分是( )
A
A.K2MnO4和MnO2
B.KMnO4、K2MnO4和MnO2
C.KMnO4和MnO2
D.KMnO4和K2MnO4
思路:根据氧气的质量来求生成这么多氧气需要分解多少克高锰酸钾。要注意到15.8克
高锰酸钾有可能没有全部分解。所以15.8克这个数据在此不能直接用于计算。
316 ∶
197 ∶ 87 ∶ 32
65 2 14、有X、Y两种元素,12gX2与XY3反应生成24gC,若反应的化学方程式为X2 + XY3 === 3C,则X、Y两元素的相对原子质量之比为(
= )
13g 2KClO3 ==== 2KCl + 3O2↑
X
(2)气体、液体的体积,要换算成气体、液体的质量。
65
2
5g-3.7g
X
65
2
1.3g = X
X = 0.04g
答:生成氢气的质量为0.04克
4、把23克乙醇(俗称酒精)在空气中充分燃烧后,只生成27克水和44克二 氧化碳,由此推断乙醇由几种元素组成?
思路:乙醇中肯定有什么元素? 为什么有? 乙醇中的C元素、H元素的质量是多少? 怎么计算?
C:44克× H 27克×
65
1
2CX.铁+ 生Y2锈=以=后= 2总Z2质K量M 比原n来O铁的4=加质==量热=大 K2MnO﹢4 MnO2﹢ O2
该 A.物煤质燃中烧碳后、剩氢余元2煤素×渣的的1质质5量8量比小为于3煤︰的1 质量
32
6g A.CH4 B.C2H2 C.CH3OH D.C2H5OH
化学方程式简单计算

(2)第 一 次实验碳有剩余,剩余 1.5 g。 (3)第 二 次实验中氧气有剩余,剩余 5 g。
练习:若氢气、氧气混合气体共20克,点燃后 还有2克的气体剩余,则原混合气体中氢气和氧 气的质量比( ) A. 1 :4 B. 1 :9 C. 4 :1 或1 :9 D. 1 :4 或1 :9
方法一: 解:设混合物中原有金属铜质量为x
CuO + H2 ==== Cu + H2O
80 64 0.92克–x 0.76克–x 80 64 x 0.12克 0. 92克 x 0.76克 x 氧化铜的质量= 0.92克–0.12克= 0.8克 答:混合物中有氧化铜的质量为0.8克。
2H2+ O2===2H2O 4 :32
点燃
有两种情况: 一是氢气过量,氢气和氧气的质量比 (2+2):16=1 : 4 二是氧气过量,氢气和氧气的质量比 2:( 2+16)=1 : 9 答案:D
金属铜和氧化铜的混合物0.92克在不断通入氢 气的情况下加热,充分反应后,停止加热并继 续通氢气直到试管冷却,称量得到0.76克固体 物质。求反应前混合物中氧化铜的质量?
四.关于质量和体积间的换算
练习 医疗上需要180千克氧气,如果用电 解水的方法来制取,那么同时可以得到 多少千克氢气?这些氢气在标准状况下 占多大的体积?(ρH2=0.09克/升)
气体的质量=气体的体积×气体的密度
讨论:
H :1
O:16
若将1g氢气和10g氧气混合在一密闭的容器中 使之充分反应,生成水的质量为多少?
高温
利用化学方程式的简单计算最全

利用化学方程式的简单计算最全化学方程式是用化学符号和化学方程来描述化学反应的方式。
通过化学方程式,我们可以了解反应物与产物之间的物质的数量关系,从而进行计算。
下面将介绍几种常见的利用化学方程式进行简单计算的方法。
1.计算反应物与产物的物质的摩尔数关系:化学方程式中的化学式代表了物质里的原子或分子的数量。
根据方程式,可以计算反应物与产物的物质的摩尔数关系。
例如,对于反应式:2H2+O2->2H2O,可以得知每2摩尔的H2反应生成2摩尔的H2O。
2.计算反应物的摩尔数及质量:根据已知的反应物的摩尔数和化学式里的原子质量,可以计算反应物的质量。
例如,对于反应式:H2 + O2 -> H2O,已知2mol的H2,需要计算H2的质量。
根据氢气的摩尔质量(2g/mol),可以计算出质量为4g。
3.计算反应产物的摩尔数及质量:根据已知的反应物的摩尔数和化学式里的摩尔比,可以计算反应产物的摩尔数及质量。
例如,对于反应式:H2 + O2 -> H2O,已知4g的H2,需要计算产生的H2O的质量。
根据反应式的摩尔比为1:1,可以计算出摩尔数为2mol 的H2O,进而计算出质量为36g的H2O。
4.计算反应后剩余物质的摩尔数及质量:根据已知的反应物的摩尔数和化学式里的摩尔比,可以计算反应后剩余物质的摩尔数及质量。
例如,对于反应式:2H2 + O2 -> 2H2O,已知2mol的H2和2mol的O2,需要计算剩余的H2O的摩尔数和质量。
根据反应式的摩尔比为2:1,可以计算出剩余的摩尔数为1mol的H2O,进而计算出质量为18g的H2O。
5.计算反应过程中的气体的体积:对于气体反应,可以利用化学方程式计算反应过程中的气体的体积。
根据烧瓶法则(Avogadro's law),相同条件下,气体的体积与物质的摩尔数成正比。
例如,对于反应式:2H2 + O2 -> 2H2O,已知2mol的H2和1mol的O2,根据化学反应的摩尔比,可以计算出反应产生2mol的H2O。
利用化学方程式的简单计算最全

[知识要点梳理]助知识点一:化学方程式的计算步骤函实例:工业上,高温煅烧石灰石(主要成分是CaCO3)可制得生石灰(CaO)和二氧化碳。
如果要制取1t氧化钙,需要碳酸钙多少吨?解:①根据题意设未知量设需要碳酸钙的质量为x。
②写出反应的化学方程式并配平CaCO3里建CaO + CO2 T③写出相关物质的相对分子质量100 56和已知量、未知量x 1t100 56④列出比例式,求解二北100 x Itx= 、=1.8t答:需要碳酸钙1.8t。
⑤简明地写出答案【要点诠释】(1)化学方程式书写要正确,否则会一错全错;(2)化学方程式中体现的是各纯净物质间的质量关系,故只有纯净物的质量才能代入计算;(3)质量单位要统一,在解题过程中,已知量后一定要带单位,未知量求出后也要带单位;(4)解题要严格按照格式书写。
知识点二:利用化学方程式计算的规范格式及注意事项二知识点一实例的规范解题格式如下:解:设需要碳酸钙的质量为x。
-------------------- 注意:未知数不能带单位CaCO3金娶CaO + CO2 T -------------------------------------------------------------------- 化学方程式一定要配平100 5611t -------------------------------------------- 已知量不要忘记带单位100 56 x 二It100-ltx=56=1.8t ------------------------------------- 计算结果要有单位答:需要碳酸钙1.8t。
【要点诠释】利用一种反应物或生成物的质量,计算出另一种反应物或生成物的质量的计算格式是本课题的重点:一解二设最后答,化学方程(式)不能差;准确寻找质量比,纯量代入不掺假;所有单位要一致,列式计算解决它。
知识点三:几种常见的计算类型混1.常规题:已知反应物(或生成物)的质量,利用化学方程式求生成物(或反应物)的质量。
根据化学方程式的简单计算教案

根据化学方程式的简单计算教案一、教学目标:1. 知识与技能:(1)理解化学方程式的基本概念;(2)掌握化学方程式中的物质守恒定律;(3)学会运用化学方程式进行简单计算。
2. 过程与方法:(1)通过实例分析,让学生掌握化学方程式的计算步骤;(2)培养学生运用化学方程式解决实际问题的能力。
3. 情感态度与价值观:(1)培养学生对化学学科的兴趣;(2)培养学生严谨的科学态度。
二、教学重点与难点:1. 教学重点:(1)化学方程式的基本概念;(2)物质守恒定律的应用;(3)化学方程式的简单计算方法。
2. 教学难点:(1)化学方程式计算中的比例运算;(2)实际问题中化学方程式的应用。
三、教学准备:1. 教师准备:(1)熟悉化学方程式的基本概念和计算方法;(2)准备相关实例和练习题。
2. 学生准备:(1)掌握基本的数学运算;(2)了解化学方程式的基本概念。
四、教学过程:1. 导入新课:(1)通过生活实例引入化学方程式的概念;(2)讲解化学方程式表示的意义。
2. 知识讲解:(1)讲解化学方程式中的物质守恒定律;(2)介绍化学方程式的简单计算方法。
3. 实例分析:(1)分析实例中的化学方程式;(2)引导学生运用物质守恒定律进行计算。
4. 练习巩固:(1)让学生独立完成练习题;(2)讲解练习题中的关键步骤。
5. 课堂小结:(1)总结本节课的主要内容;(2)强调化学方程式计算中的注意事项。
五、课后作业:1. 完成课后练习题;2. 运用所学知识解决实际问题。
六、教学策略与方法:1. 采用问题驱动法,引导学生主动探究化学方程式的计算方法;2. 通过实例分析,让学生深刻理解物质守恒定律在化学计算中的应用;3. 运用小组合作学习,培养学生团队合作精神,提高解决问题的能力。
七、教学评价:1. 课堂表现评价:观察学生在课堂上的参与程度、提问回答等情况,了解学生的学习状态;2. 练习题评价:通过学生完成的练习题,评估学生对化学方程式计算方法的掌握程度;3. 课后作业评价:检查学生完成的课后作业,了解学生对课堂所学知识的应用能力。
5.2根据化学方程式进行简单计算-2024-2025学年九年级化学人教版上册

根据化学方程式进行简单计算1.小明同学用一定浓度的过氧化氢溶液制取氧气,向2g二氧化锰固体中加入100g溶质的质量分数为3.4%的过氧化氢溶液,充分反应至不再产生气泡。
请计算:(1)反应后二氧化锰的质量为_______g。
(2)理论上产生氧气的质量。
2.双氧水因生成物没有污染而被称之为绿色消毒剂,可用于家庭消毒,以预防“新型冠状病毒肺炎”。
小美同学为了测定一瓶医用双氧水溶液的溶质质量分数。
有关实验操作和数据如图所示:(1)生成的氧气为______克。
(2)该双氧水溶液的溶质质量分数为多少?3.钛(Ti)是广泛应用于航空、航海等领域的一种重要金属。
在一定条件下,钛由四氯化钛(TiCl4)和金属镁反应而制得。
现有380 kg四氯化钛,可生产金属钛多少千克?4. 某校兴趣小组在实验室做制取氧气的实验,他们取氯酸钾和二氧化锰的混合物6.0 g 放入大试管中进行加热,并在不同时刻测定试管内剩余固体的质量如下表: (已知:用氯酸钾和二氧化锰制取氧气的化学方程式为2KClO 3 =====KCl+3O 2↑)反应时间/min 1.0 1.5 2.0 2.5 3.0 3.5 剩余固体质量/g5.14.54.24.084.084.08(1)生成氧气的质量为_________g 。
(2)原混合物中二氧化锰的质量是多少?(写出计算过程)5. 称取12.5g 石灰石(主要成分是CaCO 3,杂质不参加反应)放入烧杯中,向其中加入50g 稀盐酸,二者恰好完全反应。
反应结束后称量烧杯中剩余物质的总质量为58.1g(不包括烧杯的质量,且气体的溶解忽略不计)。
试计算石灰石中杂质的质量分数。
6. 用赤铁矿石(主要成分为Fe 2O 3)炼铁的反应原理为Fe 2O 3 + 3CO====2Fe+3CO 2。
用含60%的赤铁矿石800t ,理论上可炼出纯铁多少吨?MnO 2△高温7. 实验室用100 g某盐酸(溶质为氯化氢)与足量的大理石(主要成分为碳酸钙)充分反应,得到8.8 g二氧化碳,计算该盐酸中溶质的质量分数。
5.3利用化学方程式的简单计算-九年级化学人教版上册

单击此处添加副标题
学习目标:
1、知道化学方程式计算的依据 2、掌握化学方程式计算的步骤(重难点)
新课引入:
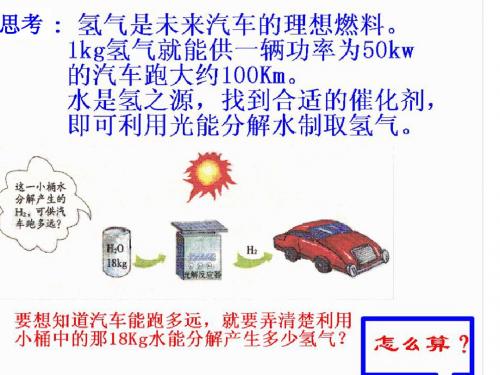
现代火箭一般采用液氢做燃料,液氧做助燃剂,科学家是如何 精确计算出火箭发射所需添加的液氢和液氧的质量的呢?这就需要 利用化学方程式来进行计算。
K2MnO4 + O2↑+ MnO2 32
(相关物质) 6.3g
x
(4)列比例式
2158 6.3g 32 x
(微观质量比 = 实际质量比)
(5)求解 (6)答
x 32 6.3g 0.6g 2 158
答:分解6.3g高锰酸钾,可得0.6g氧气。
新知学习 利用化学方程式的简单计算
需要注意的是:
72%
答:这种锌粒中锌的质量分数为72%。
注意事项 有关不纯物质的计算
代入化学方程式计算的都是纯净物的质量。
如果遇到不纯反应物或生成物,应将不 纯物质换算成纯物质的质量。
不纯物质和纯物质质量间的换算: 纯物质的质量 = 不纯物质的质量 ×纯度(质量分 数)
题型二:有关质量和体积间的换算
典例 足量的镁带在标准状况下与11.2升的氧气(密度为1.43 g/L) 充分燃烧,可以生 成多少克氧化镁?
100g x
y
答:需要3550g氯气,生成3650g氯化氢。
解法②:设需要氯气的质量为x 。
H2 + Cl2 =
2
71
2HCl
100g x
由质量守恒定律可知
氯化氢的质量为: 100g+3550g=3650g 答:需要3550g氯气,生成3650g氯化氢。
2.实验室用氯酸钾和二氧化锰的固体混合物粉末共33.2g加热制取氧 气,记录产生氧气的质量与加热时间的关系如图所示请回答下列问题:
【完整版】利用化学方程式的简单计算
(4)进行准确、熟练的数学运算(这是解题正确的保证)。
(5)要有完整的解题步骤和规范的书写格式。 (这是解题规范的必需)
2、根据化学方程式进行计算的步骤
(1)设未知数 ……………....…………设 (2)写出化学方程式 …...…… 写 (3) 写出有关物质的相对分子质量 (不忘乘以前面的化学计量数) 列 已知量和未知量 比 列比例式 (4) 求解 …...….…..………………… 解
↑
4.8克
练习三.实验室用13g锌粒与足量的稀硫酸反应制取氢气。 (已知:Zn+H2SO4===ZnSO4+H2↑) 计算:(1)生成氢气的质量为多少克?
(2)这些氢气在标准状况下的体积是多少升?
(标准状况下,氢气密度为0.0899g/L) 解: 设生成氢气的质量为X Zn+H2SO4===ZnSO4+H2↑ 2 65 13g X
第五章
化学方程式
课题三
利用化学方程式的简单计算
复习提问 以镁在空气中燃烧为例说明化学方程式的涵义之一。
镁在空气中燃烧反应中反应物与生成物之间的质量比
2Mg +
O2 ======
点燃
2 Mg O
2×24 :16×2 : (24+16)×2 48 : 32 : 80 若: 48克 :( )克 : ( ) 克 若:( )克 :( )克 : 40 克
(1) [解]:设可得到氧气的质量为X。 生成氯化钾的质量为Y MnO2 2 K C l O 3 ====== 2KCl +3O2 △ 245 149 96
↑
12.25克 245 12.25克 ------- = ------X 96
Y
X
245 12.25克 ------- = ---------149 Y
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
练习(H-1 O-16P-31 Fe-56)
1、化学教师在实验室做红磷燃烧试验,测得反应前红磷的质量为6.2g,若这些红磷在氧气中完全燃烧,则能生成多少克的五氧化二磷。
2、某工厂需要100Kg的氧气做燃料,若用电解水的方法制取氧气,所消耗的水的质量是多少?同时可以得到氢气的质量是多少?
二、教学目标
知识与技能:1、在理解化学方程式的基础上,使学生掌握有关反应的反应物、生成物的质量的计算
2、能够从定量的角度理解化学反应,了解根据化学方程式的计算在生活和科学实验的意义,学会科学的利用能源。
过程与方法:通过学案,学生自学教材,了解和掌握如何应用化学式进行简单的计算。
情感、态度与价值观:通过自学,学生培养自学能力。在小组讨论的过程中,激励学生勇于表达自己想法,积极解决问题,培养合作意识。
2*158 32
X16g
316 32 316*16g
x16g32
答:制备16g氧气至少需要高锰酸钾158g
七、学案或课堂练习设计
第三节依据化学方程式的简单计算第一课时:
课前检测
一、完成下列物质的化学方程式:
1、细铁丝在氧气中的燃烧:2、高锰酸钾受热分解:
【复习引入】:
1、下列表格已知了电解水反应过程中反应物和生成物的部分质量,思考并回答下列问题
三、教学重、难点及其突破策略
教学重点是由一种反应物(或生成物)的质量计算生成物(或反应物)的质量。教学难点是根据化学方程式进行计算的方法和格式。突破的策略一是在教学设计上层层递进、逐渐深入,先利用已有的知识引出新的知识;二是充分发挥学生在课堂学习活动中的主体性作用,通过教师与学生之间的对话与交流、学生与学生之间的合作学习,激发学生学习的兴趣和对问题解决的追求,最终达到促进全体学生思维发展的教学目标;三是通过集体练习,帮助学生巩固知识。
教学设计:依据化学方程式的简单计算
一、教学分析
1.教材及课标分析
本套教材作为初中学生化学学习的启蒙阶段教材,其教学理念是让学生能够读懂,而且感到有趣。学生不仅从中能够学到许多重要的基础知识,还要逐渐懂得什么是科学。科学不仅有趣而且有用,通过以化学实验为主的多种探究活动,使学生体验科学研究的过程,激发学习化学的兴趣,强化科学探究意识,促进学习方式的转变,在实践中培养学生的创新精神和实践能力。因此,在化学基本概念的学习中,如何通过自学讨论培养学生的学习能力和合作意识,是我们教学设计的主要指导思想。本课通过自学讨论并且逐级设计问题,向同学们展示了本节课所需要掌握的解题方法与步骤,并且在疑难问题的讨论部分,培养学生的合作意识。
指导学生完成课堂练习
完成练习并写出答案
四、小结
总结化学方程式计算的一般过程
总结计算过程
五、当堂检测
(学案)
本节课还有没有疑问?
如果没有,完成检测内容
检测
提出疑问
完成检测题
五、板书设计
第七章第三节依据化学方程式的简单计算
一、例题
解:设制备16g氧气至少需要高锰酸钾的质量为x
2KMnO4→K2MnO4+ MnO2+ O2↑
引导:
注意化学方程式的书写。计算相对分子质量,
听讲,完成练习题。
导学达标
一、根据所给的已知条件,能够在化学反应方程式中相应位置填上已知量。
二、列出比例式,并且求解。
指导学生回忆所学的知识,并按照书中所给的例题格式填上题目中所给的已知量。
指导学生根据例题的格式,列出比例式,并且解出方程,明确的写出答案。
四、教学设计思路与教学结构图
流程设计如下:
五、教学过程
教学过程
教学内容
教师活动
学生活动
复习检测
1,书写几个重要的化学反应方程式。
观察学生回答情况,并对学生出现的问题及时更正。在学生回答完毕之后展示答案
(书写化学方程式的几点注意事项)
回答学案上问题
看幻灯片更正答案
导入新课
给出电解水的化学方程式,并写出各物质的相对分子质量,然后计算出相对分子质量比。
2.学生分析
我校三年制初三学生是在自学自研基础上开展理科课堂学习活动的,通过自学讨论,在知识层面上他们已经化学反应方程式的有关知识,但对于利用化学反应方程式进行简单计算还不清楚,因此我们的教学设计主要围绕通过已有知识帮助学生建立解题的方法和步骤,并进一步培养他们的自学能力和合作意识。因此,本节课设计中通过教师设计问题、学生分组学习讨论活动,建构一种交互式研究性课堂学习氛围,以促进学生提高阅读能力和思考能力。学生学习本课的困难或可能出现的问题是:一方面,化学反应方程式书写出现问题;另一方面,利用化学反应进行解题的能力也需要进一步提高。因此,学生可能在知识点上是了解的,在能力面上还是不能理解到位。
阅读教材,按照书中所给的例题格式填上题目中所给的已知量。
根据书中的格式,写出比例式,然后解方程。掌握较好的同学可以提前完成练习题。
三、根据例题完成学案
指导学生自学教材107页例一,完成学案中9道问题。
自学教材,完成学案的9道问题,在这个过程中,充分理解和掌握例题中的思路和步骤。
当堂练习:
红磷燃烧、过氧化氢反应方程式的相关计算。
检测:
1、实验室用过氧化氢在二氧化锰做催化剂的条件下制取氧气,若完全分解6.8g过氧化氢,求:
(1)生成氧气多少克?※(2)标准状况下氧气的体积合多少升?(提示:氧气的密度1.43g/L)
3、如何依据化学方程式,利用已知物质质量求出其它物质质量?
【新知阅读】:阅读教材107页〖例7-1〗(注意解题格式和步骤)并完成下列题纲
1.阅读教材回答:参加化学反应的物质是纯净物还是混合物?
2.为何能够根据化学反应方程式进行简单计算?反应物与生成物有什么样的关系?
3.参照教材中的例题,你认为,在进行计算的过程中,哪些是需要重点注意的?
2H2O 2H2+ O2
相对分子质量:_____ ______ _____
该反应方程式表示量的含义是:
_____份的水在通电的条件下恰好完全反应,生成_____份的氢气,和_____份的氧气。
电解水的质量(H2O)
生成氢气的质量(H2)
生成氧气的质量(O2)
364Βιβλιοθήκη 3218g?
?
58g
?
?
2、通过上述数据,你能得出那些结论?(反应物的质量与生成物的质量成什么比例关系)
