2018年浙江高考一轮 专题6 第2单元 原电池的工作原理及应用 (1)
高考化学大一轮复习 第二单元 原电池和化学电源习题详解课件

3.提示:(1)两电极要和电解质溶液中的金属阳离子尽可能保 持相同,以提高效率;(2)两电极的金属活泼性相差尽量大 一些,现象明显,速率较快。 [高考载体·巧妙利用] (1)负 正 (2)CH4+10OH--8e-===CO23-+7H2O 2O2+4H2O+8e-===8OH- (3)OH-向负极移动 K-向正极移动 (4)4NA (5)负极:CH4+2H2O-8e-===CO2+8H+ 正极:2O2+8H++8e-===4H2O (6)H2
2.提示:粗锌快,因为粗锌中含有杂质金属,可以和锌形成原 电池,反应速率较快。
3.(1)Cu AgNO3 (2)正 Ag++e-===Ag Cu-2e-===Cu2+ (3)Cu Ag
4.解析:(1)Fe3+具有强氧化性,可以把一些金属单质如铁、铜 等氧化成相应的离子,离子方程式是: 2Fe3++Cu===2Fe2++Cu2+。 (2)由反应 2Fe3++Cu===2Fe2++Cu2+可以判断出铜发生氧化 反应,铜作负极,Fe3+发生还原反应,正极可以选用石墨棒, 电解质溶液可以选用氯化铁溶液,仿照教材上的铜锌原电池 装置,可以画出此原电池的装置图。
+
3e
-
+
4H2O===Fe(OH)3+5OH-;书写总反应的离子方程式时,关键是抓
住 Fe 和 Zn 的存在形式分别是 Fe(OH)3 和 Zn(OH)2。
(3)由普通锌锰电池放电时的总反应可知,Zn 作负极,NH4Cl 为电解 质,正极上发生还原反应:MnO2+NH+4 +e-===MnOOH+NH3。 (4)负极实际上是稀土储氢合金吸附的 H2 失去电子生成 H+,H+再与 OH-结合生成 H2O,所以负极的电极反应式为 MH-e-+OH-===M +H2O 答案:(1)CH3OCH3+3H2O-12e-===2CO2+12H+ (2)2Fe(OH)3+3ClO-+4OH-===2FeO42-+5H2O+3Cl- FeO24-+3e-+4H2O===Fe(OH)3+5OH- 2FeO24-+8H2O+3Zn===2Fe(OH)3+3Zn(OH)2+4OH- (3)Zn NH4Cl MnO2+NH+4 +e-===MnOOH+NH3 (4)MH-e-+OH-===M+H2O
2018-2019届高考化学一轮总复习课件:第6章 化学反应与能量 第2讲

Ⅱ能避免能量损耗;装置Ⅱ中盐桥的作用是提供离子迁移通路,导电。
思考辨析
判断正误,正确的划“√”,错误的划“×”
(1)在原电池中,发生氧化反应的一极一定是负极( √ ) (2)在原电池中,负极材料的活泼性一定比正极材料强( × )
(3)在原电池中,正极本身一定不参与电极反应,负极本身一定要发
生氧化反应( × ) (4)带有“盐桥”的原电池比不带“盐桥”的原电池电流持续时间长
-,负极发生失电子的氧化反应:Ag-e-+Cl-===AgCl,阳离子交
换膜右侧无白色沉淀生成;若用NaCl溶液代替盐酸,电池总反应不会 改变;当电路中转移0.01 mol电子时,负极消耗0.01 mol Cl-,右侧正 极生成0.01 mol Cl-,左侧溶液中应有0.01 mol H+移向右侧,约减少 0.02 mol离子。 答案 D
解析 原电池反应为 Zn+CuSO4===ZnSO4+Cu。Cu 电极作正极, Cu2+在正极得电子,发生还原反应, A 项错误;由于两半池中的阴离子
- - SO2 故 c(SO2 B 项错误; 甲池中由于生成 Zn2 4 不能透过半透膜, 4 )都不变, +
,而乙池中 Cu2++2e-===Cu,则乙池中的 CuSO4 部分变为 ZnSO4,导 答案 C
( √ )
题组训练
1.(2015·福建理综)某模拟“人工树叶”电化学实验装置如图所示,
该装置能将 H 2 O 和 CO 2 转化为 O 2 和燃料 (C 3 H 8 O) 。下列说法正确的是
( ) A.该装置将化学能转化为光能和电能
B.该装置工作时,H+从b极区向a极区
迁移 C.每生成1 mol O2,有44 g CO2被还原
D.a电极的反应为:3CO2+18H+-18e
高考化学一轮复习第6章化学反应与能量第2节原电池化学电源学案20180414264.doc
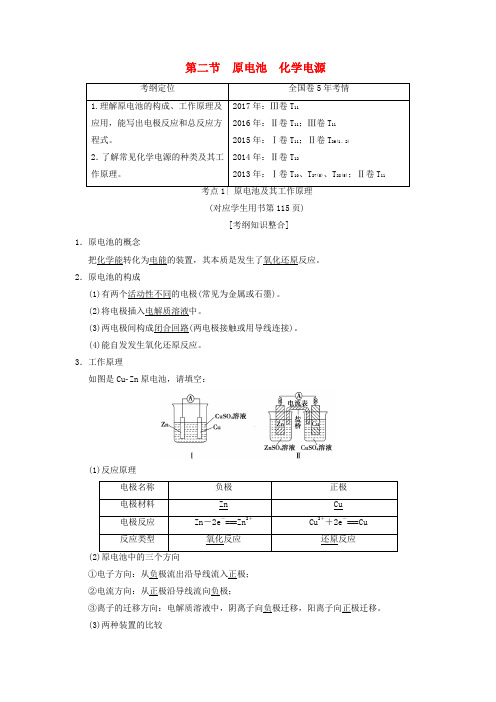
第二节 原电池 化学电源(对应学生用书第115页)[考纲知识整合]1.原电池的概念把化学能转化为电能的装置,其本质是发生了氧化还原反应。
2.原电池的构成(1)有两个活动性不同的电极(常见为金属或石墨)。
(2)将电极插入电解质溶液中。
(3)两电极间构成闭合回路(两电极接触或用导线连接)。
(4)能自发发生氧化还原反应。
3.工作原理如图是CuZn 原电池,请填空:(1)反应原理①电子方向:从负极流出沿导线流入正极;②电流方向:从正极沿导线流向负极;③离子的迁移方向:电解质溶液中,阴离子向负极迁移,阳离子向正极迁移。
(3)两种装置的比较图Ⅰ中Zn在CuSO4溶液中直接接触Cu2+,会有一部分Zn与Cu2+直接反应,该装置中既有化学能和电能的转化,又有一部分化学能转化成了热能,装置的温度会升高。
图Ⅱ中Zn和CuSO4溶液分别在两个池中,Zn与Cu2+不直接接触,不存在Zn与Cu2+直接反应的过程,所以仅是化学能转化成了电能,电流稳定,且持续时间长。
(4)盐桥作用①连接内电路,形成闭合回路;②平衡电荷,使原电池不断产生电流。
4.原电池原理的三个应用(1)设计制作化学电源①首先将氧化还原反应分成两个半反应。
②根据原电池的反应特点,结合两个半反应找出正、负极材料和电解质溶液。
(2)比较金属活动性强弱两种金属分别作原电池的两极时,一般作负极的金属比作正极的金属活泼。
(3)加快氧化还原反应的速率一个自发进行的氧化还原反应,设计成原电池时反应速率加快。
例如,在Zn与稀H2SO4反应时加入少量CuSO4溶液能使产生H2的反应速率加快。
[应用体验]正误判断(正确的打“√”,错误的打“×”)。
(1)在化学反应中,所有自发的放热反应均可以设计成原电池。
( )(2)原电池中,负极发生氧化反应,正极发生还原反应。
( )(3)MgAl形成的原电池,Mg一定作负极。
( )(4)Cu、Al、浓HNO3构成的原电池的负极反应为Al-3e-===Al3+。
2018高三化学一轮复习专题6第2单元原电池化学电源课时分层训练

原电池化学电源1.(2017·泉州模拟)课堂学习中,同学们利用铝条、锌片、铜片、导线、电流计、橙汁、烧杯等用品探究原电池的组成。
下列结论错误的是( )A.原电池是将化学能转化成电能的装置B.原电池由电极、电解质溶液和导线等组成C.图中a极为铝条、b极为锌片时,导线中会产生电流D.图中a极为锌片、b极为铜片时,电子由铜片通过导线流向锌片2.根据下图判断,下列说法正确的是( )A.装置Ⅰ和装置Ⅱ中负极反应均是Fe-2e-===Fe2+B.装置Ⅰ和装置Ⅱ中正极反应均是O2+2H2O+4e-===4OH-C.装置Ⅰ和装置Ⅱ中盐桥中的阳离子均向右侧烧杯移动D.放电过程中,装置Ⅰ左侧烧杯和装置Ⅱ右侧烧杯中溶液的pH均增大3.(2013·全国卷Ⅱ)“ZEBRA”蓄电池的结构如图所示,电极材料多孔Ni/NiCl2和金属钠之间由钠离子导体制作的陶瓷管相隔。
下列关于该电池的叙述错误..的是( )A.电池反应中有NaCl生成B.电池的总反应是金属钠还原三价铝离子C.正极反应为:NiCl2+2e-===Ni+2Cl-D.钠离子通过钠离子导体在两电极间移动4.①②③④四种金属片两两相连浸入稀硫酸中都可组成原电池。
①②相连时,外电路电流从②流向①;①③相连时,③为正极;②④相连时,②上有气泡逸出;③④相连时,③的质量减少。
据此判断这四种金属活动性由强到弱的顺序是( ) A.①③②④B.①③④②C.③④②①D.③①②④5.LiFeS2电池是目前电池中综合性能最好的一种电池,其结构如图所示。
已知电池放电时的反应为4Li+FeS2===Fe+2Li2S。
下列说法正确的是( )A.Li为电池的正极B.电池工作时,Li+向负极移动C.正极的电极反应式为FeS2+4e-===Fe+2S2-D.将熔融的LiCF3SO3改为LiCl的水溶液,电池性能更好6.(2017·安阳模拟)甲醇(CH3OH)是一种有毒物质,检测甲醇含量的测试仪工作原理如图所示。
2018届高考化学大一轮复习课件:第六章化学反应与能量第二讲

栏目 导引
第六章
化学反应与能量
2.(教材改编题)下列装置不能形成原电池的是( C )
栏目 导引
第六章
化学反应与能量
解析: A、 B、 D 项都具有①活泼性不同的电极; ②电解质溶液; ③闭合回路;④自发进行的氧化还原反应,均能构成原电池;C 项中酒精为非电解质,不能构成原电池。
栏目 导引
第六章
第六章
化学反应与能量
第二讲
原电池
新型化学电源
第六章
化学反应与能量
1.理解原电池的构成、工作原理及应 用,能书写电极反应和总反应方程式。 2.了解常见化学电源的种类及其工作 原理。
2016,卷甲 11T; 2016,卷丙 11T; 2015,卷Ⅰ 11T; 2015,卷Ⅱ 26T(1)(2); 2014,卷Ⅱ 12T
栏目 导引
第六章
化学反应与能量
[自我检测] 1.判断正误(正确的打“√”,错误的打“×”) (1)在原电池中,发生氧化反应的一极是负极。( √ ) (2)在原电池中,负极材料的活泼性一定比正极材料强。( × ) (3)在原电池中,正极本身一定不参与电极反应,负极本身一定 要发生氧化反应。( × )
栏目 导引
第六章
化学反应与能量
(2016· 高考全国卷甲,11,6 分)MgAgCl 电池是一种以 海水为电解质溶液的水激活电池。下列叙述错误的是( B ) A.负极反应式为 Mg-2e-===Mg2+ B.正极反应式为 Ag +e ===Ag C.电池放电时 Cl-由正极向负极迁移 D.负极会发生副反应 Mg+2H2O===Mg(OH)2+H2↑
栏目 导引
第六章
化学反应与能量
四、盐桥原电池的组成和作用 1.盐桥原电池中半电池的构成条件:电极金属和其对应的盐溶 液。一般不要任意替换成其他阳离子盐溶液,否则可能影响效 果。盐桥中装有饱和的 KCl、KNO3 等溶液和琼胶制成的胶冻。 2.盐桥的作用 (1)连接内电路,形成闭合回路; (2)平衡电荷,使原电池不断产生电流。
[2018-2019学年浙江高考化学一轮复习专题6 化学能与电能的转化习题 答案

1.下图是探究氢氧燃料电池工作原理的装置示意图,实验时,先闭合S1,断开S2,电解水一段时间后,再断开S1,闭合S2,二极管能持续发光。
在断开S1闭合S2时,下列有关说法正确的是()A.左侧多孔碳棒电极吸附的氢气失去电子,发生还原反应B.右侧多孔碳棒电极作正极,电极反应式为O2+2H2O+4e-===4OH-C.能量转变形式:电能→化学能→光能D.Na+向左侧多孔碳棒迁移,电子由负极经外电路流向正极答案B解析闭合S1,断开S2,左侧多孔碳棒附近的H+得电子产生氢气,故断开S1,闭合S2,左侧多孔碳棒电极吸附的氢气失去电子,发生氧化反应,A错误;右侧多孔碳棒电极作正极,O2得电子,在中性条件下结合水生成OH-,B正确;断开S1,闭合S2时,化学能转化为电能,C错误;断开S1,闭合S2时,属于原电池,阳离子移向正极,D错误。
2.我国科学家成功研制出一种全新的铝-石墨双离子电池(AGDIB)。
这种新型AGDIB电池采用廉价且易得的石墨作为电池正极材料,铝锂(AlLi)合金作为负极材料,LiPF6是电解质,LiPF6+x C+Al。
下列关于该电池的说碳酸酯为溶剂,反应原理是AlLi +C x PF6放电充电法不正确的是()A.该电池不能用水溶液作为电解质B.放电时,Li+在电解质中由负极向正极迁移C.充电时,若转移1 mol e-,阴极电极将增重7 gD.放电时,正极的电极反应式为AlLi-e-===Li++Al答案D解析Li是活泼的金属,能与水反应,因此该电池不能用水溶液作为电解质,A 正确;放电时属于原电池,Li+在电解质中由负极向正极迁移,B正确;充电时属于电解池工作原理,电解池的阴极发生得电子的还原反应,即Al+Li++e-===AlLi,所以若转移1 mol e-,阴极电极将增重7 g,C正确;放电时属于原电池的工作原理,正极C x PF6得电子被还原,电极反应式为C x PF6+e-===x C+PF-6,D错误。
2018版高考化学浙江选考总复习(配套训练)专题6课时2原电池化学电源Word版含解析
课后限时训练(时间:45分钟)必考强化1.(2016·浙江省绍兴一中高一下期末)下列设备工作时,将化学能转化为电能的是()解析A项,硅太阳能电池是将太阳能转化为电能的装置,A 不合题意;B项,锂离子电池是将化学能转化为电能的装置,B合题意;C项,太阳能热水器是将太阳能转化为热能的装置,C不合题意;D项,燃气灶是将化学能转化为热能的装置,D不符合题意。
答案 B2.(2016·浙江金华、温州、台州部分学校高一下3月联考)对原电池的电极名称,下列叙述中错误的是()A.电子流入的一极为正极B.较不活泼的一极一般为正极C.电子流出的一极为负极D.发生氧化反应的一极为正极解析A项,电子流入的一极为正极,A正确;B项,较不活泼的一极一般为正极,B正确;C项,电子流出的一极为负极,C正确;D项,发生氧化反应的一极为负极,D错误。
答案 D3.(2016·浙江省台州中学高二上期中)若将反应:Zn+H2SO4===ZnSO4+H2↑设计成原电池(如图),则下列说法不正确的是()A.该装置实现了化学能转化为电能B.b 极表面发生了还原反应C.c 溶液可以是ZnSO4溶液D.盐桥中的Cl-移向右边烧杯解析A项,形成原电池,是化学能变成电能,正确,不选A;B项,根据电子移动方向确定,说明a为负极,b为正极,发生还原反应,正确,不选B;C 项,锌做原电池的负极,所以c为硫酸锌,正确,不选C;D项,盐桥中氯离子向负极移动,即向左侧烧杯移动,错误,选D。
答案 D4.(2015·浙江省桐乡一中联盟学校高一下期末)某学生用锌片、铜片、发光二极管、滤纸、导线等在玻璃片制成如图所示的原电池,当滤纸用醋酸溶液润湿时,二极管发光。
下列有关该电池的说法正确的是()A.铜片上的电极反应:Cu2++2e-===CuB.外电路中电子由铜片经导线流向锌片C.电池工作时电能直接转化为化学能D.该电池工作时,若有13克锌被溶解,则铜片上产生标况下4.48 L H2解析A项,在该装置图中,Zn、Cu及电解质溶液构成原电池。
人教版高考化学一轮总复习精品课件 专题六 化学反应与能量变化 第18讲原电池及其应用
电解质溶液
闭合回路
(4)能自发发生氧化还原反应。
3.原电池的工作原理
甲
乙
(2)工作原理
氧化反应
还原反应
正
负
4.原电池原理的应用
续表
关键能力·提升
考向1 原电池原理及正负极的判断
典例1 如图中四种电池装置是依据原电池原理设计的,下列有关叙述错误的是( )
C
甲
乙
丙
丁
【方法点拨】 判断原电池正负极的五种方法 _
01
考点1 原电池工作原理
必备知识·梳理
1.原电池概念 把________转化为______的装置,其本质是发生了______________。
化学能
电能
氧化还原反应
2.原电池的构成条件
(1)有两个____________的电极(常见为金属或石墨)。 (2)将电极插入____________或熔融电解质中。 (3)两电极间构成__________(两电极接触或用导线连接)。
[对点训练2] 质子交换膜燃料电池的工作原理如 图所示,下列叙述正确的是( )
D
[对点训练3] (2023·宿迁模拟)研究发现,在酸性乙醇燃料电池中加入硝酸,可使电 池持续大电流放电,其工作原理如下图所示。下列说法不正确的是( )
D
03
考点3 常见的化学电源
必备知识·梳理
牺牲阳极的阴极保护法
外加电流的阴极保护法
依据
原电池原理
电解池原理
原理
形成原电池时,被保护金属作正极 (阴极),不反应受到保护;活泼金 属作负极(阳极),发生反应受到腐 蚀。阳极要定期予以更换
将被保护金属与另一附加电极作 为电解池的两极,使被保护金属 作阴极,在外加直流电的作用下 使阴极得到保护
专题33 原电池的工作原理及应用-高考全攻略之备战2018年高考化学考点一遍过
一、原电池 1.原电池的基本概念 (1)原电池:把化学能转化为电能的装置。 (2)原电池的电极 负极:电子流出——活动性较强——发生氧化反应; 正极:电子流入——活动性较弱——发生还原反应。 (3)原电池的构成条件 ①能自发发生氧化还原反应。 ②具有活动性不同的两个电极(金属和金属或金属和非金属)。 ③形成闭合回路或在溶液中相互接触。 2.原电池的工作原理 (以Zn−Cu原电池为例] 单液原电池 双液原电池
装置图 电极与电极反应 负极(锌片) Zn−2e−Zn2+ (氧化反应) 正极(铜片) Cu2++2e−Cu (还原反应)
电子流向 由锌片沿导线流向铜片 离子迁移方向 阴离子向负极迁移;阳离子向正极迁移 电池反应方程式 Zn+Cu2+Cu+Zn2+ 两类装置 还原剂Zn与氧化剂Cu2+直接接Zn与氧化剂Cu2+不直接接触,仅有化 的不同点 触,既有化学能转化为电能,又有化学能转化为热能,造成能量损耗 学能转化为电能,避免了能量损耗,故电流稳定,持续时间长
(1)一般条件下,较活泼的金属材料作负极,失去电子,电子经外电路流向正极,再通过溶液中的离子形成的内电路构成环路。 ①在原电池中,电极可能与电解质反应,也可能与电解质不反应;不发生反应的可看作金属发生吸氧腐蚀,如图所示。
②闭合回路的形成也有多种方式,可以是导线连接两个电极,也可以是两电极接触,如图所示。 (2)在原电池中,电流流动方向与电子流动方向相反。 (3)原电池的判定:一看有无外接电源,若有外接电源则为电解池,若无外接电源则可能为原电池;二看电极是否用导线相连并与电解质溶液形成闭合电路;三看电极与电解质溶液是否能发生自发的氧化还原反应。 3.原电池电极反应式的书写 (1)准确判断原电池的正负极是书写电极反应的关键。 如果原电池的正负极判断失误,电极反应式的书写一定错误。判断正负极的方法不是绝对的,例如铜片和铝片同时插入浓硝酸溶液中,由于铝片表明的钝化,这时铜失去电子,是负极,其电极反应为: 负极:Cu−2e−Cu2+
2021版浙江高考选考化学一轮复习课件:专题6 2 第二单元 原电池 化学电源
上一页
返回导航
下一页
专题6 化学反应与能量变化
16
5.(2016·浙江 4 月选考,T17)Mg-H2O2 电池是一种化学电源,以 Mg 和石墨为电极,
海水为电解质溶液,示意图如图。下列说法不正确的是
()
A.石墨电极是该电池的正极 B.石墨电极上发生还原反应 C.Mg 电极的电极反应式:Mg-2e-===Mg2+ D.电池工作时,电子从 Mg 电极经导线流向石墨电极,再从石墨电极经电解质溶液流 向 Mg 电极 解析:选 D。电子不能流经内电路(电解质溶液),故 D 不正确。
上一页
返回导航
下一页
专题6 化学反应与能量变化
27
(2)铅蓄电池
铅蓄电池是一种二次电池,用途极广,电动自行车、汽车、发电站等都用到它。铅蓄
电池的性能优良,价格便宜,可多次充、放电。
放电时,铅电极上发生氧化反应,二氧化铅电极上发生还原反应,其电极反应式为
负极:___P__b_-__2_e_-_+__S_O__24-_=__=_=_P_b_S_O__4__, 正极:P__b_O_2_+__2_e_-_+__S_O__24_-_+__4_H__+_=_=_=_P_b_S__O_4_+__2_H__2O_____, 总的电池反应:P__b_+__P_b_O__2_+__2_H_2_S_O__4_=_=_=_2_P_b_S__O_4_+__2_H__2O_。
A.P>M>N>E
B.E>N>M>P
()
C.P>N>M>E
D.E>P>M>N
上一页
返回导航
下一页
专题6 化学反应与能量变化
20
解析:选 A。由①知,金属活动性:M>N;M、P 用导线连接放入 NaHSO4 溶液中, M 表面有大量气泡逸出,说明 M 作原电池的正极,故金属活动性:P>M;N、E 构成 的原电池中,N 作负极,故金属活动性:N>E。
