碳酸氢钠热分解反应的研究
碳酸氢钠受热分解,生成碳酸钠、水和二氧化碳的反应方程式

碳酸氢钠受热分解,生成碳酸钠、水和二氧化碳的反应方程式
碳酸氢钠受热分解是一个广泛应用的化学反应,它的反应方程式为:
2NaHCO₃→Na₂CO₃+CO₂+H₂O
碳酸氢钠受热分解是一种物理反应,其中没有原子键合重新组合,只有物种振动变化。
这种反应的特点是受热的反应物在高温下会分解。
当碳酸氢钠受热分解时,原子在较高的温度下会发生变化,形成新的物质,产生了碳酸钠、水和二氧化碳。
其中,碳酸钠是释放出来的,而水和二氧化碳则以气体的形式释放出来。
碳酸氢钠受热分解是一种非常重要的化学反应,它在工业中有着广泛的应用。
例如,它可以用来制备碳酸钠,这是一种常用的化工原料,广泛用于食品、纺织和水处理等行业;除此之外,还可以用来制备气体,如氢气、
氧气等,在航天科学和汽车工业中具有重要的作用。
碳酸氢钠受热分解会释放出大量的热量,因此也得以广泛应用于可再生能源领域。
例如,它可以用来制备燃料电池电源,这是一种低排放、无污染的可再生能源。
总之,碳酸氢钠受热分解的反应方程式:
2NaHCO₃→Na₂CO₃+CO₂+H₂O,其中产生的碳酸钠、水和二氧化碳,都有重要的市场价值,它在工业、农业、医药、航天科学和可再生能源领域有着重要的应用。
碳酸氢钠水溶液分解温度

碳酸氢钠水溶液分解温度碳酸氢钠(NaHCO3),也被称为小苏打,是一种常见的化学物质。
它在水中能够溶解,并且在一定条件下会发生分解反应。
本文将探讨碳酸氢钠水溶液的分解温度以及与分解过程相关的一些知识。
碳酸氢钠的化学式为NaHCO3,它由一个钠离子(Na+)、一个碳酸根离子(HCO3-)和一个氢离子(H+)组成。
在水中,碳酸氢钠分子会与水分子发生作用,形成氢氧化钠(NaOH)和二氧化碳(CO2)。
碳酸氢钠水溶液的分解温度是指当溶液中的碳酸氢钠开始分解的温度。
分解反应的条件包括温度、压力和溶液浓度等因素。
通常情况下,碳酸氢钠的分解温度约为50℃至100℃之间。
当溶液的温度超过分解温度时,碳酸氢钠会开始分解,生成氢氧化钠和二氧化碳。
碳酸氢钠的分解反应可以用以下化学方程式表示:2NaHCO3 → Na2CO3 + H2O + CO2在这个方程式中,两个碳酸氢钠分子分解成一个碳酸钠分子(Na2CO3)、一个水分子(H2O)和一个二氧化碳分子(CO2)。
碳酸氢钠水溶液的分解温度受到多种因素的影响。
首先是溶液的浓度,浓度越高,分解温度越高。
其次是溶液中的杂质或其他物质,它们可能会提高或降低分解温度。
此外,压力也会对分解温度产生影响,但在常规条件下,压力的影响较小。
碳酸氢钠水溶液的分解温度与许多实际应用密切相关。
例如,在烘焙食品时,碳酸氢钠常被用作发酵剂。
当面团中的碳酸氢钠受热分解时,产生的二氧化碳会使面团膨胀,从而使烘焙食品变得松软蓬松。
此外,碳酸氢钠也常被用于制备药品、清洁剂和火焰灭火剂等。
需要注意的是,碳酸氢钠的分解反应是可逆的,也就是说,在适当的条件下,氢氧化钠和二氧化碳可以重新反应生成碳酸氢钠。
这种可逆性使得碳酸氢钠在许多工业和实验室应用中具有广泛的用途。
总结起来,碳酸氢钠水溶液的分解温度约为50℃至100℃之间。
分解反应会生成氢氧化钠和二氧化碳。
分解温度受到溶液浓度、杂质和压力等因素的影响。
碳酸氢钠的分解反应在烘焙食品、制药、清洁剂和灭火剂等方面有着广泛的应用。
碳酸氢钠受热分解 温度

碳酸氢钠受热分解温度
碳酸氢钠受热分解是指在一定的温度下,碳酸氢钠分解成碳酸钠、水
和二氧化碳。
具体的反应式为:
2NaHCO3(s)→Na2CO3(s)+H2O(l)+CO2(g)。
碳酸氢钠受热分解的温度一般为约130℃-200℃之间。
在这个温度范
围内,碳酸氢钠逐渐失去水分并分解,释放出大量的 CO2 气体,同时产生碳酸钠和水。
随着温度的升高,反应速率会加快,但如果温度过高,会导致反应过程过度分解,产生大量碱性氧化物 Na2O,这会对
实验室设备和环境造成不小损害。
碳酸氢钠受热分解是一种重要的化学反应,被广泛应用于制备 CO2 气体和调节 pH 值等领域。
例如,在制备糖果和蛋糕时,会将碳酸氢钠
加入食材中,发生受热分解,使膨松发泡,增加口感和松软度。
此外,在实验室中,碳酸氢钠受热分解也是一种常见的产生 CO2 气体的方法,被广泛应用于各种实验和测试中。
总的来说,碳酸氢钠受热分解是一种常见的化学反应,在各种领域中
都有广泛的应用价值。
了解碳酸氢钠受热分解的温度和反应机理可以
帮助我们更好地进行实验和工艺制造,为人们的生活和科技进步提供
支持。
碳酸氢钠受热分解的反应方程式

碳酸氢钠受热分解的反应方程式
加热碳酸氢钠化学方程式:nahco3=na2co3+co2↑+h2o(加热)分析:加热碳酸氢钠,得到碳酸钠,水和二氧化碳气体。
碳酸氢钠俗称小苏打、苏打粉、重曹,是白色细小晶体,
在水中的溶解度小于碳酸钠。
性质
物理性质
白色晶体,或不透明单斜晶系细微结晶,无臭、味咸,可溶于水,不溶于乙醇。
在水
中溶解度为7.8g(18℃)、16.0g(60℃)。
化学性质
常温下性质稳定,受热易分解,在50℃以上迅速分解,在℃时完全失去二氧化碳,在干燥空气中无变化,在潮湿空气中缓慢分解。
既能与酸反应又能与碱反应。
与酸反应生成
相应的盐、水和二氧化碳,与碱反应生成相应的碳酸盐和水。
除此之外,还能与某些盐反应,与氯化铝和氯酸铝发生双水解,生成氢氧化铝、钠盐和二氧化碳。
碳酸氢钠储运特别注意:
1、碳酸氢钠属非危险品,但应防止受潮。
2、储存于潮湿通风库房内。
3、不可与酸类混储混运。
4、食用小苏打尤须特别注意严禁与有害物品混储混运,避免污染。
碳酸氢钠加热分解的反应化学方程式

碳酸氢钠加热分解的反应化学方程式碳酸氢钠(NaHCO3),又称小苏打、重碳酸钠,是一种常见的化学物质。
它是一种无色结晶性固体,易溶于水,并具有一定热稳定性。
在加热分解的过程中,碳酸氢钠会发生化学反应,生成其他化合物和释放出气体。
碳酸氢钠的化学式为NaHCO3,其分解反应可以用以下化学方程式表示:2 NaHCO3(s) → Na2CO3(s) + CO2(g) + H2O(g)该方程式表示在加热的条件下,每2个分子的碳酸氢钠会分解为1个分子的碳酸钠(Na2CO3)、1个分子的二氧化碳(CO2)和1个分子的水蒸气(H2O)。
在反应中,产生的碳酸钠可以作为固体沉淀,并可以通过过滤或离心等操作从反应混合物中分离出来。
二氧化碳气体则会以气态逸出,由于其比空气的密度大,通常形成密度较大的气体层,可以通过通入吸收剂、冷却、或进行其他后续处理来收集。
碳酸氢钠加热分解产生的二氧化碳可以通过试管观察到,通常会产生大量的气泡,并伴随着由碳酸氢钠溶液中释放出的水蒸气,使颜色的饱和度发生变化。
使用孔板或导管等装置可以将气体收集起来。
碳酸氢钠加热分解反应的速率受到温度的影响。
随着温度的升高,反应速率加快,分解反应更加迅速。
这是因为在高温下,分解反应的起始能量要求得到了满足,分子之间的碰撞频率增加,反应速率自然加快。
但需要注意的是,碳酸氢钠的加热分解反应不是一个完全的单步反应。
实际上,在碳酸氢钠的分解过程中,可能还会发生其他的副反应或附加反应。
其中,最主要的副反应是碳酸氢钠的失水反应,其化学方程式可以表示为:NaHCO3(s) → Na2O(s) + CO2(g) + H2O(g)该反应是碳酸氢钠分解反应的一个竞争反应,产物中的水分子来自于碳酸氢钠晶格结构中的结合水。
这个失水反应的速率较慢,通常发生在高温情况下或加热的时间较长时才会发生。
除了上述的两个主要反应以外,碳酸氢钠在加热分解过程中还可能发生其他次要的附加反应,但这些反应的产物和反应速率对实际观察和分析的影响相对较小。
碳酸氢钠热分解反应的研究
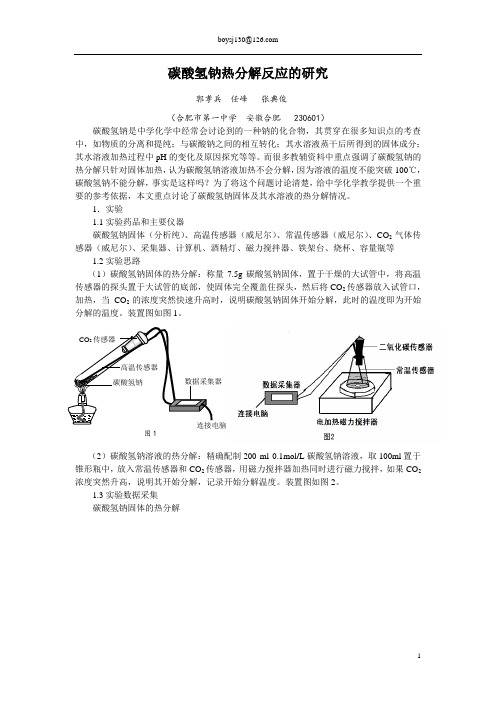
碳酸氢钠热分解反应的研究郭孝兵 任峰 张典俊(合肥市第一中学 安徽合肥 230601)碳酸氢钠是中学化学中经常会讨论到的一种钠的化合物,其贯穿在很多知识点的考查中,如物质的分离和提纯;与碳酸钠之间的相互转化;其水溶液蒸干后所得到的固体成分;其水溶液加热过程中pH 的变化及原因探究等等。
而很多教辅资料中重点强调了碳酸氢钠的热分解只针对固体加热,认为碳酸氢钠溶液加热不会分解,因为溶液的温度不能突破100℃,碳酸氢钠不能分解,事实是这样吗?为了将这个问题讨论清楚,给中学化学教学提供一个重要的参考依据,本文重点讨论了碳酸氢钠固体及其水溶液的热分解情况。
1.实验1.1实验药品和主要仪器碳酸氢钠固体(分析纯)、高温传感器(威尼尔)、常温传感器(威尼尔)、CO 2气体传感器(威尼尔)、采集器、计算机、酒精灯、磁力搅拌器、铁架台、烧杯、容量瓶等1.2实验思路(1)碳酸氢钠固体的热分解:称量7.5g 碳酸氢钠固体,置于干燥的大试管中,将高温传感器的探头置于大试管的底部,使固体完全覆盖住探头,然后将CO 2传感器放入试管口, 加热,当CO 2的浓度突然快速升高时,说明碳酸氢钠固体开始分解,此时的温度即为开始(2)碳酸氢钠溶液的热分解:精确配制200 ml 0.1mol /L 碳酸氢钠溶液,取100ml 置于锥形瓶中,放入常温传感器和CO 2传感器,用磁力搅拌器加热同时进行磁力搅拌,如果CO 2浓度突然升高,说明其开始分解,记录开始分解温度。
装置图如图2。
1.3实验数据采集碳酸氢钠固体的热分解高温传感器碳酸氢钠CO 2传感器数据采集器 连接电脑 图1图3碳酸氢钠溶液的热分解图41.4实验分析碳酸氢钠固体的热分解实验操作较为简单,干扰因素很少,图像较完整,100.2℃开始分解。
但是由于其分解温度较低,酒精灯升温速度较快,不利于观察持续变化过程,再加上可能会出现固体受热不均现象,而使测量结果出现偏差,所以,在加热过程中,先匀速移动酒精灯给试管底部加热,再集中对高温传感器探头所在位置加热。
改性碳酸氢钠形貌及热分解性能的研究

种新型耐盐高吸水复合材料ꎬ 提高了共聚物的溶胀速
率ꎮ 胡高远 [8] 利用 NaHCO3 作为发泡剂ꎬ 探究了对发
发展ꎬ 发泡剂起到了至关重要的作用ꎮ 发泡剂可分为
泡水泥综合性能的影响ꎬ 发现发泡水泥具有优异的小
化学发泡剂、 物理发泡剂ꎬ 其中常用的为化学发泡
体积吸水率、 耐腐蚀性能和抗冻性能ꎮ 雷麒 [9] 分析
sodiumbicarbonate?epoxyresin?modification?thermaldecompositionperformance发泡材料因其质量轻具备吸震缓冲吸音保温过滤等功能?尤其是微发泡材料被认为是21世纪的新材料?多应用在汽车医疗体育休闲航空航天建筑装饰等领域13?而对于发泡材料的发展?发泡剂起到了至关重要的作用?发泡剂可分为化学发泡剂物理发泡剂?其中常用的为化学发泡剂45?化学发泡剂大多为吸热型发泡剂如nahco3sb?nh42co3?nh4no2等?其中nahco3因具有污染小发气量大原材料价格低等优点?在发泡材料中应用越来越广泛6?但是nahco3的分解温度太低分解温度范围太宽热稳定性较差?以至于其在实际发泡制品的应用中受到限制?所以对nahco3的改性成了研究者们的研究热点?目前?国内外学者在nahco3的应用和改性方面做了大量相关研究?qi等7采用nahco3作为发泡剂?对以部分中和的丙烯酸2丙烯酸氨基2甲基1丙磺酸amps和凹凸棒石作为原料合成的一种新型耐盐高吸水复合材料?提高了共聚物的溶胀速率?胡高远8利用nahco3作为发泡剂?探究了对发泡水泥综合性能的影响?发现发泡水泥具有优异的小体积吸水率耐腐蚀性能和抗冻性能?雷麒9分析了环氧树脂ep对微胶囊nahco3分解温度的影响?结果表明
( DSC) and thermogravimetry ( TG) were used to investigate the effects of different particle sizes modified sodium bicarbonate on the
碳酸氢钠的改性及其热分析

碳酸氢钠的改性及其热分析碳酸氢钠(NaHCO3),也称为小苏打,是一种常见的无机化合物。
它具有广泛的应用领域,如食品和饮料、制药、清洁剂等。
然而,纯碳酸氢钠并不能满足一些特殊应用的需求,因此需要对其进行改性。
本文将探讨几种常见的碳酸氢钠改性方法,并对其热分析进行讨论。
一种常见的碳酸氢钠改性方法是制备包覆型复合物。
通过将碳酸氢钠与适当的包覆剂进行共混,可以改善其溶解性、稳定性和储存性能。
例如,聚乙烯吡咯烷酮(PVP)是一种常用的包覆剂,它可以通过溶液共混法与碳酸氢钠反应制备包覆型复合物。
研究表明,包覆型复合物具有较好的溶解性和储存稳定性,适用于一些对碳酸氢钠溶解度要求较高的应用。
另一种常见的碳酸氢钠改性方法是制备复合材料。
碳酸氢钠通过与其他材料进行共混,可以形成具有独特性能的复合材料。
例如,将碳酸氢钠与纳米颗粒(如二氧化硅纳米颗粒)进行共混,可以形成纳米复合材料,具有较大的比表面积和较好的催化活性。
此外,在制备复合材料的过程中,还可以添加一些功能化剂,如改善溶解性的有机溶剂或表面活性剂。
这些改性方法可以提高碳酸氢钠的性能,使其适用于更广泛的应用领域。
对于碳酸氢钠的热分析,主要包括热重分析(TGA)和差热分析(DSC)。
热重分析是通过连续测量样品在不同温度下的重量变化,来研究样品的热行为。
热重分析可以用于研究碳酸氢钠的热稳定性、热分解反应和失重过程等。
例如,在热重分析中,可以观察到碳酸氢钠在高温下分解产生二氧化碳、水和氧化物。
这些数据可以为工业应用提供参考,如在高温下烘干碳酸氢钠产品,以获得更高纯度的产物等。
差热分析是通过测量样品与参比物在相同条件下的温度差异,来分析样品的热性质。
差热分析可以用来研究碳酸氢钠的热效应,如吸热或放热反应、相变和热分解反应等。
例如,差热分析可以用来测量碳酸氢钠的熔点,研究其熔化过程和相变行为。
总结而言,碳酸氢钠的改性方法包括制备包覆型复合物和复合材料等。
碳酸氢钠的热分析可通过热重分析和差热分析等方法来研究其热性质和热分解反应。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
碳酸氢钠热分解反应的研究
郭孝兵任峰张典俊
(合肥市第一中学安徽合肥)
碳酸氢钠是中学化学中经常会讨论到的一种钠的化合物,其贯穿在很多知识点的考查中,如物质的分离和提纯;与碳酸钠之间的相互转化;其水溶液蒸干后所得到的固体成分;其水溶液加热过程中的变化及原因探究等等。
而很多教辅资料中重点强调了碳酸氢钠的热分解只针对固体加热,认为碳酸氢钠溶液加热不会分解,因为溶液的温度不能突破100℃,碳酸氢钠不能分解,事实是这样吗?为了将这个问题讨论清楚,给中学化学教案提供一个重要的参考依据,本文重点讨论了碳酸氢钠固体及其水溶液的热分解情况。
.实验
实验药品和主要仪器
碳酸氢钠固体(分析纯)、高温传感器(威尼尔)、常温传感器(威尼尔)、气体传感器(威尼尔)、采集器、计算机、酒精灯、磁力搅拌器、铁架台、烧杯、容量瓶等实验思路
()碳酸氢钠固体的热分解:称量7.5g碳酸氢钠固体,置于干燥的大试管中,将高温传感器的探头置于大试管的底部,使固体完全覆盖住探头,然后将传感器放入试管口,加热,当的浓度突然快速升高时,说明碳酸氢钠固体开始分解,此时的温度即为开始分解的温度。
图
()碳酸氢钠溶液的热分解:精确配制碳酸氢钠溶液,取置于锥形瓶中,放入常温传感器和传感器,用磁力搅拌器加热同时进行磁力搅拌,如果浓度突然升高,说明其开始分解,记录开始分解温度。
装置图如图。
实验数据采集
碳酸氢钠固体的热分解
图
碳酸氢钠溶液的热分解
图
实验分析
碳酸氢钠固体的热分解实验操作较为简单,干扰因素很少,图像较完整,100.2℃开始分解。
但是由于其分解温度较低,酒精灯升温速度较快,不利于观察持续变化过程,再加上可能会出现固体受热不均现象,而使测量结果出现偏差,所以,在加热过程中,先匀速移动酒精灯给试管底部加热,再集中对高温传感器探头所在位置加热。
图像中的突变问题可能是由于温度升高后,分解速率加快所致。
不足之处就是由于传感器量程的局限性,未能测出其分解完全时与温度的动态关系。
碳酸氢钠溶液的热分解,给我们的认识带来较大冲击,20℃左右其就开始分解了,只不过速率较慢,随着温度的升高,分解速率逐渐加快,在76℃左右时,浓度发生突变,开始急剧分解,但是在整个分解过程中,出现了浓度下降,后来又急剧升高的现象,可能是水蒸汽附在传感器表面造成的影响,待水蒸汽冷凝滴下后,传感器测出的浓度又恢复正常。
.实验总结
通过实验可以看出,碳酸氢钠固体的分解比其溶液分解温度要高。
碳酸氢钠固体分解温度在100.2℃左右,这与东南大学能源与环境学院的赵传文等进行的热重分析法测定结果较为吻合,考虑到反应气氛、升温速率、压强等对于其分解速率可能会带来影响,该测定结果主要针对常压、空气中加热做的分析,在以后的研究中,将对升温速率的控制做进一步的思考改进。
而碳酸氢钠溶液常温下就可以分解,只是速率较慢,温度升高后,分解速率会加快,在76℃左右开始急剧分解。
这一结论对于我们理解中学化学中很多与此有关的内容时,有很好的参考价值。
如碳酸氢钠溶液蒸干时,得到的应是碳酸钠固体;溶液温度升高,碳酸氢钠溶。
