第七章 过渡金属碳环配体配合物
中级无机化学-第七章

第七章:d区过渡元素(I)—配位化合物
D4h
Oh
D4h
变形的另一种型式是三 方形畸变, 它包括八面体沿 三重对称轴的缩短或伸长, 形式三方反棱柱体。
三方形畸变
ቤተ መጻሕፍቲ ባይዱ
一种非常罕见的六配位配合 物是具有三棱柱的几何构型, 之所 以罕见是因为在三棱柱构型中配 位原子间的排斥力比在三方反棱 柱构型中要大。
第七章:d区过渡元素(I)—配位化合物
可以发现:
① 在中心离子周围的七个配位原子所构成的几 何体远比其他配位形式所构成的几何体对称性要差 得多。 ② 这些低对称性结构要比其他几何体更易发生 畸变, 在溶液中极易发生分子内重排。 ③ 含七个相同单齿配体的配合物数量极少, 含 有两个或两个以上不同配位原子所组成的七配位配 合物较为稳定,但却是加剧了配位多面体的畸变。
第七章:d区过渡元素(I)—配位化合物
7.2.1 配合物的立体异构
立体异构可分为几何异构和光学异构两种 1 几何异构 在配合物中, 配体可以占据中心原子周围的不同位置。 所研究的配体如果处于相邻的位置, 称为顺式结构, 如果配 体处于相对的位置, 称为反式结构。由于配体所处顺、反位 置不同而造成的异构现象称为顺-反异构。 很显然, 配位数为2的配合物, 配体只有相对的位置, 没 有顺式结构, 配位数为3和配位数为4的四面体, 所有的配位 位置都是相邻的, 因而不存在反式异构体, 然而在平面四边 形和八面体配位化合物中,顺-反异构是很常见的。
八配位的几何构型有五种基本方式:
四方反棱柱体
十二面体
立方体 双帽三角棱柱体 六角双锥
其中最常的是四方反棱柱体和十二面体。
过渡金属配合物催化剂及其相关催化过程共35页文档

40、学而不思则罔,思而不学则殆。——孔子
过渡金属配合物催化剂及其相关催化 过程
6
、
露
凝
无
游
氛
,
天
高
风
景
澈
。
7、翩翩新 来燕,双双入我庐 ,先巢故尚在,相 将还旧居。
8
、
吁
嗟
身
后
名
,
于
我
若
浮
烟
。
9、 陶渊 明( 约 365年 —427年 ),字 元亮, (又 一说名 潜,字 渊明 )号五 柳先生 ,私 谥“靖 节”, 东晋 末期南 朝宋初 期诗 人、文 学家、 辞赋 家、散
1
0
、
倚
南
窗
以
寄
傲
,
审
容
膝
之
易
安
。
谢谢!
36、自己的鞋子,自己知道紧在哪里。——西班牙
37、我们唯一不会改正的缺点是软弱。——拉罗什福科
xiexie! 38、我这个人走得很慢,但是我从不后退。——亚伯拉罕·林肯
39、勿问成功的秘诀为何,且尽全力做你应该做的事吧。——美华纳
过渡金属元素

V(OH)2 弱B
V(OH)3 更弱B
V(OH)4 AB
HVO3 A
Cr(OH)2 B
Cr(OH)3 BA
H2CrO4 A
Fe(OH)2 B
Fe(OH)3 BA
同一元素低价态化合物碱性比高价态碱性强。
八、配合物:
形成配合物倾向 比主族Mn+大得多:
① (n-1) d 与 ns 能量相近,(n-1)d电子参与成键; ② d 区 Mn+: (9 17)e构型, (强极化力 + 大变形性)。
CO CO CO CO
Ni(CO)4 四面体
问 实测:Ni—C键长184 pm,理论:Ni—C键长198 pm;
题 CO把电子给予Ni,Ni上负电荷过剩,使该化合物不稳定, 而事实Ni(CO)4十分稳定。
20
CO的分子轨道式
接受Ni的d电子
(1σ)2 (2σ)2 (3σ)2 (4σ)2 (1π)4 (5σ)2 (2π)0 (6σ)0
σδ π π
σ成键 π成键 δ键
Re3+
↑ ↑ ↑ ↑ —— dz2 dxy dyz dxz dx2-y2
||
|
头面 肩
碰对 并
头面 肩
Re-Re成键情况
27
3. 双氮配合物与N2分子的活化
端基配位——以σ电子给予金属M
N2形成配合物
M···N≡N M···N≡N···M
N
侧基配位——以π电子给予金属 M
2. 羰基簇合物 (分子中含有M—M键的化合物) 过渡元素能和CO形成许多羰基簇合物。 羰基簇合物中金属原子多为低氧化态并具有适宜的d轨道。
双核和多核羰基簇合物中羰基与金属原子的结合方式: (1) 端基(1个CO和1个成簇原子相连);(2) 边桥基(1个CO 与2个成簇原子相连);(3) 面桥基(1个CO与3个成簇原子相 连)。
金属有机化学基础-过渡金属膦配合物

PPh PhP Fe P Ph2 Br
+
P Ph2P Pt
Ph PPh2 P Pt Cl Cl
ห้องสมุดไป่ตู้Ph
P Ph2
Cl Cl
Bacci & coworkers Inorg. Chem., 1984, 23, 2798
Bruggeller & coworkers Inorg. Chim. Acta, 1992, 197, 75
PPh2
PPh2 P Co
PPh2
P
PPh2 P(OMe)3
PPh2 tetraphos-2
PPh2
Meek & coworkers Inorg. Chem., 1983, 25, 616
tris(diphenylphosphinoethyl)phosphine
diphenylphosphinoethane bis(diphenyl)phosphinoethane
Ni
Cl
95.5°
NiCl2(dppe) Cl
van Koten, et al Acta Crys. C, 1987, 43, 1878
chelating ligand
Me2P
dmpe (107° )
2
R:OR(烷氧基) phosphite/亚磷酸酯
膦配体具有三个R基团,与金属配位后则具有四面体的 配位构型,从而成为最具有变化性的中性2e给电子配体。
通过改变R基团,可以显著改变膦配体的性质:
显著改善膦配体的电子因素(从优秀的给体/弱的p-电子受体转变 为弱的给电子体/好的p-电子受体); 显著改变立体位阻因素(从小位阻配体到巨大位阻的配体);
讲座十、过渡金属的非经典配合物
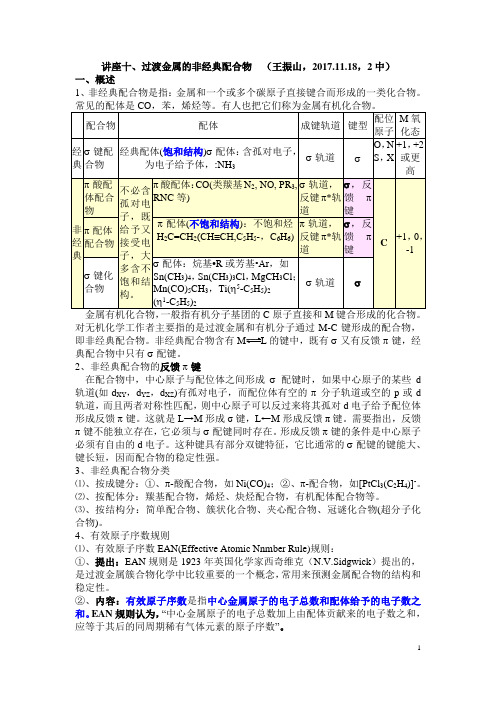
讲座十、过渡金属的非经典配合物(王振山,2017.11.18,2中)一、概述1、非经典配合物是指:金属和一个或多个碳原子直接键合而形成的一类化合物。
常见的配体是CO,苯,烯烃等。
有人也把它们称为金属有机化合物。
学工作者主要指的是过渡金属和有机分子通过M-C键形成的配合物,即非经典配合物。
非经典配合物含有L的键中,既有σ又有反馈π键,经典配合物中只有σ配键。
2、非经典配合物的反馈π键在配合物中,中心原子与配位体之间形成σ配键时,如果中心原子的某些d轨道(如d XY,d YZ,d XZ)有孤对电子,而配位体有空的π分子轨道或空的p或d轨道,而且两者对称性匹配,则中心原子可以反过来将其孤对d电子给予配位体形成反馈π键。
这就是L→M形成σ键,L←M形成反馈π键。
需要指出,反馈π键不能独立存在,它必须与σ配键同时存在。
形成反馈π键的条件是中心原子必须有自由的d电子。
这种键具有部分双键特征,它比通常的σ配键的键能大、键长短,因而配合物的稳定性强。
3、非经典配合物分类⑴、按成键分:①、π-酸配合物,如Ni(CO)4;②、π-配合物,如[PtCl3(C2H4)]-。
⑵、按配体分:羰基配合物,烯烃、炔烃配合物,有机配体配合物等。
⑶、按结构分:简单配合物、簇状化合物、夹心配合物、冠谜化合物(超分子化合物)。
4、有效原子序数规则⑴、有效原子序数EAN(Effective Atomic Nnmber Rule)规则:①、提出:EAN规则是1923年英国化学家西奇维克(N.V.Sidgwick)提出的,是过渡金属簇合物化学中比较重要的一个概念,常用来预测金属配合物的结构和稳定性。
②、内容:有效原子序数是指中心金属原子的电子总数和配体给予的电子数之和。
EAN规则认为,“中心金属原子的电子总数加上由配体贡献来的电子数之和,应等于其后的同周期稀有气体元素的原子序数”。
EAN规则的另一种说法是18电子规则18-electron rule,“每个中心金属原子的价电子数加上由配体贡献来的电子数之和应等于18”,所以EAN规则又称18电子规则。
第七章配位化合物

第七章 配位化合物第一节 配合物的组成及命名一、配合物的组成 1、配合物配离子:由两种不同离子或一种离子与一种分子形成的复杂离子称之。
如:[]+23)(NH Ag 、[]+243)(NH Cu 、[]-36)(CN Fe 、[]-46)(CN Fe配合物:含配离子的化合物。
如:[]Cl NH Ag 23)(、[]443)(SO NH Cu 、[]63)(CN Fe K 、[]64)(CN Fe K 有时也把配离子笼统称为配合物。
2、配合物的组成配合物结构较复杂,但一般都有一个成分作为配合物的核心,其它部分围绕这一核心有规则地排列。
(1)中心离子(配合物的形成体):位于配合物中心的离子或原子。
多为具有空轨道的过渡元素的金属离子(d 区、s d 区)。
少数为高氧化数非金属原子,如:[]-26SiF 、[]-6PF 。
个别为中性原子,如:[]4)(CO Ni 、[]5)(CO Fe 。
(2)配位体★含义:与中心原子结合的分子或离子。
多为含孤对电子的分子或离子。
如3NH 、O H 2、-Cl 、-CN 、-SCN 等。
★分类:根据一个配体中所含配位原子数目的不同,可将配体分为单齿配体和多齿配体。
单齿配体:一个配位体只含一个配位原子。
多齿配体:一个配位体只含两个或两个以上的配位原子。
(3)配位原子:配位体中直接与中心离子结合的原子。
配位原子大多为电负性较大的非金属原子,如:N 、O 、F 、C 、S 、x 等。
(4)配位数:★含义:直接与中心原子结合的配位原子数。
单齿配体:配位数=配位体数。
多齿配体:配位数=配位体数×一个配位体所含配位原子的个数(齿数)。
如:[]+22)(en Pt★影响因素中心离子正电荷:电荷数↑,配位数↑半径:中心离子半径↑,配位数↑配体半径↑,配位数↓外界因素:浓度,配体浓度高有利于形成高配位数。
温度,温度低有利于形成高配位数。
★经验:中心离子 +1 +2 +3 +4 配位数 2 4(6) 6(4) 6(8) (5)内界:即配离子,用“[ ]”括起。
金属有机化学基础-过渡金属卡宾和卡拜配合物及催化应用共52页
•
46、寓形宇内复几时,曷不委心任去 留。
•
47、采菊东篱下,悠然见南山。
•Байду номын сангаас
48、啸傲东轩下,聊复得此生。
•
49、勤学如春起之苗,不见其增,日 有所长 。
•
50、环堵萧然,不蔽风日;短褐穿结 ,箪瓢 屡空, 晏如也 。
21、要知道对好事的称颂过于夸大,也会招来人们的反感轻蔑和嫉妒。——培根 22、业精于勤,荒于嬉;行成于思,毁于随。——韩愈
23、一切节省,归根到底都归结为时间的节省。——马克思 24、意志命运往往背道而驰,决心到最后会全部推倒。——莎士比亚
25、学习是劳动,是充满思想的劳动。——乌申斯基
谢谢!
化学反应中的过渡金属配位机制
化学反应中的过渡金属配位机制过渡金属配位化学是现代化学中一个重要且广泛的领域。
过渡金属元素能够形成稳定的配合物,这是由于它们具有未填满的d轨道,这些电子可以与配体中的原子轨道相重叠形成配位键。
通过深入研究过渡金属配位机制,我们可以更好地理解和设计化学反应以及新型配合物的合成。
一、配位键的形成机制过渡金属配位化合物的形成涉及配体和过渡金属离子之间的配位键的形成。
配体是指可以提供一个或多个电子对给过渡金属离子的化合物或离子。
配位键的形成机制包括配体提供电子对,通过共价键形成以及配体和金属之间的电荷转移。
在形成配位键时,配体中的原子轨道与过渡金属离子中的未填满的d轨道重叠,产生一个共价键。
这种配位键的形成可以通过Donor-Acceptor模型来解释,即配体作为电子给体,提供电子给金属离子作为受体。
二、配位数与配位键的影响过渡金属离子的配位数是指围绕中心金属离子所形成的配位键数目。
配位数取决于过渡金属元素的电子结构以及配体的性质。
常见的配位数有4、5、6等。
配位数的变化会影响到配位化合物的性质和化学行为。
不同配位数的配合物在稳定性、溶解度、光谱性质等方面表现出不同的特点。
此外,配位数的变化还会影响到反应的速度和机理。
三、配位发生的动力学概念了解配位发生的动力学概念对于理解过渡金属配位机制至关重要。
配位发生包括两个方面:配合物的形成和解离。
配合物的形成速率取决于配体和过渡金属离子之间的反应速率以及配体的浓度。
配体的取代反应可以通过互变反应速率常数来评估,而配体的电子效应和空间位阻则会影响反应速率。
配合物的解离取决于配合物中配体与金属之间的键强度、水解能力以及其它配体促进解离的因素。
理解配合物的解离机理可以帮助我们设计更稳定的配位化合物或者利用溶剂效应来控制反应速率。
四、配位理论的应用过渡金属配位机制的研究在很多领域中都有着广泛的应用。
例如,配位化合物在催化反应、药物设计、材料科学等方面起着重要的作用。
通过深入研究过渡金属配位机制,可以开发新的催化剂,设计具有特殊功能的材料,并提供新的药物研究方向。
金属有机化学基础-过渡金属羰基配合物及原子簇合物
6.1 成键方式
CO的分子轨道
5
羰基具有空的p*-轨道 强有力的p-电子接受体
是用于稳定富电子低价金属
中心的优秀配体
标准成键模式
端基形式 2e 中性配体
m2-桥式 2e 中性配体 1e,每个金属中心
m3-桥式 3e 中性配体 1e,每个金属中心
6.1.1 端基羰基
CO-M形成s键
M-C bond C-O bond: nCO freq:
Zr Hf
Nb Ta
Mo(CO)6 W(CO)6
Tc2(CO)10 Re2(CO)10
Pd Pt
Ag Au
低聚集态(单核、双核)的金属羰基化合物一般满足18电子规则。例
外:
多金属中心的金属羰基簇合物不再满足18电子规则,而是满足Wade规
则;
含有偶数d电子的金属能形成稳定单核中性金属羰基化合物;含有奇数
nCO cm-1 2143 2204 2060
更多的电子密度进入CO的p*-反键轨道, 从而使C-O进一步削弱;
使M-CO键进一步增强,而具有双键性,
[Co(CO)4][Fe(CO)4]2[Mn(CO)6]+ d6 Cr(CO)6 [V(CO)6]-
1890
1790 2090 2000 1860
M=Cr, Mo, W
3 缩合法 含卤素的过渡金属羰基配合物与含碱金属的过渡金属羰基配合物反应, 脱掉一分子盐而形成过渡金属羰基簇合物。这个方法适用制备异核过渡金 属羰基簇合物。
(CO)5ReBr + NaMn(CO)5 —→ (CO)5Mn-Re(CO)5 + NaBr
6.3 过渡金属羰基配合物、簇合物的反应
过渡金属与配位化学
过渡金属与配位化学过渡金属元素是化学中的重要组成部分,也是许多生物和工业过程中的关键因素。
配位化学是一门研究配位化合物的合成、结构和反应的学科,其中包括过渡金属与配体之间的相互作用和配位共价键的形成。
一、过渡金属的性质和应用过渡金属元素具有特殊的性质,比如高的熔点、良好的导电性、高催化活性等,这些特性使得它们在许多领域有重要的应用。
过渡金属催化剂被广泛应用于有机合成、环境保护和能源转化等领域。
例如,铂催化剂常被用于汽车尾气处理,而铁催化剂可用于氧气还原反应。
二、配位化合物的结构与性质过渡金属与配体结合形成配位化合物,这些化合物通常具有复杂的结构和多样的性质。
配位化合物的结构由金属中心、配体以及它们之间的配位键构成。
金属中心通常位于化合物的中心,而配体则通过配体原子与金属中心形成配位键。
配位键可以是共价键或离子键,取决于配体的性质。
配位化合物的性质由金属中心和配体的性质决定。
金属中心的电子结构决定了配合物的稳定性和反应性,而配体的选择可以调节配位化合物的溶解度、磁性和光学性质。
例如,铁配合物可以具有不同的自旋态,从而呈现出不同的磁性行为。
三、配位化学反应配位化合物可以通过一系列反应进行合成和转化。
常见的反应包括配体置换、氧化还原反应和配位聚合等。
配体置换反应是最常见的反应之一,通过更换配体来改变配位化合物的性质。
氧化还原反应则涉及到配位化合物的电子转移过程,通常需要使用氧化剂或还原剂。
配位聚合是通过配位化合物之间的键的形成而构建高分子化合物,常见的例子是配位聚合物和金属有机框架材料。
四、生物中的过渡金属在生物体中起着关键作用,例如参与催化酶的催化反应和参与氧气运输的血红蛋白。
这些生物配位化合物通常含有特殊的配体和金属中心,形成稳定的配位键。
生物配位化合物的结构和功能的研究有助于我们理解生物体的化学过程和开发新的生物医学应用。
总结:过渡金属与配位化学是一门重要的学科,涉及到过渡金属元素的性质和配位化合物的合成、结构以及反应。
