血小板活化
血小板膜表面CD62P检测活化方法

血小板膜表面CD62P检测
操作步骤
1. 标本采集:
(1)采血管顺序编号。
(2)抽取静脉血,采血管中注入2ml。
(3)于10分钟之内完成血小板激活和染色步骤,操作时应注意
减少人工激活。
注意事项:1、至少要采集10ml全血
2、而且必须用粗针采血
3、如果是用注射器,则将采的血先放入才血管,最后将
剩余的几毫升弃掉或做它用。
4、如果是用采血针采血,先弃掉2ml,然后再往采血管中采
集。
2. 荧光抗体染色:
(1)取2支试管,加入待测外周血标本,两管各加5ul
(2)在对照管中加入CD62P的同型对照抗体、CD61 各20μl
(3)在试验管中加入CD62p抗体和CD61抗体各20μl。
(4)轻轻混匀,室温暗处孵育15-20分钟。
(5)孵育后,加入500ul的PBS(若血小板数目过多,可以多加一
些PBS),混匀后上机检测;若不能立即上机,加入500ul 1%的多聚甲醛溶液固定,24小时内上机分析。
注意事项:
1、在所有操作中动作应轻柔,不可力度过大,因为血小板容易活化
2、方案的建立:
两张图:(1)散点图CD61/SS,圈CD61阳性的血小板(2)直方图CD62P,分析血小板的表达情况
FS,SS均应选择Log方式检测,阈值设在FL1(CD61的荧光通道)上,值可能会比较大,可能在200、300左右。
各类血小板功能检测的临床意义

显微镜计数法
通过人工显微镜观察血液样本,计数血小板数 量。
其他方法
如流式细胞术、电镜技术等,用于特殊情况下或进一步研究。
血小板计数检测的临床意义
诊断出血性疾病
血小板计数是诊断出血性疾病的 重要指标,如特发性血小板减少 性紫癜、血栓性疾病等。
监测抗凝治疗
对于接受抗凝治疗的患者,定期 检测血小板计数有助于评估治疗 效果和调整治疗方案。
通过检测血小板表面的活化标记物, 了解血小板活性状态。
血小板功能检测的临床应用
诊断血栓性疾病
通过对血小板功能的检测,有助于诊 断血栓性疾病,如动脉粥样硬化、心 肌梗死、脑卒中等。
评估心血管疾病风险
通过检测血小板功能,可以评估个体 发生心血管疾病的风险,为预防和治 疗提供依据。监测抗血小板药物治疗效果来自血小板活化检测的临床意义
诊断血栓性疾病
01
血小板活化是血栓形成的关键步骤,通过检测血小板活化程度
有助于诊断血栓性疾病,如心肌梗死、脑梗死等。
评估抗血小板治疗效果
02
对于接受抗血小板治疗的患者,检测血小板活化程度有助于评
估治疗效果,指导治疗方案调整。
预测心血管事件风险
03
血小板活化程度与心血管事件风险密切相关,通过检测血小板
活化程度有助于预测患者发生心血管事件的风险。
血小板活化检测的注意事项
01
02
03
标本采集和处理
采集血液标本时应避免过 度挤压和抗凝剂不足,防 止血小板活化和聚集。
检测方法选择
不同检测方法对血小板活 化的敏感性和特异性存在 差异,应根据具体情况选 择合适的检测方法。
结果解读
结合患者临床表现和其他 检查结果综合分析血小板 活化检测结果,避免误诊 和漏诊。
血小板聚集功能
*
Resting Platelet
ADP
GPⅤ
Activated Platelet one
Activated Platelet two
GPⅡb-Ⅲa
Aggregation
二. 聚 集 功 能
Ⅱa
GPⅡb-Ⅲa
Fibrinogen
膜脂质
75%~80%
20%~25%
2%~5%
2.膜脂质
SPH
*
Phosphatidylcholine, PC
Phosphatidylethano- lamine,PE
Phosphatidylserine, PS
Phosphatidylinositol,PI
Sphingomyelin,SPH
溶血磷脂
①
②
③
A and B
二聚体
细丝
微管
微管 维持血小板形态
*
骨架系统和收缩蛋白
微丝 肌动蛋白细丝及肌球蛋白粗丝,参与血小板收缩活动,伪足形成和释放 膜下细丝
*Байду номын сангаас
(三)血小板细胞器和内容物
D
D
D
1.α-颗粒( granule): P-selectin,PF4,β-TG,TSP,Fn
a
a
platelet
*
重要糖蛋白缺乏所导致的疾病?
*
生化组成
磷脂酰胆碱(PC) 磷脂酰乙醇胺(PE) 膜磷脂 鞘磷脂+甘油磷脂 磷脂酰丝氨酸(PS) 磷脂酰肌醇(PI) 溶血卵磷脂 胆固醇 糖脂
a-granule
Glanzmann Thrombastenia
DMXAA抗血小板、抗血栓作用和NOD2增强血小板活化和血栓形成的研究

DMXAA抗血小板、抗血栓作用和NOD2增强血小板活化和血栓形成的研究第一部分:肿瘤血管破坏剂DMXAA的抗血小板、抗血栓作用及其机制随着我国人民生活水平的提高,动脉血栓性疾病如冠心病和中风等已超过恶性肿瘤成为导致国人死亡的首要疾病。
血小板功能亢进或异常激活引起的血管内血栓形成是此类疾病的病理基础,抗血小板药对其治疗效果是肯定的。
目前临床上使用的抗血小板药主要有环氧化酶抑制剂阿司匹林、P2Y12受体拮抗剂氯吡格雷、磷酸二酯酶(PDE)抑制剂西洛他唑、和整合素allbβ3受体拮抗剂阿昔单抗等,但由于存在阿司匹林抵抗和氯吡格雷抵抗等现象,导致现有的抗血小板药对某些血栓性疾病患者临床应用受限,部分患者治疗效果未尽如人意。
因此,临床仍需要抗血小板作用更强且副作用更小的药物面世以改善某些动脉血栓性疾病患者的疗效,研究开发此类药物仍具有较大的市场。
DMXAA作为肿瘤血管破坏剂治疗非小细胞肺癌等已进入Ⅲ期临床试验,其主要通过破坏肿瘤组织血管导致肿瘤组织血供减少,从而达到抑制肿瘤作用。
FAA 结构与DMXAA类似,显著抑制小鼠来源肿瘤,但其作为肿瘤血管破坏剂进入临床试验发现其几乎不抑制人来源肿瘤。
在临床试验中发现患者使用FAA治疗时有明显出血,进一步研究发现其具有抗血小板、抗血栓作用。
虽然,临床试验中使用DMXAA治疗的患者未见明显出血,其是否具有抗血小板、抗血栓作用也未见报道,但由于DMXAA与FAA结构类似,均属于黄酮类药物,我们推测其具有与FAA类似的抗血小板、抗血栓作用。
因此,在本研究中,我们探讨DMXAA是否具有抗血小板、抗血栓作用,及其相应机制。
在本研究中,我们发现DMXAA在10-600μmol/L范围内浓度依赖性地抑制TXA2类似物U46619诱导的阿司匹林处理或未处理的人血小板聚集和ATP释放。
300 μmol/L DMXAA强烈抑制AA、ADP、胶原或瑞斯托酶素诱导的阿司匹林未处理的人血小板聚集和ATP释放。
血小板活化对恶性肿瘤病情和预后影响的临床研究

1 0 F 外 , 癌 、 癌 、 癌 组 T B 、 — X 2T P、— G、 4 、N 肺 肠 肝 X DH T B 、 S pT GMP பைடு நூலகம்0和 C 4 GMP升 高 , 癌 、 癌 F 下 降 。2 肿 瘤 组 C 肠 肺 N ) GMP与
中图 分 类 号 : 4 . 1 R7 7 R4 6 6 ; 33 文 献标 识 码 : A 文 章 编 号 : 7 — 1 0 2 1 ) 10 3 3 1 34 3 ( 0 0 0 0 10 6
Ex o a i n o he e f c s o at l t a tv t o n t a i nt t a i na umor a he r p o n s s pl r to f t f e t f pl e e c i a i n o he p t e s wi h m lg ntt nd t i r g o e
.
Ex e to h P, c p ft e TS GM P 1 0 t e h p tcc n e r u h e a i a c rg o p,t e lv l o 4 h e es f TXB , 2 DH— TXB , P, — 2 TS G TG, GM P 1 0 a d C 一 4 n GM P i c e s d n r a e
t m ora h og s s M e h d Ra o i m un t nd ElI u nd t e pr no e . to s di m iy a SA r m p o d t t c h FXB2, we e e l ye o de e tt e DH TXB2, TSP , 一 8 TG , GM P一
活化血小板在2型糖尿病中的临床价值

( 稿 日期 :0 00—3 收 2 1—20 )
活 化 血 小 板 在 2型 糖 尿 病 中 的 临 床 价 值
D1 :0 3 6 /.s n 1 7 4 5 2 1 . 5 0 8 0 1 . 9 9 j is . 6 29 5 . 0 0 1 . 4
中 图分 类 号 : 8 . R5 7 1
文 献标 志码 : B
文章 编 号 : 6 29 5 ( 0 0 1 — 6 0 0 17 -4 5 2 1 )51 2—2
2 . 41
[ ] 田辉 , 铁 军 , 连群 , . 2 吴 张 等 重症 颅 脑 损 伤 患 者 脑 氧 利 用 率 的 l 研 究 [] 中 国危 重 病 急 救 医 学 ,0 4 l ( ) 2 3 临床 J. 2 0 ,6 4 : 2
2 . 25
[] 唐 承 富 , 善 撰 , 晓林 . 幼 儿 外 伤 性 脑 死 的 C 诊 断 : 7 张 郑 婴 T 附 6例 分 析 [] 临 床 放 射 学 杂 志 ,98 1 () 1 51 6 J. 1 9 ,7 3 :8 —8 . [] 杨 振 铭 , 波 , 阳世 杰 , . 6例 d J  ̄ 伤后 基底 节 区腔 8 杨 欧 等 1 ,L b
型 糖 尿 病 组 患者 外周 血 小板 活化 率 明显 高 于 非糖 尿 病 患 者 组 。结 论 2型 糖 尿 病 血 小 板 活 化 率 增 高 ; 小板 活 化 血
率 增 高 可 能是 糖 尿 病 患者 t脑 血 管病 发 病 率 高 的 重要 机 制 之 一 。 0 2
创伤 血小板激活机制

创伤血小板激活机制
血小板激活机制是指在创伤或血管损伤后,血小板被激活并参与血栓形成的生物学过程。
在血管损伤后,血管壁会释放一系列信号分子,如组织因子(TF)和胶原蛋白,这些信号分子能够激活血小板。
血小板激活的过程包括黏附、激活和聚集三个主要步骤。
首先,血小板通过黏附到受损血管壁上的胶原蛋白和其他细胞表面分子来被激活。
这种黏附是通过血小板表面的受体(如GPⅠb-Ⅸ和GPⅥ)与血管壁上的分子(如von Willebrand因子和胶原蛋白)的结合实现的。
接着,激活的血小板释放出一系列生物活性物质,如血小板活化因子、血小板激活因子和血小板磷脂酶A2等,这些物质能够进一步激活周围的血小板。
最后,激活的血小板聚集在损伤部位,形成血小板聚集体,同时释放血小板衍生生长因子(PDGF)、血小板因子4(PF4)和凝血酶原激活抑制剂(PAI-1)等物质,促进血栓形成和修复受损血管。
此外,血小板激活还涉及到一系列信号传导通路,如磷脂酶C (PLC)通路、蛋白激酶C(PKC)通路和肾上腺素能受体激活等,这些通路的激活可以进一步增强血小板的激活状态。
总的来说,血小板激活机制是一个复杂的生物学过程,涉及多种信号分子、受体
和信号传导通路的相互作用,最终导致血小板的激活、聚集和血栓形成,从而实现创伤部位的止血和修复。
211233863_依洛尤单抗对急性心肌梗死患者血小板活化及预后的影响分析

活化及预后的影响分析曹明英㊀姚朱华㊀张伶俐㊀王永刚300121天津市人民医院心内一科(曹明英㊁姚朱华㊁张伶俐);300070天津医科大学研究生院(王永刚)通信作者:姚朱华,电子信箱:tjyzhpci@DOI:10.3969/j.issn.1007-5410.2023.02.002㊀㊀ʌ摘要ɔ㊀目的㊀分析急性心肌梗死患者血清前蛋白转化酶枯草溶菌素9(PCSK9)水平并探讨其影响因素,观察PCSK9抑制剂(依洛尤单抗)对血小板活化的影响及对患者预后的影响㊂㊀方法㊀前瞻性队列研究㊂入选2019年12月至2021年12月天津市人民医院心内科收治的急性心肌梗死患者89例㊂采用随机数字表法分为依洛尤单抗组45例和对照组44例,依洛尤单抗组于入院24h内给予皮下注射依洛尤单抗140mg,间隔14d再次注射㊂于入院时和第1个月检测患者血清PCSK9水平和血小板活化指标㊂采用多因素线性回归方法分析PCSK9水平的影响因素,观察依洛尤单抗对血小板活化的作用及患者预后的影响㊂㊀结果㊀两组一般临床情况比较,差异均无统计学意义(均为P>0.05);基线血清PCSK9水平和血小板活化指标比较,差异也无统计学意义(均为P>0.05)㊂血清PCSK9水平受性别(B=285.894,t=2.093,P=0.040)和炎症指标高敏C反应蛋白(B=-19.533,t=-2.356,P=0.021)影响㊂干预组中依洛尤单抗能够抑制血小板活化(Z=4.977,P<0.01)㊂依洛尤单抗组的心绞痛和再入院发生率低于对照组(χ2=4.21,P=0.04),而两组出血发生率无统计学差异(均为P>0.05)㊂Logistic回归分析结果提示,血清PCSK9水平为出血的独立风险因素(B=-0.36,t=15.405,P<0.01)㊂㊀结论㊀依洛尤单抗可能通过抑制急性心肌梗死患者的血小板活化,改善患者预后㊂ʌ关键词ɔ㊀前蛋白转化酶枯草溶菌素9;㊀依洛尤单抗;㊀心肌梗死;㊀血小板活化;㊀预后基金项目:天津市人民医院科研项目(2019YJ014)Effects of Evolocumab on platelet activation and prognosis in patients with acute myocardialinfarction㊀Cao Mingying,Yao Zhuhua,Zhang Lingli,Wang YonggangDepartment of Cardiology,Tianjin Union Medical Center,Tianjin300121,China(Cao MY,Yao ZH,Zhang LL);Graduate School of Tianjin Medical University,Tianjin300070,China(Wang YG)Corresponding author:Yao Zhuhua,Email:tjyzhpci@ʌAbstractɔ㊀Objective㊀To analyze the level of serum proprotein convertase subtilisin/kexin type9(PCSK9)in patients with acute myocardial infarction(AMI)and explore its influencing factors,and toobserve the effect of PCSK9inhibitor(Evolocumab)on platelet activation and prognosis of AMI patients.Methods㊀This research was a prospective cohort study.A total of89AMI patients in Department of Cardiology at Tianjin Union Medical Center were enrolled from December2019to December2021. According to random number table,the patients were randomly divided into Evolocumab group(n=45)andcontrol group(n=44).The Evolocumab group received subcutaneous injection of Evolocumab140mgwithin24hours of admission,and re-injected at intervals of14days.Serum PCSK9levels and platelet activation indicators were detected at admission and the first month.Multivariate linear regression methodwas used to analyze the influencing factors of PCSK9level,and the effect of Evolocumab on platelet activation and prognosis of patients were observed.㊀Results㊀There was no statistically significant difference in general clinical baseline(all P>0.05),serum PCSK9level and platelet activation indicatorsbaseline level(both P>0.05)between the two groups.Serum PCSK9level was affected by sex(B=285.894,t=2.093,P=0.040)and high-sensitivity C-reactive protein(B=-19.533,t=-2.356,P=0.021).Evolocumab in the intervention group showed inhibition effect of platelet activation(Z=4.977,P<0.01).The incidence of cardiac events was lower in the Evolocumab group than that in the control group(χ2=4.21,P=0.04),and there was no significant difference in the incidence of bleeding between the twogroups(both P>0.05).Logistic regression analysis suggested that PCSK9level was an independent risk factor for bleeding(B=-0.36,t=15.405,P<0.01).㊀Conclusions㊀Evolocumab may improve the prognosis of AMI patients by inhibiting platelet activation.ʌKey wordsɔ㊀Proprotein convertase subtilisin/kexin type9;㊀Evolocumab;㊀Myocardial infarction; Platelet activation;㊀PrognosisFund program:Project of Tianjin Union Medical Center(2019YJ014)㊀㊀血小板异常活化在急性冠状动脉综合征发生发展过程中起着关键作用[1],此类患者经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)术后即刻血小板CD62p㊁CD63和糖蛋白(glycoprotein,GP)Ⅱb/Ⅲa水平较术前明显增高[2-3]㊂PCI术中对狭窄局部实施球囊机械性压迫㊁撕裂及支架置入,使斑块破裂,暴露出内皮下胶原㊁血管性血友病因子(von Willebrand factor,vWF)等配体,通过vWF-GPⅠb介导血小板粘附于损伤表面,引起血小板活化㊂活化的血小板不仅参与血栓形成,还释放多种血管活性物质㊁细胞因子和生长因子,参与介入治疗后的急性和亚急性血管再闭塞和再狭窄的发生[4-5]㊂前蛋白转化酶枯草溶菌素9 (proprotein convertase subtilisin/kexin type9, PCSK9)是一种丝氨酸蛋白酶,通过促进低密度脂蛋白受体在核内体和溶酶体中的降解,增加血液中低密度脂蛋白胆固醇的水平,在脂质代谢中起着重要作用[6]㊂最近研究也有报道PCSK9在心血管事件中发挥的作用与调节低密度脂蛋白胆固醇外作用相关,包括它在促进血小板活化和凝血过程中的作用,从而使心血管疾病进展[7-9]㊂研究显示,高PCSK9水平与接受直接PCI的急性心肌梗死患者的心脏事件独立相关,其原因可能是PCSK9与患者的炎症和血小板活化标志物有较强的相关性[10-11]㊂由此,PCSK9抑制剂(PCSK9inhibitors,PCSK9i)因在预防和治疗心血管疾病中的多效性而备受关注,不过迄今为止,以上结果仅限于动物实验或少数临床研究㊂本研究旨在观察PCSK9i(依洛尤单抗)对急性心肌梗死患者血小板活化的影响及对患者预后的影响㊂1㊀对象和方法1.1㊀研究对象前瞻性队列研究㊂入选2019年12月至2021年12月在天津市人民医院心内科住院的以急性心肌梗死为首要初次诊断的患者89例,男性67例,女性22例,年龄38~81岁,平均(63.7ʃ9.6)岁㊂入选标准:(1)年龄18~85岁,性别不限;(2)诊断依据‘非ST段抬高型急性冠状动脉综合征诊断和治疗指南(2016)“[12]和‘急性ST段抬高型心肌梗死诊断和治疗指南(2019)“[13];(3)发病时间在24h内;(4)无论是否接受再灌注治疗(包括静脉溶栓和PCI)均可㊂排除标准:(1)严重贫血(血红蛋白<60 g/L);(2)血小板计数<100ˑ109/L;(3)丙氨酸氨基转移酶或天门冬氨酸氨基转移酶>2倍参考值上限;(4)重度肾功能不全(Cockcroft-Gault公式估算肾小球滤过率<30ml㊃min-1㊃1.73m-2);(5)肿瘤终末期,感染性休克,结缔组织病,血液系统疾病,难治性高血压,急性脑卒中,糖尿病酮症或高渗昏迷,妊娠;(6)长期口服抗凝药物和糖皮质激素类药物㊂本研究经天津市人民医院伦理委员会批准[伦理审批号:(2019)年快审第(C02)号],每位研究对象均签署知情同意后进行㊂1.2㊀研究分组采用随机数字表方法将入选患者分为依洛尤单抗组45例和对照组44例㊂依洛尤单抗组于入院24h内给予皮下注射1支(140mg)依洛尤单抗注射液(生产厂家:Amgen Manufacturing Limited,国药批准文号:S2*******),14d后再次注射1支㊂对照组不予注射㊂两组均于入院时给予负荷剂量的阿司匹林300mg和替格瑞洛180mg㊂此后每日常规应用抑制血小板聚集和他汀降脂药物,包括阿司匹林75~100mg/次每日1次,替格瑞洛90mg/次每日2次,瑞舒伐他汀10mg/次每日1次㊂1.3㊀观察指标记录所有入选患者的临床特征,包括年龄㊁性别㊁急性心肌梗死分型(急性ST段抬高型心肌梗死和急性非ST段抬高型心肌梗死)㊁吸烟㊁高血压㊁糖尿病和卒中史㊂入院时均检测肝功能㊁血脂㊁高敏C 反应蛋白和行超声心动图检查㊂分别于入院时(干预前)㊁第1个月检测血清PCSK9水平和血小板活化指标(CD63和CD62P双标阳性的百分比)㊂1.4㊀检测方法1.4.1㊀血清PCSK9水平检测㊀采用双抗体夹心法测定血清PCSK9水平,按照酶联免疫吸附试验(ELISA)试剂盒(上海酶联生物科技有限公司)说明书进行操作㊂1.4.2㊀血小板活化指标检测㊀采用流式细胞术检测血浆中血小板CD62P与CD63双阳性表达的百分比㊂主要试剂:(1)美国BD公司生产的Monoclonal Antibody CD62P-FITC单克隆抗体;(2)美国BD公司生产的Monoclonal Antibody CD63-FITC 单克隆抗体;(3)PBS液等㊂流式细胞仪:美国BD 公司,型号:FACSCantoⅡ,Flowjo软件㊂检测步骤:CD62P的阳性表达率测定:(1)以Flowcheck荧光微球检查仪器光路㊁流路,调整颜色补偿,该项工作由流式细胞实验室专业人员协助完成;(2)从-20ħ冰箱中取出富含血小板血浆的待测液,使用微量加样枪各取5μl;(3)取上样管两支,分别使用微量加样枪加入20μl CD62P-FITC单克隆抗体和20μl IgG1-FITC,并标记;(4)室温下避光反应20min;(5)然后各加入PBS液4ml;(6)反应后立即上机进行检测;(7)选择波长为488nm的氩离子激光门,通过前向散射光(FSC)和侧向散射光(SSC)区分血小板群;(8)设置血小板门,将血小板群与其他颗粒及细胞区分,流速控制在100~200个/s;(9)每份标本检测10000个血小板,以同型对照阳性率大于0%,小于2%为界,设定阳性细胞门,计算荧光标记阳性血小板百分比,CD62P的表达率以阳性血小板所占全部检测血小板的百分比表示㊂操作过程严格按照试剂盒所标记的注意事项,以避免血小板激活,确保检验数据准确,检查及调整仪器等在试验各步骤之间等待的时间间隙顺利完成㊂CD63的阳性表达率测定:CD63阳性表达率使用CD63-FITC单克隆抗体,其具体操作步骤及注意事项参照上述CD62P的阳性表达率测定㊂1.5㊀终点事件评价本研究中主要不良心血管事件包括严重心脏事件和出血事件㊂严重心脏事件定义为冠心病相关死亡㊁非致死性心肌梗死㊁因心绞痛再入院㊂出血事件以2011年出血学术研究联合会(BARC)制定的出血分类标准定义[14],记录BARC出血1~2型㊁3或5型情况㊂1.6㊀随访于入组后第1㊁3㊁6㊁12和24个月分别进行随访,采取门诊复诊或电话随访方式,详细记录主要不良心血管事件发生情况,并于第1㊁6和12个月检测患者N末端B型利钠肽原㊁心电图和超声心动图㊂1.7㊀统计学方法采用SPSS23.0统计软件进行分析㊂符合正态分布的计量资料以 xʃs表示,组间比较首先采用单因素方差分析,然后采用独立样本t检验和配对t检验;非正态分布的计量资料以M(Q1,Q3)表示,组间比较采用秩和检验;计数资料用百分构成比表示,组间比较采用χ2检验㊂影响因素分析采用多因素logistic回归;Cox生存分析和统计图表采用GraphPad Prism8.0完成制作㊂P<0.05为差异有统计学意义㊂2㊀结果2.1㊀一般资料两组患者的基线临床特征㊁血清PCSK9水平和血小板活化情况比较,差异均无统计学意义(均为P>0.05),见表1㊂表1㊀两组基线资料比较项目依洛尤单抗组(45例)对照组(44例)t/χ2/Z值P值年龄( xʃs,岁)64.0ʃ9.463.3ʃ9.90.3320.741男性[例(%)]37(82.2)30(68.2) 2.3570.125高血压[例(%)]25(55.6)21(47.7)0.5460.460糖尿病[例(%)]12(26.7)16(36.4)0.9700.325吸烟史[例(%)]13(28.9)18(40.9) 1.4160.234卒中史[例(%)]9(20.0)10(22.7)0.0990.754 STEMI[例(%)]29(64.4)33(75.0) 1.1730.279急诊再灌注[例(%)]29(64.4)29(65.9)0.0210.885 PCSK9( xʃs,ng/ml)597.48ʃ47.41582.87ʃ58.88 1.2770.205hs-CRP( xʃs,mg/L)30.85ʃ9.4829.74ʃ7.230.6160.539 TC( xʃs,mmol/L) 4.89ʃ1.06 4.46ʃ1.13 1.7600.082 LDL-C( xʃs,mmol/L) 3.15ʃ0.89 2.82ʃ0.87 1.7560.083 LVEF( xʃs,%)54.76ʃ5.6055.20ʃ4.460.4070.685 CD62P与CD63双标阳性[M(Q1,Q3)] 1.03(0.31,2.51) 1.02(0.42,1.56)-1.0920.275㊀㊀注:STEMI:ST段抬高型心肌梗死;PCSK9:前蛋白转化酶枯草溶菌素9;hs-CRP:高敏C反应蛋白;TC:总胆固醇;LDL-C:低密度脂蛋白胆固醇;LVEF:左心室射血分数2.2㊀PCSK9水平的影响因素纳入年龄㊁性别㊁高血压㊁糖尿病㊁卒中史㊁吸烟㊁梗死类型(前壁㊁下壁及非ST 段抬高型心肌梗死)㊁血小板活化指标㊁高敏C 反应蛋白㊁N 末端B 型利钠肽原和左心室射血分数建立多因素回归方程㊂结果发现,性别(B =285.894,t =2.093,P =0.040)和高敏C 反应蛋白(B =-19.533,t =-2.356,P =0.021)对血清PCSK9水平的影响有统计学意义;血小板活化指标与血清PCSK9水平无相关性(B =-40.756,t =-1.148,P =0.255)㊂2.3㊀依洛尤单抗对PCSK9水平和血小板活化的影响依洛尤单抗组的血小板活化指标在干预前后存在统计学差异(Z =4.977,P <0.01),对照组则无统计学差异(Z =1.471,P =0.141),见图1㊁表2㊂依洛尤单抗组明显抑制了PCSK9水平,而对照组PCSK9水平无明显变化,见表3㊂图1㊀两组干预前后血小板活化流式图2.4㊀依洛尤单抗对急性心肌梗死患者预后的影响本研究随访截止时间为2022年2月28日,中位随访时间为17.6个月,最短11.1个月,最长26.9个月㊂依洛尤单抗组:因心绞痛就诊或再入院2例,其中1例行再灌注治疗;2例发生脑出血,其中1例于1个月时死亡;1例因急性心力衰竭住院期间死亡㊂对照组因心绞痛就诊或再入院8例,其中3例行再灌注治疗㊂两组因心绞痛就诊或再入院发生率比较,差异有统计学意义(χ2=4.21,P =0.04)㊂2.5㊀出血事件比较及影响因素两组BARC1或2型出血发生率比较,差异无统计学意义[17.8%(8/45)比9.1%(4/44),χ2=1.439,P =0.230];BARC3或5型出血情况:依洛尤单抗组发生2例颅内出血(其中1例死亡),对照组发生1例消化道出血,两组发生率比较差异无统计学意义(Fisher 精确检验,P =0.509)㊂经过二元logistic 回归分析,纳入入院时血小板活性指标和血清PCSK9水平两个因素,结果提示血清PCSK9水平是出血的独立风险因素(B =-0.36,t =15.405,P <0.01),见图2㊂3㊀讨论PCSK9i 显著降低动脉粥样硬化性心血管疾病患者低密度脂蛋白胆固醇水平和心血管事件发生风险的作用,已在大规模临床试验如依洛尤单抗的FOURIER 等研究中得到明确证实[15-16]㊂此外,一系列人类临床试验也证实了PCSK9对止血系统的影响:前瞻性PCSK9-REACT 研究显示,在接受PCI 和P2Y 12抑制剂的近期急性冠状动脉综合征患者中,血浆PCSK9水平与治疗期间高血小板反应性直接相关,提示PCSK9可能增强血小板活化[17]㊂急性心肌梗死患者在急诊PCI 治疗后,严重影响预后的是急性冠状动脉内血栓事件,而急性期机体的应激炎症状态促使血小板处于活化状态,这就增加了血栓事件的发生风险㊂本研究基于既往的基础研究发现,观察PCSK9i 对急性心肌梗死患者血小板活化表2㊀干预前后血小板活化指标变化情况[M(Q 1,Q 3)]组别例数CD62P 与CD63双标阳性干预前干预后Z 值P 值依洛尤单抗组45 1.04(0.32,2.58)0.19(0.09,0.61) 4.9770.000对照组441.02(0.42,1.56)0.93(0.42,1.53)1.4710.141表3㊀干预前后血清PCSK9水平变化情况(x ʃs ,ng /ml)组别例数PCSK9干预前干预后t 值P 值依洛尤单抗组45597.48ʃ47.41453.05ʃ52.4425.6820.000对照组44582.87ʃ58.88588.71ʃ55.051.5890.118A:血小板活化指标联合PCSK9水平对出血事件的预测价值ROC 曲线,显示预测率86.56%;B:PCSK9与出血事件的概率图,显示PCSK9水平越高,出血风险越低;C:血小板活化指标与出血事件的概率图,显示血小板活化指标越高,出血风险越高图2㊀出血事件的影响因素分析状态的影响,并对非计划性血运重建等心脏事件进行了分析,结果显示,基于抑制血小板活化,PCSK9i (依洛尤单抗)能降低上述心脏事件的发生风险㊂静止状态的血小板内分布着多种颗粒,如a颗粒㊁溶酶体颗粒等㊂这些颗粒表面存在着一些特定蛋白,如a颗粒表面有CD62P抗原,溶酶体颗粒表面有CD63抗原㊂血小板活化时,由于颗粒膜蛋白与血小板膜蛋白相互融合,使颗粒膜蛋白翻转到血小板膜表面㊂因此,可通过检测这些颗粒膜蛋白来判断血小板的活化状态[18]㊂本研究采用流式细胞检测的方法,检测CD63和CD62P双标阳性的血小板,来定义活化的血小板㊂结果显示,应用依洛尤单抗治疗能够较非干预组明显抑制血小板活化㊂Di Minno等[19]采用一种结合代谢组学和脂质组学的方法发现,应用PCSK9i治疗家族性高胆固醇血症患者可降低血小板活化因子及其前体的血浆水平㊂体外研究证实了CD36和Nox2激活介导的活性氧通路是PCSK9诱导血小板活化的潜在机制[20]㊂PCSK9i对血小板活性的影响凸显了PCSK9与人类血小板功能调节之间的相互作用㊂PCSK9i可降低氧化应激,调节ox-LDL途径和抑制Nox2激活,阻断花生四烯酸信号转导,并抑制健康人的血小板活化[21-22]㊂Barale等[23]研究证实,PCSK9i给药6个月后血小板活化降低,并发现23例杂合型家族性高胆固醇血症患者在PCSK9i治疗后血小板活化标志物(如CD62P表达㊁血浆可溶性CD40L㊁血小板因子4和可溶性P选择素)水平降低,这些标志物与血清PCSK9之间存在相关性㊂汇总既往研究和本研究结果提示,PCSK9i在与低密度脂蛋白受体结合的同时,也可能与血小板表面的相关受体结合,从而抑制血小板的活化㊂近年来,PCSK9已被证实与动脉粥样硬化疾病进展过程中的血小板活化有关㊂这些研究的开展源于一个横断面调查,该研究从330例稳定型冠状动脉疾病患者中发现血浆PCSK9水平与血小板计数之间存在明确且独立的相关性[24]㊂Pastori等[25]研究发现,在心血管高危患者中,PCSK9升高与11-脱氢血栓素B2尿排泄量增加密切相关,11-脱氢血栓素B2是血栓素A2的一种稳定代谢物,提示PCSK9可能在调节血小板活化方面发挥作用㊂Camera等[8]的实验研究进一步印证了这些临床研究结果,他们利用动物模型研究PCSK9对血小板活化㊁聚集和血栓形成的影响,结果表明PCSK9基因的缺失降低了小鼠的血小板功能和动脉血栓的生成和稳定性㊂本研究通过多因素线性回归分析,未能证实急性心肌梗死患者体内血清PCSK9水平与血小板活化指标相关,与既往研究结果不同,分析原因可能是选取的标记物不同和未入选健康者作对照㊂抑制血小板活化,减少血栓事件发生,势必减少了非计划再次血运重建的风险㊂但减少血小板活化,可能增加出血风险㊂相关研究发现,心绞痛患者血清PCSK9水平与活化部分凝血活酶时间和凝血酶原时间呈负相关[26],所以应用PCSK9i后降低血清PCSK9水平,可能延长活化部分凝血活酶时间和凝血酶原时间,势必增加出血风险㊂另一项长达两年的随访研究发现,凝血酶原时间延长为急性心肌梗死患者全因死亡的独立危险因素[27]㊂本研究结果显示,两组小出血事件发生率无统计学差异,但依洛尤单抗组发生了2例危及生命的颅内出血,对照组仅发生了1例消化道出血,所以出血风险需要进一步关注㊂总之,应用PCSK9i可能抑制血小板活化,减少心血管事件风险,而是否增加出血风险尚需扩大样本量和延长观察时间㊂本研究显示PCSK9i(依洛尤单抗)有抑制血小板活化,从而减少心血管事件发生的趋势,如果增加样本量和应用干预药物疗程,可能效果会更明显㊂增加分子生物学机制进一步深究PCSK9i抑制血小板活化的机制是本研究进一步深入的方向㊂尽管本研究为PCSK9i提供了一种新的降胆固醇治疗作用外的多效性探索模式,为各类高危心血管患者的治疗提供了新的方向,然而此类药物确切的疗效与安全性仍有待更多的临床研究论证[28]㊂后期研究还应增加更多安全性指标的监测,如药物依赖性和相关抗体的产生等,也是本研究的不足之处㊂利益冲突:无参㊀考㊀文㊀献[1]Kennon S,Price CP,Mills PG,et al.The central role of plateletactivation in determining the severity of acute coronary syndromes[J].Heart,2003,89(10):1253-1254.DOI:10.1136/heart.89.10.1253.[2]Kamińska J,Koper OM,Siedlecka-Czykier E,et al.The utilityof inflammation and platelet biomarkers in patients with acutecoronary syndromes[J].Saudi J Biol Sci,2018,25(7):1263-1271.DOI:10.1016/j.sjbs.2016.10.015.[3]Theofilis P,Sagris M,Oikonomou E,et al.Factors Associatedwith Platelet Activation-Recent Pharmaceutical Approaches[J].Int J Mol Sci,2022,23(6):3301.DOI:10.3390/ijms23063301.[4]Liu R,Li T,Yuan D,et al.Long-term effects of baseline on-treatment platelet reactivity in patients with acute coronarysyndrome and thrombocytopenia undergoing percutaneouscoronary intervention[J].J Int Med Res,2022,50(4):3000605221081725.DOI:10.1177/03000605221081725.[5]Song NP,Zhen XW,Li LD,et al.Plasma calprotectin wasassociated with platelet activation and no-reflow phenomenon inacute coronary syndrome[J].BMC Cardiovasc Disord,2020,20(1):443.DOI:10.1186/s12872-020-01717-5. [6]李乐,孙福成.前蛋白转化酶枯草溶菌素9抑制剂对血脂代谢作用的研究进展[J].中国心血管杂志,2021,26(1):78-81.DOI:10.3969/j.issn.1007-5410.2021.01.020.㊀Li L,Sum FC.Research progress on the effect of proproteinconvertase subtilisin/kexin type9inhibitors on lipid metabolism[J].Chin J Cardiovasc Med,2021,26(1):78-81.DOI:10.3969/j.issn.1007-5410.2021.01.020.[7]Cannon CP,Cariou B,Blom D,et al.Efficacy and safety ofalirocumab in high cardiovascular risk patients with inadequatelycontrolled hypercholesterolaemia on maximally tolerated doses ofstatins:the ODYSSEY COMBOⅡrandomized controlled trial[J].Eur Heart J,2015,36(19):1186-1194.DOI:10.1093/eurheartj/ehv028.[8]Camera M,Rossetti L,Barbieri SS,et al.PCSK9as a PositiveModulator of Platelet Activation[J].J Am Coll Cardiol,2018,71(8):952-954.DOI:10.1016/j.jacc.2017.11.069. [9]Hachem A,Hariri E,Saoud P,et al.The Role of ProproteinConvertase Subtilisin/Kexin Type9(PCSK9)in CardiovascularHomeostasis:A Non-Systematic Literature Review[J].CurrCardiol Rev,2017,13(4):274-282.DOI:10.2174/1573403X13666170804150954.[10]Song L,Zhao X,Chen R,et al.Association of PCSK9withinflammation and platelet activation markers and recurrentcardiovascular risks in STEMI patients undergoing primary PCIwith or without diabetes[J].Cardiovasc Diabetol,2022,21(1):80.DOI:10.1186/s12933-022-01519-3. [11]Momtazi-Borojeni AA,Sabouri-Rad S,Gotto AM,et al.PCSK9and inflammation:a review of experimental and clinical evidence[J].Eur Heart J Cardiovasc Pharmacother,2019,5(4):237-245.DOI:10.1093/ehjcvp/pvz022.[12]中华医学会心血管病学分会,中华心血管病杂志编辑委员会.非ST段抬高型急性冠状动脉综合征诊断和治疗指南(2016)[J].中华心血管病杂志,2017,45(5):359-376.DOI:10.3760/cma.j.issn.0253-3758.2017.05.003.㊀Chinese Society of Cardiology of Chinese Medical Association,Editorial Board of Chinese Journal of Cardiology.Guideline andconsensus for the management of patients with non-ST-elevationacute coronary syndrome(2016)[J].Chin J Cardiol,2017,45(5):359-376.DOI:10.3760/cma.j.issn.0253-3758.2017.05.003.[13]中华医学会心血管病学分会,中华心血管病杂志编辑委员会.急性ST段抬高型心肌梗死诊断和治疗指南(2019)[J].中华心血管病杂志,2019,47(10):766-783.DOI:10.3760/cma.j.issn.0253-3758.2019.10.003.㊀Chinese Society of Cardiology of Chinese Medical Association,Editorial Board of Chinese Journal of Cardiology.2019ChineseSociety of Cardiology(CSC)guidelines for the diagnosis andmanagement of patients with ST-segment elevation myocardialinfarction[J].Chin J Cardiol,2019,47(10):766-783.DOI:10.3760/cma.j.issn.0253-3758.2019.10.003. [14]Mehran R,Rao SV,Bhatt DL,et al.Standardized bleedingdefinitions for cardiovascular clinical trials:a consensus reportfrom the Bleeding Academic Research Consortium[J].Circulation,2011,123(23):2736-2747.DOI:10.1161/CIRCULATIONAHA.110.009449.[15]Sabatine MS,Giugliano RP,Keech AC,et al;FOURIERSteering Committee and Investigators.Evolocumab and clinicaloutcomes in patients with cardiovascular disease[J].N Engl JMed,2017,376(18):1713-1722.DOI:10.1056/NEJMoa1615664.[16]Schwartz GG,Steg PG,Szarek M,et al.Alirocumab andCardiovascular Outcomes after Acute Coronary Syndrome[J].NEngl J Med,2018,379(22):2097-2107.DOI:10.1056/NEJMoa1801174.[17]Navarese EP,Kolodziejczak M,Winter MP,et al.Association ofPCSK9with platelet reactivity in patients with acute coronarysyndrome treated with prasugrel or ticagrelor:The PCSK9-REACT study[J].Int J Cardiol,2017,227:644-649.DOI:10.1016/j.ijcard.2016.10.084.[18]Lee J,Jung CW,Jeon Y,et al.Effects of preoperative aspirinon perioperative platelet activation and dysfunction in patientsundergoing off-pump coronary artery bypass graft surgery:Aprospective randomized study[J].PLoS One,2017,12(7):e0180466.DOI:10.1371/journal.pone.0180466. [19]Di Minno A,Orsini RC,Chiesa M,et al.Treatment withPCSK9Inhibitors in Patients with Familial HypercholesterolemiaLowers Plasma Levels of Platelet-Activating Factor and ItsPrecursors:A Combined Metabolomic and Lipidomic Approach[J].Biomedicines,2021,9(8):1073.DOI:10.3390/biomedicines9081073.[20]Cammisotto V,Pastori D,Nocella C,et al.PCSK9RegulatesNox2-Mediated Platelet Activation via CD36Receptor in Patientswith Atrial Fibrillation[J].Antioxidants(Basel),2020,9(4):296.DOI:10.3390/antiox9040296.[21]Cammisotto V,Baratta F,Castellani V,et al.ProproteinConvertase Subtilisin Kexin Type9Inhibitors Reduce PlateletActivation Modulating ox-LDL Pathways[J].Int J Mol Sci,2021,22(13):7193.DOI:10.3390/ijms22137193. [22]Barale C,Bonomo K,Frascaroli C,et al.Platelet function andactivation markers in primary hypercholesterolemia treated withanti-PCSK9monoclonal antibody:A12-month follow-up[J].Nutr Metab Cardiovasc Dis,2020,30(2):282-291.DOI:10.1016/j.numecd.2019.09.012.[23]Barale C,Melchionda E,Morotti A,et al.PCSK9Biology andIts Role in Atherothrombosis[J].Int J Mol Sci,2021,22(11):5880.DOI:10.3390/ijms22115880.[24]Li S,Zhu CG,Guo YL,et al.The relationship between theplasma PCSK9levels and platelet indices in patients with stablecoronary artery disease[J].J Atheroscler Thromb,2015,22(1):76-84.DOI:10.5551/jat.25841.[25]Pastori D,Nocella C,Farcomeni A,et al.Relationship ofPCSK9and Urinary Thromboxane Excretion to CardiovascularEvents in Patients with Atrial Fibrillation[J].J Am CollCardiol,2017,70(12):1455-1462.DOI:10.1016/j.jacc.2017.07.743.[26]Peng J,Liu MM,Liu HH,et al.Association of circulatingproprotein convertase subtilisin/kexin type9concentration,prothrombin time and cardiovascular outcomes:a prospectivecohort study[J].Thromb J,2021,19(1):90.DOI:10.1186/s12959-021-00344-0.[27]Wang X,Chen R,Li Y,et al.Predictive value of prothrombintime for all cause mortality in acute myocardial infarction patients[J].Annu Int Conf IEEE Eng Med Biol Soc,2018:5366-5369.DOI:10.1109/EMBC.2018.8513654.[28]张国瑞,张静,王立君,等.新型降胆固醇药物前蛋白转化酶枯草溶菌素9抑制剂的研究进展[J].中国心血管杂志,2018,23(1):92-95.DOI:10.3969/j.issn.1007-5410.2018.01.021.㊀Zhang GR,Zhang J,Wang LJ,et al.Research progress of thenew cholesterol-lowering drugs:proprotein convertase subtilisin/kexin type9inhibitors[J].Chin J Cardiovasc Med,2018,23(1):92-95.DOI:10.3969/j.issn.1007-5410.2018.01.021.(收稿日期:2022-04-30)(本文编辑:谭潇)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
阿司匹林抵抗定义
应用阿司匹林作为心脑血管疾病的二级预防,阿
司匹林未完全预防栓塞及其它缺血事件 服用阿司匹林患者体外试验血小板聚集功能未受 到抑制或出血时间未延长
Gum PA, et al. J Am Coll Cardiol 2003; 41:961-965
复方丹参滴丸?
复方丹参滴丸抗血小板活化临床研究
AR+ASR 显效 有效 有效率
(例)
107
48 25(27.1%) 68.2% (41.1%)
合用组 血小板最大聚集率前后比较
治疗前 69.5±22.8 治疗2周后 27.8±26.7
(Patrono C,et al.Chest ,1998,114:470-488.)
•
ASA Resistance and Clinical Outcome in CVD Patients
326 CVD patients on ASA 325 mg > 7 days
p=0.03
ASA-R: mean aggregation ≥70% with 10 µM ADP & ≥20% with 0.5 mg/ml AA
注:降低幅度=(用药前值-用药后值)/用药前值
复方丹参滴丸明显降低UA患者血浆 GMP-140含量
70 60 50 40 30 20 10 0 治疗前 治疗后
常规治疗 复方丹参滴丸
﹡
﹡﹡ ﹟
与治疗前比较* P<0.05 ,** P<0.01 ,组间比较﹟P<0.05。 GMP-140:α-颗粒膜蛋白
血小板活化
• 在正常血循环中血小板 处于无活性状态,当血管 内皮损伤等凝血因素启动 后,血小板被激活。
血小板活化包括血小板
粘附、聚集和释放三个 过程。
过去判断活化程度通过
测定血小板的释放产物 花生四烯酸代谢产物含 量
可受多种因素影响。
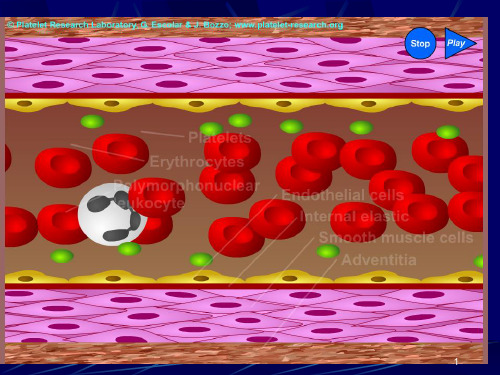
静止(兰色)和激活的血小板(绿色)
其它抗血小板药物作用机理
血小板的功能
血小板的功能主要是促进止血和加速凝血, 同时血小板还有维护毛细血管壁完整性的功能。 血小板在止血和凝血程中,具有形成血栓,堵 塞创口,释放与凝血有关的各种因子等功能。 血小板的平均寿命为7—9天,衰老死亡的血 小板通过血流最终在脾脏被吞噬处理。
血小板聚集和活化
正常血小板 血小板聚集
血小板活化形成血栓
中国心血管杂志2003年10月第8卷 第5期
复方丹参滴丸抗血小板作用机理
既往的临床与基础研究表明
复方丹参滴丸能显著抑制血小板聚集
对红细胞行为有较强的干预作用
丹参多酚酸可对抗ADP诱导的血小板聚集
和抑制血栓形成
推测复方丹参滴丸抗血小板聚集、阻断 血栓素合成的机制可能与阿司匹林不同
经配对t检验:p<0.01
加用复方丹参滴丸 血小板最大聚集率平均降幅为51.57%,总有 效率达85%
注:降低幅度=(用药前值-用药后值)/用药前值
单用组 血小板最大聚集率前后比较
治疗前 治疗2周后
80.4±12.1
62.8±38.2
经配对t检验:p<0.05
单用复方丹参滴丸 血小板最大聚集率平均降幅为18.75%,总有 效率达49%
