2019届高考化学一轮提分练:考点14-氧化还原反应的计算 Word版含答案
2019版高考一轮复习(江苏专用):专题1第3讲氧化还原反应

第3讲 氧化还原反应【2019·备考】【2019·备考】最新考纲:最新考纲:1.1.1.理解氧化还原反应的本质。
理解氧化还原反应的本质。
理解氧化还原反应的本质。
2.2.2.了解氧化还原反应在生产、生活中的应用。
了解氧化还原反应在生产、生活中的应用。
了解氧化还原反应在生产、生活中的应用。
最新考情:氧化还原反应考查一是在选择题某选项中出现,主要考查电子转移数目、氧化还原反应基本概念,如2017年12D 12D、、2015年3A 3A,,4C 4C,,11A 11A、、2014年6D 等;二是填空题某空中出现,主要考查电子守恒的应用,如2015年18题、题、20142014年20题;三是考查新情境下氧化还原反应型离子方程式的书写,涉及氧化还原反应方程式配平、氧化还原产物的判断,这是高考命题的重点,每年均有考查。
考点一 氧化还原反应的相关概念及表示方法[知识梳理知识梳理] ]1.1.氧化还原反应的本质和特征氧化还原反应的本质和特征氧化还原反应的本质和特征2.2.相关概念及其关系相关概念及其关系相关概念及其关系实例:实例:反应4HCl(4HCl(浓浓)+MnO 2=====△MnCl 2+Cl 2↑+↑+2H 2H 2O 中,氧化剂是MnO 2,氧化产物是Cl 2,还原剂是HCl HCl,还原产,还原产物是MnCl 2;生成1 mol Cl 2时转移电子的物质的量为2__mol 2__mol,被氧化的,被氧化的HCl 的物质的量是2__mol 2__mol。
提醒:氧化还原反应概念间的关系:熟记六个字:“升、失、氧;降、得、还”提醒:氧化还原反应概念间的关系:熟记六个字:“升、失、氧;降、得、还”[[元素化合价升高元素化合价升高((降低降低))、失(得)电子,发生氧化电子,发生氧化((还原还原))反应反应]]。
3.3.氧化还原反应中电子转移的表示方法氧化还原反应中电子转移的表示方法氧化还原反应中电子转移的表示方法 (1)(1)双线桥法双线桥法双线桥法实例:实例:请标出Cu 与稀硝酸反应中电子转移的方向和数目:与稀硝酸反应中电子转移的方向和数目:(2)(2)单线桥法单线桥法单线桥法实例:实例:请标出Cu 与稀硝酸反应中电子转移的方向和数目:与稀硝酸反应中电子转移的方向和数目:4.4.氧化还原反应与四种基本反应类型间的关系氧化还原反应与四种基本反应类型间的关系氧化还原反应与四种基本反应类型间的关系提醒:①一定属于氧化还原反应的是置换反应。
2019高考化学一轮复习 第4讲 氧化还原反应讲练结合学案

第4讲氧化还原反应★★分析解读氧化还原反应基本概念、氧化还原反应离子方程式的书写、氧化还原反应的相关计算是每年高考必考考点。
本专题考点通常是结合基本理论、元素化合物、化学实验及工艺流程以非选择题中的某些设问进行考查。
对本专题备考应予以足够重视。
命题分析2(4)(OH)2O(OH)气体溶解度随温度升高而降低2好教育云平台——教育因你我而变2017年高考“最后三十天”专题透析mol,中含氧量为高考真题考点一 氧化还原反应的基本概念1.(2017天津理综,3,6分)下列能量转化过程与氧化还原反应无关的是( ) A.硅太阳能电池工作时,光能转化成电能 B.锂离子电池放电时,化学能转化成电能 C.电解质溶液导电时,电能转化成化学能D.葡萄糖为人类生命活动提供能量时,化学能转化成热能 答案 A2.(2015四川理综,1,6分)下列物质在生活中应用时,起还原作用的是( ) A.明矾作净水剂 B.甘油作护肤保湿剂C.漂粉精作消毒剂D.铁粉作食品袋内的脱氧剂 答案 D3.(20142CH 2+HClCH - 2Cl 2+ Zn 4NaOH+O HCl+HClO答案 B4.(2016天津理综,9,18分)水中溶氧量(DO)是衡量水体自净能力的一个指标,通常用每升水中溶解氧分子的质量表示,单位mg·L -1。
我国《地表水环境质量标准》规定,生活饮用水源的DO 不能低于5 mg·L -1。
某化学小组同学设计了下列装置(夹持装置略),测定某河水的DO 。
Ⅰ.测定原理:碱性条件下,O 2将Mn 2+氧化为MnO(OH)2:①2Mn 2++O 2+4OH- 2MnO(OH)2↓酸性条件下,MnO(OH)2将I -氧化为I 2:②MnO(OH)2+I -+H +Mn 2++I 2+H 2O(未配平) 用Na 2S 2O 3标准溶液滴定生成的I 2:③2S 2+I 2 S 4+2I -Ⅱ.测定步骤:a.安装装置,检验气密性,充N2排尽空气后,停止充N2。
2019年高考化学一轮复习 专题 氧化还原反应的配平每日一题

氧化还原反应的配平高考频度:★★★☆☆难易程度:★★☆☆☆(1)请将下列五种物质:KBr、Br2、I2、KI、K2SO4分别填入下列横线上,组成一个未配平的化学方程式:KBrO3+ +H2SO4→ + + + +H2O。
(2)如果该化学方程式中I2和KBr的化学计量数分别是8和1,则:①Br2的化学计量数是;②请将反应物的化学式及配平后的化学计量数填入下列相应的位置中:KBrO3+ +H2SO4→……;③若转移10 mol电子,则反应后生成I2的物质的量为。
【参考答案】(1)KI I2 Br2 K2SO4 KBr(四种产物顺序可变)(2)①1 ②3 16 KI 9 ③5 mol氧化还原反应配平的特殊技巧(1)从右向左配平法适用范围:此法最适用于某些物质(如硝酸、浓硫酸的反应)部分参加氧化还原反应的类型。
例如:Cu + HNO3(浓)— Cu(NO3)2 + NO2 + H2O分析:由于HNO3在反应中有两个作用即酸性和氧化性,因此如按照一般的方法从左向右配的话比较麻烦,但如采用从右向左配平法的方法,这个问题显得很简单。
(2)整体总价法(零价法)适用范围:在氧化还原反应中,一种反应物中有两种或两种以上的元素化合价发生变化,或几种不同物质中的元素化合价经变化后同存在于一种产物中,把该物质当成一个“整体”来考虑,可令该物质中各元素的化合价均为零,然后计算出各元素化合价的升降值,利用化合价升降相等进行配平。
例如:FeS2 + O2 — Fe2O3 + SO2分析:在FeS2中Fe的化合价由+2变到+3,S的化合价由−1变到+4,即同一种物质中有两种元素的化合价同时在改变,我们可以用整体总价法,把FeS2当成一个“整体”来考虑。
(3)歧化归一法适用范围:同种元素之间的歧化反应或归一反应。
技巧:第三种价态元素之前的系数等于另两种元素价态的差值与该价态原子数目的比值。
例如:Cl2 + KOH — KCl + KClO3 + H2O分析:该反应中,电子转移只发生在氯元素之间,属于歧化反应。
2025年高考化学一轮复习专题知识点归纳及训练—氧化还原反应(解析版)
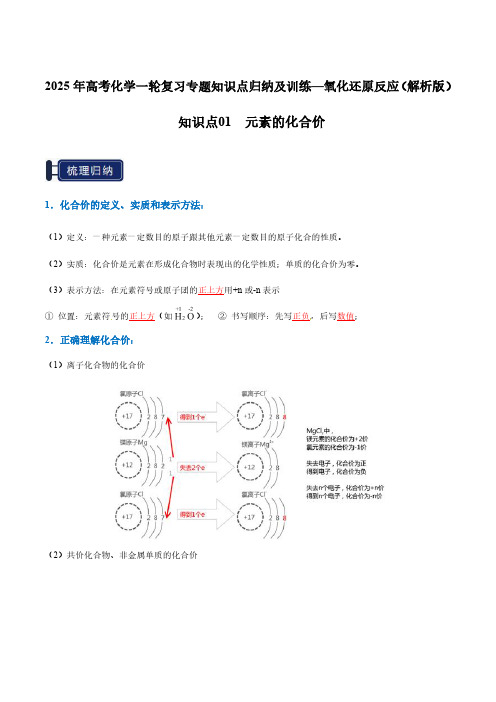
2025年高考化学一轮复习专题知识点归纳及训练—氧化还原反应(解析版)知识点01元素的化合价1.化合价的定义、实质和表示方法:(1)定义:一种元素一定数目的原子跟其他元素一定数目的原子化合的性质。
(2)实质:化合价是元素在形成化合物时表现出的化学性质;单质的化合价为零。
(3)表示方法:在元素符号或原子团的正上方用+n或-n表示①位置:元素符号的正上方(如);②书写顺序:先写正负,后写数值;2.正确理解化合价:(1)离子化合物的化合价(2)共价化合物、非金属单质的化合价3.化合价的数值及正负判定4.元素化合价的规律(1)化合价原则:①化合物中,正负化合价的代数和=0②离子中,正负化合价的代数和=电荷③在化合物里,氢通常显+1价,氧通常显-2价;④金属元素通常显正价,非金属元素通常显负价,但在非金属氧化物里,氧显负价,另一非金属元素显正价;⑤单质中元素的化合价规定为零;⑥许多元素具有可变化合价,如:硫、碳等;⑦“根”的化合价一定不为零。
(2)常用等量关系①主族元素最高正价=主族序数=原子的最外层电子数②主族元素的最高正价+|最低负价|=8或2③最高正化合价与其最低负化合价代数和a.等于0的短周期元素:H、C、Sib.等于2的短周期元素:N、Pc.等于4的短周期元素:Sd.等于6的短周期元素:Cl(3)化合价的范围:+1≤最高价≤+7,-4≤最低价≤-15.化合价的特殊点(1)F元素没有正化合价,金属元素没有负化合价(2)O元素有正化合价,但是没有其所在族的最高正化合价(3)硼元素只有+3价(4)氢元素的化合价①金属氢化物中,氢显-1价,如NaH、NaAlH4、②非金属氢化物中,氢一般显+1价,如NH3、CH4、B2H6(5)氧元素的化合价①普通的含氧微粒中,氧显-2价②含O22―或―O―O―的微粒中,氧显-1价③在S2O82―()中,过氧键中的两个O显-1价,其余的O显-2价。
④在CrO5中,两个过氧键中的4个O显-1价,其余的O显-2价。
2019年高考化学一轮复习 专题 利用得失电子守恒巧解氧化还原反应计算题每日一题

利用得失电子守恒巧解氧化还原反应计算题高考频度:★★★★★难易程度:★★★☆☆向27.2 g Cu和Cu2O的混合物中加入某浓度的稀硝酸0.5 L,固体物质完全反应,生成NO 和Cu(NO3)2。
在所得溶液中加入1.0 mol·L-1的NaOH溶液1.0 L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为39.2 g。
下列有关说法不正确的是A.Cu与Cu2O的物质的量之比为2∶1B.硝酸的物质的量浓度为2.6 mol·L-1C.产生的NO在标准状况下的体积为4.48 LD.Cu、Cu2O与硝酸反应后剩余HNO3为0.2 mol【参考答案】B(1)在氧化还原反应(包括电化学)的有关计算中,易忽视氧化还原反应的先后顺序,不能根据氧化还原反应的“先后规律”分析问题。
当同一体系中,有多个氧化还原反应发生时,要注意反应的先后顺序,必须遵循强者优先的原则。
(2)不能准确而迅速地再现、提取和运用氧化与还原、氧化剂与还原剂、氧化产物与还原产物等一系列对立统一的概念。
(3)对潜在的氧化还原反应的忽视,如:在酸性环境中能表现强氧化性(中性、碱性环境中则无强氧化性)。
1.羟氨(NH2OH)是一种还原剂。
将25.00 mL 0.049 mol/L的羟氨酸性溶液与足量硫酸铁在煮沸条件下反应,生成的Fe2+又恰好被24.50 mL 0.020 mol/L的酸性KMnO4溶液所氧化。
在上述反应中,羟氨的氧化产物为A.NO2 B.NO C.N2O D.N22.FeS与一定浓度的HNO3反应,生成Fe(NO3)3、Fe2(SO4)3、NO2、N2O4、NO和H2O,当NO2、N2O4、NO的物质的量之比为1∶1∶1时,实际参加反应的FeS与HNO3的物质的量之比为A.1∶6 B.1∶7 C.2∶11 D.16∶253.向含a mol NaClO的溶液通入b mol SO2充分反应(不考虑二氧化硫与水之间的反应以及次氯酸的分解)。
(优化练习)2019年高考化学一轮复习:第二章 第8讲 氧化还原反应的基本概念 Word版含解析

(优化练习)2019年人教版高考化学一轮复习课时作业1.化学与生活密切相关,下列应用中利用了物质的氧化性的是( )A .SO 2漂白纸浆B .纯碱清洗油污C .Na 2S 除污水中的Cu 2+D .漂白粉漂白织物解析:SO 2漂白纸浆利用了二氧化硫的漂白性,A 错误;纯碱清洗油污,利用了纯碱溶液显碱性,碱性条件下油脂能水解彻底,B 错误;Na 2S 除污水中的Cu 2+发生的是复分解反应,利用的是CuS 的难溶性,C 错误;漂白粉漂白织物是利用的漂白粉的氧化性将有色物质氧化褪色,D 正确。
答案:D2.(2017·浙江瑞安四校联考)下列变化过程不涉及氧化还原反应的是( )A .将一小块钠放在石棉网上加热,生成淡黄色物质B .向新制氯水中加入足量亚硫酸钠溶液,氯水褪色C .向纯碱溶液中滴加酚酞,溶液变红色D .向氢碘酸中滴加FeCl 3溶液,产生棕色物质解析:将一小块钠放在石棉网上加热,生成的淡黄色物质为过氧化钠,反应过程中Na 、O 元素化合价发生变化,属于氧化还原反应,故A 错误;向新制氯水中加入足量亚硫酸钠溶液,氯气将SO 2-3氧化成SO 2-4,Cl 、S 元素化合价发生变化,属于氧化还原反应,故B 错误;向纯碱溶液中滴加酚酞,溶液变红色,说明CO 2-3水解显碱性,没有化合价变化,不属于氧化还原反应,故C 正确;向氢碘酸中滴加FeCl 3溶液,产生棕色物质,说明Fe 3+将I -氧化成碘单质,Fe 和I 元素化合价发生变化,属于氧化还原反应,故D 错误。
答案:C3. 氧化还原反应与四种基本反应类型的关系如图所示,则下列化学反应属于阴影3区域的是( )A .Cl 2+2NaI===2NaCl +I 2B .CH 4+2O 2=====点燃CO 2+2H 2OC .4Fe(OH)2+O 2+2H 2O===4Fe(OH)3D .2H 2O 2=====MnO 22H 2O +O 2↑解析:阴影3所表示的反应类型为氧化还原反应,但不属于四种基本反应类型。
2019高考化学总复习 02 化学物质及其变化(7)氧化还原反应方程式的配平及计算(1)(含解析)新人教版
经典教育资源 经典教育资源(一) 氧化还原反应方程式的配平及计算
李仕才
基础巩固 1.(2018年四川省宜昌市一中高三一模)2016年10月17日,“神舟11号”在酒泉发射升空,并取得圆满成功。“神舟11号”的运载火箭所用燃料是偏二甲肼(C2H8N2)和四氧化二氮(N2O4)。在火箭升空过程中,燃料发生反应:C2H8N2+2N2O4―→2CO2+3N2+4H2O提供能量。下列有关叙述正确的是( ) A. 该燃料绿色环保,在燃烧过程中不会造成任何环境污染 B. 该反应中N2O4是氧化剂,偏二甲肼是还原剂 C. N2既是氧化产物又是还原产物,CO2既不是氧化产物也不是还原产物 D. 每有0.6 mol N2生成,转移电子数目为2.4NA 解析: 本题考查氧化还原反应。A.四氧化二氮可污染环境,故A错误;B.偏二甲肼中碳元素化合价从-1价升高到+4价,氮元素从-3价升高到0价,做还原剂,故B正确;C.碳元素化合价升高,则二氧化碳为氧化产物,故C产物;D.由方程式分析,每有0.6摩尔氮气生成,则消耗0.4摩尔四氧化二氮,则转移电子的物质的量为0.4×4×2=3.2摩尔,则每有0.6摩尔氮气生成转移3.2摩尔电子,故D错误。 答案:B 2.(2018年福建省泉州市一中二模)高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,其与水反应的离子方程式为:4FeO2-4+10H2O===4Fe(OH)3(胶体)+3O2↑+8OH-,工业上先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入一定量的KOH就可制得高铁酸钾,制备高铁酸钠的两种方法的主要反应原理如下: 湿法制备:2Fe(OH)3+3ClO-+4OH-===2FeO2-4+3Cl-+5H2O 干法制备:2FeSO4+6Na2O2===2Na2FeO4+2Na2O+2Na2SO4+O2↑ 下列有关说法错误的是( ) A.高铁酸钾与水反应时,水发生氧化反应 B.干法制备中,每生成1 mol Na2FeO4,共转移4 mol电子 C.湿法制备中,每生成1 mol Na2FeO4,共转移3 mol电子 D.K2FeO4处理水时,不仅能杀菌,还能除去H2S、NH3等,并使悬浮杂质沉降 解析: 解:本题考查氧化还原反应。A.高铁酸钾与水反应时,水中O元素的化合价升高,则水发生氧化反应,故A正确;B.干法制备中,Fe元素的化合价由+2价升高为+6价,过氧化钠中O元素的化合价既升高又降低,则每生成1 mol Na2FeO4,转移电子为1 mol×4+1 mol×1=5 mol,故B错误;C.湿法制备中,Fe元素的化合价由+3价升高为+6价,则每生成1 mol Na2FeO4,共转移1 mol×(6-3)=3 mol电子,故C正确;D.+6价铁具有强氧化性,不仅能杀菌,还能除去H2S、NH3等,还原产物中铁离子水解生成胶体,可使悬浮杂质沉降,故D正确。 答案:B 3.(2018年安徽省亳州市二中高三一模)24 mL 0.05 mol·L-1的 Na2SO3溶液恰好与20 mL 0.02 mol·L-1的K2R2O7的溶液完全反应,则R元素在还原产物中的化合价为( ) 经典教育资源 经典教育资源(一) A.0 B.+2
高考化学一轮复习跟踪检测十追根知反应3__氧化还原反应的配平与计算含解析20190510384.doc
追根知反应(3)——氧化还原反应的配平与计算1.高铁酸钠(Na 2FeO 4)是一种新型净水剂,制取Na 2FeO 4的离子方程式为Fe 3++OH -+Cl 2―→FeO 2-4+Cl -+H 2O ,该反应配平的离子方程式中H 2O 的化学计量数是( )A .4B .6C .8D .10 解析:选C 反应Fe 3++OH -+Cl 2―→FeO 2-4+Cl -+H 2O 中,铁元素化合价:+3价→+6,化合价升高3价;氯元素化合价:0→-1,Cl 2参加反应,化合价降低1×2价,化合价变化的最小公倍数为6,所以Fe 3+的化学计量数为2、Cl 2的化学计量数为3,根据氯原子守恒,Cl -的化学计量数为6,即2Fe 3++OH -+3Cl 2―→2FeO 2-4+6Cl -+H 2O ,根据电荷守恒,OH -的化学计量数为16,根据氢原子守恒,水的化学计量数为162=8。
2.(2019·陕西汉中一模)含氟的卤素互化物通常作氟化剂,使金属氧化物转化为氟化物,如2Co 3O 4+6ClF 3===6CoF 3+3Cl 2+4X 。
下列有关该反应的说法正确的是( )A .X 是还原产物B .ClF 3中氯元素为-3价C .反应生成3 mol Cl 2时转移18 mol 电子D .Co 3O 4在反应中作氧化剂解析:选C A 项,根据原子守恒知,X 是O 2,该反应中氧气是氧化产物;B 项,ClF 3中氯元素为+3价;C 项,氯元素由+3价降为0价,反应生成3 mol Cl 2时转移18 mol 电子;D 项,Co 3O 4中钴元素和氧元素的化合价均升高,所以Co 3O 4在反应中作还原剂。
3.(2019·邯郸检测)硫代硫酸钠溶液与氯气能发生反应:Na 2S 2O 3+4Cl 2+5H 2O===2NaCl +6HCl +2H 2SO 4。
下列说法错误的是( )A .氧化产物、还原产物的物质的量之比为1∶1B .若0.5 mol Na 2S 2O 3作还原剂,则转移4 mol 电子C .当Na 2S 2O 3过量时,溶液能出现浑浊D .硫代硫酸钠溶液吸收氯气后,溶液的pH 降低解析:选A 由化学方程式可知,氯气是氧化剂,硫代硫酸钠是还原剂,氯化钠和氯化氢是还原产物,硫酸是氧化产物。
2019年高考化学热点题型和提分秘籍 第2.3讲 氧化还原反应(教学案) 含解析
1.了解氧化还原反应的本质是电子的转移。
2.了解常见的氧化还原反应。
3.掌握常见氧化还原反应的配平和相关计算热点题型一认识和理解氧化还原反应例1、(2018年北京卷)下列实验中的颜色变化,与氧化还原反应无关的是A. AB. BC. CD. D【答案】C【变式探究】【2017北京卷】下列变化中,气体被还原的是A.二氧化碳使Na2O2固体变白B.氯气使KBr溶液变黄C.乙烯使Br2的四氯化碳溶液褪色D.氨气使AlCl3溶液产生白色沉淀【答案】B【解析】二氧化碳使Na2O2固体变白,发生反应2CO2+2Na2O2=O2+2Na2CO3,CO2的化合价没有发生改变,过氧化钠既是氧化剂,也是还原剂,A错误;氯气使KBr溶液变黄,发生反应2KBr+Cl2=2KCl+Br2,Cl元素化合价降低,被还原,B正确;乙烯使Br2的四氯化碳溶液褪色,是乙烯与溴发生了加成反应,Br元素化合价降低,Br2被还原,乙烯被氧化,C 错误;氨气使AlCl 3溶液产生白色沉淀氢氧化铝,反应过程中NH 3化合价没有改变,不是氧化还原反应,D 错误。
【提分秘籍】解答氧化还原反应概念型习题的思路(1)理清概念间的关系,把握知识线索(详见前面的基础梳理)。
(2)明确分析问题的方法思路:找变价、判类型、分升降、定其他。
其中“找变价”是非常关键的一步,特别是不同反应物中含有同种元素的氧化还原反应,必须弄清元素化合价的变化情况。
基本方法是先标出熟悉元素的化合价,再根据化合物中正负化合价的代数和为零的原则求解其他元素的化合价。
【举一反三】工业上将Na 2CO 3和Na 2S 以1∶2的物质的量之比配成溶液,再通入SO 2,可制取Na 2S 2O 3,同时放出CO 2。
在该反应中( )A .硫元素被氧化,氧元素被还原B .氧化剂与还原剂的物质的量之比为1∶2C .每生成1 mol Na 2S 2O 3,转移4 mol 电子D .相同条件下,每吸收10 m 3SO 2就会放出2.5 m 3CO 2【答案】D热点题型二 氧化还原反应三大规律的灵活应用例2、【2017海南】在酸性条件下,可发生如下反应: 3ClO -+2M 3++4H 2O=27M O n -+Cl -+8H +, 27M O n -中M 的化合价是 ( )A. +4B. +5C. +6D. +7 【答案】C【解析】根据离子反应方程式中,反应前后所带电荷数相等,即6-1=8-n -1,解得n=2,从而得出M 2O 7n -中M 的化合价为+6价,故C 正确。
2019届高考化学专题练习卷氧化还原反应
氧化还原反应1.科学家发现了如下反应:O 2+PtF 6===O 2(PtF 6),已知O 2(PtF 6)为离子化合物,Pt 为+5价,下列说法正确的是( )A .O 和F 无正化合价B .1 mol O 2参加反应,转移1 mol e -C .上述反应中O 2作氧化剂D .上述反应属于加成反应 答案 B2.钯的化合物PdCl 2通过化学反应可用来检测有毒气体CO ,该反应的反应物与生成物有CO 、Pd 、H 2O 、HCl 、PdCl 2和一种未知物质X 。
下列说法错误的是( )A .未知物质X 为CO 2,属于氧化产物B .每转移1 mol e -时,生成2 mol X C .反应中PdCl 2作氧化剂,被还原 D .还原性:CO>Pd 答案 B3.氧化还原反应与四种基本反应类型的关系如图所示,则下列化学反应属于阴影部分的是( )A .Cl 2+2KBr===Br 2+2KClB .2NaHCO 3=====△Na 2CO 3+H 2O +CO 2↑ C .4Fe(OH)2+O 2+2H 2O===4Fe(OH)3 D .2Na 2O 2+2CO 2===2Na 2CO 3+O 2 答案 D4.以下试剂的浓溶液在空气中久置都会变质,在变质过程中既发生了氧化还原反应,又发生了非氧化还原反应的是( )A .氢氧化钠B .硫化氢C .次氯酸钙D .硫酸亚铁答案 C5.氧化还原反应中,水可以是氧化剂、还原剂、既是氧化剂又是还原剂、既不是氧化剂又不是还原剂等。
在下列反应中,水的作用与Br 2+SO 2+2H 2O===H 2SO 4+2HBr 中的不同的是( )A .2Na 2O 2+2H 2O===4NaOH +O 2↑D.2Al+2NaOH+2H2O===2NaAlO2+3H2↑答案 D6.已知:还原性HSO-3>I-,氧化性IO-3>I2。
在含3 mol NaHSO3的溶液中逐滴加入KIO3溶液,加入KIO3和析出I2的物质的量的关系曲线如图所示。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2
3
1.(2017·衡水中学高三第一次调研)将3.48 g四氧化三铁完全溶解在100 mL 1 mol·L
-
1的硫酸中,然后加入K2Cr2O7溶液25 mL,恰好使溶液中的Fe2+全部转化为Fe3+,Cr2O2-
7
全
部转化为Cr3+,则K2Cr2O7溶液的物质的量浓度是( )
A.0.05 mol·L-1 B.0.1 mol·L-1
C.0.2 mol·L-1 D.0.3 mol·L-1
2.(2017·桂林十八中高三月考)实验室将氯酸钠和亚硫酸钠按物质的量之比1∶2倒入烧杯
中,水浴加热,同时滴入硫酸溶液,产生棕黄色气体X,反应后测得氯酸钠和亚硫酸钠恰好
完全反应,则X为( )
A.Cl2 B.Cl2O
C.ClO2 D.Cl2O7
3.(2017·六安一中高三第一次月考)水热法制备Fe(FeO2)2纳米颗粒的反应3Fe2++2S2O2-3+
O2+xOH-===Fe(FeO2)2+S4O2-6+2H2O,下列说法中不正确的是( )
A.每生成1 mol Fe(FeO2)2转移4 mol电子
B.该反应中Fe2+和S2O2-3都是还原剂
C.3 mol Fe2+被氧化时有1 mol O2被还原
D.反应方程式中化学计量数x=4
4.(2016·河北武邑中学高三第一次调研)已知:还原性HSO-3>I-,氧化性IO-3>I2。在含
3 mol NaHSO3的溶液中逐滴加入NaIO3溶液。加入NaIO3的物质的量和析出的I2的物质的量
的关系曲线如图。下列说法正确的是( )
A.反应过程中的氧化产物均为Na2SO4
B.a点时消耗NaHSO3的物质的量为1.0 mol
C.O~b间的反应可用如下离子方程式表示:3HSO-3+IO-3+3OH-===3SO2-4+I-+3H2O
2
3
D.当溶液中I-与I2的物质的量之比为5∶3时,加入的NaIO3为1.1 mol
5.已知酸性条件下有以下反应关系:①KBrO3能将KI氧化成I2或KIO3,其本身被还原为Br2。
②Br2能将I-氧化为I2。③KIO3能将I-氧化为I2,也能将Br-氧化为Br2,其本身被还原为
I2。现向含有1 mol KI的硫酸溶液中加入含a mol KBrO3的溶液,a的取值不同,所得产物
也不同。下列判断正确的是( )
编号 a的取值范围 产物的化学式(或离子符号)
① a≤16 I2、Br-
② 16
A.①③④ B.②③④
C.①②③④ D.①④
6.(2016·辽宁重点高中高三模拟)向含有 0.2 mol FeI2的溶液中加入a mol Br2。下列叙
述不正确的是( )
A.当a=0.1时,发生的反应为2I-+Br2===I2+2Br-
B.当a=0.25时,发生的反应为2Fe2++4I-+3Br2===2Fe3++2I2+6Br-
C.当溶液中I-有一半被氧化时,c(I-)∶c(Br-)=1∶1
D.当0.2<a<0.3时,溶液中各离子浓度的关系为
2c(Fe2+)+3c(Fe3+)+c(H+)=c(Br-)+c(OH-)
7.(2016·上海五校下学期联考)向一定量的Fe、FeO、Fe2O3、Fe3O4的混合物中,加入150 mL
4 mol·L-1的稀硝酸,恰好使混合物完全溶解,并放出标准状况下NO气体2.24 L,向所得
溶液中加KSCN溶液,无血红色出现。若用一定量的氢气在加热条件下还原相同质量的该混
合物,所得固体的物质的量可能为( )
A.0.30 mol B.0.28 mol
C.0.25 mol D.0.22 mol
8.(2016·荆州中学一检)高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比
Cl2、O3、ClO2、KMnO4氧化性更强,无二次污染。工业上是先制得高铁酸钠,然后在低温下,
向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
2
3
(1)湿法制备高铁酸钠(Na2FeO4)的反应体系有六种微粒:Fe(OH)3、ClO-、OH-、FeO2-4、
Cl-、H2O。
①写出并配平湿法制备高铁酸钠的离子方程式:_______________________________
________________________________________________________________________。
②低温下,在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4),最可能的原因是
________________________________________________________________________
________________________________________________________________________。
(2)干法制备高铁酸钠的主要反应为2FeSO4+6Na2O2===2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反
应中的还原剂是________________,氧化产物是____________,每生成1 mol Na2FeO4转移
________mol电子。
9.硒和硫是同一主族元素,二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为
环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。完成下列填空:
(1)Se和浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1∶1,写出Se
和浓HNO3反应的化学方程式:_________________________________________
________________________________________________________________________。
(2)已知:Se+2H2SO4(浓)===2SO2↑+SeO2+2H2O;2SO2+SeO2+2H2O===Se+2SO2-4+
4H+。SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是________________________。
(3)回收得到的SeO2的含量,可以通过下面的方法测定:
①____SeO2+____KI+____HNO3===____Se+____I2+____KNO3+____H2O
②I2+2Na2S2O3===Na2S4O6+2NaI
配平化学方程式①,并标出电子转移的方向和数目。
(4)实验中,准确称量SeO2样品0.150 0 g,消耗了0.200 0 mol·L-1的Na2S2O3溶液25.00 mL,
所测样品中SeO2的质量分数为________。
2
3
答案精析
1.B
2.B
3.C
4.D
5.C
6.B
7.C
8.(1)①2Fe(OH)3+3ClO-+4OH-===2FeO2-4+3Cl-+5H2O ②高铁酸钾溶解度小于高铁酸钠
(2)FeSO4、Na2O2 Na2FeO4、O2 5
解析 (2)在反应2FeSO4+6Na2O2===2Na2FeO4+2Na2O+2Na2SO4+O2↑中Fe、O元素的化合价升
高,O元素的化合价降低,则氧化剂为Na2O2,还原剂为FeSO4和Na2O2,氧化产物是Na2FeO
4
和O2。根据方程式可知每生成1 mol Na2FeO4转移的电子数为(6-2) mol+1 mol=5 mol。
9.(1)Se+2HNO3(浓)===SeO2+NO↑+NO2↑+H2O
(2)H2SO4(浓)>SeO2>SO2
(3)SeO2+4KI4e-+4HNO3===Se+2I2+4KNO3+2H2O
(4)92.5%
解析 (1)利用题中信息可知Se与浓HNO3反应,Se被氧化为+4价的SeO2,HNO3被还原为
NO与NO2,生成NO与NO2的物质的量之比为1∶1,即二者化学计量数比为1∶1,令二者化
学计量系数为1,根据电子转移守恒可知,Se的系数为1×3+1×14=1,故反应方程式为Se
+2HNO3(浓)===SeO2+NO↑+NO2↑+H2O。
(2)在氧化还原反应中,氧化剂的氧化性强于氧化产物的,所以根据反应的化学方程式可知,
SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是H2SO4(浓)>SeO2>SO2。(3)反应①中I-失去
电子生成I2,共升高2价,SeO2中+4价Se得到电子被还原为单质Se,共降低4价,化合
价升降最小公倍数为4,故KI的化学计量数为4,I2的化学计量数为2,SeO2、Se的化学计
量数都是1,KNO3的化学计量数为4,H2O的化学计量数为2,配平并标出电子转移的方向和
数目为SeO2+4KI4e-+4HNO3===Se+2I2+4KNO3+2H2O。
(4)根据反应的化学方程式可知SeO2~2I2~4Na2S2O3,消耗的n(Na2S2O3)=0.200 0 mol·L
-
1
×0.025 L=0.005 mol,根据关系式计算样品中n(SeO2)=0.005 mol×14=0.001 25 mol,
故SeO2的质量为0.001 25 mol×111 g·mol-1=0.138 75 g,所以样品中SeO2的质量分数
2
3
为0.138 75 g0.150 0 g×100%=92.5%。
