酶与底物作用的饱和动力学特征
酶促反应动力学

不属于抑制剂。
通常抑制作用分为可逆性抑制和不可逆性抑制两类。
(一)不可逆性抑制作用(irreversible inhibition) 不可逆性抑制作用的抑制剂,通常以共价 键方式与酶的必需基团进行不可逆结合而使 酶丧失活性。常见的不可逆抑制剂如下图所 示。按其作用特点,又分专一性及非专一性 两种。
3.4 酶促反应动力学 酶促反应动力学(kinetics of enzymecatalyzed reactions)是研究酶促反应速度及其 影响因素的科学。 酶促反应的影响因素主要包括
1. 2. 3. 4. 5. 6. 底物的浓度、 酶的浓度、 pH、 温度、 抑制剂 激活剂
一、 底物浓度对反应速度的影响
木瓜蛋白酶
胆碱脂酶
动物体内多数酶的最适pH值接近中性,但也有例外,如胃
蛋白酶的最适pH约1.8,肝精氨酸酶最适pH约为9.8(见下表)。
一些酶的最适pH
五. 激活剂对酶反应速度的影响
能使酶活性提高的物质,都称为激活剂(activator),其 中大部分是离子或简单的有机化合物。如Mg++是多种激酶和 合成酶的激活剂,动物唾液中的α-淀粉酶则受Cl-的激活。
3、反应系统处于稳态平衡状态,即„ES‟的形成速度等于„ES‟ 的分解速度:d„ES‟/dt=-d„ES‟/dt
Briggs和Haldane“稳态平衡”理论
(1) (2)
稳态平衡理论:
反应进行一段时间后,系统的ES浓度,由零逐渐 增加到一定数值,在一定时间内,尽管底物浓度和 产物浓度不断变化,复合物ES的浓度也在不断的 生成和分解,但当系统中ES的生成速率和ES的分 解速率相等时,ES的浓度不变。
酶促反应的机制

酶-底复合物形成时,酶分子构象发生变化,底物分子 也常常受到酶的作用而发生变化,甚至使底物分子发生扭 曲变形,从而使底物分子某些键的键能减弱,产生键扭曲, 有助于过度态的中间产物形成,从而降低了反应的活化能。
诱导底物变形,扭曲,促进了化学键的断裂。
酶中某些基团可使底物分子的敏感键中某些基团的电子 云密度变化,产生电子张力,降低了底物的活化能。 底物与酶结合诱导酶的分子构象变化,变化的酶分子又 使底物分子的敏感键产生“张力”甚至“形变” ,从而促 使酶-底物中间产物进入过渡态。
-OH的亲核催化(胰蛋白酶)
某些通过共价催化机制进行的酶反应
酶
3-磷酸甘油醛脱氢酶
共价中间络合物
酰基-酶
参与共价中间络合物 形成的氨基酸残基
Cys
D-氨基酸氧化酶 乙酰CoA酰基转移酶 Gly咪基转移酶
蔗糖磷酸化酶 转醛醇酶 胰蛋白酶 木瓜蛋白酶 碱性磷酸酯 ATP-柠檬酸解酶 果糖二磷酸醛缩酶 磷酸葡萄糖变位酶 琥珀酰CoA合成酶
氏双曲线。
在底物足够过量而其它条件固定的情况下,并且 反应系统中不含有抑制酶活性的物质及其他不利 于酶发挥作用的因素时,酶促反应的速度和酶浓 度成正比。
(一)、底物对酶促反应的饱和现象:
反应级数
(二)、曲线的基本含义 研究前提
I. II.
单底物、单产物反应; 酶促反应速度一般在规定的反应条件下,用单位时间内 底物的消耗量和产物的生成量来表示; 以内)时的反应速度;
子的排除、排斥,在非极性环境中可显著增高两个带电基团 之间的静电作用,有利于同底物的结合;同时,酶的催化基 团被低介电环境所包围,底物分子的敏感键和酶的催化基团 之间就会有很大的反应力,有利于酶加速反应的。
细胞生物学-物质的跨膜运输(翟中和第四版)-含注释!!!
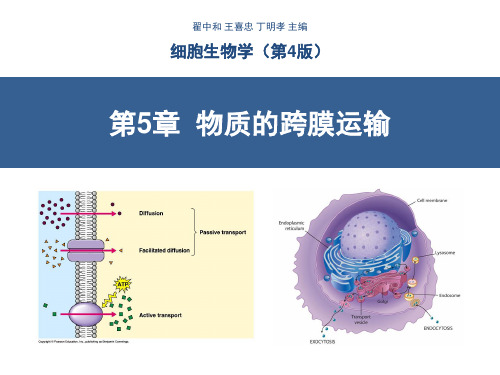
动物、植物细胞主动运输比较
三、ABC 超家族
• ABC 超家族也是一 类ATP 驱动泵 • 广泛分布于从细菌 到人类各种生物中, 是最大的一类转运 蛋白 • 通过ATP 分子的结 合与水解完成小分 子物质的跨膜转运
(一)ABC转运蛋白的结构与工作模式
• 4 个“核心”结构域
– 2 个跨膜结构域,分别含6 个跨
H+/K+ ATPase Control of acid secretion in the stomach
二、V 型质子泵和 F 型质子泵
• V 型质子泵广泛存在 于动物细胞的胞内体 膜、溶酶体膜,破骨 细胞和某些肾小管细 胞的质膜,以及植物、 酵母及其他真菌细胞 的液泡膜上 (V 为 vesicle) • 转运 H+ 过程中不形成 磷酸化的中间体
导兴奋)
B. 配体门通道(胞外配体)
(突触后膜接收乙酰胆碱的
受体)
C. 配体门通道(胞内配体)
D. 应力激活通道(内耳的 听毛细胞)
含羞草“害羞”的机制
• 估计细胞膜上与物质转运有关的蛋白占核基因编码蛋白的 15~30%,细 胞用在物质转运方面的能量达细胞总消耗能量的2/3。
• 两类主要转运蛋白:
P型泵的主要特点:都是跨膜蛋白,并且是由一条多肽完成 所有与运输有关的功能,包括ATP的水解、磷酸化和离子 的跨膜运输。
Na+-K+ATP酶的分子结构:
α β 两种亚基组成的二聚体。
α 亚基具有ATP酶的活性;
β 亚基是具有组织特异性的糖蛋白。
(一)Na+-K+ 泵(Na+-K+ ATPase)
Figure 11-14 Molecular Biology of the Cell (© Garland Science 2008)
酶促反应动力学
第一节 酶促反应的动力学方程
一、化学动力学基础
1、反应分子数和反应级数 1)反应分子数
指在反应中真正相互作用的分子数。
A
P
A+B
P+Q
2)反应级数
指实验测得的反应速率与反应物浓度之间的关系,符合 哪种速率方程,则这个反应就是几级反应。
蔗糖 + H2O 蔗糖酶 葡萄糖 + 果糖
1
3)零级反应的特征
反应速率与反应物浓度无关。初始浓度增加,反应速度不变, 要使反应物减少一半所需完成的反应量增加,因此最后表现为半 衰期与初始浓度成正比。
二、底物浓度对酶促反应的影响
1、酶促反应初速度与底物浓度之间的关系 1903年Henri以蔗糖酶水解蔗糖为例,研究底物浓度与酶促反
应速度之间关系时,发现两者的关系符合双曲线关系。
k2
Km= (k2+k3)/k1
Km是[ES]的分解常数与生成常数的比值。 Km的真正含义是, Km越大意为着[ES]越不稳定,越容易分解。但不能说明[ES]是容 易分解成底物还是产物。
kcat/Km可表示为 [k3/(k2 + k3)]k1, k3/(k2 + k3)代表[ES] 分解成产 物的分解常数占[ES] 总分解常数的比值。 k3/(k2 + k3)越大,说明 [ES]越容易分解成产物。 k1是[ES] 生成常数。因此, kcat/Km数 值大不仅表示[ES]容易生成,还表示[ES]易分解成产物。真正代 表酶对某一特定底物的催化效率。所以,也称为专一性常数。 极限值是k1 ,意为[ES]不会再分解为底物。
酶的化学本质是蛋白质,因此,酶 对温度具有高度的敏感性,随着温度 的升高,分子的构象会逐渐地被破 坏,失去催化活性。
酶与酶及底物之间的相互作用

酶与酶及底物之间的相互作用酶与酶及底物之间的相互作用1. 什么是酶和底物?•酶是一种特殊的蛋白质,它在生物体内起着催化化学反应的作用。
•底物是酶作用的对象,它可以是有机物、无机物或其他生物分子。
2. 酶与底物的结合方式酶与底物之间的相互作用可以通过以下几种方式进行:A. 酶与底物的亲和性•酶与底物之间存在一定的亲和性,即酶对于特定的底物具有较高的结合能力。
•酶通过与底物形成酶-底物复合物,从而使化学反应速率增加。
B. 酶与底物的结构匹配•酶的活性部位与底物的结构具有一定的匹配性。
•酶通过结构识别,将匹配的底物与自身结合,形成酶-底物复合物。
C. 酶与底物的氢键和离子键相互作用•酶与底物之间可以通过氢键和离子键进行相互作用。
•这种相互作用可以增强酶与底物的结合力,促使化学反应的进行。
3. 酶底物复合物的形成酶与底物的相互作用过程可以概括为以下几个步骤:A. 识别和结合•酶通过与底物结构的匹配和氢键、离子键的相互作用,识别并结合特定的底物分子。
B. 酶底物复合物的稳定化•酶与底物结合后,酶底物复合物将会形成,并通过氢键、离子键等相互作用稳定下来。
C. 化学反应•在酶底物复合物的稳定状态下,化学反应会以较快的速率进行。
D. 产物释放•化学反应完成后,产物会从酶底物复合物中释放出来,酶则可以再次参与其他底物的反应。
4. 酶与底物的特异性酶与底物之间的相互作用具有一定的特异性:•酶对于特定的底物具有较高的亲和性和特异性。
•不同的酶对于不同的底物具有不同的催化活性。
结论酶与酶及底物之间的相互作用是生物化学反应中不可或缺的一环,通过亲和性、结构匹配和氢键、离子键的相互作用,酶能够高效催化底物的化学反应。
酶底物复合物的形成是一个多步骤的过程,经过识别和结合、复合物的稳定化、化学反应和产物释放等步骤,底物被转化为产物。
酶与底物之间的相互作用具有特异性,这为生物体内的代谢途径和信号传导提供了基础。
5. 酶与底物相互作用的重要性酶与底物之间的相互作用对于生物体的正常功能和代谢过程至关重要:•酶催化反应可以加速底物的转化速率,使生化反应在体内迅速进行。
酶促反应动力学(有方程推导过程)

五. 激活剂对酶反应速度的影响
能使酶活性提高的物质,都称为激活剂(activator),其中大部分是 离子或简单的有机化合物。如Mg++是多种激酶和合成酶的激活剂,
动物唾液中的α-淀粉酶则受Cl-的激活。
特点:1、酶对激活剂有一定的选择性,一种酶的激活剂对另 一种酶来说可能是抑制剂
2、有一定的浓度要求,当激活剂的浓度超过一定的范围 时,它就成为抑制剂。
(3). Km 值是酶的特征性常数,只与酶的性质,酶所催化 的底物和酶促反应条件(如温度、pH、有无抑制剂等)有关, 与酶的浓度无关。酶的种类不同,Km值不同,同一种酶与 不同底物作用时,Km 值也不同。各种酶的 Km 值范围很 广,大致在 10-1~10-6 M 之间。
第十七页,编辑于星期五:二十点 五十八分。
四、 底物浓度对反应速度的影响 1、酶反应与底物浓度的关系
1902年,Henri用蔗糖酶水解蔗糖的实验中观察到: 在蔗糖酶酶的浓度一定的条件下测定底物(蔗糖)浓
度对酶 反应速度的影响, 它们之间的关系呈现矩形双 曲线(rectangular hyperbola)。如下图所示:
第十一页,编辑于星期五:二十点 五十八分。
将(4)代入(3),则:
v
VmaxS Km S
第十五页,编辑于星期五:二十点 五十八分。
Vmax指该酶促反应的最大速度,[S]为底
物浓度,Km是米氏常数,V是在某一底物浓
度时相应的反应速度。从米氏方程可知: 当底物浓度很低时 [S] << Km,则 V≌Vmax[S]/Km ,反应速度
与底物浓度呈正比;
〔ES〕和〔EI〕的相对稳定性;
③加大底物浓度,可使抑制作用减弱甚至消除。
酶工程酶学概论

A对照管— A实验管
(
×
1
×
1
×
1 0.1
× 10
发酵液体积 反应时间 0.1A= 1单位
0.2
15
稀释倍数
)
比色法:
酶反应的产物可与特定的化学试剂反应而生成稳定的有色溶液, 生成颜色的深浅与产物浓度在一定范围内有线性关系。
过氧化物酶活性的测定
过氧化物酶是植物体内普遍存在的、活性较高的一种酶。 在有过氧化氢存在的条件下,过氧化物酶能使愈创木酚氧化,生 成茶褐色物质,该物质在 470 nm 处有最大吸收。
与酶分子上的某些必需基团结合,使这些基团的结构 和性质发生改变,从而引起酶活力的下降或丧失。
与变性剂的区别: 1. 没有引起酶的变性 2. 有一定的选择性
抑制剂的分类:
不可逆抑制剂
不可逆抑制剂通常以比较牢固的共价键与酶蛋 白中的基团结合,而使酶失去活性。 不可逆抑制剂与酶结合后,不能通过透析和超 过滤等物理方法除去抑制剂。 如:有机磷, 有机汞、有机砷、氰化物,重金属等。
米氏常数的意义:
3. Km值可帮助判断某一代谢的方向及生理 功能。催化可逆反应的酶,对正逆两个方向 反应的Km常常是不同的。
测定这些Km的大小及细胞内正逆两向的底物浓度,
可以大致推测该酶催化正逆两向反应的效率;这对了解酶在细 胞内的主要催化方向及生理功能具有重要的意义。
4. 判断酶的最适底物。 有的酶可作用多种 底物,因此对每一个底物都有一个Km值,Km最 小的那个底物为该酶的最适底物或天然底物。
(1)竞争性抑制作用(competitive inhibition) (2)非竞争性抑制作用(noncompetitive inhibition) (3)反竞争性抑制作用(Uncompetitive inhibition) (4)线性混合型抑制作用
细胞生物学名词解释

名词解释细胞生物学:是研究细胞基本生命活动规律的科学,它是在不同层次(显微、亚显微与分子水平)上以研究细胞结构与功能、细胞增殖、分化、衰老与凋亡、细胞信号传递、真核细胞基因表达与调控、细胞起源与进化等为主要内容的学科。
其核心问题是将遗传与发育在细胞水平上结合起来。
原生质体:由细胞质膜包围的一团原生质,分化为细胞核与细胞质。
脂质体:在水溶液环境中人工形成的一种球型脂双层结构。
细胞外基质:指分布于细胞外空间,由细胞分泌的蛋白质和多糖所构成的复杂网络结构透明质酸:一种重要的糖氨聚糖,是增殖细胞和迁移细胞胞外基质的主要成分,在早期胚胎中含量特别丰富,与其他糖氨聚糖相比,不被硫酸化,不与核心蛋白共价连接。
连接子:间隙连接中由连接蛋白connexin在质膜内簇集形成的多亚基复合体。
每个连接子由6个连接蛋白亚基环形排列而成,中间形成一直径约1.5nm的通道。
协助扩散:物质通过与特异性膜蛋白的相互作用,从高浓度向低浓度的跨膜转运形式。
胞吞作用:通过质膜内陷形成膜泡,将细胞外或细胞质膜表面的物质包裹到膜泡并转运到细胞内(胞饮和吞噬)的过程。
胞吐作用:携带有内容物的膜泡与质膜融合,将内容物释放到胞外的过程。
细胞通讯:一个细胞发出的信息通过介质(又称配体)传递到另一个细胞(靶细胞)并与靶细胞相应的受体相互作用,然后通过细胞信号转导引起靶细胞产生一系列生理生化变化,最终表现为细胞整体的生物学效应的过程。
信号分子:作为信号载体,能与靶细胞受体特异性结合并引起靶细胞内信号转导最终产生生物学效应的一类分子。
脂溶性:视黄醇、维生素D、甲状腺素、甾类激素。
水溶性:神经递质、多肽类激素、局部介质。
受体:一种能够识别和选择性结合某种配体(信号分子)的大分子,绝大多数已鉴定的为糖蛋白,少数为糖脂或糖蛋白糖脂复合物。
半自主性细胞器:其生长和增殖受核基因组和自身基因组两套遗传系统的控制的细胞器,如线粒体和叶绿体。
电子传递链(呼吸链):在线粒体内膜上存在的一组酶复合体,有一系列能可逆的接受和释放电子或H+的化学物质组成,它们在内膜上相互关连地有序排列成传递链,称为电子传递链或呼吸链,是典型的多酶体系。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
酶与底物作用的饱和动力学特征
酶是一种生物催化剂,在许多生物化学反应中起着重要的作用。
酶与其底物之间的作用是一种互相作用的关系,而底物浓度的变化会影响酶的催化速率。
酶的饱和动力学特征是指在一定浓度的底物下,酶催化速率的变化情况。
酶与底物作用的饱和动力学特征表现为,随着底物浓度的增加,酶的催化速率会增加,但当底物浓度达到一定程度时,酶的催化速率将不再增加,而保持一个稳定的最大值。
这表明酶与底物之间的作用是有限的,酶分子数量有限,当底物分子数达到酶分子数时,酶分子全部被用完,酶的催化速率也不能再增加。
酶与底物作用的饱和动力学特征还可以用麦克斯韦玻尔兹曼分
布来解释。
在一定浓度的底物下,酶分子将不断吸收底物分子,形成酶-底物复合物,复合物再分解成产物和酶。
随着底物浓度的增加,复合物的形成速率将增加,但酶分子的数量是有限的,当复合物形成速率达到一个极限时,酶分子全部被用完,酶的催化速率也不能再增加。
酶与底物作用的饱和动力学特征对于生物化学反应的研究和生
物工程中的酶催化反应的设计和优化具有重要意义。
在实际应用中,可以通过改变酶的浓度或底物的浓度来调节酶的催化速率,实现反应的控制和优化。
- 1 -。
