考点16 氮元素单质及其重要化合物
高一化学氮及其化合物ppt课件.ppt
病原体侵入机体,消弱机体防御机能 ,破坏 机体内 环境的 相对稳 定性, 且在一 定部位 生长繁 殖,引 起不同 程度的 病理生 理过程
氮气
1、氮元素的存在及单质的物理性质
存 游离态形式存在于空气中 在 化合态形式存在于多种无机物及有机物中
物 理 无色无味的气体、密度比空气小; 性 难溶于水,1体积水溶解0.02体积的氮气。
思考题
1、1molMg在足量的氮气、空气、纯氧气、二
氧化碳气体中燃烧生成 的固体质量由大到小的 排列次序是_二__氧__化__碳__>__氧__气___>_空__气__>__氮__气_____.
点燃
2Mg + O2 →2MgO
点燃
3Mg + N2 → Mg3N2
(40g) (100/3g)
2Mg + CO2 →点燃2MgO +C (46g)
质
病原体侵入机体,消弱机体防御机能 ,破坏 机体内 环境的 相对稳 定性, 且在一 定部位 生长繁 殖,引 起不同 程度的 病理生 理过程
工业上怎样制取氮气?利用氮气的什么性质?
空气
液化
先气化 液态空气
氮气 b.p -195.8℃
后气化
氧气 b.p -183℃
病原体侵入机体,消弱机体防御机能 ,破坏 机体内 环境的 相对稳 定性, 且在一 定部位 生长繁 殖,引 起不同 程度的 病理生 理过程
氮的固定------把大气中的游离态氮转化为氮的化合物 1生物固氮
豆科作物根瘤中的固氮菌常温下将空气中的氮 气转化为硝酸盐。
病原体侵入机体,消弱机体防御机能 ,破坏 机体内 环境的 相对稳 定性, 且在一 定部位 生长繁 殖,引 起不同 程度的 病理生 理过程
《氮及其重要化合物》 讲义

《氮及其重要化合物》讲义一、氮元素概述氮是一种非常重要的元素,在我们的生活和自然界中都有着广泛的存在和重要的作用。
氮元素在元素周期表中位于第 7 位,原子序数为 7。
它的原子结构决定了其化学性质。
氮原子的外层电子构型为 2s²2p³,这使得氮具有多种化合价,常见的有-3、0、+1、+2、+3、+4、+5 等。
在自然界中,氮主要以氮气(N₂)的形式存在于大气中,约占空气体积的 78%。
氮气是一种相对稳定的气体,因为氮氮三键的键能非常大,这使得氮气在常温常压下很难与其他物质发生反应。
二、氮气(N₂)氮气是一种无色、无味、无毒的气体,密度略小于空气。
氮气的化学性质不活泼,但在一定条件下也能与某些物质发生反应。
1、氮气与氢气的反应在高温、高压、催化剂的条件下,氮气和氢气可以发生反应生成氨气(NH₃),这是工业合成氨的重要反应:N₂+ 3H₂⇌ 2NH₃2、氮气与氧气的反应在放电或高温条件下,氮气和氧气会发生反应生成一氧化氮(NO):N₂+ O₂= 2NO三、氮的氧化物氮有多种氧化物,常见的有一氧化氮(NO)、二氧化氮(NO₂)、一氧化二氮(N₂O)等。
1、一氧化氮(NO)一氧化氮是一种无色、无味的气体,难溶于水。
它在空气中很容易被氧化为二氧化氮。
一氧化氮在人体内也有一定的生理作用,例如在血管内皮细胞中产生,能够调节血管的舒张。
2、二氧化氮(NO₂)二氧化氮是一种红棕色、有刺激性气味的气体,易溶于水并与水反应生成硝酸和一氧化氮:3NO₂+ H₂O = 2HNO₃+ NO二氧化氮是形成酸雨和光化学烟雾的重要污染物之一。
四、氨气(NH₃)氨气是氮的氢化物,是一种有强烈刺激性气味的无色气体。
1、氨气的物理性质氨气极易溶于水,一体积水可以溶解约 700 体积的氨气。
氨气的水溶液称为氨水。
2、氨气的化学性质(1)氨气与水反应:NH₃+ H₂O ⇌ NH₃·H₂O ⇌ NH₄⁺+OH⁻,这使得氨水显碱性。
《氮及其重要化合物》 讲义

《氮及其重要化合物》讲义一、氮元素的存在与性质氮元素在自然界中广泛存在,是地球大气的主要成分之一。
大气中约 78%是氮气(N₂)。
氮气是一种无色、无味、无毒的气体,化学性质相对稳定。
氮原子的结构特点使得氮元素具有多样的化合价,常见的有-3、0、+1、+2、+3、+4、+5 等。
这种化合价的多样性决定了氮及其化合物丰富的化学性质。
二、氮气(N₂)氮气分子由两个氮原子通过三键结合而成,键能很大,因此氮气在常温常压下化学性质稳定。
但在高温、高压、放电等条件下,氮气能与氧气、氢气等发生反应。
1、氮气与氧气的反应在放电或高温条件下,氮气和氧气会发生反应生成一氧化氮(NO):N₂+ O₂= 2NO2、氮气与氢气的反应氮气和氢气在高温、高压、催化剂的条件下可以合成氨气(NH₃):N₂+ 3H₂⇌ 2NH₃三、氮的氧化物氮的氧化物种类较多,常见的有一氧化氮(NO)、二氧化氮(NO₂)等。
1、一氧化氮(NO)一氧化氮是一种无色、难溶于水的气体,在空气中极易被氧化为二氧化氮。
它在生物体内具有重要的生理作用,如调节血管舒张等。
2、二氧化氮(NO₂)二氧化氮是一种红棕色、有刺激性气味的气体,易溶于水并与水反应生成硝酸和一氧化氮:3NO₂+ H₂O = 2HNO₃+ NO二氧化氮是形成酸雨和光化学烟雾的重要污染物之一。
四、氨气(NH₃)氨气是一种无色、有刺激性气味的气体,极易溶于水,水溶液呈碱性。
1、氨气的化学性质(1)与水反应:NH₃+ H₂O ⇌ NH₃·H₂O ⇌ NH₄⁺+ OH⁻(2)与酸反应:NH₃+ HCl = NH₄Cl(3)催化氧化:4NH₃+5O₂=4NO +6H₂O(催化剂、高温)2、氨气的制备实验室常用氯化铵(NH₄Cl)和氢氧化钙Ca(OH)₂混合加热来制取氨气:2NH₄Cl + Ca(OH)₂= CaCl₂+ 2NH₃↑ + 2H₂O 工业上则是通过氮气和氢气的合成反应来大规模生产氨气。
高考复习-氮及其化合物

氮气的用途:
(1) 是合成氨、制硝酸的重要原料 (2) 保护气:焊接金属;灯泡的填充气体;
保存粮食、罐头、水果
(3) 医学上,用液氮作冷冻剂。
在常压下,液氮温度为-196℃,液氮(常写为LN2)
(4) 高科技领域中用液氮制造低温环境。
N2制备:
工业上: 空气
空气
降温加压
液态
N2
蒸发
N2 O2
C,△
)
A
氨气的物理性质
无色、有剌激性气味的气体
比空气轻 极易溶于水(1:700) 易液化(可作致冷剂)
熔沸点高(氢键)
氨气的结构和性质
氨气的电子式: 氨气和酸反应的实质是什么?
H + H+ [ ]+
NH3分子有孤对电子,易通过配位键与H+结合 形成NH4+。 据反应实质,解释氨水为什么是碱性的?
大部分
铵盐
铵盐是NH4+和酸根离子组成的化合物。
1.物理性质 铵盐都是晶体,易溶于水。
小结铵盐: 硫酸铵【(NH4)2SO4 ,俗称硫铵】 氯化铵【NH4Cl,俗称氯铵】 硝酸铵【NH4NO3,俗称硝铵、炸药】 碳酸氢铵【NH4HCO3,俗称碳铵】铵盐属于铵态 氮肥。 常用氮肥有铵态氮肥和尿素【 CO(NH2)2 】
请写出氨气的电子式:
氨气的结构和性质
孤对电子
氨气的熔沸点比PH3高还是低,为什么?列出氮族元素 氢化物熔沸点高低顺序。 比PH3高,氨气分子之间能形成氢键。 氨气在水中的溶解度如何?在CCl4或苯中呢? 1:700 氨气极易溶于水,难溶于CCl4或苯。可用来防倒吸 氨气容易发生液化吗?为什么极易液化?利用这个性质 ,液氨可以用作那种用途? 氨气易液化,液氨气化时吸收大量热,可用作制冷剂。
氮及其重要化合物

(2)CaO(或NaOH或碱石灰) 浓氨水(或浓NH4Cl溶液) ⑥
(3)①4NH3+5O2 催化剂 4NO+6H2O ====
△
2NO+O2 ====2NO2 ②2NO2(g) N2O4(g)(正反应为放热反应),降低温度使平 衡正向移动,部分红棕色NO2转化为无色N2O4
(4)①先通入O2,后通入NH3
2NO2(气)
N2O4(气) +热量,降温平衡会正向移动,生成
更多无色的四氧化二氮。
(4)氨气在空气中不能燃烧,在纯氧中能燃烧,故需先通氧气, 形成高浓度的氧气环境,且可避免不能燃烧的氨气污染环境。
△ 答案:(1)2NH4Cl+Ca(OH)2 ==== 2NH3↑+CaCl2+2H2O ③⑦ 氨气难溶于该试剂,且该试剂不易挥发,不与氨气反应
4
△
(3) NH 的检验 4 铵盐( NH ) 4
强碱 △
无色气体(NH3) 湿润红色
变蓝 试纸______
石蕊试纸
三、硝酸
1.物理性质
硝酸是无色易挥发的液体,有刺激性气味。 2.化学性质
(1)不稳定性
①反应:4HNO3
硝酸里 ________。
硝酸分解生成的NO2溶解在 ②市售浓硝酸呈黄色的原因是:________________________ 棕色 ③硝酸保存在_______试剂瓶中,置于冷暗处,不能用橡胶塞。 (2)强氧化性
△ △
②与碱反应: 铵盐与碱溶液反应的离子方程式:
NH 4 OH NH3 H 2O a. 在稀溶液中不加热:_______________________ NH OH ==== NH3 H 2O b.加热时或浓溶液: __________________________
《氮及其重要化合物》 讲义

《氮及其重要化合物》讲义一、氮元素的存在与性质氮元素在自然界中广泛存在,是地球大气的主要成分之一。
大气中约 78%是氮气(N₂)。
氮气是一种无色、无味、无毒的气体,通常情况下性质非常稳定。
氮原子的结构决定了氮元素的化学性质。
氮原子的最外层有 5 个电子,要达到稳定结构,它既可以获得 3 个电子形成-3 价的氮离子,也可以失去 5 个电子形成+5 价的氮离子,还能与其他原子共用电子对形成不同价态的化合物。
二、氮气(N₂)1、氮气的物理性质氮气在常温常压下是无色无味的气体,密度略小于空气,难溶于水。
2、氮气的化学性质由于氮氮三键(N≡N)的键能很大,所以氮气的化学性质很不活泼。
但在一定条件下,氮气也能发生化学反应。
(1)氮气与氢气的反应(合成氨)N₂+ 3H₂⇌ 2NH₃(高温、高压、催化剂)这是一个重要的工业反应,用于合成氨气,氨气是制造化肥、硝酸等的重要原料。
(2)氮气与氧气的反应N₂+ O₂= 2NO(放电或高温)生成的一氧化氮(NO)在空气中很容易被氧化为二氧化氮(NO₂)。
三、氮的氧化物1、一氧化氮(NO)NO 是一种无色、难溶于水的有毒气体。
它在常温下很容易与氧气反应生成二氧化氮。
2NO + O₂= 2NO₂2、二氧化氮(NO₂)NO₂是一种红棕色、有刺激性气味的有毒气体,易溶于水并与水反应。
3NO₂+ H₂O = 2HNO₃+ NO二氧化氮在工业上常用于制造硝酸。
3、氮氧化物的危害氮氧化物是大气污染物的重要组成部分,它们不仅会对人体健康造成危害,还会导致酸雨、光化学烟雾等环境问题。
四、氨气(NH₃)1、氨气的物理性质氨气是一种无色、有刺激性气味的气体,极易溶于水(1:700),水溶液称为氨水。
2、氨气的化学性质(1)氨气与水的反应NH₃+ H₂O ⇌ NH₃·H₂O ⇌ NH₄⁺+ OH⁻氨气的水溶液呈碱性。
(2)氨气与酸的反应NH₃+ HCl = NH₄Cl(产生白烟)这一反应常用于检验氨气的存在。
高中化学氮元素及其化合物重点知识总结
高中化学氮元素及其化合物重点知识总结(一)氮气1. 氮元素的存在既有游离态又有化合态。
它以双原子分子(N2)存在于大气中,约占空气总体积的78%或总质量的75%。
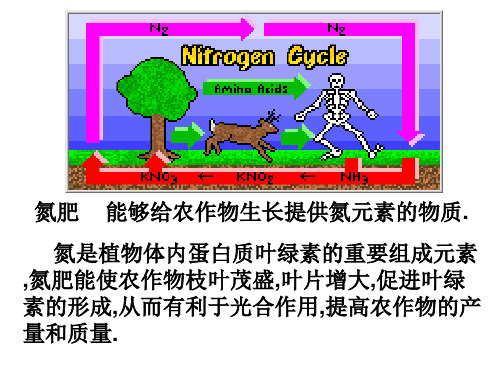
氮是生命物质中的重要组成元素,是构成蛋白质和核酸不可缺少的元素。
是农作物生长所必需的元素.充足的氮肥使植物枝叶茂盛.叶片增大,从而提高农作物的产量和质量。
2. 氮气的结构和性质(1)物理性质纯净的氮气是一种无色、无味、密度比空气稍小的气体,熔点为-209.86℃。
沸点为-195.8℃,难溶于水。
(思考N2的收集方法?)(2)结构:电子式为:______________ 结构式为___________,氮氮叁键的键能高达946kJ·mol-1,键能大,分子结构稳定,化学性质不活泼。
(3)化学性质常温下,N2的化学性质很不活泼,可代替稀有气体做保护气,但在高温、放电、点燃等条件下,N2能与H2、O2等发生化学反应。
①N2+3H2 2NH3(可逆反应)是工业上合成氨的反应原理。
②与O2反应:③与Mg反应:N2 +3 Mg Mg3N2;Mg3N2 + 6H2O=3Mg(OH)2↓+ 2NH3↑3. 氮气的用途与工业制法(1)氮气的用途:合成氨;制硝酸;用作保护气;保护农副产品;液氮可作冷冻剂。
(2)氮气的工业制法工业上从液态空气中,利用液态氮的沸点比液态氧的沸点低加以分离而制得氮气。
4. 氮的固定将空气中游离的氮气转变为氮的化合物的方法,统称为氮的固定。
氮的固定有三种途径:(1)生物固氮:豆科作物根瘤菌将N2转化为化合态氮。
(2)自然固氮:天空中打雷闪电时,N2转化为NO。
(3)工业固氮:在一定的条件下,N2和H2人工合成氨。
(二)氮的氧化物(1)物理性质NO:无色、无味的气体,难溶于水,有毒。
NO2:红棕色、有刺激性气味的气体,有毒。
(2)化学性质NO:不与水反应,易被氧气氧化为NO2。
2NO+ O2=== 2NO2NO2:①易与水反应生成硝酸和NO,在工业上利用这一反应制取硝酸。
【知识总结】氮及其重要化合物
氮及其重要化合物 知识点01 氮气的性质及应用1.氮原子结构(1)原子结构示意图:(2)在周期表中位置:第二周期第VA 族 (3)原子的轨道表示式:,单电子数:3(4)第一电离能:I 1(N )>I 1(O ) 2.氮气的结构(1)结构式N ≡N ,电子式①化学键:1个σ键2个π键 ②稳定性:σ键<π键 (2)分子极性:非极性分子 3.氮元素的自然存在4.自然界中氮的循环5.氮气的物理性质(1)色味态:无色无味气体 (2)密度:在标准状况下ρ(N 2)=22.4L/mol28g/mol =1.25g•L -1,比空气的小(极为接近)(3)溶解性:难溶于水(4)收集方法:只能用排水法(密度与空气接近,不能用排空气法) 6.氮气的化学性质(1)稳定性:N ≡N 键能很大,通常情况下很难发生反应 (2)氧化性:N 2+3H 22NH 3(工业固氮反应)(3)还原性①除去中H 2的N 2:3Mg+N 2Mg 3N 2②高能固氮反应:N2+O22NO7.氮化镁(1)电子式:(2)与水反应:Mg3N2+6H2O3Mg(OH)2↓+2NH3↑(3)与过量盐酸反应:Mg3N2+8HCl3MgCl2+2NH4Cl8、氮气的用途(1)工业上合成氨,制硝酸(2)代替稀有气体作焊接金属时的保护气,以防止金属被空气氧化(3)在灯泡中填充氮气以防止钨丝被氧化或挥发(4)保存粮食、水果等食品,以防止腐烂(5)医学上用液氮作冷冻剂,以便在冷冻麻醉下进行手术(6)高科技利用液氮制造低温环境,使某些超导材料获得超导性能(1)氮元素在自然界中主要以N2的形式存在于大气中,在空气中占体积分数约为0.78,N2的相对分子质量与空气接近,故N2的密度与空气接近,实验室只能用排水法收集。
(2)N2化学性质不活泼,在一般条件下不与氧气反应,经常作为食品包装袋的填充剂隔绝空气,避免食品被氧化变质。
在一定条件下能与部分活泼金属、非金属反应,表现出氧化性或还原性。
《氮及其重要化合物》 讲义
《氮及其重要化合物》讲义一、氮元素的简介氮是一种化学元素,原子序数为 7,位于元素周期表的第 15 族(VA 族)。
它在自然界中广泛存在,是地球大气的主要成分之一,约占大气总体积的 78%。
氮元素对于生命的存在和维持具有至关重要的意义。
氮在常温常压下是一种无色、无味、无臭的气体,化学性质相对稳定。
但在一定条件下,氮能与其他元素发生化学反应,形成各种各样的化合物。
二、氮气(N₂)1、氮气的物理性质氮气是一种无色、无味、难溶于水的气体,密度略小于空气。
在标准状况下(0℃,101kPa),氮气的密度为 1251g/L。
2、氮气的化学性质由于氮氮三键的键能很大,氮气的化学性质很不活泼,在常温下很难与其他物质发生反应。
但在高温、高压、放电等条件下,氮气能与氢气、氧气等发生反应。
(1)氮气与氢气的反应(合成氨)N₂+ 3H₂⇌ 2NH₃(高温、高压、催化剂)这是一个重要的工业反应,用于合成氨气,氨气是制造化肥、硝酸等的重要原料。
(2)氮气与氧气的反应N₂+ O₂= 2NO(放电或高温)生成的一氧化氮(NO)在空气中很容易被氧化为二氧化氮(NO₂)。
三、氮的氧化物1、一氧化氮(NO)(1)物理性质一氧化氮是一种无色、无味的气体,难溶于水。
(2)化学性质具有还原性,易被氧化为二氧化氮。
2NO + O₂= 2NO₂2、二氧化氮(NO₂)(1)物理性质二氧化氮是一种红棕色、有刺激性气味的气体,易溶于水。
(2)化学性质二氧化氮能与水反应生成硝酸和一氧化氮。
3NO₂+ H₂O = 2HNO₃+ NO二氧化氮自身还存在二聚反应:2NO₂⇌ N₂O₄四、硝酸(HNO₃)1、物理性质纯硝酸是无色、有刺激性气味的液体,易挥发。
2、化学性质(1)强酸性硝酸在水溶液中完全电离,具有强酸性。
(2)不稳定性见光或受热易分解,4HNO₃= 4NO₂↑ + O₂↑ + 2H₂O(3)强氧化性能与许多金属(除金、铂等少数金属外)和非金属发生氧化还原反应。
高考化学总复习课件氮及其重要化合物
成了蛋白质的基本骨架。
氮在蛋白质中的存在形式
02
蛋白质中的氮主要以酰胺键(-CONH-)的形式存在,连接氨
基酸形成多肽链。
蛋白质中氮的含量与蛋白质的质量关系
03
蛋白质中氮的含量是评价蛋白质质量的重要指标之一,高质量
的蛋白质通常含有较高的氮。
生物固氮与氮肥的生产和使用
生物固氮的概念
生物固氮是指某些微生物能够将大气中的氮气转化为氨或其他含氮 化合物的过程。
05
氮及其化合物的实验探究
氨的实验室制法
1 2
反应原理
利用氮气和氢气在高温高压下催化合成氨气。
实验装置
包括合成塔、热交换器、冷凝器、分离器等。
3
实验步骤
将氮气和氢气按一定比例混合,通过合成塔中的 催化剂层,在高温高压下反应生成氨气,经过冷 凝器冷却后得到液态氨。
铵盐的性质实验
铵盐的溶解性
铵盐易溶于水,且溶解度随温度升高而增大。
解题速度和准确性。
模拟试题与答案解析
模拟试题一
以氮的氧化物和氨的合成为背景,考查化学反应原理和化学计算。通过解析该题,可以检 验学生对相关知识点的掌握情况。
模拟试题二
涉及氮的固定、转化和铵盐的性质等知识点,考查学生综合运用知识解决问题的能力。答 案解析详细分析了解题思路和方法。
模拟试题三
以氮及其化合物的应用为背景,考查学生实验探究能力和创新思维。答案解析提供了多种 可能的实验方案和设计思路。
备考策略与建议
01
02
03
04
系统复习氮及其重要化合物的 性质、转化关系等基础知识,
形成完整的知识网络。
重视实验探究,掌握氮及其化 合物的实验方法和操作技能, 培养实验设计和分析能力。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1 温馨提示: 模拟题库为Word版,请按住Ctrl,滑动鼠标滚轴,调节合适的观看比例,点击右上角的关闭按钮可返回目录。
【考点16】 氮元素单质及其重要化合物 1.(2010·荆门模拟)13.8g 63%的HNO3溶液(密度为1.38g•cm-3)和100mL 13.8 mol/L的HNO3溶液相比,正确的是( ) A.都应用棕色广口瓶存储 B.浓度不同的两种HNO3溶液 C.溶液的体积不同但浓度相同 D.均可与Au反应而发生钝化现象
【解析】选C。浓硝酸应该盛放在棕色细口瓶中,因此A选项错误;前者根据公式c=1000ρw%/M可以计算出物质的量浓度为13.8 mol/L,因此两者浓度相同,B选项错误;C选项正确;浓硝酸不与Pt、Au反应,室温下浓硝酸能够使铁、铝钝化因此D选项错误。 2.(2010·福建师大附中模拟)相同质量的铜片分别与过量的体积相同的浓硝酸、稀硝酸反应。二者比较,相等的是( ) ①铜片消耗完所需时间; ②反应生成的气体体积(标准状况); ③反应中氧化剂得到的电子总数; ④反应后溶液中铜离子的浓度
A.①③ B.②④ C.③④ D.只有① 【解析】选C。硝酸的浓度越大,反应速率越快,消耗时间越少;1mol Cu与足量的浓硝酸反应会生成2mol NO2, 1mol Cu与足量的稀硝酸反应会生成2/3 mol NO;参加反应的铜的质量相同,因此氧化剂得到的电子也相同;由于铜元素守恒,反应后溶液中铜离子的浓度也相同。 3.(2010·龙岩模拟)亚硝酸(HNO2)及其钠盐参加反应时既可作氧化剂又可作还原剂。当它们作还原剂时,生成的含氮产物可能是( ) A.NO B.N2 C.NO2 D.NH3 【解析】选C。当亚硝酸(HNO2)及其钠盐作还原剂时,氮元素的化合价只能升高,因此选C选项。 4.(2010·南京模拟).研究发现,空气中少量的NO2能参与硫酸型酸雨的形成,反应过程如下: ①SO2+NO2→SO3+NO ②SO3+H2O→H2SO4 ③2NO+O2→2NO2
NO2在上述过程中的作用,与H2SO4在下列变化中的作用相似的是( )
A.加入少量H2SO4使淀粉水解 B.碳酸钠与硫酸反应 C.向铜和双氧水的混合物中加入硫酸 D.潮湿的氯气通过盛有浓H2SO4的洗气瓶 2
【解析】选A。观察题干信息可知,NO2起到了催化剂的作用,A选项中H2SO4起了催化剂的作用;B、C选项中H2SO4作为反应物;D选项中浓H2SO4起到了干燥剂的作用,A选项符合题意。 5.(2010·湖南师大附中模拟)在常温常压下,在a、b、c、d四支相同的试管中,分别装入等物质的量混合的两种气体。a试管内是NO2和O2;b试管内是Cl2和SO2;c试管内是NO和O2;d试管内是CO和O2。将四支试管迅速同时倒立于水中,最后水面上升高度h的比较正确的是( ) A、b>c>a>d B、 c>a>b>d C、d>a>c>b D、b>a>c>d
【解析】选A。假设试管中的气体分别为1mol ,那么试管a中剩余3/4mol 的O2, 试管b中无气体剩余, 试管c中剩余1/4mol 的O2,试管d中CO和O2均难溶于水,试管中剩余气体越少水面上升高度越高,因此A选项正确。 6.(2010·南京模拟)下列有关工业生产的叙述中,错误的是 ( ) A.制普通玻璃的主要原料是纯碱、石灰石、石英 B.氨是制作氮肥、硝酸、铵盐的重要原料 C.将二氧化硫催化氧化生成三氧化硫后,在吸收塔内用水吸收制得浓硫酸 D.炼铁的主要原理是在高温下,用还原剂从铁矿石中把铁还原出来 【解析】选C。如果吸收塔内用水吸收三氧化硫会形成酸雾,工业上是用浓硫酸来吸收三氧化硫。 7.(2010·姜堰模拟)下列叙述正确的是( )(用NA代表阿伏加德罗常数的值) A.2.7g金属铝变为铝离子时失去的电子数为0.3NA
B.标准状况下,5.6L一氧化氮和5.6L氧气混合后的气体中分子总数为0.5NA
C.在标准状况下,体积均为22.4L的CH4与H2O所含有的电子数均为10NA
D.CO和N2为等电子体,22.4L的CO气体与1molN2所含的电子数相等
【解析】选A。Al→Al3+,0.1mol Al失去0.3mol的电子,A选项正确;一氧化氮和氧气反应会生成二氧化氮,混合后分子总数会小于0.5NA,B选项错误;标况下水是液体,C选项错误;D选项未给出标况下,22.4L的CO气体可能不是1molCO,因此D选项错误。 8.(2010·长沙模拟)a mol FeS与b mol FeO投入到VL、c mol/L的硝酸溶液中充分反应,产生NO气体,所得澄清溶液成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为( ) ①(a+b)×63g ②(a+b)×189g ③(a+b)mol ④Vc-(9a+b)/3mol A.①④ B.②③ C.①③ D.②④
【解析】选D。在此反应中硝酸分两部分参加反应即硝酸的总量=被还原的硝酸的量+未被还原的硝酸的量,由铁原子守恒和氮原子守恒可知n(未被还原的硝酸)=3n[Fe(NO3)3],m(未被还原的硝酸)=(a+b)×3×63=(a+b)×189g;由得失电子相等可以求出被还原的硝酸的物质的量:a×(3-2)+a×[6-(-2)]+b×(3-2)=n(被还原的硝酸)×(5-2) n(被还原的硝酸)= (9a+b)/3mol,n(未被还原的硝 3
酸)=n(总硝酸)—n(被还原的硝酸)= Vc-(9a+b)/3mol因此D选项正确。 9.(2010·台州模拟)1.28g Cu完全溶于一定量的浓HNO3中,生成的气体刚好充满500mL的烧瓶,然后将该烧瓶倒置于水中,缓缓通入一定量的氧气后容器内刚好充满水,则通入的氧气为( ) A.0.16g B.0.02mol C.0.32g D.0.224g 【解析】选C。铜失去的电子给了硝酸,然后硝酸被还原为氮氧化物,氮氧化物与氧气反应,氮氧化物又把电子给了氧气,相当于铜直接把电子给了氧气;由得失电子相等可以计算,n(失电子)=n(得电子),n(Cu)×2=n(O2)×4,(1.28÷64)×2= n(O2)×4, n(O2)=0.01mol,m(O2)=0.01mol×32g/mol=0.32g,因此C选项正确。 10.(2010·济南模拟)向一定量的Fe、FeO、Fe2O3、Fe3O4的混合物中加入150mL4 mol·L-1的稀硝酸恰好使混合物完全溶解,放出2.24LNO(标准状况),往所得溶液中加入KSCN溶液,无红色出现。若用足量的H2在加热条件下还原相同质量的混合物,所得到的铁的物质的量为( ) A.0.21mol B.0.25mol C.0.3mol D.0.35mol 【解析】选B。稀硝酸恰好使混合物完全溶解,加入KSCN溶液,无红色出现,说明铁元素在溶液中以Fe(NO3)2形式存在,根据氮元素守恒可以求出n[Fe(NO3)2]=[0.15L×4 mol·L-1—2.24L÷22.4L·mol—1] ÷2=0.25mol,再由铁元素守恒,可以知用足量的H2在加热条件下还原相同质量的混合物,所得到的铁的物质的量为0.25mol 11.(2010·台州模拟) 如图,同温同压下,两个等体积的干燥圆底烧瓶中分别充满①NH3、②NO2,进行喷泉实验。经充分反应后,瓶内溶液的物质的量浓度为( ) A.①>② B.①<② C.①=② D.不能确定
【解析】选C。假设两个容器的状况为标准状况,①中物质的量浓度计算公式为c=(VL÷22.4 L·mol—1) ÷VL=1/22.4 mol·L-1 ②中物质的量浓度计算公式为c=(2/3×V/22.4)mol÷2/3L=1/22.4 mol·L-1 因此C选项正确。 12.(2010·烟台模拟)下列说法不正确的是 ( ) A.当镀锡铁制品的镀层破损后,镀锡铁比镀锌铁更耐腐蚀,镀层能对铁制品起电化学保护作用 B.离子化合物中可以不含金属元素 C.12C和14C互为同位素,而C60与C70互为同素异形体 D.若硝酸与锌反应还原的产物为N2O,被还原硝酸与未被还原硝酸的物质的量之比为1:4 4
【解析】选A。镀锡铁制品的镀层破损后,形成原电池,铁比锡活泼,铁做负极失电子易被氧化;镀锌铁制品的镀层破损后,形成原电池,锌比铁活泼,铁做正极,受到保护,因此A选项错误;铵盐属于离子化合物不含金属元素,B选项正确;12C和14C互为同位素,而C60与C70互为同素异形体,C选项正确;假设生成1mol的N2O,xmol锌参与反应,由得失电子相等:1×2×(5-1)=2x x=4 mol 生成硝酸锌的物质的量为4 mol,n(被还原硝酸):n(未被还原硝酸)=1×2:4×2=1:4,D选项正确。 13.(2010·天津和平区模拟)已知A为常见金属,X、Y为常见非金属,X、E、F、G常温下为气体,C为液体,B是一种盐,受热极易分解,在工农业生产中用途较广(如被用作某些电池的电解质)。现用A与石墨作电极,B的浓溶液作电解质,构成原电池。有关物质之间的转化关系如下图:(注意:其中有些反应的条件及部分生成物被略去)
请填写下列空白: (1)反应④为A在某种气体中燃烧,生成单质Y和A的氧化物,其反应方程式为 。 (2)从D溶液制备D的无水晶体的“操作a”为 。 (3)反应②的化学方程式为 。 (4)反应⑤的化学方程式为 。 (5)原电池反应①中正极的电极反应式为 【答案】 (1)2Mg+CO2 ==== 2MgO+C (2)将D溶液在HCl气流中蒸干 (3)②4NH3+5O2 ==== 4NO+6H2O
(4)⑤C+4HNO3(浓)====CO2↑+4NO2↑+2H2O (5)2NH4++2e- ==== 2NH3↑+H2↑
14.(2010·厦门模拟)下列物质有如下转化关系(有的生成物未列出),其中:D为碱,G为酸,金属甲在G 的浓溶液中会钝化;F的溶液中只含一种溶质。
Y A 氯气 D溶液 C X D无水晶体
E F G H
A B溶液 G 原电池 反应
+氧气⑥ +Y高温⑦
① ② ③
电解 熔融 操作a +氧气 +氧气 +C ⑤ △
④
浓溶液
△ 加热 催化剂
