一种简便适用的蛋白质水解方法_章蓓
生物化学实验指导实验一蛋白质的性质实验(一)(呈色反应)一、目的1
生物化学实验指导实验一蛋白质的性质实验(一)(呈色反应)一、目的1.了解构成蛋白质的基本结构单位及主要联接方式。
2.了解蛋白质和某些氨基酸的呈色反应原理。
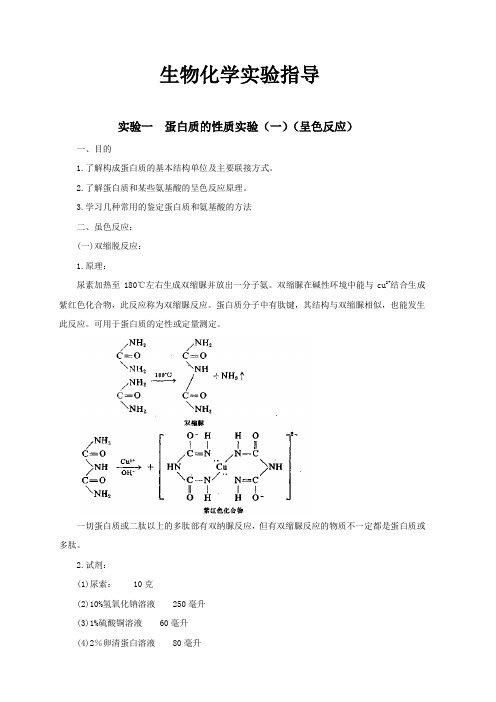
3.学习几种常用的鉴定蛋白质和氨基酸的方法二、虽色反应:(一)双缩脱反应:1.原理:尿素加热至180℃左右生成双缩脲并放出一分子氨。
双缩脲在碱性环境中能与cu2+结合生成紫红色化合物,此反应称为双缩脲反应。
蛋白质分子中有肽键,其结构与双缩脲相似,也能发生此反应。
可用于蛋白质的定性或定量测定。
一切蛋白质或二肽以上的多肽部有双纳脲反应,但有双缩脲反应的物质不一定都是蛋白质或多肽。
2.试剂:(1)尿索: 10克(2)10%氢氧化钠溶液 250毫升(3)1%硫酸铜溶液 60毫升(4)2%卵清蛋白溶液 80毫升3.操作方法:取少量尿素结晶,放在干燥试管中。
用微火加热使尿素熔化。
熔化的尿素开始硬化时,停止加热,尿素放出氨,形成双缩脲。
冷后,加10%氢氧化钠溶液约1毫升,振荡混匀,再加1%硫酸铜溶液1滴,再振荡。
观察出现的粉红颜色。
避免添加过量硫酸铜,否则,生成的蓝色氢氧化铜能掩盖粉红色。
向另一试管加卵清蛋白溶液约l毫升和10%氢氧化钠溶液约2毫升,摇匀,再加1%硫酸铜溶液2滴,随加随摇,观察紫玫色的出现。
(二)茚三酮反应1.原理:除脯氨酸、羟脯氨酸和茚三酮反应产生黄色物质外,所有α—氨基酸及一切蛋白质都能和茚三酮反应生成蓝紫色物质。
该反应十分灵敏,1:1 500 000浓度的氨基酸水溶液即能给出反应,是一种常用的氨基酸定量测定方法。
茚三酮反应分为两步,第一步是氨基酸被氧化形成CO2、NH3和醛,水合茚三酮被还原成还原型茚三酮;第二步是所形成的还原型茚三酮同另一个水合茚三酮分于和氨缩合生成有色物质。
反应机理如下:此反应的适宜pH为5—7,同一浓度的蛋白质或氨基酸在不同pH条件下的颜色深浅不同,酸度过大时甚至不显色。
2.试剂:(1)蛋白质溶液 100毫升2%卵清蛋白或新鲜鸡蛋清溶液(蛋清:水=1:9)(2)0.5%甘氨酸溶液 80毫升(3)0.1%茚三酮水溶液 50毫升(4)0.1%茚三酮—乙醇溶液 20毫升3.操作方法:(1)取2支试管分别加入蛋白质溶液和甘氨酸溶液1毫升,再各加0.5毫升0.1%茚三酮水溶液,混匀,在沸水浴中加热1—2分钟,观察颜色由粉色变紫红色再变蓝。
蛋白质的分离纯化方法(参考资料)

蛋白质的分离纯化方法2.1根据分子大小不同进行分离纯化蛋白质是一种大分子物质,并且不同蛋白质的分子大小不同,因此可以利用一些较简单的方法使蛋白质和小分子物质分开,并使蛋白质混合物也得到分离。
根据蛋白质分子大小不同进行分离的方法主要有透析、超滤、离心和凝胶过滤等。
透析和超滤是分离蛋白质时常用的方法。
透析是将待分离的混合物放入半透膜制成的透析袋中,再浸入透析液进行分离。
超滤是利用离心力或压力强行使水和其它小分子通过半透膜,而蛋白质被截留在半透膜上的过程。
这两种方法都可以将蛋白质大分子与以无机盐为主的小分子分开。
它们经常和盐析、盐溶方法联合使用,在进行盐析或盐溶后可以利用这两种方法除去引入的无机盐。
由于超滤过程中,滤膜表面容易被吸附的蛋白质堵塞,以致超滤速度减慢,截流物质的分子量也越来越小。
所以在使用超滤方法时要选择合适的滤膜,也可以选择切向流过滤得到更理想的效果离心也是经常和其它方法联合使用的一种分离蛋白质的方法。
当蛋白质和杂质的溶解度不同时可以利用离心的方法将它们分开。
例如,在从大米渣中提取蛋白质的实验中,加入纤维素酶和α-淀粉酶进行预处理后,再用离心的方法将有用物质与分解掉的杂质进行初步分离[3]。
使蛋白质在具有密度梯度的介质中离心的方法称为密度梯度(区带)离心。
常用的密度梯度有蔗糖梯度、聚蔗糖梯度和其它合成材料的密度梯度。
可以根据所需密度和渗透压的范围选择合适的密度梯度。
密度梯度离心曾用于纯化苏云金芽孢杆菌伴孢晶体蛋白,得到的产品纯度高但产量偏低。
蒋辰等[6]通过比较不同密度梯度介质的分离效果,利用溴化钠密度梯度得到了高纯度的苏云金芽孢杆菌伴孢晶体蛋白。
凝胶过滤也称凝胶渗透层析,是根据蛋白质分子大小不同分离蛋白质最有效的方法之一。
凝胶过滤的原理是当不同蛋白质流经凝胶层析柱时,比凝胶珠孔径大的分子不能进入珠内网状结构,而被排阻在凝胶珠之外,随着溶剂在凝胶珠之间的空隙向下运动并最先流出柱外;反之,比凝胶珠孔径小的分子后流出柱外。
实验六蛋白质的水解和氨基酸的纸层析法分离

实验六蛋白质的水解和氨基酸的纸层析法分离一、目的1.学习水解蛋白质的方式。
2.把握纸层析的大体技术。
3.学习用纸层析分离、鉴定氨基酸的方式。
二、原理1.蛋白质的水解蛋白质能够用酸、碱或酶如胃蛋白酶,胰蛋白酶,糜蛋白酶水解成最终产物氨基酸。
实验室中常利用酸解法水解蛋白质。
当在6 mo叭。
盐酸溶液中将蛋白质在110t加热大约20 h,肽键断裂,现在蛋白质完全分解为氨基酸。
酸法水解蛋白质的优势是在水解进程中不发生外消旋作用,所取得的氨基酸均为L一氨基酸。
大多数氨基酸在煮沸酸中是稳固的,但色氨酸那么完全被破坏。
丝氨酸和苏氨酸在酸解进程中或多或少地也有破坏。
色氨酸的水解产物已知是一种棕黑色的物质——腐黑质,因此,用酸法水解蛋白质取得的水解液为棕黑色的。
2.纸层析法分离氨基酸纸层析是以滤纸作为支持物的分派层析法。
它利用不同物质在同一推动剂中具有不同的分派系数,经层析而达到分离的目的。
在必然条件下,一种物质在某溶剂系统中的分派系数是一个常数,假设以K表示分派系数层析溶剂(又称推动剂),是选用有机溶剂和水组成的。
滤纸纤维素与水有较强的亲和力(纤维素分子的葡萄糖基上的-OH基与水通过氢键相作用)能吸附很多水分,一样达滤纸重的22%左右(其中约有6%的水与纤维素结合成复合物),由于这部份水扩散作用降低形成固定相;而推动剂中的有机溶剂与滤纸的亲和力很弱,可在滤纸的毛细管中自由流动,形成流动相。
层析时,点有样品的滤纸一端浸入推动剂中,有机溶剂持续不断地通过点有样品的原点处,使其上的溶质依据本身的分派系数在两相间进行分派。
随着有机溶剂不断向前移动,溶质被携带到新的无溶质区并继续在两相间发生可逆的从头分派,同时溶质离开原点不断向前移动,溶质中各组分的分派系数不同,前进中显现了移动速度不同,通过一按时刻的层析,不同组分便实现了分离。
物质的移动速度以R f值表示:各类化合物在恒定条件下,层析后都有其必然的R f值,借此能够达到定性、辨别的目的。
蛋白质脱盐方法

蛋白质脱盐方法蛋白质是生物体中重要的分子,对于研究其结构和功能具有重要意义。
然而,在进行蛋白质研究时,常常需要将蛋白质从混合物中分离出来,并去除其中的盐类。
这就需要采用蛋白质脱盐方法。
蛋白质脱盐是指通过一系列的操作步骤将蛋白质样品中的盐类去除,以便于后续的实验操作。
下面将介绍几种常用的蛋白质脱盐方法。
一、盐析法盐析法是一种常用的蛋白质脱盐方法。
它利用蛋白质在高盐浓度下溶解度降低的特点,通过控制溶液中的盐浓度,使蛋白质从溶液中沉淀出来。
盐析法操作简单,适用于大多数蛋白质。
盐析法的步骤如下:1. 将蛋白质溶液加入适量的高盐缓冲液中,使蛋白质溶解。
2. 缓慢加入低盐缓冲液,使盐浓度逐渐降低。
3. 盐浓度降低到一定程度后,蛋白质会出现沉淀,可以通过离心将沉淀物和上清液分离。
4. 将沉淀物溶解在适量的低盐缓冲液中,即可得到脱盐后的蛋白质溶液。
二、透析法透析法是一种利用半透膜将蛋白质与溶液中的盐类分离的方法。
透析法操作简单,适用于大分子量的蛋白质。
透析法的步骤如下:1. 将蛋白质溶液装入透析袋中,封闭袋口。
2. 将封闭的透析袋放入含有低盐缓冲液的容器中。
3. 通过半透膜的作用,蛋白质会逐渐从高盐浓度的溶液中透析到低盐浓度的溶液中。
4. 定期更换低盐缓冲液,直到蛋白质完全脱盐。
三、离子交换层析法离子交换层析法是一种利用离子交换树脂将蛋白质与溶液中的盐类分离的方法。
离子交换层析法操作相对复杂,但可以实现高效的蛋白质脱盐。
离子交换层析法的步骤如下:1. 将蛋白质溶液加载到预先平衡的离子交换树脂柱上。
2. 通过适当的缓冲液进行洗脱,将蛋白质与盐类分离。
3. 收集洗脱液中的蛋白质溶液,即可得到脱盐后的蛋白质。
四、超滤法超滤法是一种利用超滤膜将蛋白质与溶液中的盐类分离的方法。
超滤法操作相对简单,适用于小分子量的蛋白质。
超滤法的步骤如下:1. 将蛋白质溶液加入超滤装置中。
2. 施加适当的压力,使溶液通过超滤膜。
3. 盐类和其他小分子量物质会通过超滤膜排除,蛋白质则被滞留在超滤膜上。
蛋白质有哪些提取方法

蛋白质有哪些提取方法蛋白质提取方法有很多种,根据提取目的和样品特点的不同,可以选择适合的方法。
下面将介绍一些常用的蛋白质提取方法。
1. 机械破碎法:机械破碎法是最简单、最常用的蛋白质提取方法之一。
可以通过研磨、绞碎等方法将样品直接破碎,然后使用缓冲液溶解并离心,收集上清液中的蛋白质。
这种方法适用于坚硬组织的提取,如植物种子、皮肤等。
2. 超声波法:超声波法是一种通过高频震荡来破碎细胞膜的方法。
将样品与缓冲液混合后,利用超声波仪器进行处理,使细胞破裂释放出蛋白质。
这种方法操作简便、高效,适用于细胞培养物和柔软组织的提取。
3. 高压法:高压法是利用高压力破坏细胞膜,使蛋白质从细胞内部释放出来。
将样品与缓冲液混合后,置于高压容器中,施加高压力进行破碎。
这种方法适用于细胞培养物和柔软组织的提取,可以得到较高纯度的蛋白质。
4. 化学法:化学法是通过使用化学试剂使细胞破裂,溶解蛋白质。
常用的化学试剂包括乙醇、酸、酶等。
根据试剂的选择和浓度的不同,可以得到不同纯度和类型的蛋白质。
这种方法操作简单,适用于多种样品的提取。
5. 溶剂提取法:溶剂提取法是一种将样品与有机溶剂混合后,通过振荡、搅拌等方法使目标蛋白质溶于溶剂中,然后用离心将蛋白质从溶液中分离出来的方法。
常用的有机溶剂包括甲醇、醋酸乙酯等。
这种方法适用于脂质较多的样品,如种子、脂肪组织等。
6. 离心法:离心法是将样品与缓冲液混合后进行离心,利用离心过程中的离心力使细胞破裂,然后收集上清液中的蛋白质。
这种方法操作简单,适用于多种样品的提取,尤其适用于含有较多细胞碎片的样品。
7. 电泳法:电泳法是一种利用电场将蛋白质在凝胶中分离的方法。
通过混合样品与凝胶,然后施加电场,不同大小和带电性的蛋白质会在凝胶中运动,从而实现分离。
这种方法适用于复杂样品的蛋白质组分分析和纯化。
总结起来,蛋白质的提取方法多种多样,根据样品特点的不同选择合适的方法非常重要。
以上介绍的方法只是其中的一部分,还有许多其他方法,如柱层析法、磁珠法等。
棉籽蛋白水解物水解度3种测定方法的比较

棉籽蛋白水解物水解度3种测定方法的比较林虬;黄薇;宋永康;姚清华;颜孙安;钱爱萍【摘要】介绍了一种比较简单可行、适用于棉籽蛋白水解度的测定方法——OPA 法.选用中性蛋白酶将棉籽蛋白水解成棉籽多肽,通过新建立的方法测定不同酶解时间棉籽蛋白水解液的水解度,并与文献所报道的甲醛滴定法和茚三酮比色法进行比较.结果表明,与甲醛滴定法和茚三酮比色法相比,OPA法更简便、更快速,且灵敏度高、可重复性强、对环境友好,是3种方法中最适合测定棉籽蛋白水解液水解度的方法,同时该方法也适用于饲料及食品行业中其他蛋白水解度的测定.%This paper introduced a method that based on the reaction oi primary ammo groups with o-phthaldialdehyde (OPA) for determining the hydrolytic degree of cottonseed protein. Neutral protease was used to hydrolyze cottonseed protein and the degree of hydrolysis (DH) was compared with three assay methods, I. E. O-phthaldialdehyde method, formaldehyde titration method and ninhydrin colorimetric method. Comparing with formaldehyde titration and ninhydrin colorimetric methods, results showed that OPA method performed more accurate and faster in analyzing, easier to handle, repeatable in results and friendly for environment. It is recommended that OPA method is an appropriate method for evaluating in hydrolytic degree of cottonseed protein.【期刊名称】《福建农业学报》【年(卷),期】2011(026)006【总页数】5页(P1076-1080)【关键词】水解度;棉籽蛋白;对苯二甲醛法【作者】林虬;黄薇;宋永康;姚清华;颜孙安;钱爱萍【作者单位】福建省农业科学院中心实验室,福建福州 350003;福建省精密仪器农业测试重点实验室,福建福州 350003;福建省农业科学院中心实验室,福建福州350003;福建省精密仪器农业测试重点实验室,福建福州 350003;福建省农业科学院中心实验室,福建福州 350003;福建省精密仪器农业测试重点实验室,福建福州350003;福建省农业科学院中心实验室,福建福州 350003;福建省精密仪器农业测试重点实验室,福建福州 350003;福建省农业科学院中心实验室,福建福州350003;福建省精密仪器农业测试重点实验室,福建福州 350003;福建省农业科学院中心实验室,福建福州 350003;福建省精密仪器农业测试重点实验室,福建福州350003【正文语种】中文近年来,棉籽蛋白受到饲料业的普遍关注,提高棉籽蛋白资源利用率成为当前国内外学者研究的热点,其中使用蛋白酶生物技术将低值的蛋白源转化成多肽、寡肽等高值蛋白原料的方法极具生命力,是目前棉籽蛋白质的开发和利用的新方法和思路。
食品化学_蛋白质3分解
蛋白质的烷基化
方法:pH8-9条件下用碘乙酸或碘乙酰胺与氨基 或SH基反应,引入烷基。
效果:分子中正电荷减少,电子密度增大,不同 pH下的溶解性发生改变,减少二硫键交联。
方法:在还原剂存在条件下氨基被还原烷基化, 产生糖蛋白。脂肪醛酮或还原糖提供羰基。
效果:蛋白质疏水性/亲水性变化,改善起泡性 和乳化性。
蛋白质与脂肪酰氯或N-羟基琥珀酰亚胺反应引入 长链脂肪酸可以有效改善乳化性质,有利形成蛋 白质聚集结构。
酰基化反应1
酰基化反应3
蛋白质的磷酸化
方法:蛋白质与三氯氧磷反应,Ser和Thr中的 羟基和Lys中的氨基可以被磷酸化。
效果:磷酸化蛋白质对钙高度敏感,并可能导致 蛋白质的聚合化。
由于N-P键在胃中可以分解,因此不会影响蛋白 质的营养价值。
烧、烤、煎炸等加工方式可能导致食品表面蛋白 质温度超过200℃。
蛋白质分解产生致癌物质咔啉
R2
N H
N
R1
R6 N
N N H
R3
N H
R5
R4
B 氨基酸的消旋化 recemization
蛋白质在碱性条件下加热或200℃以上高温加热 时可产生L-氨基酸部分消旋化。
电子密度较大的Asp、Ser、Cys、Glu、Phe、 Asn、Thr较易发生消旋化。
碱性条件下加热还可导致β-消除反应,生成脱氢 丙氨酸(DHA)。
消旋化导致蛋白质消化吸收率下降。 D-氨基酸对人体无营养作用。
DHA的形成和消旋化
H NH C C
OH-
NH C C
CH2 O
CH2 O
R
R
NH C C CH2 O
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
泳但后者需时稍长这可能与蛋白质在
等电
点聚焦后处于电中性有关一般用电泳方法洗、脱4~厚凝胶片内的蛋白需1一3小时用
本法洗脱HbCyt一和铁蛋白(分子量分别为.67万,L3万和80万)的时间分别为l2
和
25小
时
在样品凝胶片上铺一薄层琼脂糖既防止了低浓度凝胶片在30务甘油中漂浮又为收集
蛋白样品提供了一个完整而密封的底以免样
品液流失3MNaCI覆盖在30并
甘油上后二
层间如无明显界面,则蛋白质的电泳速度将大大减慢而且蛋白质进人D层后会向E层扩
散这可能与高电导E层和低电导D层所组成的不连续电导梯度被破坏有关我们在洗脱三种蛋白(IP分别为.46679和106)时分别采用碑88和哪108两个缓冲系统结果洗脱
效果完全相同关于平板凝胶电泳和等电点聚
焦电泳后蛋白的电泳洗脱的原理及操作步骤基
本相同参考文献
飞we1234,687[9[10BvarDetal:助alBio改朗,55213197,M吐ioCmAJet威:JI,脚、刀0112825991982
Ah切adlBetal:A刀alBi伍:]`e脚97
229
1979
HanaokaFetal:A粉alBio比e附9170
1979
BrownA5etal:A刀alBzocl阴103一84
1980Katsnaspetal:A称alBio血e脚771651977ZiolaBRetalA粉al刀ioel:e附723661976
WaehsliehtHetal:A刀`1工弓ioc人e房84
533
1978OttoMetal
:
A忿alBioc八e从1111111950
StralforsPetal:An可Bi;c]绪脚128,7
1983
[本文于1984年11月21日收到]
一种简便适用的蛋白质水解方法
章蓓倪大洲刘祖
洞
〔复旦大学遗传研究所上海)
进行蛋白质的氨基酸的组成分析时蛋白质水解液的制备是十分重要的一步样品水解的好坏直接影响测定结果的准确性经典水解条件是:6NHCI110℃在封管条件下恒温水解24小时在这条件下进行水解蛋白质分子中的SerThrTrpCysTyrMet仍可能因氧化降解等反应影响回收率l[]为此,要求在封管时减压或充氮以提高回收率,但这又需要特殊装置圆国内一般实验室不具备这样的条件我们试用15而聚丙烯带盖的离心管代替玻璃指管进行蛋白质水解实验结果表明用这二种管子水解结果相同而使用聚丙烯离心管可以免去加热封管等步骤减少了样品的损失确实是一种较为简便适用的蛋白质水解方
法
材料与方法1胰岛素细胞色素c均为分析纯
2氨基酸标准样品17种氨基骏和氨(eBckmon公司产)稀释成250,二目Zml的各种氨基酸混合液3玻
璃指管水解胰岛素或油胞色素C各
l
mg分别置于玻璃指管(10X10omrn)中加
人6夕HCIIiln煤气灯上加热封口110℃
水
解24小时,尔后挥发HCI,用无离子水洗涤三次,加人pH22柠檬酸缓冲液Iiln从中取100川上
柱
4聚丙烯离心管水解:除用聚丙烯离心管代替玻璃指管外其他水解方法同(3)5氮甚酸分析仪操作及氮甚酸定性定t方法参照文献[3]结果与讨论为了使分析结果准确减少其他误差因素各组样品在进行蛋白质水解时均未抽真空或充一51几几孟君圈1扭荃胶标准液的柱层析色谱图1Ap2Thr3S斗Gly5rPo6Gl7Al8Cys9val10Met11xl12L13ryrl斗hP15His16Ly17NH18Ag氮气也未加各种保护剂,以便直接比较水解蛋白质的效果
图2(a)(b)和图3(,)(b)分别为胰岛素和细胞色素c的玻璃指管和聚丙烯离心管水解液的柱层析色谱图图中的每种氨基酸是根据氨
基酸标准液的柱层析色谱(图l)鉴定出从表1
和表2可见,胰岛素在玻璃指管中水解其AsP,
ThreS
rG
lu含量明显低于在聚丙烯
离心管
中水解而用这两种管子水解细胞色素
。
结果
相差不大这可能是在室温下细胞色素C易溶于HCI而胰岛素则不溶沾在管壁在玻璃指管封口时遭到破坏因此在常温下不易溶解的
蛋白质使用聚丙烯离心管水解更为合适,其氨
基酸回收率明显高于用
玻璃指管
从表2可见细胞色素。在玻璃指管中水
解Met完全被破坏而在聚丙烯管的水解液中尚可测出(尽管它的含量低于理论值)这是因为Mct在玻璃指管中水解时约有20多氧
化为eMt的衍生物通过柱层析又有65外的衍生物不能收回4[]而用聚丙烯离心管水解由于聚丙烯管体积小加以操作简便与空气接触时间短所以Met被降解的也少回收率就提高同样,胰岛素和细胞色素。中的val和胰
岛素中的Csy用聚丙烯离心管水解比用玻璃
721.
卜`而
`
2曰
口赞l华
::孟,0J龙’妇:,
于`汤补,劫`人
一一
s()
图2玻璃指管水解1AsP10llea21.lLeu3S12Tyr映岛素水娜浪的往层析色讼圈b聚乙烯离心管水解书oly5砂。6olu7Ala8ey9val13Jbl弓卜”15卫i,场NH17人
r
,]`弓
1,
,】L3
12
l5
103-
/2
,名
l4
l0
1,
4
}公,、用淤l
6
lI
日3(a)用玻玻指管水解的细脸色素。柱层析色斑圈1Ap2Thr3Gly4Pr5Glu6^Ia7vz8lle夕二eu10Tyr1lbPe12Lys13Hi1巧NH15Arg圈3(`)用班丙姗离心1水解的细胞色寨e柱层析色谱圈
1Asv2Thr3Gly4rPo5Glu
6Al7vl8Met9ll10L11Tyr12ph13Lys14Hi15NH16Arg
农1映岛素测定结果与理论位的比较(克分子比值)裹2细胞色素。测定结果与理论位比较(克分子比值)
氨基酸酸玻璃管水聚丙烯管管理论值tB1解结果果水解结果AP173030Thr151510Ser203030Glu207170Proo12l110Gly414340Ala3嘴2830Cy071530Vl375嘴50Illl1310L606160Tyr403740Ph32323DHis121320Lyll1010Arg101010氨基酸玻璃管水聚丙烯理论值83L
解结果水解结果果
Ap72768O*
Thr99101100
S0O0
Gl116117120
P2839呼0
Gly115115120
Al555560
Vl273130
Mt00620
1l5月5360
I595760
ry293140
ph353440
H1l4l430
Ly190193190Arg
151620
二为样品中Glu与Gln之和.
为样品中A印和人。之和
1,.2指管好文献记载闭兼丙烯熔点176℃静弯曲强度
675kg/c衬压缩强度56okg/em,吸水率(24h)
003务内圆光洁度△8并能耐受酸碱氯仿等有机溶剂我们经过几十次反复试验也证实聚丙烯离心管在110℃6NHCI密闭条件下
加热24小时均未发现有变形熔化等现象确保样品所以用聚丙烯离心管代替玻璃指管用
于蛋白质水解是一个比较简便头用的方法
「3]
{:{
参考文献
Blaekbum弋5et一才份淤n才岔刀。re,娜i
o
at初
口
入了`浓人沙.dTc五”i分``Zndd1978,p61
BklnnIntruetiCmpnyB君左琳,119C
L
A阴i”0Ac记A称召l夕万l招,“,沁刀
M
`刀泞
l1977
P斗一2
BknoIotrtinmpnyB`及份ao119CL
A水i刀理`记才”al夕二rl”`tructio”
Ma”u`l1977
P7一23
一
.1
方深高:《蛋白质化学讲义》,上册户1981
p6
.1
丁浩主编:塑料加工基础》上海科学技术出版社1981p307
I本
文于1984年10月15日收到]
过氧化物酶活性测定
朱展才
(南京粮食经济学院)
过氧化物酶是叶琳环中含有铁的蛋白质存在于所有的谷物中与谷物的呼吸作用有关是谷物品质变化的指标之一通常测定过氧化物酶活性的方法重复性不好本文报道我们对下述方法[注l]的改进和发展实际应用证实改进的方法操作方便灵敏度高结果准确一方法原理有过氧化物酶存在时愈创木酚能被过氧化氢氧化成四愈创木酚:OH/过氧化物酶斗CH+4H0一\OCHoeH(oCH)eH(oeH)ol)+8日ooCH(ocH)eH(OCH)o溶液呈橙色或橙红色而在有银离子存在时愈创木酚也能被过硫酸钱氧化成四愈创木酚:(〕H/斗CH\Ag++斗(NLI夕SO二二二二OCHoeH(oeH)eH(oCH)ol.oqH(oeH)氏H(ocH)心+4H50+斗(NH)声o’在20℃条件下1,分钟以内过氧化物酶的活性和银离子的浓度是一致的因此,根据银离子的标准曲线即可求出过氧化物酶的活性
二测定方法
1标准曲线:在一组25ml比色管中(
1一
5
号
)
分别加入硝酸银标准溶液(0o7s7gAgNo/loomlHo
)
0,102030斗oml补加水至sml再加入
1毫升03%愈创木酚混匀将试管浸人20℃水浴
中待试管内溶液达到20℃后迅速地同时向各管加入
imI3%过硫酸按溶液,立即摇匀并浸人20℃水
浴中
15分钟(从加人过硫酸按算起)时立即同时加入20毫升054N硫酸并摇匀在波长价知m处用l厘米
比色槽以水做参比测定吸光度,绘制标准曲线2过氧化物酶活性的测定:称取i一
4
克`视酶活
性而定)粉碎试样于150lm有塞三角瓶中加人50
!’l
5%硝酸钙(或氯化钙)溶液振荡15分钟后静置20分
钟过滤吸取滤液1一sml(视酶活性大小而定),补加水至sml再加入lml03%愈创木酚摇匀并浸入
20℃
的水浴中待试液达到2。℃后加入l
ml005
N
过
氧化氢溶液立即摇匀并浸入20℃水浴中从加人过氧化氢时算起15分钟后准时立即加人Zml丙酮并摇匀,然后测定吸光度(颜色物同上述标准液一样在一段
时间内稳定)用此吸光度在标准曲线上找出相当的(下转第72页)
