羧基水杨醛的制备及表征
对氨基水杨酸衍生物的合成与表征

4.席夫碱3红外图谱
5.席夫碱3紫外图谱
1.4 乙二醛缩对氨基水杨酸席夫碱(席夫碱4)
1.合成工艺
COOH OH NH2
CH OHC CHO CH OH COOH
N N
OH COOH
对氨基水杨酸熔点 156℃,乙二醛熔点 15℃; 产物熔 点为 140℃。初步判断生成新化合物。
2.席夫碱4红外光谱
•
•
研究内容
•
将对氨基水杨酸分别与四种不同的醛 (对苯二甲醛,戊二醛,对氰基苯甲醛, 乙二醛)进行反应合成水杨酸类席夫碱化 合物。并探索反应的最佳工艺条件。通过 熔点测定、紫外吸收法、 红外光谱法对其 进行结构表征。
1.1 对苯二甲醛缩对氨基水杨酸席夫碱(席夫碱1)
1. 合成路线
NH2 CHO CH N COOH
结论
本文以水浴加热回流方式进行合成反应。实验得出: (1)对氨基水杨酸和对苯二甲醛合成席夫碱1,最适宜工艺条件 为,反应时间3h,反应温度 50℃,产率93.9%。 (2)对氨基水杨酸和戊二醛合成席夫碱2,最适宜工艺条件为, 反应时间5h,反应温度 50℃,产率 46.8%。 (3)对氨基水杨酸和对氰基苯甲醛合成席夫碱3,最适宜工艺条 件为,反应时间4.5 h,反应温度40℃,产率98.62%。 (4)对氨基水杨酸和乙二醛反应,生成席夫碱4,产率 8.17%。 对粗产物通过重结晶的方式进行提纯。最后通过熔点测定、紫外 吸收法、 红外光谱法对其进行结构表征。确定为对应的席夫碱 产物。
3.席夫碱2紫外图谱
1.3 对氰基苯甲醛缩对氨基水杨酸席夫碱(席夫碱3)
1.合成路线
CHO
NH2
CH
N
COOH
OH
OH COOH CN CN
乙酰水杨酸的合成及表征
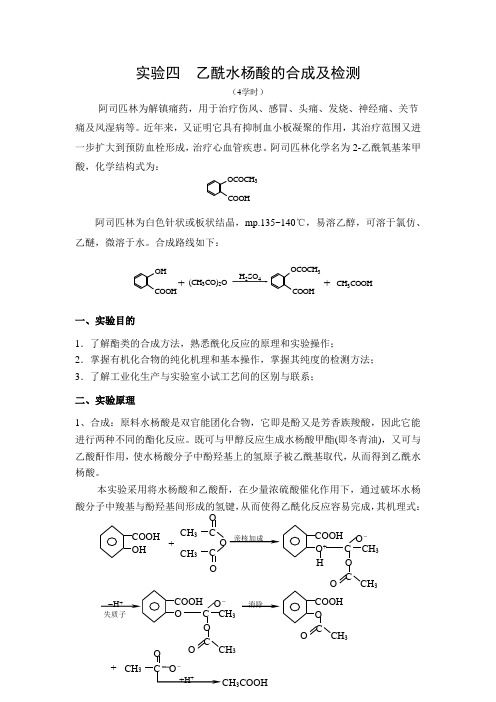
实验四 乙酰水杨酸的合成及检测(4学时)阿司匹林为解镇痛药,用于治疗伤风、感冒、头痛、发烧、神经痛、关节痛及风湿病等。
近年来,又证明它具有抑制血小板凝聚的作用,其治疗范围又进一步扩大到预防血栓形成,治疗心血管疾患。
阿司匹林化学名为2-乙酰氧基苯甲酸,化学结构式为:阿司匹林为白色针状或板状结晶,mp.135~140℃,易溶乙醇,可溶于氯仿、乙醚,微溶于水。
合成路线如下:一、实验目的1.了解酯类的合成方法,熟悉酰化反应的原理和实验操作; 2.掌握有机化合物的纯化机理和基本操作,掌握其纯度的检测方法; 3.了解工业化生产与实验室小试工艺间的区别与联系; 二、实验原理1、合成:原料水杨酸是双官能团化合物,它即是酚又是芳香族羧酸,因此它能进行两种不同的酯化反应。
既可与甲醇反应生成水杨酸甲酯(即冬青油),又可与乙酸酐作用,使水杨酸分子中酚羟基上的氢原子被乙酰基取代,从而得到乙酰水杨酸。
本实验采用将水杨酸和乙酸酐,在少量浓硫酸催化作用下,通过破坏水杨酸分子中羧基与酚羟基间形成的氢键,从而使得乙酰化反应容易完成,其机理式:O O O + CH 3 C OCH 3 C 亲核加成 COOH CH 3 C + O - O C3O O C O -O C CH 3消除COOHO C CH 3O OCOCH 3COOHOH COOH(CH 3CO)2OH 2SO 4CH 3COOH++OCOCH 3COOH2、纯化:由于水杨酸的苯环上既有羟基又有羧基,在反应过程中会形成一种高聚物副产物:可以利用乙酰水杨酸与NaHCO 3反应生成水溶性的钠盐,而高聚物不溶于NaHCO 3溶液的原理,通过过滤将高聚物分离出去。
然后再用酸将乙酰水杨酸沉淀出来,从而达到纯化产品的目的,其反应式如下:3、重结晶:在最终产物中最有可能产生的杂质是水杨酸本身,这是由于乙酰化反应不完全或是产物在分离步骤中发生水解造成的。
因此还可以用乙醇、丙酮或乙酸乙酯对最终产物进行重结晶,从而得到纯度更高的产品——阿司匹林。
二氨基硫脲异双核席夫碱化合物的合成与表征

第3 7卷第 7期
2 0 年 7月 08
应
用
化
工
V I3 o 8 o. 7 N .
Appi d Ch mia n usr le e c lI d ty
Jj2 o u. o 8
二 氨 基 硫 脲 异 双 核 席 夫 碱 化 合 物 的 合 成 与 表 征
间、 温度、 原料配 比对该 合成 的影响。结果表明 , 反应 的最佳条件为 :- 3羧基水杨醛 : 二氨基硫脲 =24: ( . 1 摩尔 比) , 在7 8 0— 0℃条件下反应 3h产 率可达 7 % 。通过元素分析 、H N , 8 MR、 u vs摩尔 电导等手段对合成得到的席 I V. 、 R、 i 夫碱化合物的组成 和结构进行表 征。
a d h d d t o c r o y a o s man mae as a d u d r t e c n ii n o cd a d l e y e. i . a b h dr z n a i tr l n n e h o d to fa i n meha o s s 1 hi i t n l a o. v n . ie e t g te ef c fmi t r ai r a t n tmp r t r n i n r a t n c r f ly T e r — e t At rt si h fe to x u e r to,e c i e e au e a d tme o e c i ae ul . n o o h e
Ke r s d t i c r o y r z n;S h f b s y wo d : i o a b h d a o h c i a e;s n h ss h r ce z t n y te i ;c a a tr ai i o
电化学法合成水杨醛

水 杨酸 电解还 原可制 得水杨醛 . 控制 反 应条 件 可使 羧基有选 择地 进行 阴极还原 而得 到 醛基. 条 件 若
控制 不 当 , 基则进行 深 度还 原而生 成 醇基或醛 、 混合物 . 羧 醇
OH OH OH
阴 极 反 应
… 等 n一 … 。
欲使醛 类达 到 高产率 , 首先 要 用强 电子 受 体基 团激 活 羧基 以使其 反 应 , 防 止醛 被深 度 还原 , 汞 要 用
作 为 抗氧 剂 , 同时也 是 石油化工 等行 业 的原 料. 近年 来 , 杨醛 的货 源紧张 , 不 应求 , 国 际市场 上 也 水 供 在
很抢手, 国内外 需求量超过 万 吨 , 因此研 究开 发水 杨醛 有现实 意义. 生 产 水 杨醛 的方 法很 多 , R i { ima ( —T) 、 甲酚 三氯 氧 磷 法 、 有 e me 一T e n R 法 邻 甲醛 法 、 杨醇 氧化 水 法、 光气 法 、 转 移催化法 等“ , 文主要 论述 电化 学法“ . 相 本
电极避 免 H一 原 , 还 防止 产物水 杨醛深 度 还原 的一 种方 法 是将其 转化 为亚硫 酸 氢盐 加和物 ( 邻羟 基苯磺 酸钠 ) 在此 还 原反 应 中, . 由于 直接 被 还 原 的是 硼 酸 一 杨酸 , 水 因此 电解 液应 使 用 水 杨 酸 与硼 酸 的复合
物 ,H 值通 过添 加盐 酸来调 节 , p 最后再 用 蒸馏的方 法 将水 杨醛从加 和物 中分 离出来. 分 离 提纯 : 加稀 硫 酸 酸化 , 蒸馏 得 粗 产 品 , 燥 过夜 后 减 压 蒸馏 , 集 1 0 k a下 5 ~ 6 干 收 .3P 9 0℃的馏
永杨醛收率/
26 6 5
水杨酸甲酯的实验报告

一、实验目的1. 学习水杨酸甲酯的制备方法。
2. 掌握水杨酸甲酯的性质及表征方法。
3. 了解水杨酸甲酯在不同领域的应用。
二、实验原理水杨酸甲酯(2-羟基苯甲酸甲酯)是一种具有清香、挥发性的有机化合物,广泛用于香料、医药、农药等领域。
本实验采用水杨酸与甲醇在浓硫酸催化下进行酯化反应,制备水杨酸甲酯。
反应方程式如下:C7H6O3 + CH3OH → C8H8O3 + H2O三、实验仪器与试剂1. 仪器:锥形瓶、烧杯、温度计、冷凝管、滴定管、水浴锅、红外光谱仪、核磁共振仪等。
2. 试剂:水杨酸、甲醇、浓硫酸、无水硫酸钠、NaHCO3、无水CaCl2、干燥器等。
四、实验步骤1. 水杨酸甲酯的制备(1)将水杨酸和甲醇按一定比例混合,加入锥形瓶中。
(2)向锥形瓶中加入少量浓硫酸,搅拌均匀。
(3)将锥形瓶放入水浴锅中,加热至70℃左右,维持反应1小时。
(4)反应结束后,冷却至室温,加入少量NaHCO3溶液,搅拌至无气泡产生。
(5)将反应液转移至烧杯中,加入无水硫酸钠干燥。
(6)过滤,收集滤液,用无水CaCl2干燥。
(7)减压蒸馏,收集水杨酸甲酯。
2. 水杨酸甲酯的性质表征(1)红外光谱分析:将制备的水杨酸甲酯进行红外光谱分析,观察其官能团特征吸收峰。
(2)核磁共振氢谱分析:将制备的水杨酸甲酯进行核磁共振氢谱分析,观察其氢原子环境。
(3)质谱分析:将制备的水杨酸甲酯进行质谱分析,确定其分子量和结构。
五、实验结果与讨论1. 水杨酸甲酯的制备根据实验结果,水杨酸与甲醇在浓硫酸催化下反应,成功制备了水杨酸甲酯。
通过减压蒸馏,收集到无色透明液体,证明水杨酸甲酯的制备成功。
2. 水杨酸甲酯的性质表征(1)红外光谱分析:水杨酸甲酯在红外光谱中呈现以下特征吸收峰:C=O伸缩振动峰位于1730 cm-1,C-O伸缩振动峰位于1100 cm-1,C-H伸缩振动峰位于2950 cm-1,证明水杨酸甲酯中含有酯基和羟基。
(2)核磁共振氢谱分析:水杨酸甲酯的核磁共振氢谱中,观察到以下氢原子环境:甲基氢(-CH3)峰位于1.1 ppm,苯环氢峰位于7.2-8.0 ppm,证明水杨酸甲酯中含有甲基和苯环。
水杨醛及其席夫碱类二芳基乙烯的合成及性质研究PPT课件

2+ 2+
Cd Ca
2+ 2+
Pb Hg
2+ 2+ 2+ 3+
Sr Cu Co Cr
3+
Fe
None
C
None
Al 3+ Zn 2+
K+
Mn Mg Ba Ni
2+ 2+ 2+ 2+
Cd Ca Pb
B D
2+ 2+ 2+
Hg Sr Cu Co Cr Fe
2+ 2+ 2+ 2+ 3+ 3+
Emission intensity (a.u.) Emission intensity (a.u.)
600 500 400 300 200 100
0 400
Vis UV
450
500
550
Wavelength (nm)
C
A
B
0.4
Free and other metal ions
1.0
0.3 0.8
0.2
0.6
Absorbance A/A
稀土水杨醛Salphen希夫碱配合物的合成与表征

稀土水杨醛 Sl e 希夫碱配合物的合成与表征 a hn p
李晓东a , b杨玲娟a , b朱元成a , b王晓峰‘ ’ b
( 天水师范学院 a新型分子材料设计与功能重 点实验室 .. . b生命科学与化学学 院, 甘肃 天水 710) 401
摘要 : 利用 N N一双 ( 杨醛 ) 邻苯 二胺 配体 () ,, 水 缩 L 与稀 土金属 离子合 成 了稀 土水杨 醛 S pe 希 夫 碱 配合物 { N 32 ・ a hn l [ O) M( 3 2 2 ; L ,dS {并利用红外光谱( 、 HO M= aN , , m m)紫外一可见光谱 ( V 、 素分析 、 u )元 摩尔 电导率 和差热热 重 ( , I' 对配合 物的结构 I y) — 1 A
纯, 由供 应 商 提供 。L ( 0 ) ・H 0 N 23 S 23 a N 3 6 2、 d 、m0、 3 0 G 2 均为分析纯, ,0 t 3 由中国西北有色地质研究所提供。
位形成稳定的配位化合物[ l 卜3 。该类配合物已成功应 用在化学研究、 化工产品和生物医学等各个方面【 8。 4 ] - 近年来 , 随着配位化学 的不断发展 , 稀土配合物被不断 合成 , 其活性研究已成为众多研究者 的热点[ 1 9 。由 I
b Clg i c neadC e ir,i su 7 10 ,h a .oeeo LeSi c hmsyTa hi 40 1C i ) l f f e n t n n
水杨醇的制备实验报告(3篇)

第1篇一、实验目的1. 掌握水杨醇的制备方法。
2. 熟悉实验操作技能,提高实验动手能力。
3. 了解水杨酸与甲醇反应制备水杨醇的原理。
二、实验原理水杨醇是一种具有酚羟基和醇羟基的化合物,可由水杨酸与甲醇在酸性催化剂的作用下发生酯交换反应制备。
反应方程式如下:C7H6O3 + CH3OH → C7H6OCH2OH + H2O三、实验仪器与试剂1. 仪器:烧杯、玻璃棒、冷凝管、锥形瓶、酒精灯、天平、滴定管、加热装置等。
2. 试剂:水杨酸、甲醇、浓硫酸、无水硫酸钠、NaOH标准溶液、酚酞指示剂等。
四、实验步骤1. 准备反应物:称取2.0g水杨酸,置于烧杯中。
2. 加入甲醇:向烧杯中加入10ml甲醇,搅拌均匀。
3. 加入催化剂:向烧杯中加入0.1ml浓硫酸,搅拌均匀。
4. 加热反应:将烧杯放入水浴中,加热至回流状态,保持回流时间为1小时。
5. 冷却反应液:将反应液冷却至室温。
6. 中和反应液:向反应液中加入适量NaOH溶液,使溶液pH值约为8。
7. 分离产物:将反应液倒入分液漏斗中,静置分层。
将有机层分离出来。
8. 干燥产物:向有机层中加入无水硫酸钠,搅拌至固体完全溶解,静置一段时间,过滤出干燥的固体。
9. 纯化产物:将干燥的固体进行重结晶,得到纯品水杨醇。
五、实验结果与分析1. 反应现象:在加热过程中,溶液颜色逐渐由无色变为浅黄色,回流时间为1小时。
2. 产物分析:采用红外光谱(IR)对产物进行表征,结果表明产物与水杨醇的IR光谱图相符。
3. 产率计算:通过计算反应前后水杨酸的质量,得到水杨醇的产率为65%。
六、实验讨论1. 反应条件对产率的影响:在实验过程中,发现反应温度、回流时间和催化剂用量对产率有显著影响。
通过调整这些条件,可以得到较高的产率。
2. 产物纯度:通过重结晶等方法,可以得到较高纯度的水杨醇。
3. 实验操作注意事项:在实验过程中,应严格控制反应条件,注意安全操作,避免发生意外事故。
七、实验总结本实验成功制备了水杨醇,通过调整反应条件,得到了较高的产率和纯度。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
西安建筑科技大学华清学院本科毕业设计(论文)题目羧基水杨醛缩羟基乙胺的金属配合物的制备学生姓名黄乐学号0805030233院(系)华清学院材料与冶金工程系专业应用化学指导教师时间年月日摘要本文介绍了3-羧基水杨醛、Schiff碱、羧基水杨醛Schiff碱金属配合物。
通过Duff法制备了3-羧基水杨醛,并用3-羧基水杨醛与乙醇胺按1:1缩合形成单Schiff碱配体,利用该配体分别与Cu(Ⅱ)、Cd(Ⅱ)、Ni(Ⅱ)和Co (Ⅱ)的硝酸盐、氯化物、醋酸盐络合形成3-羧基水杨醛缩乙醇胺过渡金属配合物,再进一步与镧系金属Eu(Ⅲ)、La(Ⅲ)、Dy(Ⅲ)Gd(Ⅲ)配位,形成d-f异双核金属配合物。
其结构用红外光谱(KBr压片)及紫外可见分光光谱进行了表征,并利用溶液扩散和溶剂扩散的方法培养单晶。
关键词:3-羧基水杨醛、乙醇胺、Schiff碱、d-f异双核金属配合物。
AbstractThis paper introduces three-inhibiting aldehyde, Schiff carboxyl acid alkali, inhibiting aldehyde Schiff base transition metal complexes.Through the Duff legal system for 3-carboxyl inhibiting aldehyde, use 3-inhibiting aldehyde and ethanol amino acid Schiff base form 1:1 condensa tion single ligands, using the ligand and Cu (Ⅱ), Cd (Ⅱ), Ni (Ⅱ) and Co (Ⅱ) of nitrate, chloride, acetic acid salt complex form 3-carboxyl inhibiting aldehyde shrink ethanol amine transition metal complexes and further and billows of metal Eu (Ⅲ), La (Ⅲ), Dy (Ⅲ) Gd (Ⅲ) even bridge, form 3-carboxyl inhibiting aldehyde shrink ethanol amine f-d metal complexes.Its structure infrared spectrometry (KBr tablets) and uv-vis spectral spectrum characterization, and use solution diffusion and solvent diffusion method training single crystal.Keywords: 3-carboxyl inhibiting aldehyde, ethanol amine, Schiff base, f-d different dual-core metal complexes.目录1绪论 (1)1.13-羧基水杨醛 (1)1.1.1 3-羧基水杨醛的结构与性质 (1)1.1.2 3-羧基水杨醛的合成方法 (1)1.2 Schiff碱 (3)1.2.1 Schiff碱的结构与分类 (3)1.2.2 Schiff碱的合成方法 (6)1.3 羧基水杨醛Schiff碱金属配合物 (8)1.3.1羧基水杨醛Schiff碱金属配合物的结构与性质 (8)1.3.2羧基水杨醛Schiff碱过渡金属配合物的合成方法 (9)1.3.3羧基水杨醛Schiff碱过渡金属配合物的应用(Schiff碱类过渡金属配合物的合成_结构及生物活性研究) (9)1.4本文研究意义、现状及内容 (10)1.4.1研究意义 (10)1.4.2研究现状 (12)1.4.3研究内容 (12)2 实验部分 (1)2.1实验仪器与试剂 (1)2.1.1 实验仪器 (1)2.1.2实验试剂 (1)2.2实验步骤 (2)2.2.1 3-羧基水杨醛的制备 (2)2.2.2 配体的制备 (2)2.2.3 过渡金属配合物的制备 (2)2.2.4 d-f金属配合物的合成 (3)3 结果与讨论 (4)3.1红外光谱分析 (4)3.2紫外光谱分析 (8)4 结论 (10)参考文献 (11)1绪论1.13-羧基水杨醛1.1.1 3-羧基水杨醛的结构与性质3-羧基水杨醛又名2-羟基-3-醛基苯甲酸,它的分子式是C8H6O4。
3-羧基水杨醛是由苯酚、羟基和羧基构成,其结构式:3-羧基水杨醛是一个无味的肉色针状晶体,易溶解于甲醇、乙醇和丙酮等有机溶剂,可溶解于热的苯,微溶于冷水, 在沸腾的水中亦有较大的溶解度,熔点是158℃。
3- 羧基水杨醛是水杨醛的一种衍生物,具有酸性,它含有三个官能团: 醛基、酚羟基和羧基,这些官能团性质都非常活跃,可与醇反应生成半缩醛、缩醛和酯,也可与胺反应生成亚胺( Schiff base) 及烯胺等。
1.1.2 3-羧基水杨醛的合成方法3-羧基水杨醛的合成方法主要有Duff 法[1-2]、Reimer-Tiemann 法[3]、溴化法[4]等。
(一)Duff 法Duff反应(Duff reaction,达夫反应),又称“六次甲基四胺甲酰化反应”。
是用六次甲基四胺(乌洛托品)对芳香族化合物进行甲酰化。
此反应为亲电芳香取代,其中亲电试剂为乌洛托品衍生出的亚胺离子 CH2NR2。
一碳的甲酰基来源于六亚甲基四胺中甲醛单位的亚甲基。
反应最初产物为另一亚胺离子,经水解得到芳醛。
反应需要在芳环上有强活化基,如酚羟基。
醛基进入酚羟基的邻位或对位(如果邻位已有取代基)反应产率较低,但操作简便,产物也较纯净。
反应机理:乌洛托品质子化、断裂产生亚胺离子,亚胺离子对芳环发生亲电芳香取代,经互变异构,生成一个苄胺衍生物。
接下来乌洛托品部分发生第二次质子化、断裂产生亚胺离子,然后进行分子内氧还作用,苄胺部分被氧化为亚苄基亚胺离子,它经过水解,即得到醛。
Duff法合成路线:(二)Reimer-Tiemann 法Reimer-Tiemann 是苯酚类化合物和氯仿在强碱水溶液中反应,在酚基的邻位引入一个醛基(-CHO )的过程。
这个反应是一个典型的亲电芳香取代反应,亲电试剂是二氯卡宾(:CCl 2),但仅有苯环上富电子的酚类(实际上是酚基负离子)才可发生此类反应。
反应机理:氯仿与强碱溶液反应产生氯仿碳负离子,该阴离子会立即发生α-消去反应(alpha-eliminate )形成二氯碳烯。
二氯碳烯能与苯酚酚羟基邻位的碳原子反应,使该次甲基上的氢原子被新形成的基团取代。
碱水解后,便能获得期望产物。
Reimer-Tiemann 法合成3-羧基水杨醛反应程式: OH CHOCOOH +OHCOOH CHCl 3OH COOHOHC NaOH +Reimer-Tiemann 法合成路线[5]:1.2 Schiff碱1.2.1 Schiff碱的结构与分类Schiff碱主要是指含有亚胺或甲亚胺特性基团(-RC=N-)的一类有机化合物,通常希夫碱是由胺和活性羰基缩合而成。
Schiff碱可通过灵活的选择各种氨类及含碳基的不同醛或酮,缩合得到链状[6]或环合[7],单齿[8]或多齿[9, 10],结构各异性能多变的有机配体如图1-1[11]。
图1-1结构各异的Schiff碱有机配体Schiff碱的分类方式是多种多样的,按配位结构可分为单Schiff碱、双Schiff 碱和大环Schiff碱或者分为对称Schiff碱和不对称Schiff碱。
按结构的不同,Schiff碱及其配合物主要为醛类、酮类、大环类Schiff碱、冠醚化的Schiff碱[12]。
a醛类Schiff碱主要为水杨醛类、香草醛类和毗咙醛类等及其衍生物Schiff碱与配合物。
醛类活性较大,最早及最多被研究作为Schiff碱前体的为水杨醛。
它的代表性Schiff碱[13.14]如图1-2[11],可与过渡金属或非过渡金属形成配合物。
图1-2 水杨醛类代表性Schiff碱化合物b酮类Schiff碱酮类Schiff碱及其配合物研究得相对较少,一般选择空间位阻较小,配位原子较多的β-二酮亚胺Schiff碱有利于形成配合物。
合成时注意选择溶剂及反应的pH条件,因β-二酮随着pH不同存在烯醇.酮式与二酮式的不同比例的平衡。
c大环类Schiff碱主要是指以芳香二醛(苯、吡啶、吠喃、噻吩等)或二酮化合物与一系列多胺反应形成的Schiff碱。
此类化合物的主要共同点是都含有不饱和Schiff碱官能团-RC=N-,该基团上的氮原子上有一对孤对电子,受氮原子强的电负性和邻位上双键电子云密度离域的影响,这一对孤对电子有很强的配位能力。
大环类Schiff碱配体多为氮杂大环类Schiff碱或氧杂大环类Schiff碱或除了具用Schiff 碱本身的特点外,还具有多胺和冠醚的特点。
由于大环配体能给键合的金属离子提供合适的配位环境并影响到金属离子的物理化学性质,被广泛的应用到模拟酶和催化反应中[15]。
d冠醚化的Schiff碱[12]冠醚化的Schiff碱键连,可构筑一类含两个或两个以上不同客体分子识别部位的新配体, 具有独特的应用价值。
近几年来,这类Schiff碱及其配合物有不少的报导。
例如:e开环的直连醚Schiff碱开环的直连醚弥补了冠醚价高,有毒等不足,它们在形成Schiff碱后往往成为多齿配体。
如已合成的:f.高分子Schiff碱及其配合物加热稳定性,使高分子表现出液晶行为等。
例如己报道的:1.2.2 Schiff碱的合成方法Schiff碱的合成是一种缩合反应,涉及加成、重排、消去等多步过程。
可能的反应机理如下[16]:第一步的反应是胺对羰基的亲核加成,紧接着很快地发生了质子转移,所得的产物为半缩胺(醇胺),因不稳定,不易得到。
第三步反应很快,而第四步反应较慢,它是决定整个反应速度的关键一步。
水从质子化的醇胺消去,得到产物。
反应速度和酸的浓度有关,当酸的浓度较高时,反应速度随酸的浓度的增加而减慢,因为氮的碱性由于质子化而被减弱,所以亲核试剂的浓度与酸的浓度成反比。
在强酸溶液中,未质子化的胺浓度很低。
从而使得反应的第一步成了决定反应速度的一步。
在中等强度的酸溶液中,有足够的游离胺,使第一步反应很快达到平衡,还有足够的酸可以有效的催化第四步反应,所以反应通常是在醋酸钠的缓冲溶液中进行[17]。
在实际设计反应体系时,溶剂的选择、介质的酸度、反应的温度要根据具体反应而定,所以了解反应机理及其影响因素将会使反应有效和顺利地进行。
