[配套K12]八年级科学下册 2.3 原子结构的模型(第2课时)练习 (新版)浙教版
八年级科学下册 2.3 原子结构模型导学案(无答案)(新版)浙教版

原子结构的模型班级小组姓名【学习目标】1、了解同位素的结构特点,能说出1-2项在实际生活中的用途。
2、知道物质也可由离子构成,认识离子微粒大小的数量级。
【学习重难点】物质也可由离子构成【学习过程】一、创设情境,自主先学“嫦娥”为何奔月?嫦娥一号是以我国古代神话人物嫦娥命名的首颗绕月人造卫星。
整个“奔月”过程大概需要8-9天。
预计卫星的总质量为2350千克左右,寿命大于1年。
绕月探测有四大科学目标,除获得月球的三维地图外,其中之一是分析月球表面有用元素含量和物质类型的分布特点绘制各元素的全月球分布图,月球岩石、矿物和地质学专题图等,发现各元素在月表的富集区,评估月球矿产资源的开发利用前景等。
特别是月球的土壤中含有可控核聚变的重要燃料氦-3(氦的一种同位素),是在长期的暴露时间内由太阳风注入的。
科学家将从嫦娥一号的微波探测数据中获得月球土壤的厚度,估算月壤中氦-3的资源量。
随着技术进步和未来月球的开发利用,月球上的氦-3资源可能成为建立月球基地甚至解决人类未来能源的一个重要来源。
1、离子是。
分为和;2、和原子、分子一样,也是构成物质的基本粒子。
如:硫酸铜是由和构成的。
3、科学上把具有相同的一类原子总称为。
如:氧元素就是所有氧原子的总称。
元素的种类有决定。
4、同位素是原子核内质子数、中子数的同类统称。
5、氢的三种同位素原子_______、_______、_______,分别有_____、______、_____个质子,_______、_______、_______个中子。
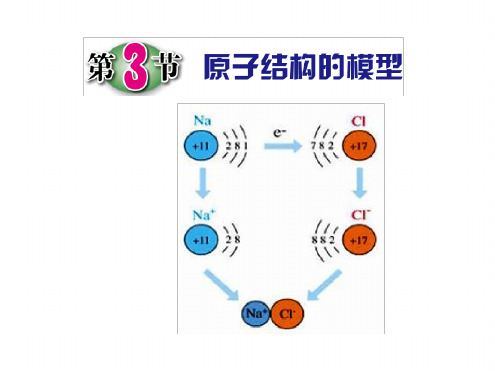
二、生生合作,探究学习(播放钠在氯气中燃烧实验的视频)1、(P45图2-17)钠在氯气中燃烧实验现象:请写出钠在氯气中燃烧的文字表达式:2、(P45图2-18)从微观上说,氯化钠的形成:钠原子电子形成电荷的钠离子(阳离子);氯原子电子形成电荷的氯离子(阴离子),钠离子与氯离子相互,就构成了。
如。
3、(P46图2-19)回答问题:氧的3种原子核有什么相同与不同?A原子核中有个质子,个中子;B原子核中有个质子,个中子;C原子核中有个质子,个中子;小结:具有相同的的同一类原子的总称为元素。
【精品讲义】浙教版 科学 8年级下册 2.3.1 原子结构的模型——原子的结构(教师版含解析)

浙教版八年级下科学同步学习精讲精练第2章微粒的模型与符号2.3-1原子结构的模型——原子的结构目录 (1) (2) (3) (6) (8)一、原子结物模型的建立1.道尔顿的实心球模型(1)模型建立的时间和依据1803年,英国科学家道尔顿提出了原子的概念,他认为原子是构成物质的最小单位。
(2)当时对原子的认识认为原子是个实心球体。
(3)模型建立的意义道尔顿的原子理论开辟了从微观世界认识物质及其变化的新纪元。
2.汤姆生的枣糕模型(又叫西瓜模型)1897年,英国科学家汤姆生发现电子后,提出了二个原子模型:原子是一个球体,正电荷均匀分布在整个球体内,电子像面包里的葡萄干那样镶嵌在其中。
该模型很快被实验否定了。
3.卢瑟福的核式结构模型(又叫行星模型)1911年,英国科学家卢瑟福用带正电的α粒子轰击金属箔的实验。
在分析实验结果的基础上,提出了原子的核式结构模型:在原子的中心有一个很小的原子核,原子的全部正电荷和几乎全部的质量都集中在原子核里,带负电的电子在核外空间绕核运动,就像行星绕太阳运动那样。
原子结构的现代模型就这样问世了。
4.玻尔的分层模型1913年,丹麦科学家玻尔改进了卢瑟福的原子核式结构模型,认为电子只能在原子内的一些特定的稳定轨道上运动。
【注意】建立模型往往需要有一个不断完善、不断修正的过程,以使模型更接近事物的本质。
二、原子的构成1.原子的结构。
原子是由居于原子中心的带正电荷的原子核和带负电荷的核外电子构成,电子在原子核周围高速运动,一个电子带一个电荷。
并且原子核和核外电子所带的电荷总数相等,电性相反,整个原子显电中性。
2.原子核的秘密通过用高能量的粒子撞击核的方法得出:(1)原子核由质子和中子构成,其中质子带正电,中子不带电。
(2)原子中电子的质量在整个原子质量中所占比例极小,可忽略不计,因而原子的质量主要集中在原子核上。
(3)质子和中子又是由更小的微粒——夸克构成。
一杯水的微观层次的分析:(4)核电荷数(原子核所带的电荷)=质子数=核外电子数。
浙教版科学八年级下册 原子结构的模型基础训练

2.3 原子结构的模型1.有三种原子,甲原子核内有8个质子和8个中子,乙原子核内有8个质子和9个中子,丙原子核内有6个质子和6个中子,则下列说法正确的是()A.甲和乙是同种原子B.甲和乙是同种元素C.乙和丙核电荷数相等D.乙和丙核外电子数相等2.科学研究中,人们通过一定的科学方法,建立一个适当的模型来代替和反映客观对象,并通过研究这个模型来揭示客观对象的形态、特征和本质。
下列分析正确的是()A.①揭示单侧光对生长素分布的影响,向光侧生长素多,生长快B.①用磁感线描述条形磁体周围的磁场分布,越密表示磁场越弱C.①是原子结构模型,中央是原子核,核外是绕核高速运动的电子D.①描述地球绕日公转,地轴始终呈倾斜状态,箭头表示公转方向3.俄国科学家门捷列夫对元素周期表的编制做出了巨大贡献,人们将101号元素命名为“钔”来纪念他。
钔原子的核电荷数为101,相对原子质量为258,则钔原子的核外电子数为()A.101B.157C.258D.3594.金属是由原子构成的,1kg下列金属中所含原子个数最多的是()A.铁B.铜C.铝D.锌5.同位素的应用非常广泛,比如用于考古。
三星堆遗址出土的文物经C-14同位素检测,已有5000年左右的历史,这表明我国上下五千年的历史是真实存在的。
碳有多种同位素,互为同位素的两种碳原子不可能具有相同的()A.化学性质B.质子数C.电子数D.中子数6.卢瑟福的α粒子轰击金箔实验为建立现代原子理论打下了基础。
如图线条中,可能是α粒子(带正电)在该实验中的运动轨迹的是()A .adB .abcC .bcdD .abcd7.1909年起,英国科学家卢瑟福和他的助手用一束带正电荷的高速α粒子流轰击一片很薄的金箔,并根据如图所示的实验现象和已有知识,在1911年提出了原子的有核模型。
要解释本实验现象产生的原因,下列知识中不需要用到的是( )A .同种电荷相互排斥B .电荷的定向移动形成电流C .力是改变物体运动状态的原因D .一个α粒子的质量比一个电子的质量大得多8.铪是一种金属,耐高温抗腐蚀,是原子能工业重要材料。
浙教版八年级科学下册23 原子结构的模型 第2课时共25张
3、点燃钠,将燃烧匙伸入氯气瓶中,反应 结束后观察瓶内的物质。 白色固体生成 。
实验现象: 剧烈燃烧,产生黄色火焰,产生大量白烟。
实验结论:
钠 + 氯气
氯化钠
钠原子跟氯原子是怎样生成氯化钠的呢?
钠原子失去一个电子 氯原子得到一个电子
成为一个带正电的微粒 成为一个带负电的微粒
质子数+中子数
图2-20 氢的3种同位素
氕
1 1
H
氘
2 1
H
氚
3 1
H
162C
核电荷数 (即质子数)
为了区分元素的同位素原子,有时把质子数和 中子数的总数标出以示区别。
原子种类 核电荷数 质子数 中子数 核外电子数
碳 的
碳—12
6
6
6
6
同 碳—13
6
6
7
6
位 素 碳—14
6
6
8
6
3、同位素原子的应用
2、同位素 我们把原子中核内质子数相同、中子数不相同 的同类原子互为同位素原子。 例如,上述 3种氧原子的原子核内均含 8个质 子,而中子数不同,它们互为同位素原子。
元素是同位素原子的总称,同位素原子是一种 元素的不同种原子。
大多数元素都有同位素原子。
如汞元素就有7种稳定的同位素原子。
氢元素也有3种同位素原子。
叫钠离子 Na+
叫氯离子 Cl—
带有相反电荷的钠离子和氯离子之间相互吸引构 成了电中性的氯化钠。
2、离子 ——带电的原子
(1)我们把带电的原子(或原子团)叫离子
阳离子:带正电的原子或原子团。
离子
例:钠离子 Na+ Cu2+
浙教版八年级下册科学课件2.3原子结构的模型2

课堂练习
3、下列有关原子、分子的说法错误的是( C ) A.原子、分子都是构成物质的微粒 B.原子、分子总是在不断地运动 C.分子可以再分,原子不能再分 D.分子间有一定的间隔
课堂练习
4、如图为小明制作的原子模型,外圈上小球为电子,
内圈为原子核。下列说法正确的是( A.该模型表示一种碳原子
D
)
B.该原子的核电荷数为4
2、原子的质量主要集中在原子核里。 2、卢瑟福在α粒子(带正电荷)散射实验中,断定原子中的绝大部分空间是空的,他的依据是( )
视频:原子结构
三、揭开原子核的秘密
原子核很不,要认识原子核的结构更难。科学家们用高能 量的粒子撞击核的方法来揭示原子核的秘密。
通过实验,最终科学家们发现原子核是由两种更小的粒子-----质子和中子构成的。
例如: 一种氧原子的原子核由8个质子和8个中子紧密相连构成。 一种碳原子的原子核由6个质子和6个中子紧密相连构成。 ……
视频:原子核结构
原子核 原
质子(带正电) 中子(不带电)
子 核外电子(带负电)
1、科学上把原子核所带的电荷数称为核电荷数。 2、在原子中,质子数=核外电子数=核电荷数,且质子
数、核电荷数与核外电子数相等,它们所带的电荷总数相等, 电性相反,因而原子呈电中性。
课堂小结
1、原子由居于原子中心的带正电的原子核与核外带负电 的电子带构成,原子核由质子和中子构成,质子和中子由更 小的夸克构成。
2、在原子中,质子所带的电荷总数等于核电荷数,也等 于核外电子数所带的电荷数相等,且它们电性相反,因而原 子呈电中性。
3、原子的质量主要集中在原子核里。
课堂练习
1、在夸克、原子、质子、原子核这些粒子中,按空间 尺度由小到大排列正确的是( A )
2.3 原子结构的模型 培优提升同步练习题— 浙教版八年级下学期科学

2.3 原子结构的模型一、选择题1.我区存在大面积富硒土壤,有利于提高水果的品质,富硒土壤中的“硒”指的是()A.元素B.分子C.原子D.单质2.2019年意大利科学家首次测得氙-124的半衰期大约为22⨯年,氙-124是一种1.810稀有气体元素,元素符号Xe,原子序数54,相对原子质量为124.下列说法正确的是()A.氙-124原子的电子数为54B.氙-124原子的电子数为70C.氙-124原子的中子数为54D.氙-124原子的质子数为703.2021年3月,考古学家对三星堆遗址新出土文物的碳14-含量进行了测定,推测其年代距今约3200年左右。
已知碳14-原子-原子与碳12-原子互为同位素,则据碳12的原子模型可确定碳14-原子的原子模型图为()A.B.C.D.4.用“”“”和“”分别表示质子、中子和电子,如图表示四种原子结构模型,下列有关说的是()A.甲、乙互为同位素B.乙、丁为同一种元素C.甲、丙的核电荷数不同D.丙、丁为同一种原子5.2019年4月,《自然》杂志发文,科学家首次在太空中检测到氦合氢离子(HeH+),被预测为宇宙中第一个分子离子。
已知氦为2号元素,那么一个HeH+()A.带1个单位负电荷B.有2个电子C.相对原子质量是35D.有4个质子6.1909年起,英国科学家卢瑟福和他的助手用一束带正电荷的高速α粒子流轰击一片很薄的金箔,并根据如图所示的实验现象和已有知识,在1911年提出了原子的有核模型。
要解释本实验现象产生的原因,下列知识中不需要用到的是()A.同种电荷相互排斥B.电荷的定向移动形成电流C.力是改变物体运动状态的原因D.一个α粒子的质量比一个电子的质量大得多7.在近代原子学说的发展过程中,有下列观点:①物质都是由原子构成的;①原子都是实心球体;①正电荷均匀分布在整个原子内。
1911年卢瑟福用带正电的a粒子轰击原子,发现多数a粒子穿过后仍保持原来的运动方向,但有绝少数a粒子发生了较大角度的偏转,如图所示,分析实验结果,可以否定上述观点中的()A.①①B.①C.①①D.①①①8.原子结构模型是经过一代代科学家不断地发现和提出新的原子结构模型的过程。
八年级科学下册 2.3 原子结构的模型(3)同步练习 (新版)浙教版
2.3 原子结构的模型(3)1.如图所示是氕、氘、氚三种氢原子的结构示意图。
请根据图中所提供的信息回答下面的问题:(第1题)(1)氕、氘、氚三种原子的核内质子数相同,中子数不同,我们把这三种原子称为同位素原子。
(2)在原子中,质子数=核外电子数。
2.2010年4月5日,科学家成功合成了第117号新元素,填补了第116号和118号元素之间的空缺。
推测该元素为117号元素的依据是(B)A. 中子数B. 质子数C. 电子数D. 中子数和质子数3.2011年3月日本大地震引发了核泄漏事故。
事故发生时,放射性原子氮16可能短暂存在。
氮16原子的质子数为7,中子数为9。
下列有关氮16原子的说法正确的是(D)A.核外电子数为9B.核电荷数为9C.和普通氮原子是相同的原子D.和普通氮原子属于同种元素4.下表所示的粒子中,属于阳离子的是B,互为同位素的是AD。
(填字母)5.科学上常用元素符号左下角的数字表示原子的质子数,左上角的数字表示原子的中子数与质子数之和,如 613C表示核内有6个质子和7个中子的碳原子。
下列关于 53131I和 53127I的说法中错误..的是(A) A. 各取一个原子相比较,中子数相同B. 属于同种元素C. 各取一个原子相比较,核外电子数相同D. 各取一个原子相比较,质子数相同6.用“”“”和“”分别表示质子、中子和电子,如图表示四种原子结构模型,下列有关说法正确的是(B),(第6题))A. 甲、丁互为同位素B. 乙、丁为同一种元素C. 甲、丙的核电荷数不同D. 甲、丙为同一种原子7.居里夫妇在1898年从几吨铀盐废料中提炼出0.3克镭。
镭具有放射性,镭原子会分裂,变成一个质子数为86、中子数为136的氡原子和一个具有2个中子、2个电子的氦原子,并释放出能量,试推测镭原子的核电荷数为88,中子数为138。
【解析】镭原子→氡原子+氦原子,则镭原子的质子数=氡原子的质子数+氦原子的质子数=86+2=88,镭原子的中子数=氡原子的中子数+氦原子的中子数=136+2=138。
八年级科学下册《原子结构的模型》同步练习 浙教版
原子结构的模型1.2.将下列科学家与其提出的相应的原子模型连线:英国道尔顿电子云模型(电子像云雾笼罩在原子核的周围)英国汤姆森分层模型(电子在固定的轨道上分层运动)英国卢瑟福卫星模型(原子核像太阳,电子像行星围绕核运行)丹麦波尔西瓜模型(电子嵌在平均分布着正电荷的原子球体)现代科学家实心球模型(认为原子是组成物质的最小的单位)2.从原子结构模型建立的过程,我们发现建立模型是一个不断,不断的过程,以使它更接近事物的本质。
★3.现代科学实验证明原子的结构:核外电子(一个电子带一个单位电荷)原子质子(一个质子带一个单位电荷)(电性)原子核(带电荷)中子(中子电)相关说明:(1)原子核带的电荷数又叫;★(2)由于整个原子不显电性,所以原子中各粒子的关系:核电荷数质子数核外电子数(3)原子中的质量可以略不计,故原子的质量主要集中在;(注:联系后面讲到原子的相对原子质量=中子数+质子数)(4)阅读P14页表格,不难发现下列规律:★核电荷数质子数核外电子数;有些原子中可以没有,不同的原子中一定不同;原子中质子数和中子数(一定或不一定)相等;4.下列基本粒子中最小的是:;★化学反应中最小的基本粒子是:;相同的原子中数一定相同。
A分子 B原子 C质子 D中子 E电子 F夸克★5.科学上把具有相同(即)的同一类原子总称为元素。
如铁元素就是指的总称。
元素是宏观、集合概念,(讲或不讲)个数。
6.原子核内相同,不相同的同类原子统称为。
7.由钠的一种同位素原子2311Na可知钠原子核内质子数为,中子数为,核外电子数为;氢的三种同位素原子是(用符号表示):、、。
8.金属钠在氯气中燃烧时,金属钠原子失去形成带电荷的钠离子,氯原子得到形成带电荷的氯离子;带有相反电荷的钠离子和氯离子之相互,最终构成电的氯化钠。
可见氯化钠是由和构成的。
(离子像分子,原子一样也是构成物质的基本粒子)9.硫酸铜是由和构成的。
★用线把下列物质与相应构成物质的粒子连起来:原子铜硫酸铜离子干冰金刚石分子氧气。
专题2.3原子的结构模型-2020年浙教版八年级下科学同步学习(试卷和答案)
第 1 页,共 6 页专题2.3原子的结构模型-2020年浙教版八年级下科学同步学习(试卷和答案)一、选择题1. 下列叙述正确的是( )A .汤姆生建立的“汤姆生模型”认为原子核像太阳,电子像行星绕原子核运行B .卢瑟福建立的“卢瑟福模型”认为电子像云雾一样出现在原子核周围C .波尔建立的“分层模型”认为电子在原子核周围分层运动D .现代科学家认为电子像西瓜籽似地嵌在原子中2. 如图为某原子的结构示意图,该原子的原子核中有( )A .6个质子和8个中子B .8个质子和6个中子C .6个质子和8个电子D .8个质子和6个电子3. 下列关于水的微观层次的说法,错误的是( )A .一杯水是由许多水分子构成的B .每个水分子由1个氧原子和2个氢原子构成C .氧原子和氢原子都是由原子核和核外电子构成的D .水是由水分子构成的,水分子是由水原子构成的4. 微观和宏观物体的大致尺度按从小到大顺序排列,正确的是( )A .电子----原子----生物体----太阳系----银河系B .电子----分子----生物体----银河系----太阳系C .原子----原子核----生物体----太阳系----银河系D .电子----原子核----生物体----银河系----太阳系5. 图甲是卢瑟福用α粒子轰击原子而产生散射的实验,在分析实验结果的基础上,他提出了图1-3-1乙所示的原子核式结构,卢瑟福的这一研究过程是一个( )A .建立模型的过程B .得出结论的过程C .提出问题的过程D .验证证据的过程6. 我们生活中常见的碘原子是碘-127,而核反应中会产生碘原子碘-131,碘-131能够被甲状腺迅速吸收,增加儿童甲状腺癌的风险。
日本福岛核电站发生核泄漏后,虽然在我国多数地区均检测到碘-131,但含量极低不会对人体造成危害。
下列关于碘-127和碘-131这两种原子的描述,正确的是( )A .它们是同一种元素B .两者化学性质不同C .两者中子数相同D .两种原子的核外电子数不同7. 有3种原子,甲原子核内有6个质子和6个中子,乙原子核内有6个质子和8个中子,丙原子核内有7个质子和7个中子.下列说法正确的是( )A .甲和乙是同一种原子B .甲和乙是同一种元素C .乙和丙的核电荷数相等D .乙和丙互为同位素原子8. 同学们从科学课本和课外资料中获悉:有些元素有多种不同的单质,如O 2、O 3;H 2、H 3;C 60、C 90、C 240等.由此他们做出了推测:①同种元素可以形成多种单质,②单质可能存在着复杂的结构,③单质的研究前景广阔,④同种元素形成的这些单质也可能是同种物质,如红磷、白磷只是颜色不同.你认为以上推测正确的是( )A .①②③④B .只有①②③C .只有①②D .只有①。
【课时练习】2020-2021学年浙教版科学八年级下册 第2章 第3节 原子结构的模型(原卷版)
2020-2021学年浙教版科学八年级下册第2章第3节原子结构的模型课时练习一、单选题(共20题;共40分)1.如图为某原子结构模型的示意图,其中a、b、c是构成该原子的三种不同粒子,下列说法正确的是()A. 决定该原子种类的粒子是bB. 原子的质量集中在a和c上C. 原子中b与c的数目一定相同D. 原子中a与c的数目一定相同2.原子论开辟了从微观世界认识物质及其变化的新纪元。
下列哪位科学家最早提出了原子的概念()A. 牛顿B. 爱因斯坦C. 道尔顿D. 阿基米德3.曾经充满活力的碧波,滋养着740平方公里土地的母亲河“温瑞塘河”,而现今由于生活污水的肆意排放造成了重度污染,水质监测结果表明,氮、磷含量严重超标,这里提到的“氮”、“磷”指的是()A. 分子B. 原子C. 离子D. 元素4.知识梳理有助于我们对已学知识的巩固,如图是某同学学习物质结构层次后以氧气为例进行的梳理,下列选项中与a、b、c相对应的是( )A. 原子、原子核、核外电子B. 原子核、原子、核外电子C. 原子、核外电子、原子核D. 核外电子、原子核、原子5.我国著名科学家张青莲教授主持测定了铕等9种原子质量新值,已知铕原子的相对原子质量为152,核电荷数为63,则铕原子的核外电子为()A. 63B. 89C. 152D. 2156.决定元素种类的是()A. 电子数B. 中子数C. 最外层电子数D. 质子数7.下列关于原子核构成的说法正确的是()A. 一般由质子和电子构成B. 一般由质子和中子构成C. 一般由电子和中子构成D. 一般由质子、中子和电子构成8.俄罗斯科学家利用第72号元素铪和第74号元素钨精确测出月球至少比地球早700万年形成。
铪、钨两种元素原子本质的不同是()A. 核内质子数目B. 核内中子数目C. 核外电子数目D. 相对原子质量9.下列关于元素的理解,正确的是()A. 元素的种类取决于该元素原子的核外电子数B. 中子数相等的原子的统称叫元素C. 元素既论种数,也可计个数D. 自然界中所有的物质都是由元素组成的10.科学家用质子数为20的钙离子,轰击核电荷数为98的锎元素靶,使两种元素的原子核合并在一起,合成核电荷数为118的新元素。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
教育配套资料K12
教育配套资料K12
第3节 原子结构的模型
姓名 学号
一、我学会了
1、钠在氯气中燃烧的现象: 燃烧,发出 火焰,生成 固体。 氯气是 色气
体。钠是具有 的固体。
2、离子是 原子或 。带 的离子称为 。带 的离子称
为 。离子所带的电荷数取决于 的数目。离子与原子之间的转换可以通过
来实现。
3、构成物质的微粒有: 、 、 。 大多数物质是由 构成的; 是
化学变化中的最小微粒;硫酸铜是由 和 构成的。
4、把具有相同 (即质子数)的同一类原子总称为 。目前人类已知的 元素有
多种。
5、原子中核内质子数 、中子数 的同类原子互为同位素原子。 氢元素也 有3种同位
素原子,分别称 、 、 。同位素原子在 、 、 、 等方面有着广泛
的应用。
二、我理解了
6.物质是由原子、分子、离子等粒子构成的,有一粒子,其原子核内有16个质子、 16个中子,原
子核外有18个电子,该粒子是---------------------------------( )
A. 原子 B. 阳离子 C. 阴离子 D. 分子
7.下列有关微粒的说法错误的是------------------------------------------------------
( )
A. 离子带电,但由离子构成的物质不带电
B. 钠原子失去1个电子形成钠离子
C. 硫酸铜晶体就是由铜原子和硫酸根离子构成的
D. 离子能通过得失电子转化为原子
8.科学家成功合成了第117号新元素,填补了第116号和118
号元素之间的空缺。推测该元素为117号元素的依据是---------------------( )
A. 中子数 B. 质子数 C. 电子数 D. 中子数和质子数
9.日本大地震引发了核泄漏事故。事故发生时,放射性原子氮16可能短暂存在。氮16原子的质
子数为7,中子数为9。下列有关氮16原子的说法正确的是
教育配套资料K12
教育配套资料K12
-------------------------------------------------------------------------------------
( )
A.核外电子数为9 B.核电荷数为9
C.和普通氮原子是相同的原子 D.和普通氮原子属于同种元素
10.科学上常用元素符号左下角的数字表示原子的质子数,左上角的数字表示原子的中子数与质子数
之和,如 613C表示核内有6个质子和7个中子的碳原子。下列关于 53131I和 53127I的说法中错误
的是----------------------------------------( )
A. 各取一个原子相比较,中子数相同 B. 属于同种元素
C. 各取一个原子相比较,核外电子数相同D. 各取一个原子相比较,质子数相同
11.美国夏威夷联合天文中心的科学家发现了一种新型氢粒子,它由三个氕原子核和两个电子构成。
这对解释宇宙演化提供了新的参考。对于这种粒子,下列说法中错误的是
-------------------------------------------------------------------------------( )
A.它一定含有3个中子 B.它比一个普通氢分子多一个氢原子核
C.它的组成可以用H3+表示 D.它的化学性质与H2不同
12.法国里昂的科学家发现了一种由四个中子构成的微粒,这种微粒被称为“四中 子”,也有
人称之为“零号元素”,它与天体中的中子星构成类似。下列有关“四中子”微粒的说法正确的是
--------------------------------------------------------------( )
A. 该微粒是一种原子 B. 该微粒不显电性
C. 该微粒与普通中子互为同位素 D. 该微粒的质量为4克
13.科学研究证实,物质是由微粒构成的。例如,铁是由铁原子构成的。请你填写构成下列物质的
具体微粒名称。
(1)家中铝合金窗户中的铝是由 构成的。
(2)用于人工降雨的干冰(固态二氧化碳)是由 构成的。
(3)用于配制生理盐水的氯化钠晶体是由 和 构成的。
14.请填表并比较氯原子与氯离子、镁原子与镁离子、镁离子与氯离子,把它们的
教育配套资料K12
教育配套资料K12
异同点写在下面的横线上。
氯原子与氯离子:
。
镁原子与镁离子:
。
镁离子与氯离子:
。
15.如图表示某物质的微观形成过程。请仔细观察并回答下列问题:
(1) 该过程说明原子通过 电子形成离子。
(2) 甲原子形成的离子是 离子。
(3) 最终形成的化合物 (填“显”或“不显” )
电性,原因是 。
粒子 名称 核内质子数 核外电子
数
粒子所带电荷
镁原子 12 12 0
镁离子 12 10 两个单位正电荷
氯原子 17 17 0
氯离子 17 18 一个单位负电荷
