蛋白质和核酸
核酸与蛋白质的相互作用

核酸与蛋白质的相互作用
咱今儿就来唠唠核酸与蛋白质的相互作用,这可真是个奇妙又重要的事儿啊!
你想啊,核酸就好比是一个大导演,它手里有剧本,指挥着蛋白质这个演员该怎么演。
蛋白质呢,就像是个听话的演员,乖乖按照核酸的指示来行动。
核酸里面的基因啊,那可是包含了各种信息,就像菜谱一样,告诉蛋白质该长成啥样,该有啥功能。
蛋白质呢,就得根据这个菜谱,精确地折叠、组装自己,变成有特定形状和功能的家伙。
比如说吧,在咱们身体里,有一种蛋白质叫酶。
酶就像是个小工人,能帮忙加快各种化学反应的速度。
那酶是怎么知道自己该干啥的呢?这就得靠核酸给它的指示啦!核酸告诉酶,你去这儿,干这个活儿,酶就得乖乖听话,跑去发挥作用。
这就好像是一场精彩的舞台剧,核酸是编剧兼导演,蛋白质就是舞台上的演员。
没有核酸这个导演的指挥,蛋白质演员可就不知道该怎么演啦,这场舞台剧也就没法精彩上演。
再想想,要是核酸和蛋白质之间配合不好,那会咋样?那不就乱套啦!就好比导演和演员意见不合,这戏还怎么演得下去?身体里要是这样,那可不得了,各种生理功能都会出问题。
还有啊,核酸和蛋白质的相互作用可不仅仅是这么简单。
它们之间的关系那是相当紧密,互相影响。
蛋白质也不是完全被动的,有时候它也能反过来影响核酸呢!就像是演员也能给导演提提意见,让戏变得更好。
咱们身体里的这么多复杂的过程,不都是靠核酸和蛋白质的完美配合嘛。
它们就像一对默契的搭档,一起为了我们的健康和生命活动努力着。
所以说啊,核酸和蛋白质的相互作用可真是太重要啦!我们得好好爱护我们的身体,让它们能一直好好地合作下去,这样我们才能健康快乐地生活呀,难道不是吗?。
糖_脂类_蛋白质和核酸的代谢及相互关系

丙酮 醉
下
一
葡” “ 一
分户
肪 一 撇夕旨 酸
…
,
乙酞
乙
行 酵 解产 物 丙 酮 酸 经三 梭酸 循 环 后 可释
放 大 量 能 量 首 先 丙 酮 酸 氧 化脱 玫 变 成 乙
。
薪
,
、
、
索酸 玻泊 酸
一
酞 辅酶
释放
十
,
,
再 经 八 步反 应
和 一分 子
,
最 后 彻 底分 解
・
‘
丁
八
循环
柠 檬酸
而 脱下的氢共 形 成 个 分子的
脱 氨 而 言 不 同生 物 脱 氨方 式也 不 同 主 要 的 脱 氨方 式 有氧 化 脱氨 非氧化 脱 氨 和 转 氨 其 中转
, ,
氨 作 用在 氨 基 酸 分 解 代 谢 中占 重要 地 位 与转 氮作 用 相 偶 联 的 反 应 有 卜 谷 氨 酸 脱 氢 酶 和 腺昔
。
酸 脱 氨 酶 所 催化 的脱 氨 反 应
、
。
脱 下的 氨 经 尿 素 循 环 生成 尿 素 氨 基 酸 经 脱 氨 后 的 碳 骨 架可通 过 乙 酸
。
、
。 酮 戊二 酸
、
唬 拍 酸 延 胡索酸 和 草 酞 乙 酸 等 五 个 入
氨 基 酸 和 蛋 白质 的 合成 代 谢
。
口进 入 三 梭酸 循环
。
不 同 生 物 合 成 氨 基 酸 的能 力 不 同 凡 不 能 自 己 合成 的
,
,
。
糖异 生 糖原 合成 过程
。
,
但有 三 步 反 应 与酵 解 不 同 需 另 外 的 酶 参 与 血 液 中的 葡萄 糖 经葡 萄糖
核酸、蛋白检测项目

核酸、蛋白检测项目标题:核酸和蛋白检测项目一、引言在生物医学领域,核酸和蛋白的检测是研究的重要部分。
它们不仅提供了生命现象的基础信息,而且也是诊断和治疗各种疾病的关键工具。
本文将详细介绍核酸和蛋白检测的相关知识及其应用。
二、核酸检测项目核酸(DNA和RNA)是生命体的遗传物质,它们携带了生命体的所有遗传信息。
通过分析核酸序列,我们可以了解生物体的基因型,预测其表型,并且可以用于疾病的诊断和治疗。
1. DNA测序:这是最直接的核酸检测方式,通过对DNA进行测序,可以获取个体的完整遗传信息。
2. PCR技术:PCR是一种用于扩增特定DNA片段的技术,常用于病毒或肿瘤基因的检测。
3. RNA-seq:这是一种高通量的RNA测序技术,可以全面了解细胞中基因表达的情况。
三、蛋白检测项目蛋白质是生命的执行者,它们负责完成所有的生理功能。
通过检测蛋白质的表达和活性,我们可以了解生物体的功能状态,以及疾病的发生和发展过程。
1. Western blot:这是一种常用的蛋白检测技术,可以定量和定性地检测特定蛋白质的存在和表达水平。
2. ELISA:这是一种高度敏感和特异的蛋白检测方法,常用于检测血液中的抗体或抗原。
3. 蛋白质组学:这是一种系统性的蛋白检测方法,可以全面了解细胞中所有蛋白质的状态。
四、结论核酸和蛋白的检测在生物医学研究和临床实践中具有重要价值。
随着科技的进步,我们有越来越多的方法来精确地检测核酸和蛋白,这些技术的发展无疑会推动我们的科研和医疗工作更上一层楼。
五、参考文献[此处列出相关的参考文献]注:以上内容仅供参考,具体操作应根据实际需求和实验室条件进行。
蛋白质和核酸
• 命题点2 围绕蛋白质与核酸考查科学思维
3.图中甲、乙、丙表示生物大分子,①②③表示生理过程。 下列分析错误的是( )
B
A.a、b、c共有的元素为C、H、O、N B.a与b的区别只是含有的五碳糖不同 C.通过②③过程核酸控制蛋白质的合成 D.同一生物不同细胞中的丙有差异
归纳拓展
考点一
(1)DNA、RNA和蛋白质三者间的内在关系:
免疫作用 促进B细胞增殖、分化为浆细 胞或记忆B细胞 主要运输氧气 识别等作用
与信号分子特异性结合,引 起受体细胞代谢变化
结构蛋白
构成细胞和生物体的成分
蛋白 质的 结构 层次
氨基酸 脱水缩合
多肽
原因:氨基酸之
间能够形成氢键
等
盘曲、
具有一定空
折叠 间结构的蛋
白质
原因:两条或多条 肽链通过化学键如 二硫键相互结合在 一起。
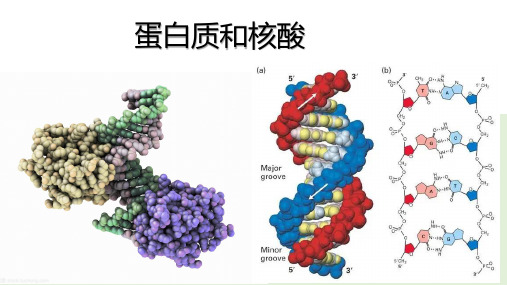
考点2 核酸的结构与功能
完成【必备知识回顾】和【思考】 要求:先自己结合课本思考完成,
再小组之间核对统一答案, 准备好回答问题。
DNA与RNA的区别比较: Nhomakorabea(1)分子组成的不同
DNA(脱氧核糖核酸) RNA(核糖核酸) ①DNA 的 五 碳 糖 是
结构
双链
单链
_脱__氧__核__糖__而RNA的则是核
RNA分布在细胞质中 ③老鼠细胞质中的遗传物质是RNA ④把DNA的一条
单链中的T换成U就是一条RNA链了 ⑤原核细胞中既有DNA,又有RNA ⑥
鉴定物种可以选择DNA、RNA、核苷酸
A.①⑤
B.①②④⑤
C.①②⑤⑥
D.①②③⑤
易混辨析
不同生物的核酸、核苷酸及碱基的情况
生命科学中的蛋白质与核酸相互作用机制研究

生命科学中的蛋白质与核酸相互作用机制研究生命科学是一门研究生物体及其生命现象的学科,其中的蛋白质与核酸相互作用机制研究属于其中的重要领域。
蛋白质与核酸是生命体系中最为基础和常见的大分子,两者之间的相互作用可谓是生命功能调控的基础。
本文将从以下几个方面进行介绍与探讨。
一、蛋白质与核酸的概念及其结构蛋白质和核酸都是生命体系中最为重要的分子。
蛋白质是由氨基酸组成的多肽,它们在体内担任着各种结构、传递、催化以及调控功能的重任。
而核酸是生命体系中的遗传物质,形成了DNA和RNA两种不同类型的核酸,DNA负责存储遗传信息,而RNA负责将遗传信息转化为具体的功能。
蛋白质与核酸的结构也是二者相互作用的基础。
蛋白质的结构分为四个层次:一级结构指蛋白质中氨基酸的化学序列,二级结构指蛋白质在局部呈现的空间结构,常见的包括a-螺旋和b-片层,三级结构指蛋白质整体的空间结构,包括局部折叠和全局折叠,四级结构指由多个蛋白质组成的复合物。
核酸的结构也具有大的类似性。
DNA分子大部分呈现出螺旋形状,通过镶嵌在螺旋内的氢键和VanderWaals力来保持稳定。
RNA的结构则有更多的变化,可以是线性或环形结构,提供了诸如催化反应和调控遗传信息等功能。
二、蛋白质与核酸的相互作用在生命系统中,蛋白质与核酸之间的相互作用可以体现出多种生物过程,如DNA复制、转录和翻译、RNA修饰、RNA剪切以及蛋白质的折叠和降解等。
其中,DNA复制是生命系统中最为基础和重要的过程之一,它需要依靠DNA聚合酶和其他辅助因子来实现。
在DNA复制过程中,DNA聚合酶能够在模板链上识别特定的配对碱基并合成新的链,一旦出现错配会被修复酶进行纠错。
复制完成后,两个完全相同的双链DNA分子得以产生。
RNA转录也是生命系统中非常重要的过程,它可以从DNA模板中复制一份RNA分子,并且有着诸多的调控机制。
转录过程中,RNA聚合酶沿着DNA模板链滑动,在核酸序列上拼接RNA,以此形成RNA多肽序列。
高中生物 1-3-2蛋白质和核酸课件必修1

结构破坏,其功能也就丧失。
答案 C
核酸
1.分类 (1) 核糖核酸 ,简称RNA;
(2) 脱氧核糖核酸 ,简称DNA。
2.功能 核酸是细胞中控制其 生命活动的大分子。每个细胞中都有 DNA 和 RNA 。DNA中贮藏的 遗传信息 控制着细胞的所有活动,并决定 细胞和整个生物体的 遗传特性 ;RNA在合成 蛋白质 时是必需的。
1.蛋白质的功能 ①有些蛋白质分子是构成细胞和生物体结构的重要物质。如人和
动物的肌肉中的主要组成物质是蛋白质。
②有些蛋白质具有调节功能。
③有些蛋白质具有催化作用。
④有些蛋白质具有运输功能。如红细胞中的血红蛋白具有运输O2 和一部分CO2的功能。 ⑤有些蛋白质具有免疫功能。举例分析:
2.蛋白质功能多样性能原因 结构决定功能,蛋白质结构的多样性决定了其功能的多样性。
【巩固2】 下列四个结构式中,属于构成蛋白质的氨基酸分子的是
( )。
解析
由氨基酸分子的结构通式可知,每个氨基酸分子至少含有
一个氨基(-NH2)和一个羧基(-COOH),并且都有一个氨基和一 个羧基连接在中央碳原子上。题中A项只有氨基,没有羧基;B项 只有羧基,没有氨基;C项的氨基和羧基不连接在同一个中央碳原 子上,只有D项能正确表示构成蛋白质的氨基酸分子。
人体细胞不能合成,必须从外界获取)和非必需氨基酸(人体细胞能
合成)。
拓展深化
人体的必需氨基酸
人体的必需氨基酸有8种,可巧记为“携一本两色书来家”,
即携(缬氨酸)、一(异亮氨酸)、本(苯丙氨酸)、两(亮氨酸)、色(
色氨酸)、书(苏氨酸)、来(赖氨酸)、家(甲硫氨酸)。注意:婴儿 有9种,多出的一种是组氨酸。
度分析。
核酸与蛋白质的生物合成
3、需要引物primer
4、双向复制与复制叉
DNA复制时,局部双链解开形成两条单链,这种叉状结构称为复制叉。
DNA复制时,以复制起始点为中心,向两个方向进行复制。但在低等生物中,也可进行单向复制(如滚环复制)。
02
中心法则
反中心法则
在RNA病毒中,其遗传信息贮存在RNA分子中。因此,在这些生物体中,遗传信息的流向是RNA通过复制,将遗传信息由亲代传递给子代,通过反转录将遗传信息传递给DNA,再由DNA通过转录和翻译传递给蛋白质,这种遗传信息的流向就称为反中心法则。
第一节 DNA的复制与修复 一、DNA复制的特点 1、半保留复制 DNA在复制时,以亲代DNA的每一股作模板,合成完全相同的两个双链子代DNA,每个子代DNA中都含有一股亲代DNA链,这种现象称为DNA的半保留复制(semi-conservative replication)。
02
真核生物DNA聚合酶
2)DNA复制的保真性
为了保证遗传的稳定,DNA的复制必须具有高保真性。DNA复制时的保真性主要与下列因素有关: 遵守严格的碱基配对规律; DNA聚合酶在复制时对碱基的正确选择; 对复制过程中出现的错误及时进行校正。
5、DNA连接酶ligase
DNA连接酶(DNA ligase)可催化两段DNA片段之间磷酸二酯键的形成,从而使两段DNA连接起来。 DNA连接酶催化的条件是: 需一段DNA片段具有3‘-OH,而另一段DNA片段具有5’-Pi基; 未封闭的切口位于双链DNA中,即其中有一条链是完整的,但T4 DNA连接酶能连接平头双链DNA; 需要消耗能量,在原核生物中由NAD+供能,在真核生物中由ATP供能。
第4章-第3节蛋白质和核酸
肽键。
课 时 作 业
菜
单
新课标 ·化学 选修5 有机化学基础
教 学 目 标 分 析 课 堂 互 动 探 究
1.组成和结构 (1)组成
教 学 方 案 设 计
蛋白质是由C、H、 O 、 N 、S等元素组成的结构复杂 的化合物。 (2)结构 一级结构 卷曲盘旋和折叠 盘曲折叠 ――→ 二级结构 ――→ 三级结构
教 学 方 案 设 计
A.仅②④ C.仅①②③
【解析】
既能与盐酸反应又能与NaOH溶液反应的物
当 堂 双 基 达 标
质有:多元弱酸的酸式盐(如NaHCO3)、弱酸弱碱盐[如
当 堂 双 基 达 标
课 前 自 主 导 学 菜 单
课 时 作 业
新课标 ·化学 选修5 有机化学基础
教 学 目 标 分 析 课 堂 互 动 探 究
2.如何鉴别棉麻织品与丝织品的布料?
教 学 方 案 设 计
【提示】
棉麻织品的成分是纤维素,丝织品成分是
蛋白质。分别取样品灼烧,有烧焦羽毛气味产生的布料为 丝织品。
当 堂 双 基 达 标
课 前 自 主 导 学
【答案】
C
课 时 作 业
菜
单
新课标 ·化学 选修5 有机化学基础
教 学 目 标 分 析 课 堂 互 动 探 究
1.在四种化合物:①NaHCO3、②Al(OH)3、 ③(NH4)2S、④HN2—CH2COOH中,跟盐酸和氢氧化钠溶 液都能反应的是( ) B.仅①② D.①②③④
当 堂 双 基 达 标
课 前 自 主 导 学
亚基的立体排布 (三维) ――→ 四级结构 亚基间相互作用与布局
菜 单
课 时 作 业
蛋白质和核酸
【讨论】若不小心误服了铅离子,在去医院前可 以采用什么急救措施?
盐析与变性的对比
盐析
变性
相同点
加入某种物质后有沉淀生成
不 同
盐 加入某些浓盐溶液,
不 如: Na2SO4 同 (NH4)2SO4等
重金属盐、醛、加 热或剧烈震动
点 复原 可逆,加水即可
不可逆
的缩反合应机理: 酸脱羟基,氨脱氢
+
肽键
+ H2O
多种氨基酸分子按不同的排列顺序以肽键相互结合,
可以形成千百万种具有不同的理化性质和生理活性 的多肽链。相对分子量在10 000以上的,并具有一 定空间结构的多肽,称为蛋白质。
知识拓展
H
NH HO O
CH2
C
Δ
O
C
CH2 OH HN
H
H NO ON H
3、具有酸性
4、分类: (1)脱氧核糖核酸(DNA):生物遗传信息的载体; 还指挥着蛋白质的合成、细胞的分裂和制造新的细胞。 (2)核糖核酸(RNA):根据DNA提供的信息控制 体内蛋白质的合成。
二、蛋白质的结构与性质
1、蛋白质的组成
组成元素主要包括: C、H、O、N、S等
组成基本结构单元: 氨基酸
相对分子质量:
几万----几千万
属于含氮生物高分子化合物
2、蛋白质的结构
一级结构:蛋白质中各种氨基酸的连接方式和排列顺序, 肽键是一级结构的主键。
二级结构:多肽链卷曲盘旋和折叠的空间结构
三级结构:二级结构 的肽链进一步盘曲折 叠形成亚基。
1、什么是酶
一类由细胞产生的,对生物体内的化学反 应具有催化作用的蛋白质。
蛋白质序列转化为核酸序列
蛋白质序列转化为核酸序列蛋白质是生物体中不可或缺的重要分子,它们在细胞内担任着各种功能。
蛋白质的合成是通过DNA的转录和翻译过程来完成的。
DNA 中的基因编码了蛋白质的氨基酸序列,而这个序列被转录成mRNA,再通过翻译过程转化成蛋白质。
但有时候,我们可能需要根据蛋白质的氨基酸序列来反推出对应的核酸序列,这在一些生物信息学研究中是非常重要的。
我们需要了解蛋白质和核酸之间的对应关系。
蛋白质由20种氨基酸组成,而核酸则由4种碱基(腺嘌呤、胞嘧啶、鸟嘌呤和胸腺嘧啶)组成。
每个氨基酸都对应着一个或多个核苷酸三联体,这被称为密码子。
因此,在将蛋白质序列转化为核酸序列时,我们需要根据这种对应关系进行推断。
我们可以利用生物信息学工具和数据库来进行蛋白质序列到核酸序列的转化。
常用的方法是通过比对蛋白质序列到核酸序列的转录版本,然后再根据密码子的对应关系来推断出核酸序列。
这种方法可以帮助我们准确地将蛋白质序列转化为核酸序列,为后续的研究和分析提供基础。
还有一些基于机器学习和人工智能的算法可以帮助我们进行蛋白质序列到核酸序列的转化。
这些算法可以通过大量的数据训练,从而提高转化的准确性和效率。
通过这些算法,我们可以更快地将大量的蛋白质序列转化为对应的核酸序列,为生物信息学研究提供更多可能性。
总的来说,将蛋白质序列转化为核酸序列是一项重要的生物信息学任务,它可以帮助我们更深入地理解蛋白质和核酸之间的关系,为生物学研究和药物设计提供更多的线索。
通过合理利用生物信息学工具和算法,我们可以更准确地完成这项任务,为科学研究和医学健康带来更多的可能性。
希望未来能够有更多的研究和技术突破,让蛋白质序列到核酸序列的转化变得更加便捷和高效。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第十九章 蛋白质和核酸§19—1氨基酸一、氨基酸的结构、分类和命名蛋白质完全水解后生成氨基酸。
氨基酸已有200余种,绝大多数为α—氨基酸,绝大多数为L —氨基酸。
R C 2HCOOH 天然产的各种不同的α-由氨基酸只R 不同而已。
1.分类① 肪族氨基酸、芳香族氨基酸、杂环氨基酸。
② 据氨基和羧基的相对位置分为:α—氨基酸、β—氨基酸和γ—氨基酸。
③ 据氨基和羧基的数目可分为:中性氨基酸、酸性氨基酸和碱性氨基酸。
2.命名:根据氨基酸的来源或性质命名。
见表20-1。
生物体内作为合成蛋白质的原料只有二十种。
这二十种氨基酸都有国际通用的符号,但熟记比较困难,暂用它的中文名的第一个字,如甘氨酸用“甘”。
二、氨基酸的构型D/L 标记法:距羧基最近的手性碳原子为标准。
注意和糖中讲的D/L构型区别,糖中是以距醛基最远的手性碳原子为HOCOOHH CH 3H 2NCOOHH CH 3H 2NCOOHHR L- 乳酸L- 丙氨酸L- 型氨基酸标准。
三、化学性质 具有氨基和羧基的典型反应。
还表现出特性。
1.两性①形成内盐 氨基酸在一般情况下不是以游离的羧基或氨基存在的,而是两性电离,在固态或水溶液中形成内盐。
如果把测得甘氨酸的K a 值看成是代表甘氨酸中铵离子的酸度。
H 3 NCHRCOO +-+H 2OH 3O ++H 2NCHRCOO-K a =H 3O +H 2NCHRCOO-H 3 NCHRCOO+-如果把测得甘氨酸的K b 值看成是代表甘氨酸中羧酸根离子的碱度。
H 3 NCHRCOO +-+H 2O+HO -H 3 NCHRCOOH +HO -K b =H 3 NCHRCOO+-H 3 NCHRCOOH +测得甘氨酸的K a =1.6×10-10,甘氨酸的K b =2.5×10-12。
而大多数羧酸K a 约为10-5,大多数脂肪胺的K b 约为10-4。
因为在水溶液中,一个共轭酸和它的共轭碱的酸碱度的关系式是L- 苏氨酸H 2N COOHH CH 3HOH D-苏阿糖HO CHO H CH 3HOH R CH COOHNH 2R CH COO3+-K a ×K b =10-14。
由上式算出甘氨酸中的正离子—N +H 3,K a =1.6×10-10,这意味着它的共轭碱—NH 2的K b =6.3×10-5。
同样算出甘氨酸中共轭碱—COO -的K b 为2.5×10-12,这意味着它的共轭酸—COOH 的K a =4×10-3。
前者对一个脂肪胺来说,后者对一个有强吸电子的羧酸来说,其酸碱度都是合理的数值。
因此,在象甘氨酸这样简单的氨基酸中它的酸性基团是—N +H 3,它的碱性基团是—COO -。
② 氨基酸存在形式:氨基酸在强酸性溶液中以正离子存在,在强碱性溶液中以负离子存在。
在等电点时,氨基酸主要以两性离子存在:这样,在强酸性介质中电解氨基酸溶液,则在阴极上析出氨基酸;反之,如在强碱性介质中,则氨基酸的负离子移向阳极。
③ 成盐在溶液中有少量不电离的氨基酸,可与强酸、强碱都能成盐,遇酸成铵盐,遇碱成羧酸盐:④ 离子化-R CH COOHNH 3R CH COONH 3+-R CH COONH 2-(Ⅱ)(Ⅰ)+正离子两性离子负离子-R CH COOHNH 2R CH COONH 3+-R C H C OOH N H 2+HClR C H C OOHN H3++Cl-RC H C OOH N H 2+RC H C OO N H 2+NaOH-Na +在水溶液中,氨基酸分子中的羧基和氨基可以分别象酸或碱一样的离子化。
2.等电点氨基酸在水中可以发生离子化,但离子化程度是不相同的。
当向氨基酸水溶液中加入酸或碱可以抑制氨基酸分子中的羧基或氨基的离子化程度。
① 等电点:当溶液调节至一定的pH 值时,氨基酸可以两性离子的形式存在,将此溶液置于电场中,氨基酸不向电场的任何一极移动,即处于电中性状态,这时溶液的pH 值称为氨基酸的等电点,通常以pl 表示。
K 1:-COOH 电离常数;K 2:-NH 3+电离常数。
② pH 值:中性氨基酸的等电点小于7(负离子要多些)。
等电点一般在5~6.3之间。
酸性氨基酸需加入酸将溶液调到等电点,故其等电点小于7。
等电点OH -R CH COOHNH 3R CH COONH 3++-R CH COO NH 2-(Ⅱ)(Ⅰ)+正离子两性离子负离子+H 3O+R CH COOHNH 3R CH COONH 3+-R CH COONH 2-(Ⅱ)(Ⅰ)++OH -OH -+RC H C OOH N H 2+RC H C OO N H 2+-H 2H 3O+RCH COOH NH 2+RCH COOH NH 3+H 2O+OH -=pIpK 1+pK 22一般在2.8~3.2之间。
碱性氨基酸需加入碱将溶液调到等电点,故其等电点大于7。
等电点一般在7.6~10.8之间。
(习题:P649,2)pH<pI 氨基酸以正离子形式存在(酸性增加); pH>pI 氨基酸以负离子形式存在(碱性增加)。
③ 氨基酸在等电点时,溶解度最小。
可用调节氨基酸等电点的方法分离氨基酸的混合物。
3.氨基酸的反应 氨基酸分子中的氨基和羧基的化学反应。
① 氨基酰化乙酰氯、醋酸酐 、苯甲酰氯、邻苯二甲酸酐等都可作酰化剂,得到相应的氨基酸衍生物。
因为在蛋白质中氨基酸是以酰胺的形式存在的,在研究合成蛋白质的过程中人们创造了各种构成酰胺键的试剂和方法。
例如:为了保护氨基可用苄氧甲酰氯作为酰化剂,因为既可容易引入,又能用多种方法把它脱下来。
② 氨基的烃基化2,4-二硝基氟苯能氨基酸的氨基发生反应,用2,4-二硝基氟苯作为测定N 端的试剂:氨基酸的二硝基衍生物,用非极性溶剂抽提出来,再用层析法分离鉴定。
`R COClRCH COOHH 2N +`R CRCH COOHHN O+HCl`R CH 2Cl RCH COOHH 2N +`RCH 2RCH COOH HN +HClRCH C OOHH 2N +RCH COOHH N HFF NO 2N O 2N O 2NO 2-③ 与亚硝酸反应:HNO 2的作用—范斯莱克氨基酸测定法(测定计算分子中氨基的含量)放出的氮气,一半来自氨基酸的氨基,半来自亚硝酸,反应是定量完成的,衡量放出的氮气。
④ 与茚三酮反应—α-氨基酸的特有反应(鉴别α-氨基酸)一般生成紫色。
脯氨酸、羟基脯氨酸生成黄色。
甲醛作用 (使氨基消失,既碱性消失,可用碱滴定羧基的含量)⑤ 氨基酸羧基的反应主要利用它能生成酯,成酐、成酰胺的一些反应。
将氨基酸转化成酯再与肼作用生成酰肼,酰肼与亚硝酸作用则生成叠氮化合物。
叠氮化合物与另一氨基酸作用即能缩合成二肽:R`COOR``H 2N R 3ZHN O +`R COOR``HN R O↑R CH COOH NH 2+HNO 2R CH COOH OH+N 2+H 2O R CH COOH NH 2+R CH COOH N=CH 2+H 2OH 2NCHCOOH R +OH OH OONOO O O2+RCHO CO 23H 2O++RC H C O OH H 2N RC H C O OR `H 2N NH 2NH 2R CH C-NH-NH2H 2N OHONOR CH C-N 3H 2N O叠氮法合成的肽能保持产品光学纯度。
⑥ 受热反应 (注意和前面讲过的羟基酸受热反应比较) α-氨基酸受热时,两分子α-氨基酸失水形成哌嗪二酮的衍生物α-羟基酸加热形成交酯。
β-氨基酸受热时则失氨而形成α,β-不饱和酸。
(和β-羟基酸受热产物一样)γ-氨基酸和δ-氨基酸受热则分子内氨基与羧基失水形成内酰胺。
(γ-羟基酸和δ-羟基酸受热形成内酯。
) 四、物理和光谱性质1.α—氨基酸都是无色结晶。
因是在等电点成两性离子时结晶出来的,在分子内即有极强的静电引力,其熔点无疑要较相应的胺或羧酸高,通常熔融时都分解。
2.α—氨基酸溶于水,在等电点时溶解度最小。
由于它具两性离子的结构,一般难溶于非极性有机溶剂。
2C CHH 3C O OH NH 2C CH CH 3OHO+HNC CHH 3C ONH CCH 3O3,6-二甲基-2,5-哌嗪二酮H 2CH R CH 2COOH△HC CHR COOH +NH 3H 2CH R CH 2CH 2COOH△+H 2OCH R CH 2CH 2COγ-氨基酸γ-内酰胺3.α—氨基酸IR :1600cm -1处有一羧负离子的吸收带(1720 cm -1没有羧基的典型谱带)。
在3100-2600 cm -1间有一强而宽的N-H 键伸缩吸收带。
§19—2 多肽 一、肽和肽键氨基酸分子间的氨基与羧基失水,以酰胺键(肽键)相连而成的化合物叫做肽。
1.肽键2.肽的结构C —端:保留游离的羧基;N —端:保留游离的氨基。
三肽有6种可能的方式;四肽有24种可能的方式;六肽有720种可能的方式。
氨基酸和二肽类的整个酰胺基是共平面的,即羰基碳、氮以及连接它们的四个原子都处于一个平面中, 3.多肽的命名H 2N CH R NRCOOHO 12二肽H 2N CH R NHC R O 12三肽N O C HRCOOH3H 2N CH 2OHC CH 3COOH(Ⅰ)甘氨酰- - 丙(Gly - Ala)H 2N CHO CH 2COOH丙氨酰 - - 甘(Ala - Gly )CH 3(Ⅱ)CNHO肽键以含C —端的氨基酸为母体,把肽链中其它氨基酸名称中的酸字改为酰字,将含N —端的氨基酸写在最前,然后按它们在链中的顺序依次排列至最后含C —端的氨基酸。
二、多肽结构的测定和端基分析确定天然多肽结构是很麻烦的。
首先知道由哪些氨基酸组成的(可通过长度水解确定),还要知道各氨基酸的连接顺序。
1.分子量大小的测定(相对分子质量)多肽虽是个高分子化合物,但是个具有极其严格而精细结构的,有固定的相对分子质量,而不是象一般高分子化合物那样只是一个平均相对分子质量,可用化学方法或用各种物理方法,如渗透压法、光散射法,以用测量超离心时的性能和X 衍射。
2.氨基酸的定量分析多肽在6mol/LHCl ,105℃时水解(碱性水解易引起手性碳的外消旋化,故不能用)。
水解后得的氨基酸混合液可用氨基酸分析仪分离和测定。
3.测定N 端和C 端① 2,4—二硝基氟苯法NH 2CHCH 2CH 2OCH 谷氨酰- 半胱氨酰 - 甘氨酸简写为谷- 半胱 - 甘(Glu - Cys - Gly )HOOCCH 2H 2C COOHSHOH 2N CH OCH RR CH COOHOO 2NO 2NR 123F +DNFB 为标记N —端试剂。
