硅酸钠和氯化钙反应方程式
硅酸钠制硅酸的化学方程式

硅酸钠制硅酸的化学方程式
硅酸钠(Na2SiO3)是一种无机化合物,其化学式为Na2O·nSiO2,其中n为硅酸钠分子中硅酸的个数,通常为5-6。
硅酸钠可由石英砂与碳酸钠反应得到,化学方程式如下所示:
SiO2 + Na2CO3 → Na2SiO3 + CO2↑
在这个反应过程中,石英砂(SiO2)与碳酸钠(Na2CO3)发生化学反应生成硅酸钠(Na2SiO3)和二氧化碳(CO2)。
这个反应是一种酸碱反应。
碳酸钠是一种弱碱性物质,而石英砂则是一种无机酸。
在反应中,碳酸钠中的碱性氧化物氧化钠(Na2O)与石英砂中的酸性氧化物二氧化硅(SiO2)发生中和反应,生成硅酸钠。
硅酸钠是一种白色结晶性固体,可溶于水。
它在水中能够解离产生硅酸根离子(SiO32-)和钠离子(Na+)。
硅酸根离子是一种具有酸性的离子,它能够与金属离子或酸性氧化物发生反应,生成相应的盐类或硅酸。
硅酸钠在许多工业领域中具有广泛的应用。
例如,在水泥工业中,硅酸钠被用作水泥的主要成分之一。
它能够与水泥中的钙化合物反应生成硅酸钙,从而增强水泥的硬度和耐久性。
此外,硅酸钠还被用作玻璃制造、洗涤剂生产、纸浆漂白等方面的原料。
总结起来,硅酸钠制硅酸的化学方程式为SiO2 + Na2CO3 → Na2SiO3 + CO2↑。
这个反应是一种酸碱反应,通过中和反应生成硅酸钠。
硅酸钠在水中能够解离产生硅酸根离子和钠离子,具有广泛的应用领域。
(人教版)2020中考化学真题分类汇编 第十单元 酸和碱(含解析)

第十单元酸和碱1.(2019广州)下列物质属于碱的是()A. H2OB. NaHCO3C. Ca(OH)2D. H3BO3【答案】C【解析】H2O属于氧化物;NaHCO3属于盐;Ca(OH)2属于碱;H3BO3属于酸。
故选C。
2.(2019重庆A)食醋里通常含有3-5%的醋酸( CH3COOH),食醋与鸡蛋壳反应产生能使澄清石灰水变浑浊的气体。
下列说法不正确的是()A. 产生的气体是二氧化碳B. 加水稀释食醋,溶液pH变小C. 醋酸在水溶液里能解离出H+D. 不宜用铝制容器盛装食醋【答案】B【解析】鸡蛋壳的主要成分是碳酸钙,碳酸钙与醋酸反应生成醋酸钙、水和二氧化碳;加水稀释食醋,溶液的酸性减弱,溶液pH变大;电离时产生的阳离子全部是氢离子的化合物属于酸,醋酸属于酸在水溶液里能解离出H+;铝是活泼金属,能与醋酸反应生成醋酸铝和氢气,不宜用铝制容器盛装食醋。
故选B。
3.(2019北京)一些物质的pH范围如下,其中呈碱性的是()A.油污净(12~13)B.西瓜汁(5~6)C.洁厕灵(1~2)D.橘子汁(3~4)答案:A解析:pH>7即呈现出碱性,故应选择A答案。
4.(2019邵阳)下表是人体内一些液体的正常pH范围其中酸性最强的是A. 血浆B. 唾液C. 胃液D. 尿液【答案】C【解析】当溶液的pH<7时,随着pH的减小酸性增强,胃液的pH最小,胃液酸性最强。
故选C。
5.(2019北京)下列物质能与NaOH反应的是()A.FeB.CO2C.Fe2O3D.NaCl答案:B解析:NaOH物质分类属碱,碱的化学性质有四点,其中一点是与非金属氧化物反应,CO2属于非金属氧化物,故选择B。
6.(2019天津)人体中一些体液或排泄物的pH范围如下,其中酸性最强的是()A. 胃液0.9~1.5B. 唾液6.6~7.1C. 尿液4.7~8.4D. 胰液7.5~8.0【答案】A【解析】pH值越小,酸性越强,故选A。
硅酸钠和氯化钙反应方程式

硅酸钠和氯化钙反应方程式硅酸钠和氯化钙反应方程式如下所示:
Na2SiO3 + CaCl2 → CaSiO3 + 2NaCl
在这个反应中,硅酸钠(Na2SiO3)与氯化钙(CaCl2)发生化学反应,产生了硅酸钙(CaSiO3)和氯化钠(NaCl)。
这个反应属于酸碱中和反应类型,其中硅酸钠是酸性物质,氯化钙是盐酸性物质,通过反应生成了中性物质硅酸钙和氯化钠。
这个反应方程式描述了反应的化学计量比例,它告诉我们1摩尔的硅酸钠和1摩尔的氯化钙会生成1摩尔的硅酸钙和2摩尔的氯化钠。
在该方程式中,化学式后面的数字表示摩尔比例。
p区非金属元素二(氮硅硼)

p区非金属元素(二)(氮族、硅、硼)●[实验目的]1、试验并掌握不同氧化态氮的化合物的主要性质。
2、试验磷酸盐的酸碱性和溶解性。
3、掌握硅酸盐,硼酸及硼砂的主要性质。
4、练习硼砂珠的有关实验操作。
●[实验用品]见教材。
●[实验内容]一、铵盐的热分解在一支干燥的硬质试管中放入约1g氯化铵,将试管垂直固定、加热,并用润湿的pH试纸横放在管口,观察试纸颜色的变化。
在试管壁上部有何现象发生?解释现象,写出反应方程式。
反应方程式如下所示:NH4Cl=NH3+HCI现象:由于NH3气体的密度小于空气也小于HCI,生成的NH3气体首先挥发到试管管口,用湿润的pH试纸检验呈碱性,随着分解反应的进行,有大量的HCI气体逸出至试管管口,使pH试纸呈酸性;同时又由于NH3和HCI气体具有加合性,且反应速度极快,在试管壁生成一层白色附着物。
分别用硫酸铵和重铬酸铵代替氯化铵重复以上实验,观察并比较它们的热分解产物,写出反应方程式。
反应方程式如下:(NH4)2SO4= NH3↑+NH4HSO4(NH4)2Cr2O7=Cr2O3+N2↑+4H2O根据实验结果总结铵盐热分解产物与阴离子的关系。
结论:固态的铵盐加热极易分解,一般分解为NH3和相应的酸。
如果酸是不挥发的,则生成NH3和酸式盐或酸残留在容器中。
如果生成的酸有氧化性,则NH3被氧化为N2O。
二、亚硝酸的生成和分解1.亚硝酸的生成和分解将1mL 3M H2SO4溶液注入在冰水中冷却的1mL饱和NaNO2溶液中,观察反应情况和产物的颜色。
将试管从冰水中取出,放置片刻,观察有何现象发生相应的反应方程式如下:NaNO2+H2SO4= HNO2+NaHSO4现象:由于生成的HNO2很不稳定,仅能存在于冰的稀溶液中。
微热,甚至在冷的情况下,也易分解为NO、NO2和水。
NO2为稳定气体。
试管口有棕色气体。
反应式:4HNO2=4NO+2H2O+O22NO+O2=2NO2结论:HNO2易分解,稳定性差。
人教版九年级化学下专题训练——酸与碱的探究题含答案
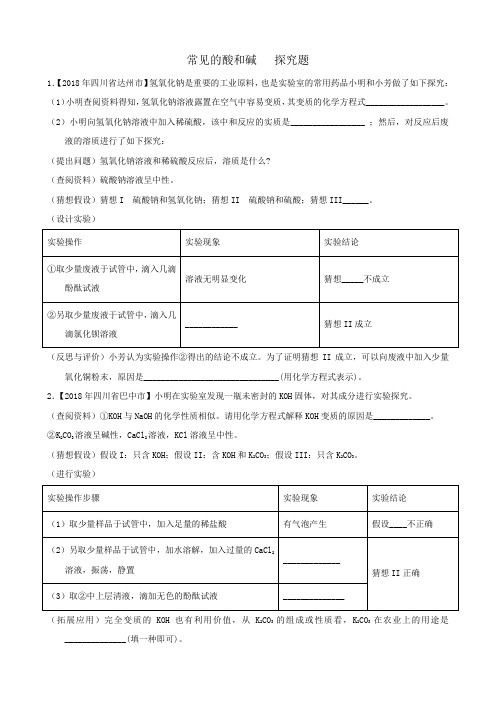
常见的酸和碱探究题1.【2018年四川省达州市】氢氧化钠是重要的工业原料,也是实验室的常用药品小明和小芳做了如下探究:(1)小明查阅资料得知,氢氧化钠溶液露置在空气中容易变质,其变质的化学方程式__________________。
(2)小明向氢氧化钠溶液中加入稀硫酸,该中和反应的实质是_________________ ;然后,对反应后废液的溶质进行了如下探究:(提出问题)氢氧化钠溶液和稀硫酸反应后,溶质是什么?(查阅资料)硫酸钠溶液呈中性。
(猜想假设)猜想I 硫酸钠和氢氧化钠;猜想II 硫酸钠和硫酸;猜想III______。
(设计实验)(反思与评价)小芳认为实验操作②得出的结论不成立。
为了证明猜想II成立,可以向废液中加入少量氧化铜粉末,原因是_______________________________(用化学方程式表示)。
2.【2018年四川省巴中市】小明在实验室发现一瓶未密封的KOH固体,对其成分进行实验探究。
(查阅资料)①KOH与NaOH的化学性质相似。
请用化学方程式解释KOH变质的原因是_____________。
②K2CO3溶液呈碱性,CaCl2溶液,KCl溶液呈中性。
(猜想假设)假设I:只含KOH;假设II:含KOH和K2CO3;假设III:只含K2CO3。
(进行实验)(拓展应用)完全变质的KOH也有利用价值,从K2CO3的组成或性质看,K2CO3在农业上的用途是______________(填一种即可)。
3.【2018年山东省青岛市】某兴趣小组在实验室里准备常见酸、碱、盐的性质实验时,发现实验台上摆放的药品中,有一瓶未盖瓶塞且标签破损的溶液(如图),他们决定对这瓶溶液的成分进行探究。
(提出问题)这瓶溶液的溶质是什么?(获得信息)(1)酸、碱、盐的性质实验中用到含钠元素的物质有氯化钠、氢氧化钠、碳酸钠、碳酸氢钠。
(2)实验室里盛放碱性溶液的试剂瓶通常使用橡胶塞。
(3)碳酸氢钠溶液与氯化钡溶液不反应;氯化钡溶液呈中性。
2019届中考复习-氢氧化钠、碳酸钠、碳酸氢钠实验探究专题(含答案)

2019届中考复习—氢氧化钠、碳酸钠、碳酸氢钠实验探究专题1. (2018·山东烟台)已知某品牌膨松剂的成分是碳酸氢钠、碳酸氢铵中的一种或两种,某化学兴趣小组为确定该品牌膨松剂的成分,进行如下探究:查阅资料:①氨气水溶液呈碱性②浓硫酸和碱石灰都可做气体吸收剂;浓硫酸能吸收氨气,不能吸收二氧化碳;碱石灰是氧化钙与氢氧化钠固体的混合物,不与氨气反应。
【设计实验】兴趣小组利用如下装置进行探究(装置气密性良好,各装置中气体吸收剂足量)依次连接A、C、D装置,点燃A 处的酒精灯,将试管中的该膨松剂样品充分加热至完全反应后,通过观察到、现象可以证明该膨松剂中含有NaHCO3和NH4HCO3 两种物质。
其中装置C 的作用是。
【拓展探究】为进一步确定该品牌膨松剂中NaHCO3 和NH4HCO3的质量比,同学们取两份等质量的该品牌膨松剂样品,利用图提供的实验装置,设计并进行了如下两组实验:序号实验操作测得数据实验1 将其中的一份膨松剂样品加入A 装置试管中,将A装置依次连接B、C 装置,充分加热至膨松剂完全反应装置C增重1.98g实验2 将另一份膨松剂样品加人A 装置试管中,将A 装置依次连接C、B 装置,充分加热至膨松剂完全反应装置B增重0.34g基于以上实验数据分析,该品牌膨松剂中NaHCO3和NH4HCO3的质量比是。
【实验反思】小明认为以上拓展探究实验存在一定误差,导致误差的原因是(答一条即可)。
2. (2018·江苏无锡)碳酸钠广泛用于造纸、纺织、玻璃、洗涤剂、肥皂、制革等工业,是一种重要的化工原料。
吕布兰、索尔维和侯德榜为碳酸钠的工业化生产作出了巨大贡献。
I 、吕布兰法:1789 年,法国医生吕布兰(N.Leblanc ,1742﹣1806)以食盐、浓硫酸、木炭和石灰石为原料,开创了规模化工业制取碳酸钠的先河,具体流程如图1)碳酸钠俗称2)在高温条件下,②中发生两步反应,其中一步是Na2SO4和木炭生成Na2S和CO,该反应的化学方程式为(3)③中“水浸”时通常需要搅拌,其目的是(4)不断有科学家对吕布兰法进行改进,是因为此法有明显不足,请写出一条不足之处。
水玻璃反应方程式

水玻璃反应方程式嘿,朋友们!今天咱们来唠唠水玻璃相关的反应方程式,那可太有趣啦!水玻璃,学名叫硅酸钠(Na₂SiO₃),就像一个神秘的化学小怪兽。
先来说说它和盐酸(HCl)的反应吧。
就好像水玻璃这个小怪兽遇到了盐酸这个超级英雄,然后发生了一场激烈的战斗。
化学方程式是Na₂SiO₃ + 2HCl = 2NaCl + H₂SiO₃↓。
你看啊,盐酸把水玻璃打得吐出了硅酸(H₂SiO₃)这个白色的小云朵(沉淀就像小云朵一样),还产生了氯化钠(NaCl)这个小跟班。
再看看水玻璃和二氧化碳(CO₂)的反应。
二氧化碳就像一个调皮的小幽灵,悄悄地钻进了水玻璃的世界。
反应方程式是Na₂SiO₃ + CO₂ + H₂O = Na₂CO₃ + H₂SiO₃↓。
这就好比小幽灵二氧化碳和水一起,把水玻璃弄出了硅酸这个小疙瘩(沉淀),还留下了碳酸钠(Na₂CO₃)这个小尾巴。
要是水玻璃和硫酸(H₂SO₄)相遇呢?哇塞,那就是一场化学界的大乱斗啊!方程式为Na₂SiO₃ + H₂SO₄ = Na₂SO₄ + H₂SiO₃↓。
硫酸像个大力士,把水玻璃撞得七零八落,弄出了硅酸这个白色的小怪物(沉淀),还有硫酸钠(Na₂SO₄)这个小碎片。
水玻璃和氯化钙(CaCl₂)也能发生反应呢。
想象一下,水玻璃是个蓝色小星球,氯化钙是个绿色小星球,当它们靠近的时候,就会发生Na₂SiO₃+ CaCl₂ = CaSiO₃↓+ 2NaCl。
硅酸钙(CaSiO₃)就像一座小桥梁(沉淀)搭在两个星球之间,同时还有氯化钠这个小游客在旁边看着。
还有水玻璃和氯化铵(NH₄Cl)的反应。
这就像水玻璃在和氯化铵玩一场交换游戏。
方程式是Na₂SiO₃ + 2NH₄Cl = 2NaCl + H₂SiO₃↓+2NH₃↑。
氯化铵这个小魔术师,把水玻璃变成了硅酸这个小硬块(沉淀)和氨气(NH₃)这个小臭屁虫,还留下了氯化钠这个小成果。
水玻璃和硝酸(HNO₃)碰到的时候,那也是很精彩的。
氯化钙

氯化钙一、产品说明Calcium Chloride氯化钙化学式CaCl2,为白色粉状、粒状、片状、块状物。
熔点782℃,沸点1600℃,密度2.15克/厘米3(25℃)。
氯化钙在水中的溶解度很大,0℃时100克水能溶解59.5克氯化钙,100℃时溶解159克。
能形成含1、2、4、6个结晶水的水合物,它们存在的温度范围是:CaCl2•6H2O低于29℃;CaCl2•4H2O,29~45℃;CaCl2•2H2O,45~175℃;CaCl2•H2O,200℃以上。
它也溶于乙醇,生成CaCl2•4C2H5OH,与氨作用,形成CaCl2•8NH3。
无水氯化钙是工业和实验室常用干燥剂,但不能用来干燥乙醇和氨。
氯化钙易潮解,可用于浇洒道路以消尘。
二、产品用途1、道路、高速公路、停车场、机场、高尔夫球场等冬季除雪;2、石油钻探、钻井工作液、完井液、石油化工脱水液;3、防除尘埃、煤尘、矿尘;4、建筑行业早强剂,提高混凝土强度,生产涂料的凝固剂;5、用于防潮用干燥剂;工艺中气体和液体的干燥介质;6、橡胶行业乳胶凝结剂;7、黑色冶金工业氯化剂和添加剂;8、造纸工业添加剂及废纸张脱墨;9、化学工业的无机化工原料及硫酸根脱除剂,海藻酸钠的凝固剂;10、制冷工业用于制冷;11、用于防治小麦、苹果、白菜等腐烂及食品防腐剂;12、用于染料及印染工业生产中。
三、产品品种(一)液体氯化钙(二)固体氯化钙1、按氯化钙所含含量结晶水的多少分为:(1)二水氯化钙a、二水片状氯化钙,含量为70% min ;72%min;74%min;77%minb、二水粒状氯化钙,含量为74%min;77%minc、二水粉状氯化钙,含量为74%min;77%min(2)无水氯化钙a、无水片状氯化钙,含量为90%min;92%min;94%minb、无水粒状氯化钙,含量为90%min;92%min;94%minc、无水粉状氯化钙,含量为90%min;92%min;94%min2、按级别分为:(1)工业级氯化钙(2)食品级氯化钙都要反应因为硅酸钙是沉淀所以第一个方程会置换生成新盐Na2SiO3 + CaCl2 = CaSiO3↓ + 2NaCl第二个反应也会生成不溶于碱的强碱弱酸盐(呈碱性)沉淀所以反应可以发生Na2SiO3 + Ca(OH)2 = CaSiO3↓ + 2NaOH利用生成不溶于碱的强碱弱酸盐(呈碱性)沉淀的反应是生成强碱的重要途径之一氯化钙一硅酸钠双液法调剖剂这种双液法调剖剂主要发生如下反应:CaC12+Na2 O ·mSi02一CaO ·mSiC~+ 2NaC1CaCl2具有吸水性,溶于水并大量放热,化学性质稳定,溶于浓硫酸中放出氯化氢气体水玻璃为硅酸钠溶液状态,南方多称水玻璃,北方多称泡花碱。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
硅酸钠和氯化钙反应方程式
硅酸钠和氯化钙是两种常见的无机盐,它们在一定条件下反应可
以生成沉淀。
本文将详细介绍硅酸钠和氯化钙反应的方程式和机理。
首先,我们来分析硅酸钠和氯化钙这两种化合物的化学式和性质。
硅酸钠的化学式为Na2SiO3,是一种白色结晶粉末,可溶于水,具有一定的碱性。
氯化钙的化学式为CaCl2,是一种无色结晶固体,可以溶解在水中,具有一定的盐性。
当硅酸钠和氯化钙混合并加热时,它们会发生反应。
这个反应需
要适宜的温度和反应时间,一般在100-400摄氏度范围内。
反应过程中,硅酸钠分解产生硅酸根离子(SiO3^2-)和钠离子(Na+),氯化
钙分解产生氯离子(Cl-)和钙离子(Ca2+)。
硅酸根离子和钙离子结
合形成硅酸钙(CaSiO3),同时钠离子和氯离子结合形成氯化钠(NaCl),这是反应的主要产物。
反应方程式可以表示为:Na2SiO3 + CaCl2 → CaSiO3 + 2NaCl
在该反应中,硅酸钙是一个白色固体,也是反应的主要产物,可
以生成可见的沉淀。
氯化钠则是无色结晶固体,溶解在水中可以形成
透明的溶液。
这个反应方程式符合化学方程式平衡的原则,反应前后离子种类
和数量保持一致。
硅酸钠的两个钠离子和氯化钙的两个氯离子结合形
成两个氯化钠分子,钙离子和硅酸钠的硅酸根离子结合形成一个硅酸
钙分子。
该反应属于双替换反应,双替换反应是指两个反应物中的阳离子
和阴离子对换位置,生成两个新的离子化合物。
在这个反应中,硅酸
钠中的钠离子和氯化钙中的氯离子互相交换位置,形成氯化钠和硅酸钙。
总之,硅酸钠和氯化钙反应方程式为Na2SiO3 + CaCl2 → CaSiO3 + 2NaCl,该反应是一种双替换反应,在适宜的温度和反应时间下进行,生成硅酸钙和氯化钠。
这两种产物可以根据其溶解性和沉淀性质进行
进一步的分离和利用。
该反应方程式的了解有助于我们理解无机化学
反应的机理和产物生成过程。
