高中化学必修1 第二章 《化学物质及其变化》(教材辅导)(43张)
人教版化学高一上学期必修一第二章化学物质及其变化第三节氧化还原反应(共33张PPT)

1. 2H2 + O2 点=燃 2H20 √
2. CaO + H2O = Ca(OH)2 ×
3. 2KMnO4 △= K2MnO4 + MnO2 + O2↑ √
4. 5.
CaCO3 Fe +
△= CO2↑ H2SO4 =
+ CaO FeSO4
×
+ H2↑
√
6. Cu + 2AgNO3 = Cu(NO3)2 + 2Ag √
应
火箭的升空,需要燃料 的燃烧。燃料燃烧过程 中伴随着很多化学变化 和物理变化,伴随着许 多能量的转化。
—氧化还原反应
结合这些图片,写一篇关于氧化还原反应的小论文。
+4
CuO + CO = Cu + CO2
+2
0 △0
+4
2CuO + C =2Cu + CO2↑
+1
0 高温 0
+2
H2O + C = H2 + CO
1.判断哪些物质发生氧化反应、那些发生还原反应?
2.这几个反应有什么共同的特征? 3.讨论氧化还原反应与元素化合价升降的关系
并得出结论?
从化合价角度分析氧化还原反应
氧化反应:物质所含元素化合价升高的反应 还原反应:物质所含元素化合价降低的反应 氧化还原反应:凡是有元素化合价升降的化学反应
1.只有得氧、失氧的反应才是氧化还原反应 ×
2.元素化合价发生变化的反应一定是氧化还原反应
√
氧化还原反应的特征:元素化合价变化 化合价变化是判断反应是否为氧化还原反应的 另一种依据
7. Ba(OH)2 + H2SO4= BaSO4↓+ 2H2O ×
高中化学(人教版)必修1课件:第二章 化学物质及其变化 2.2.2
课时作业第2课时 离子反应及其发生的条件
课时作业
课时作业自主学习·新知全解
课时作业
课时作业白色沉淀
Ba2+
课时作业离子符号
课时作业
课时作业
课时作业②⑤
课时作业
课时作业
课时作业
课时作业
解析: B 选项生成Fe(OH)2沉淀;C 选项生成CO 2气体;D 选项生成H 2O 。
答案: A
课时作业合作探究·课堂讲练
课时作业
课时作业答案: D
课时作业
课时作业
课时作业
课时作业
课时作业
课时作业
课时作业答案: D
课时作业
课时作业
课时作业
课时作业
课时作业
课时作业
课时作业
课时作业答案: C
课时作业
课时作业
课时作业
课时作业
课时作业
课时作业点击进入课时作业
课时作业谢谢观看!。
人教版高一化学必修1-第二章化学物质及其变化第一课时《氧化还原反应》PPT教学课件

●典例剖析 (2014·试题调研)下列化学反应中电子转移的
表示方法正确的是( )
【解析】 A项元素的电子得失标反;B项也是元素的电 子得失标反;D项电子转移方向弄反,即箭头指出标反。
【答案】 C
已知铜在常温下能被稀硝酸溶解,其反应的化 学方程式如下:
3Cu+8HNO3===3Cu(NO3)2+2NO↑+4H2O (1)用双线桥法表示电子得失的方向和数目: ___________________________________________。 (2)用单线桥法表示电子得失的方向和数目: ____________________________________。 (3)若3 mol Cu参加反应,则该过程转移的电子是 ________mol。
(2)从化合价升降的角度认识
①从化合价的角度分析氧化反应、还原反应的特点:
升高 降低
②从化合价的角度判断:氧化还原反应是有__元__素__化__合__价__升__降_ 的化学反应。
(3)从电子转移的角度认识
①从电子转移的角度分析氧化反应、还原反应的特点: 失去电子或电子对偏离 得到电子或电子对偏向
②从电子转移的角度判断: 氧化还原反应是_有__电__子__转_移__(_得__失_或__偏__移__) ___的化学反应。 2.氧化还原反应的基本概念和实质 (1)基本概念和实质 ①基本概念。
得到
偏向
失去
偏离
还原
氧化
②实质:电子的转移(即电子的得失或偏移)。 ③特征:元素化合价发生变化。 (2)反应中概念间的关系
①氧化剂在反应中化合价__降__低____→具有__氧__化____性→被 __还__原____→生成__还__原____产物。
②还原剂在反应中化合价_____升__高_______→具有__还__原____ 性→被__氧__化____→生成__氧__化____产物。
高中化学(人教版)必修1课件:第二章 化学物质及其变化 2.1.2

化学 必修1
第二章 化学物质及其变化
自主学习·新知全解
合作探究·课堂讲练
课时作业
[微点拨] 丁达尔效应是胶体的特征性质,是区分胶体和其他分散系的常用方法。 [自我诊断] 判断下列说法正误(正确的打“√”,错误的打“×”)。 (1)溶液、胶体和浊液中最稳定的分散系是溶液。(√) (2)布朗运动是胶体稳定的主要原因。(×) (3)应用电泳可静电除尘。(√) (4)使 Fe(OH)3 胶体凝聚可采取加过量的稀 H2SO4 的方法。(×)
化学 必修1
第二章 化学物质及其变化
自主学习·新知全解
合作探究·课堂讲练
课时作业
合作探究·课堂讲练
化学 必修1
第二章 化学物质及其变化
自主学习·新知全解
合作探究·课堂讲练
课时作业
溶液、胶体、浊液三类分散系 [典例 1] (2015·苏州高一检测)AlCl3 溶液、Al(OH)3 胶体和 Al(OH)3 浊液是重 要的分散系。下列叙述中不正确的是( ) A.Al(OH)3 胶体区别于其他分散系的本质特征是分散质的微粒直径在 10-9~ 10-7m B.光线透过三种分散系时,只有胶体可发生丁达尔效应 C.三种分散系均是无色透明的液体 D.Al(OH)3 胶体能够使水中悬浮的固体颗粒沉降,达到净水目的
化学 必修1
第二章 化学物质及其变化
自主学习·新知全解
合作探究·课堂讲练
课时作业
解析: A 项属于蛋白质胶体遇电解质发生聚沉;B 项是土壤胶粒遇海水中的 电解质发生聚沉;C 项是蛋白质胶体的丁达尔效应;D 项发生的化学反应是 Fe3+ +3OH-===Fe(OH)3↓,此时生成的是 Fe(OH)3 沉淀,而不是胶体。
化学 必修1
必修一第二章化学物质及其变化复习ppt课件
3.氧化还原反应与四种基本类型反应关系
氧化还原反应
置换反应 复分解反应
火灾袭来时要迅速疏散逃生,不可蜂 拥而出 或留恋 财物, 要当机 立断, 披上浸 湿的衣 服或裹 上湿毛 毯、湿 被褥勇 敢地冲 出去
知识点五:氧化还原反应
4.基本概念
还原剂 失电子 还原性
价升
被氧化
氧化 产物
火灾袭来时要迅速疏散逃生,不可蜂 拥而出 或留恋 财物, 要当机 立断, 披上浸 湿的衣 服或裹 上湿毛 毯、湿 被褥勇 敢地冲 出去
知识点五:氧化还原反应
5.基本规律
3、电子得失守恒规律: 例.已知M2O7 x-+ 3S 2-+ 14H+ = 2 M3+3S↓+ 7H2O,则M2O7 x-中的M的化合价为 (D)
火灾袭来时要迅速疏散逃生,不可蜂 拥而出 或留恋 财物, 要当机 立断, 披上浸 湿的衣 服或裹 上湿毛 毯、湿 被褥勇 敢地冲 出去
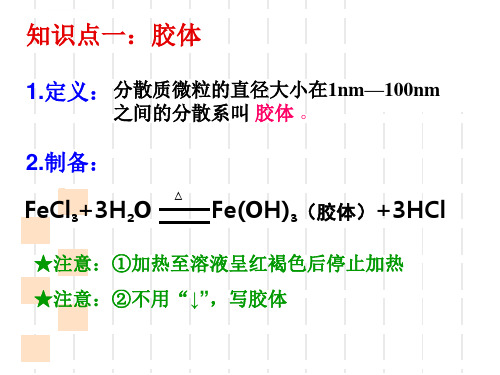
知识点一:胶体
1.定义: 分散质微粒的直径大小在1nm—100nm
之间的分散系叫 胶体 。
2.制备: FeCl3+3H2O △
Fe(OH)3(胶体)+3HCl
★注意:①加热至溶液呈红褐色后停止加热 ★注意:②不用“↓”,写胶体
3.性质:
⑤胶体的凝聚 Ⅰ加电解质溶液 Ⅱ加带相反电荷的胶粒 Ⅲ加热凝聚(加热较长时间)
火灾袭来时要迅速疏散逃生,不可蜂 拥而出 或留恋 财物, 要当机 立断, 披上浸 湿的衣 服或裹 上湿毛 毯、湿 被褥勇 敢地冲 出去
知识点一:胶体
均匀透明 稳定 d<1nm 小分子或离子
氯化钠溶液
均匀透明 介稳定
钾盐、钠盐、铵盐、硝酸盐全溶 SO42-除Ba2+(Ca2+、Ag+ 微溶) Cl-除Ag+ CO32-只溶K+、Na+、NH4+(Mg2+微溶) OH-只溶K+、Na+、Ba2+(Ca2+微溶)
高中化学(人教版)必修1课件:第二章 化学物质及其变化 2.3.1_最新修正版

最新修正版
2
化学 必修1
第二章 化学物质及其变化
自主学习·新知全解
合作探究·课堂讲练
课时作业
自主学习·新知全解
最新修正版
3
化学 必修1
第二章 化学物质及其变化
自主学习·新知全解
从不同角度认识氧化还原反应 1.从得氧、失氧的角度认识
合作探究·课堂讲练
课时作业
从得氧、失氧的角度分析氧化反应、还原反应的特点。
合作探究·课堂讲练
课时作业
氧化还原反应中电子转移的表示方法
最新修正版
11
化学 必修1
第二章 化学物质及其变化
自主学习·新知全解
合作探究·课堂讲练
课时作业
合作探究·课堂讲练
最新修正版
12
化学 必修1
第二章 化学物质及其变化
自主学习·新知全解
合作探究·课堂讲练
课时作业
氧化还原反应的概念 △
[典例 1] 实验室制取少量 N2 常利用的反应是 NaNO2+NH4Cl=====NaCl+ N2↑+2H2O,关于该反应的说法正确的是( )
合作探究·课堂讲练
课时作业
2.反应中概念间的联系 Fe+CuSO4===F 化合价升高,被氧化 eSO4+C 化合价降低,被还原 u (1)氧化剂在反应中化合价_降__低__→具有_氧__化__性→被_还__原__→生成_还__原__产物。 (2)还原剂在反应中化合价_升__高__→具有_升__高__性→被_还__原__→生成_氧__化__产物。 [微点拨] 判断一个反应是否是氧化还原反应的依据是看反应中是否有元素化合价的变 化。
最新修正版
10
化学 必修1
第二章 化学物质及其变化
高中化学必修1第二章化学物质及其变化
点燃
C+O2==CO2
2.C
高温
C+2CuO==CO2 +2Cu
讨论小结1:
金属单质
金属+O2/Cl2
氧化物/氯化物
金属+酸
盐+H2
1.单质
金属+盐溶液 新盐+新的金属
与氧气反应
氧化物
非金属单质 与金属氧化物反应
答案:
3.CO2 CO2+H2O==H2CO3 CO2+2NaOH==Na2CO3+H2O CO2+ CaO == CaCO3
碱性氧化物+酸性氧化物 含氧酸盐
可溶性碱
答案:
5. H2SO4
H2SO4 + CaO ==CaSO4+H2O H2SO4 + 2NaOH ==Na2SO4+2H2O
H2SO4 + Na2CO3== Na2SO4+ H2O+CO2
讨论小结1:
3.酸
酸+指示剂
酸+碱性氧化物 盐+水 酸+碱 盐+水 酸+盐 新盐+新酸 某些含氧酸 水+酸性氧化物
钾盐 铵盐
碳酸盐 …… 硝酸盐
按酸 根是 否含 氧分
含氧酸盐 无氧酸盐
KNO3、KMnO4、FeSO4 NaCl、ZnS、CaCl2
物质的分类
氧化物的分类
金属氧化物 CuO、Fe2O3、Na2O
从组
氧 化
成元 素分
非金属氧化物 CO、P2O5、H2O
物 从性 质分
酸性氧化物 碱性氧化物
CO2、P2O5、SO3 CaO、CuO、K2O
交流与讨论:
下列实验室常见的物质,它们能和 哪些物质发生反应,写出反应的方程 式。并总结反应的规律
高中化学(人教版)必修1课件:第二章 化学物质及其变化 2.3.2
课时作业第2课时 氧化剂和还原剂
课时作业
课时作业自主学习·新知全解
课时作业
得到电子(或电子对
偏向
失去电子(或电子对
偏离
课时作业
氧化
还原
得电子
失电子
课时作业
课时作业
课时作业
Cl2
KMnO4
金属
非金属
低
课时作业
课时作业
课时作业合作探究·课堂讲练
课时作业
课时作业答案: D
课时作业
课时作业
课时作业
课时作业
课时作业答案: C
课时作业
课时作业
课时作业答案: (1)①Fe3+、H+ ②Fe ③Fe2+(2)② HNO
NO 1
3
课时作业
课时作业
课时作业
课时作业
课时作业
解析: Ag+氧化性最强,最先置换出Ag,Al没有Mg活泼,故不能置换出Mg。
答案: C
课时作业
课时作业
课时作业
课时作业
课时作业点击进入课时作业
课时作业谢谢观看!。
人教版高中化学必修1:第二章化学物质及其变化_归纳与整理_课件7
4.下列各离子组在指定溶液中一定能大量共存的是 ( ) A.(2011·安徽高考)碱性溶液中,NO3-、I-、Na+、 Al3+ B.(2011·安徽高考)Na2S 溶液中:SO24-、K+、Cl-、 Cu2+ C.(2011·江苏高考)碱性溶液:K+、Na+、CH3COO-、 Br- D.(2010·广东高考)NH+4 、Ag+、PO34-、Cl-
的反应实质,两边各元素的原子个数也相等,但两边离子 所带电荷不守恒;选项 D,Ca(OH)2 是微溶物,作为反应 物时写成离子形式,由于通入的 CO2 是少量的,生成的 CaCO3 不溶解。 答案:D
离子共存的判断
这类试题主要考查离子反应发生的条件,特别是有 限制条件的离子共存。试题通常以选择题的形式出现,题 目设置的条件经常具有一定的隐蔽性。解答该类题目除了 熟悉常见离子的性质外,还要注意题设情境,即能否共存 的环境及要求符合的条件。如酸性环境,无色透明溶液、 产生气体或沉淀,发生氧化还原反应,“一定大量共存”、 “可能大量共存”、“不能大量共存”,等等。
C.(2011·新课标全国卷)NH4HCO3 溶于过量的 NaOH 溶
液中:HCO3-+OH-===CO23-+H2O
D.(2011·新课标全国卷)大理石溶于醋酸中:CaCO3+ 2CH3COOH===Ca2++2CH3COO-+CO2↑+H2O
解析:A项,离子方程式两边的电荷不守恒,A项错误;
NH
(2)所涉及的化学反应类型主要是复分解反应和氧化还 原反应。
(3)一些重要的离子反应方程式,在历年高考中多次出 现。
[考题印证]
1.[双选题]下列表示对应化学反应的离子方程式正确的
是
()
A.(2011·江苏高考)FeCl3 溶液与 Cu 的反应:Cu+Fe3+ ===Cu2++Fe2+
高中化学(人教版)必修1课件:第二章 化学物质及其变化 2.1.2
课时作业第2课时 分散系及其分类
课时作业
课时作业自主学习·新知全解
课时作业一种(或多种)物质分散在另一种(或多种)物质
分散质
分散剂
课时作业
9
课时作业
课时作业答案: D
课时作业答案: B
课时作业
FeCl3的饱和溶液
红褐色
课时作业
无
有
能
不能
课时作业
课时作业
课时作业溶液和浊液
布朗运动
课时作业
定向移动
阴极阴极
电解质相反电荷的胶粒
加热
课时作业
课时作业合作探究·课堂讲练
课时作业
课时作业答案: C
课时作业
课时作业
课时作业
课时作业答案: C
课时作业
课时作业答案: D
课时作业
课时作业
课时作业答案: C
课时作业
课时作业
课时作业
课时作业
课时作业
课时作业
课时作业点击进入课时作业
课时作业谢谢观看!。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第 三 节 物 质 与 氧 5.1根据实 验 事实 《 必 修 1 《 金 属 及 其 化 合 基于分类准的
氧 化 还 的 反 应 属 了解氧化还原反应 物》、《非金属及其化合物》选择,对化学
原反应 于 氧 化 反 的本质是电子的转 应用研究物质氧化性或还原 学习的重要价
应。 知道一些 具体的氧
移,能够利用化合 价升降,判断反应 是否为氧化还原反 应。
顺义第九中学
Shunyi No.9 School
第一节 物质的分类 第1课时 简单分类法及其应用
【教学目标】 1.知识与技能 (1)能根据物质的组成和性质对物质进行分类。 (2)了解物质的化学通性,初步学会利用物质的通性预测陌生物
质的化学性质。 2.过程与方法:通过类比日常生活和生物学系中应用分类方法实
通过实验事实 性盐的电离方程式。
求。
认识离子反应 4.2通过实验事实认识离子反
较复杂反
及其发生的条 应及其发生的条件,能正确书 应的离子方程
件。
写常见的离子方程式。
式书写暂不做
要求。
二、教学目标分析 顺义第九中学 Shunyi No.9 School
内容标准
学习要求
补充说明
5. 根据实 5.1根据实验事实了解氧化还原反
Shunyi No.9 School
【教材利用】
教学从日常生活入手, 使学生直观感受分类 的标准与好处。
建议:可以增加一些 图片;也可与生物学 习中的分类实例整合; 还可使用徐光宪的 “抽屉情结”。
顺义第九中学
Shunyi No.9 School
【教材利用】
可将其与图22整合为:请 尝试对Na2CO3、 Na2SO4、 K2SO4、 K2CO3进行分类。
第 ( 组 成 ) 。液 中 能 发 生 了解强电解质、弱电 和微观相结合的角
二 节
酸 、 碱 、电 离 ; 能 正 解质在水溶液中电离 盐 的 水 确 书 写 强 酸 、程度的差异,能判断
度分析与解决实际 问题。体会科学探 究的一般过程。领
离 溶 液 能 强碱和可溶 常见的强电解质和弱 悟宏观辨识与微观
及转化
对四大基本反应的交叉 分类,引入离子反应、 氧化还原反应则是对已 有知识的深入,从本质 上揭示其含义
顺义第九中学
Shunyi No.9 School
设置 两条主线
化学物质 化学反应
教学内容编排以分类方法为主导
教学内容
渗透 四个学科素养
1.宏观辨识与微观 探析。
2证据推理与模型 认知
3.科学探究与创新 意识。
会从氧化还原反应 选修4 《 电化学基础》应
的视角研究物质的 用氧化还原反应理论解决实
化学性质
际问题。
顺义第九中学
Shunyi No.9 School
四.具体教法建议
(一)注意初、高中知识的衔接,使本章成为初、 高中化学的纽带和桥梁。
(学二内)容认深真 广教研 度学究 。中《除课程了标要准考》虑和知教识材的,正严确密定性位、教思 (三)更新维观的念深,刻关注性核,心还素要养注的意渗必透和修核模心块概承念担 的建构过程的。教学任务特点,注意减轻学生过重
顺义第九中学
Shunyi No.9 School
二.模块学习要求
新内容标准
学习要求
补充说明
能 根 据 物 质 的 1.1能根据物质的组成和 物质分类要注意初、
组 成 和 性 质 对 性质对物质进行分类。 高 中 的 衔 接 , 并 在
物 质 进 行 分 类 。1.2了解常见物质及变化 后 续 学 习 中 逐 步 完
顺义第九中学
Shunyi No.9 School
必修1第二章
《化学物质及其变化》
教材分析及教法建议
顺义第九中学
Shunyi No.9 School
一.教学内容分析
1.内容编排
第一节 化学物质的分类 第二节 离子反应 第三节 氧化还原反应
顺义第九中学
Shunyi No.9 School
分类法
运用分类思想
Shunyi No.9 School
【教学重点】了解常见化学物质的分类方法;物质的化学通性。 【教学难点】归纳物质的化学通性。
【教学流程】
教学环节
教学内容
设计意图
环节1 讨论日常生活和生物学中 创设情境,认识分类方
涉及到的分门别类的实例。法在生活中和生物学习
中的意义。
环节2 按照物质的组成和性质, 能根据物质的组成和性
与模型认知素
元 素 的 常 剂;能列举中学常 必修2《 物质结构 元素周 养。
见 化 合 价 。见的氧化剂和还原 期律》对物质氧化性和还原
剂。
性的强弱建立规律性认识,
5.3举例说明 生产、并能够从原子结构的角度预 生活中常见的氧化 测分析物质的氧化性和还原 还原反应,初步学 性以及强弱关系。
应用模型解决 问题
胶体的概念只 要求了解其不 同于溶液的特 性,而对胶体 的渗析、凝聚、 布朗运动和电 泳现象等不做 要求。
顺义第九中学
Shunyi No.9 School
内容标准
学习要求
补充说明
4. 知道酸、 4.1认识(知道)酸、碱、盐是
弱电解质
碱、盐在溶液 电解质,在溶液中能发生电离;的电离及相关
中能发生电离,能正确书写强酸、强碱和可溶 知识暂不做要
教学 顺初义第中九化中学 本章要求 内容 学 Shunyi No.9 School
知识层级发展
核心素养发展
知 道 酸 、4.1知道酸、 《选修4 化学反应原 实验探究方法认识
碱 、 盐 碱、盐是电 理》《第三章 水溶 电解质在水溶液中
的 概 念 解 质 , 在 溶 液中的离子平衡》 的电离,能从宏观
(四)整体把握知识结构,有目的、有计划地进行
教学。 的学习负担,不随意扩大知识的外延, (五)积极不开过发多和涉充分及利尚用未多学种的课基程础资源知。识。
顺义第九中学
Shunyi No.9 School
课时建议
☆第一节 物质的分类 2课时
☆第二节 离子反应 2课时
☆第三节 氧化还原反应 2 课时
☆章复习、测试、讲评 各1课时,共3课时
例对化学物质分类,体会移植研究的一般过程,领悟个性与共 性相结合的科学思想,归纳物质的化学通性,学习用演绎方法 预测陌生物质的化学性质。
3.情感态度与价值观:通过归纳类别通性并预测陌生物质的化学 性质,认识物质性质的规律性,认同分类、归纳和演绎方法对 于化学科学研究和化学学习的重要作用。
顺义第九中学
性的思路方法,初步体会到 物质的氧化性或还原性存在 强弱关系,学生初步应用电 子转移守恒原则进行一些需
值 具有证据意识
化 还 原 反 5.2对于简 单 的氧 要掌握的氧化还原反应的配
应实例。 化还原反应,能够 平,能够书写简单的氧化还 渗透证据推理
知 道 常 见 找出氧化剂和还原 原反应的离子方程式。
顺义第九中学
Shunyi No.9 School
教学案例
为什么要学习分类方法?
教材章序言: “对于这么多的化学物质和如 此丰富的化学变化,人们是怎样认识和研究的呢? ”(核心语言)。
潜台词:如何解决化学学科的学习困惑?(“ 杂”、“乱”、“散”)
教材章图(一个背景和三张照片)和序言:运 用科学方法。
对一系列纯净物进行分类。质对物质进行分类。
顺义第九中学
Shunyi No.9 School
教学环节
教学内容
设计意图
环节3 归 纳 物 质 的 化 学 复习整理初中化学知识,了解物
通性。
质的化学通性,感受分类等科学
方法对于化学科学研究和化学学
习的重要作用。
环节4 预测陌生物质的 初步学会利用物质的通性预测陌
和反应
完整的认识。 的重要价值
知道溶液概念 2.1知道胶体是一种分散系,《选修5有机化
和组成、溶解 能列举生活中常见的胶体。 学基础》研究化
度 、 质 量 分 数 ,2.2知道胶体的丁达尔效应,合物类别中的另
能区分溶液和 知道丁达尔效应是区分溶 一个分支 有机
浊液
液和胶体的一种方法。 物及有机反应。
的分类方法。
善。
1.3认同分类法对于化学
科学研究和化学学习的
重要作用。
顺义第九中学
Shunyi No.9 School
内容标准
学习要求
补充说明
2.知道胶体是 一种常见的分 散系。
2.1知道胶体是一种分散系, 能列举生活中常见的胶体。
2.2知道胶体的丁达尔效应, 知道丁达尔效应是区分溶液和 胶体的一种方法。
化学性质。
生物质的化学性质,感受分类等
科学方法对于化学科学研究和化
学学习的重要作用。
环节5 总结常见化学物 概括提升,进行学法指导。
质的分类、化学
通性和研究物质
性质的基本思路
和方法。
顺义第九中学
Shunyi No.9 School
【注意问题】 1.分类方法本身不是教学的主要目的。重在: (1)运用分类和归纳方法对已有知识系统化梳理,提升认识。 (2)体会分类法在化学研究和学习中的作用。
知识层级发展 核心素养发
内容
展
知道纯净物、 主题1.梳理归纳金属单质、 分类思想贯穿了
混合物、单质、酸、碱、盐的通性,初步形 高中化学学习的
第 化合物、有机 成由个体性质认识整体规律 始终。
能从不同层
一 物、无机物的 再类比迁移到其他同类个体 《化学 必修1》 次认识物质
节
物 质 的 分 类
概念,能基本 识别各类化合 物,知道一些 具体的金属单 质及常见几种 氧化物、酸、 碱、盐的性质
