配位化学讲义KE
配位化学

NO 2
en
Co
en
反式-[Co(eNnO)2(2NO2)2], 无旋光对映体
en
en
NO2 O2N
Co
Co
NO 2 en
O2N en
顺式-[Co(en)2(NO2)2] 有旋光对映体
6.2.2 化学结构异构
结构异构是因为配合物分子中原子与原子间成键的顺序 不同而造成的, 常见的结构异构包括电离异构, 键合异构, 配 位体异构和聚合异构。
B
A
A
A
B
A
面式
经式(子午式)
B
B
B
B
A
A
[M(AB)3]也有面式和经式的两种异构体:
[M(ABA)2](其中ABA为齿配体)型
A
B
B
B
称的经式和不对称的经式。
面式
经式
B
A
A
B
B
A
A
A
A
[MA3(BC)D](其中BC为不对称 二齿配体)也有面式和经式的区别。
3 四配位化合物
四配位是常见的配位, 包括 平面正方形和四面体 两种构型。
一般非过渡元素的四配位化合物都是四面体构型。这是因 为采取四面体空间排列, 配体间能尽量远离, 静电排斥作用最小 能量最低。但当除了用于成键的四对电子外, 还多余两对电子时 , 也能形成平面正方形构型, 此时, 两对电子分别位于平面的上下 方, 如XeF4就是这样。
①平面四边形配合物
MA2B2型平面四边形配合物有顺式和反式两种异构体。
AA
AB
M 顺式
M 反式
BB
BA
最典型的是Pt(NH3)2Cl2, 其中顺式结构的溶解度较大, 为 0.25
配位化学2

为什么? ★物质的磁矩于物质中原子或离子的未成对 电子数n有关
m B n(n 2)
[FeF6]3-
(4)sp3(4)d2
3d
4s
4p
4d
[Fe(CN)6
]3-
(3)d2(4)sp3
[Co(CN)6]3-
Co3+ d6电子构型
(3)d2(4)sp3
μ= 4.9B· M μ=0 B· M
3、解释配合物的稳定性
配位原子的电负性很大,对中心原子的结构影 响很小。 Fe3+, d1d1d1d1d1(sp3d2+6F-)12 外轨型配合物
配位原子的电负性很小,对中心原子的结构 影响很大。 Fe3+, d2d2d1(d2sp3+6CN-)12 内轨型配合物
4、电中性原理和反馈π键 ★电中性原理:中心原子的净电荷量越接近于 零,配合物才能越稳定存在。 [Co(NH3)6]3+
五、姜-泰勒效应
在对称的非线性分子中,体系不可能在轨道简并状 态下保持稳定,而必然要发生畸变并使得一个轨道 的能级降低,消除简并性。
对于d9组态的Cu2+
(t2 g ) 6 ( d z 2 ) 2 ( d x2 y 2 )1 (t2 g ) 6 ( d x2 y 2 ) 2 ( d z 2 )1
◆
平面正方形配合物 主要是d8电子构型的过渡金属。
低自旋
d轨道在其他构型配合物中的能级分裂 E = 12.28 Dq
d
x y2
2
能 量
E = 1.78 Dq d
= 4.45 Dq d E = -2.67 Dq
d E = 6 Dq E = 0 Dq = 10 Dq E = 2.28 Dq d xy
配位化学知识

第一章配位化学的基础知识第一节配合物的基本概念研究配合物的化学称配位化学Coordination chemistry或称配合物化学Chemistry of Coordination Compounds络合物化学Complex Chemistry1891年Werner提出配位理论Werner配位理论的主要要点:1 配合物内中心离子(原子)有两种化合价,一种是主价,一种是副价,主价即表示氧化态,副价则表示配位数,3NH3NH3Cl3NHNH32 把配合物分成内界和外界3 提出了配合物的空间结构配合物的定义:凡是有含有孤对电子(或 电子)的离子或分子与具有能接受孤对电的适当空轨道的离子或分子或原子所结合而成的离子或分子经典的配合物配合物离子与异电荷离子构成的电中性化合物如KAu(CN)2带电荷的配合物称为配离子如Au(CN)2- , Ag(CN)2-配合物本身为分子如Ni(CO)4, [Pt(NH3)2Cl2]配合物的组成:[Cu (NH3)4]2+SO42-中心离子配位键配位原子配位体配位数配离子电荷外界离子中心离子(原子):金属离子配位体:与中心离子相结合的阴离子或分子配位原子配位体中直接与中心离子结合的原子称为配位原子配位原子在周期表中的位置:配位数:配合物中,与中心离子直接结合的配位原子的总数,多齿配体:第二节 配合物的稳定常数[Cu (NH 3)4]SO 4溶于水时,内外界之间完全离解[Cu(NH 3)4]SO 4=[Cu(NH 3)4]2+ + SO 42-[Cu(NH 3)4]2+ 进一步离解成[Cu(NH 3)3]2+ [Cu(NH 3)2]2+ [Cu(NH 3)]2+ Cu 2+氨的浓度高时可能形成[Cu(NH 3)6]2+1 配离子的逐级和积累稳定常数只讨论单核单配的情况配合物形成的反应方程式和平衡常可表示为:ML L M =+ (1)]][[][1L M ML K =2ML L ML =+ (2)]][[][22L ML ML K =n n ML L ML =+-1]][[][1L ML ML K n n n -=[ ] 浓度稳定常数 ( ) 活度稳定常数K 1, K 2,… , K n 称为逐级稳定常数(分步稳定常数) K 1-第一级稳定常数 K 2-第二级稳定常数, …K n -第n 级稳定常数如将(1)和(2)相加合并,则有:M +2L =ML 2相应的稳定常数表达式为:212222]][][][[]][[]][[][K K L M L ML ML ML L M ML ===β将(1)、(2)和(3)式相加,有:33ML L M =+321333]][[][K K K L M ML ==β对ML n ,则有:n ML nL M =+∏====ni i n n n n K K K K K L M ML 1321...]][[][β其中,.,21211K K K ==ββn βββ....21称为积累稳定常数另一种表示方法可采用不稳定常数稳定常数的数据汇编:A.E Martell and R.M. Smith :Critical stability constantsVol.1 Amino acid (1974) Vol.2 Amines (1975) Vol.3 Other organic ligand Vol.4 Inorganic complexes本校图书馆的分类号:54。
配位化学知识点总结

配位化学知识点总结一、配位化学的基本概念配位化学是研究金属离子(或原子)与配体之间形成的配位化合物的结构、性质和反应的化学分支。
首先,我们来了解一下什么是配体。
配体是能够提供孤对电子与中心金属离子(或原子)形成配位键的分子或离子。
常见的配体有水分子、氨分子、氯离子等。
而中心金属离子(或原子)则具有空的价电子轨道,可以接受配体提供的孤对电子。
配位键是一种特殊的共价键,由配体提供孤对电子进入中心金属离子(或原子)的空轨道而形成。
配位化合物则是由中心金属离子(或原子)与配体通过配位键结合形成的具有一定空间结构和化学性质的化合物。
二、配位化合物的组成配位化合物通常由内界和外界两部分组成。
内界是配位化合物的核心部分,由中心金属离子(或原子)与配体紧密结合而成。
例如,在Cu(NH₃)₄SO₄中,Cu(NH₃)₄²⁺就是内界。
外界则是与内界通过离子键结合的其他离子。
在上述例子中,SO₄²⁻就是外界。
中心金属离子(或原子)的化合价与配体的化合价之和等于配位化合物的总化合价。
配位数指的是直接与中心金属离子(或原子)结合的配体的数目。
常见的配位数有 2、4、6 等。
三、配位化合物的结构配位化合物具有特定的空间结构。
常见的配位几何构型有直线型、平面三角形、四面体、八面体等。
例如,配位数为 2 时,通常形成直线型结构;配位数为 4 时,可能是平面正方形或四面体结构;配位数为 6 时,多为八面体结构。
这些结构的形成取决于中心金属离子(或原子)的电子构型和配体的大小、形状等因素。
四、配位化合物的命名配位化合物的命名有一套严格的规则。
先命名外界离子,然后是内界。
内界的命名顺序为:配体名称在前,中心金属离子(或原子)名称在后。
配体的命名顺序遵循先无机配体,后有机配体;先阴离子配体,后中性分子配体。
对于同类配体,按配体中原子个数由少到多的顺序命名。
如果配体中含有多种原子,先列出阴离子配体,再列出中性分子配体。
配位化学讲义 第六章 溶液中配合物的稳定性
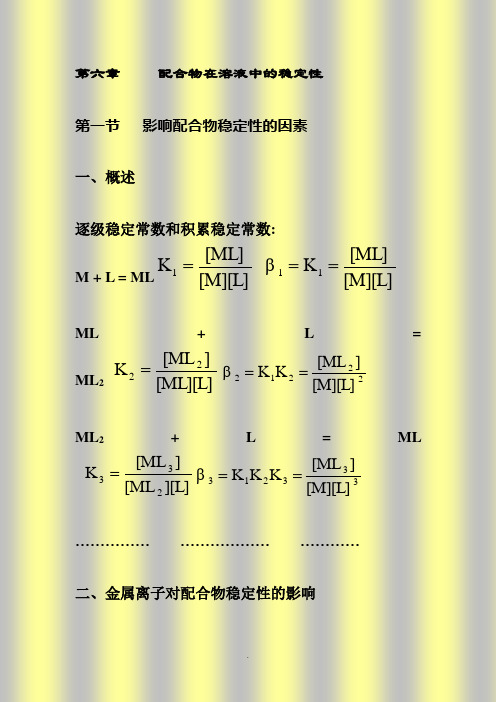
研究发现:第四周期过渡金属离子与含O、N配位原子的配体的高自旋八面体配合物,其稳定性顺序如下:Mn2+<Fe2+< Co2+< Ni2+< Cu2+ >Zn2+CFSE(Dq) 0 -4 -8 -12 -6 0这称为Irving-Williams顺序,可用CFSE解释。
Ni2+<Cu2+,可用Jahn-Teller效应解释。
三、配体性质对配合物稳定性的影响1、碱性配位原子相同,结构类似的配体与同种金属离子形成配合物时,配体碱性越强,配合物越稳定。
例:Cu2+的配合物:配体lgK H lgK1BrCH2CO2H 2.86 1.59ICH2CO2H 4.05 1.91phCH2CO2H 4.311.982、螯合效应1)螯合效应:螯合环的形成使配合物稳定性与组成和结构相似的非螯合配合物相比大大提高,称为螯合效应。
例:[Ni(NH3)6]2+lgβ6 = 8.61;心原子的关系1、软硬酸、碱概念(指Lewis酸碱)硬酸:其接受电子对的原子(离子)正电荷高,变形性低。
如:Li+、Mg2+、Al3+。
软酸:其接受电子对的原子(离子)正电荷低,变形性高。
如:Cu+、Ag+、Au+。
硬碱:其给出电子对的原子变形性小,电负性大。
如: F-、OH-。
软碱:其给出电子对的原子变形性大,电负性小。
如: I-、S2-。
2、软硬酸碱规那么在配合物稳定性中的应用1)硬酸倾向于与硬碱结合;2)软酸倾向于与软碱结合;配位化学中,作为中心离子的硬酸与配位原子各不相同的配体形成配合物倾向为:F>Cl>Br>I (1)O>>S>Se>Te (2)N>>P>As>Sb (3)而与软酸中心离子形成配合物的倾向的顺序为:F < Cl < Br < I (4)O << S ~ Se ~ Te(5)N << P > As > Sb (6)对(6)的解释:σ键增强N << P > As > Sb空d轨道:无3d 4d 5d反馈π键减弱π键作用大于σ键。
第三章 配位化学

O ↓↑ HO − S ↓↑ O − OH
d.p反馈π键
能形成Л接受配体的有: 能形成Л接受配体的有:CO、CN-、-NO2、N2 R3P
、
、C2H4、R3As等。
说明
价键理论虽能解释许多配合物的配位数和空间 结构,解释配离子的稳定性、 结构,解释配离子的稳定性、磁性等某些基本性 质,但它有局限性,只能定性而不能量性,当配 但它有局限性,只能定性而不能量性, 位体不同时不能解释。 位体不同时不能解释。 稳定性d0<d1<d2<d3<d4<d5<d6<d7<d8<d9<d10 它不能 稳定性 解释配离子的颜色和某些结构。 解释配离子的颜色和某些结构。
无机化学
高自旋和低自旋
高自旋和低自旋配合物对于d5-8的中心离子如何 高自旋和低自旋配合物对于d 杂化成键? 杂化成键?
Fe3+
无机化学
[Fe(H2O)6]3+ 高自旋 配合物外轨型 sp3d2杂化 八面体 [Fe(CN)6]3- 低自旋 配合物内轨型 d2sp3杂化 八面体
高自旋d电子排布符合洪特规则。 高自旋d电子排布符合洪特规则。 未成对电子数与离子相同。 未成对电子数与离子相同。 低自旋d电子重排成对,不符合洪特规则。 低自旋d电子重排成对,不符合洪特规则。未成 对电子数与离子不相同。 对电子数与离子不相同。 外轨型:系用ns,np,nd轨道杂化成键。 外轨型:系用ns,np,nd轨道杂化成键。 ns,np,nd轨道杂化成键 内轨型:系用( 内轨型:系用(n-1)d,nd,np轨道 nd,np轨道 杂化成键。 杂化成键。
无机化学
八面体场
在八面体场中沿坐标轴方向伸展的dz 在八面体场中沿坐标轴方向伸展的dz2,dx2-y2 轨道,与配体处于迎头相碰状态, 轨道,与配体处于迎头相碰状态,故受配体电 场的强烈排斥而能差升高,而夹在坐标轴之间 场的强烈排斥而能差升高, dxy,dxz,dyz轨道则受到的排斥力较小 轨道则受到的排斥力较小, 的dxy,dxz,dyz轨道则受到的排斥力较小,能 差上升较少, 差上升较少,由于这三个轨道对配体有相同的 空间分布,因此能差相同, 空间分布,因此能差相同,形成一组三重简并 轨道。称为dε轨道。 dε轨道 轨道。称为dε轨道。而dz2,dx2-y2在八面体场 中具有相同的能量, 中具有相同的能量,所以形成另一组二重简并 轨道称dr轨道。 dr轨道 轨道称dr异构现象:化学式相同而结构式不同的 现象。 现象。
第19章配位化合物ppt课件

38
(2) 四面体场
d
dr
四面体场中的坐标和d轨道的分裂 由于dε和dγ两组轨道与配体电场作用的大小区别,远不如 在八面体场中的明显,所以四面体场的分裂能 △t 较小, △t < △o 。
39
(3)正方形场
s
正方形场中坐标的选取和d轨道的分裂 在正方形场中,△s 很大,△s > △o 。
y Ni (CO)4 中d-pπ配键(反馈π键)示意图 35
过渡金属与羰基、氰、链烯烃、环烯烃等配体形成 的配合物都含有反馈π键。
烯烃配合物
1827年,丹麦药剂师Zeise合成了K [ PtCl3(C2H4) ]·H2O, 这是第一个有机金属化合物,但其结构直到120多年后才 确定。
σ 配键
d-pπ 配键
12
3 、配体的先后顺序
(1)先无机后(有机) (2)先阴离子后分子 (3)同类配体中,按配位原子在英文字母表中的次序 (4)配位原子相同,配体中原子个数少的在前 (5)配位原子相同,配体中原子个数相同,则按和配
位原子直接相连的其它原子英文字母次序。
13
命名下列配合物
1. PtCl2(Ph3P)2 2. K [PtCl3 (NH3 )] 3. [Co (NH3 )5 H2O ] Cl3 4. [Pt(Py)(NH3 )(NH2OH)(NO2)]Cl 5. [ Pt (NH3)2 (NO2) (NH2) ]
铂与乙烯之间的成键示意图 36
19- 2- 2 晶体场理论
1、 晶体场中d 轨道的分裂
在自由原子或离子中,五种 d 轨道的能量简并, 其原子轨道的角度分布如图
y x
dxy
z x
dxz
z
配位平衡基础知识讲义

10
溶解效应(逆沉淀效应)
AgCl(s)
K=KSK稳 =1.8×10-10×1.1×107
Ag+ + Cl-
+
2NH3 浓氨水(6M)
[Ag (NH3)2 ] +
(氨夺取与Cl-结合的Ag+)
溶解效应与沉淀效应具有相同的实质,就是 沉淀剂与配合剂对金属离子的争夺。
11
配离子的转化
[HgCl4] 2-+ 4 I-
硬水中加入少量三聚磷酸 钠(Na5P3O10)将与水中 的Ca2+,Mg2+发生络合可 防止锅垢的形成。
无磷洗涤剂
配合物的应用
2 电镀工业
电镀中简单金属离子在阴极上沉积太快,镀层粗糙、结合 力差、无光泽。常将金属离子形成配合物,使溶液中游离 金属离子浓度降低,从而控制金属在镀层形成规格晶格排 列(Cu,Zn,Sn,Ag,Au)。
内界
[Cu(NH3)4]SO4 ↑ ↑ ↑↑
外界
配 位
中配配外 心位位界
离 离体数离
子子
2
配位离子的电荷:等于简单离子电荷的代数和
Fe3+ + 6CN –
[Fe(CN)6 ]3–
(根据配离子电荷-某酸某,某化某)
命名:配位体数-配位体名称-合-中心离子(氧化数)
先分清是配位阳离子或配位阴离子
[CoCl3 (NH3)3]
解:写成配合物:
⑴ K2[PtCl6]; ⑵ [Co(NH3)6]Cl3 ⑶[CrCl2 (NH3)4]Cl; ⑷ [Pt(NH3)6]Cl4
导电能力与离子数成正比,所以有: ⑷>O4 [Cu(NH3)4]2+
[Cu(NH3)4]2+ + SO42- Cu2++4 NH3
