高中化学竞赛辅导专题讲座——三维化学3-
高中化学竞赛-硼族元素
高中化学奥林匹克竞赛辅导硼族元素一、硼族元素简介硼族元素包括硼(B)、铝(Al)、镓(Ga)、铟(In)、铊(Tl),在周期表中处于第Ⅲ A族。
硼族元素的价电子构型为n s2n p1,除硼外其余元素均为金属元素,金属性随原子序数的增加而增强。
B的半径较小,失去三个电子非常困难,因此硼不能形成简单阳离子B3+,只能通过共用电子对形成共价化合物。
Al、Ga、In、Tl在水溶液中可以形成M3+。
因为惰性电子对效应,Tl3+具有强氧化性。
在硼族元素形成的共价分子中,中心原子最外层只有6个电子,未达到8电子的外层结构,属于缺电子化合物,它们具有一个空p轨道,可以接受孤对电子形成配位键,是强的路易斯酸。
硼族元素的性质二、硼及其化合物1.硼的单质硼的非金属单质以原子晶体形式存在。
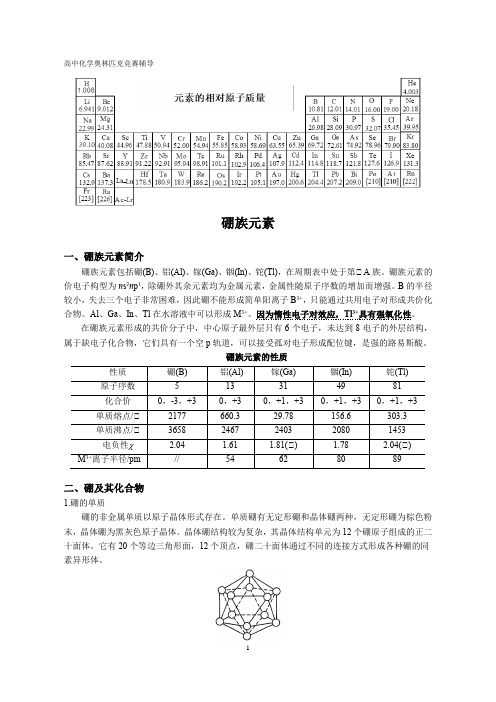
单质硼有无定形硼和晶体硼两种,无定形硼为棕色粉末,晶体硼为黑灰色原子晶体。
晶体硼结构较为复杂,其晶体结构单元为12个硼原子组成的正二十面体。
它有20个等边三角形面,12个顶点,硼二十面体通过不同的连接方式形成各种硼的同素异形体。
晶体硼的化学活性较低,无定形硼较活泼。
常温下,硼能与F 2反应,高温下能与N 2、O 2、S 等非金属单质反应。
无定形硼可被热的浓硝酸、浓硫酸氧化成硼酸,也能与强碱作用放出氢气。
2B+N 22BN(与金刚石C 2互为等电子体,是原子晶体) B+3HNO 3(浓)B(OH)3+3NO 2↑2B+2NaOH+2H 2O2NaBO 2+3H 2↑(与Al 的性质相似)2.硼的氧化物及含氧酸硼最重要的氧化物是B 2O 3,熔融B 2O 3能溶解许多金属氧化物,形成具有特征颜色的偏硼酸盐,这个反应用于定性分析,称为硼珠实验:CuO+B 2O 3Cu(BO 2)2(蓝色) NiO+B 2O 3Ni(BO 2)2(绿色) B 2O 3的水化物为硼酸H 3BO 3或B(OH)3。
H 3BO 3是白色的片状晶体,具有片层结构,层和层 之间存在范德华力,容易发生滑动,其中氢键对其结构的形成具有支配的作用。
高中化学竞赛-配合物,络合物,配位化学,配体,配位数,中心体

高中化学奥林匹克竞赛辅导配合物(配位化合物)化学基础【竞赛要求】配位键。
常见的配合物的中心离子(原子)和常见的配体(水、羟离子、卤离子、拟卤离子、氨分子、酸根离子、不饱和烃等)。
螯合物及螯合效应。
常见的络合剂及常见的配合反应。
定性说明配合反应与酸碱反应、沉淀反应、氧化还原反应的联系。
配合物几何构型和异构现象的基本概念。
配合物的杂化轨道理论。
八面体配合物的晶体场理论。
Ti(H2O)6的颜色。
路易斯酸碱的概念。
1.配合物:由中心离子(或原子)和几个配体分子(或离子)以配位键相结合而形成的复杂分子络合物。
如[Co(NH3)6]3+、[Cr(CN)6]3–、Ni(CO)4都是配位单元,分别称作配阳离子、配阴离子、配分子。
判断物质是配合物的关键在于物质是否含有配位单元。
配合物和复盐的区别:前者一定含有配位键,后者没有配位键,如KCl·MgCl2·6H2O是复盐,不是配合物。
2.配合物的组成:为外界,内外界(1)配合物的内界和外界:以[Cu(NH3)4]SO4为例,[Cu(NH3)4]2+为内界,SO-24之间是完全电离的。
内界是配位单元,外界是简单离子。
又如K3[Cr(CN)6]之中,内界是[Cr(CN)6]3–,外界是K+。
配合物可以无外界,但不能没有内界,如Ni(CO)4。
(2)中心离子(原子)和配位体:a.中心离子(原子):又称配合物的形成体或中心体,多为过渡金属离子,如Fe3+、Fe2+、Co2+、Ni2+、Cu2+,也有电中性的原子为配合物的中心原子,如Ni(CO)4、Fe(CO)5中的Ni和Fe都是电中性的原子。
只要能提供接纳孤对电子的空轨道的离子或原子均可作中心体。
b.配位体:含有孤对电子的阴离子或分子。
如NH3、Cl—、CN—等。
配位体中直接同中心原子配合的原子,叫做配位原子。
如[Cu(NH3)4]2+配阳离子中,NH3是配位体,其中N原于是配位原子。
配位原子经常是含有孤对电子的原子。
高中化学竞赛辅导参考资料(全)

绪论1.化学:在分子、离子和原子层次上,研究物质的组成和结构以及物质的化学性质和化学变化及其内在联系的科学。
应注意的问题:(1)化学变化的特点:原子核组成不变,发生分子组成或原子、离子等结合方式的改变;(2)认为物理变化不产生质变,不生成新物质是不准确的,如:2H+31H==42He+10n是质变,产生了新元素,但属于物理变化的范畴;1(3)化学变化也有基本粒子参加,如:2AgCl==2Ag+Cl2就有光子参加;(4)物质2.无机化学:除去碳氢化合物及其大多数衍生物外,对所有元素和他们的化合物的性质和反应进行研究和理论解释的科学。
(莫勒提法)3.怎样学习无机化学?(1)你所积累的好的学习方法都适于学习无机化学。
(2)课前预习,带着问题听课。
提倡写预习笔记。
(3)课上精力集中,边听边看边想边记,眼、耳、手、脑并用。
(4)课后趁热复习,按时完成作业,及时消化,不欠账。
(5)提高自学能力,讨论课积极发言。
(6)随时总结,使知识系统化。
达到书越读越薄之目的。
(7)理论联系实际,做好化学实验。
第一章原子结构和原子周期系教学目标:1.学会一个规则:斯莱特规则;2.掌握两个效应:屏蔽效应、钻穿效应;3.掌握三个原理:能量最低、保里不相容、洪特规则;4.掌握四个量子数:n、l、l、m s5.掌握五个分区:s、p、d、ds、f6.掌握六对概念;7.掌握七个周期;8.掌握八个主族八个副族。
重点:1.原子核外电子排布三个原理,核外电子的四个量子数;2.元素周期表的结构其及元素性质变化规律。
难点:屏蔽效应、钻穿效应概念及应用;教学方法:讲授与讨论相结合,做适量练习题和作业题。
教学内容:§1-1经典物理学对原子结构的认识1-1原子的核形结构1708年卢瑟福通过α粒子散射实验确认:原子是由中央带正电的原子核和周围若干绕核旋转的电子组成。
遇到的问题:电子绕核运动,将不断辐射电磁波,不断损失能量,最终将落到核上,原子因此而消亡实际与此相反,原子是稳定存在的,急需找到理论解释。
高中化学竞赛辅导

.
11
十一.烃A含92.26%(质量)的碳。A与过量的干燥溴化氢于敞口容器中在光照下作用, 很快形成含溴43.18%(质量)的产物B。A与浓溴化氢水溶液之间的反应,即使在这两种 液体搅拌的情况下,也进行得很慢,生成的主要产物为化合物C。B和C两种物质都能与热 的高锰酸钾溶液反应。当用过量的高锰酸钾作用于B和C而得到的反应产物的水溶液被酸 化时,在两种情况下生成了不含卤素的无色晶体物质,分别表示为BB和CC。1g BB能与 73.4mL的0.l mol/L NaOH溶液完全反应,而1gCC能与81.9mL的0.1mol/ L NaOH溶液反应。
1.试确定物质A、B、C结构; 2.试写出产物BB和CC的化学式; 3.试指出物质B和C的结构; 4.试写出题中所述反应的图式; 5.试说明由烃A生成B和C的反应图式。
1.烃A中C、H比为:1:1;A与过量HBr在光照下反应生成B,说明是双键与HBr起自由基 加成反应,根据B中含溴量为43.18%,可计算出烃A的分子量为104。 烃A的分子式为C8H8,其中不饱和度5,减去一个苯环,还剩下一个双键。 A的结构式为 C6H5CH=CH2,B的结构式为C6H5CH2CH2Br(在光照条件下与HBr的加成是自由基加成, 产物为反马氏规则产物)。C的结构式为:C6H5CH Br—CH3,这是亲电加成,符合马氏规 则。
将A、A’分别跟稀NaOH溶液微微加热,A得到C;A’得到C’。C可以被KMnO4 酸性溶液氧化得到酸性化合物D,D中含碳氢共63.6%;而在同样条件下C’却不被 氧化。
1.试写出A、A’、B、C、C’、D的结构简式,并据此画一框图,表示它们之 间的联系,但是不必写反应条件。
高中化学竞赛三维化学单元练习

《三维化学》单元练习姓名成绩(时间:180分钟满分:100分)一.(9分)有一立方晶系的离子晶体,其结构如右图所示,试回答:1.晶体所属的点阵形式;2.已知r Cs+=169pm,r Cl-=181pm,Cs+,Cl-离子半径大致相近,试问此两种离于联合组成了何种型式的密堆积;3.Cu2+处在何种空隙里?4.指出各离子的配位情况?二.(11分)黄铜矿是最重要的铜矿,全世界的2/3的铜是由它提炼的。
回答下列问题:1.右图为黄铜矿的晶胞。
计算晶胞中各种原子的数目:Cu Fe S 写出黄铜矿的化学式2.在高温下,黄铜矿晶体中的金属离子可以发生迁移。
若铁原子与铜原子发生完全无序的置换,可将它们视作等同的金属离子,请画出它的晶胞。
3.在无序的高温型结构中,硫原子作什么类型的堆积?金属原子占据什么类型的空隙?该空隙被金属原子占据的分数是多少?4.计算黄铜矿晶体的密度(晶胞参数:a=52.4pm,c=103.0pm;相对原子量:Cu 63.5 Fe55.84 S 32.06)第 1 页共4 页三.(13分)冰晶石(Na3AlF6)用作电解法炼铝的助熔剂。
冰晶石晶胞是以大阴离子(AlF63-)构成的面心立方晶格,Na+可看作是填充在晶格的空隙中,已知冰晶石的密度为2.95g/cm3,Al—F键长181 pm,相对原子质量:Na 23.0;Al 27.0;F 19.0。
1.指出AlF63-配离子中心离子的杂化轨道类型、配离子空间构型和所属分子点群。
2.指出Na3AlF6的点阵形式;阴离子作何种形式的堆积,阳离子占据何种空隙及占有率;写出它们的分数坐标。
3.计算冰晶石晶体的晶胞参数。
五.(17分)CaCu x合金可看作由下图所示的a、b两种原子层交替堆积排列而成:a 是由Cu和Ca共同组成的层,层中Cu-Cu之间由实线相连;b是完全由Cu原子组成的层,Cu-Cu之间也由实线相连。
图中由虚线勾出的六角形,表示由这两种层平行堆积时垂直于层的相对位置。
全国高中化学竞赛辅导讲义—核外电子的排布

全国⾼中化学竞赛辅导讲义—核外电⼦的排布第⼆节核外电⼦的排布【竞赛要求】⽤s、p、d等来表⽰基态构型(包括中性原⼦、正离⼦和负离⼦)核外电⼦排布。
【授课⽇期】年⽉⽇【本节内容】⼀、多电⼦原⼦的能级⼆、核外电⼦的排布规律【知识整理】⼀、多电⼦原⼦的能级1、鲍林的轨道能级图:1939 年,鲍林(Pauling,美国化学家)根据光谱实验的结果,提出了多电⼦原⼦中原⼦轨道的近似能级图,⼜称鲍林能级图①近似能级图是按原⼦轨道的能量⾼低来排的,并不是按离核远近排的。
严格意义上只能叫“顺序图”,顺序是指轨道被填充的顺序或电⼦填⼊轨道的顺序,把能量的相近能级划成⼀组,称为能级组:第⼀能级组1s s轨道能容纳2个电⼦第⼆能级组2s,2p第三能级组3s,3p p轨道能容纳6个电⼦第四能级组4s,3d,4p第五能级组5s,4d,5p d轨道能容纳10电⼦第六能级组6s,4f,5d,6p第七能级组7s,5f,6d,7p f轨道能容纳14电⼦第⼋能级组8s,5g,6f,7d,8p第九能级组 9s,6g,7f,8d,9p g轨道能容纳18电⼦②主量⼦数n 相同,⾓量⼦数l越⼤能量越⾼,即发⽣“能级分裂”现象。
例如:E4s< E4p < E4d < E4f 。
③当主量⼦数 n和⾓量⼦数同时变动时,发⽣“能级交错”。
例如:E4s< E3d< E4p , E6s< E4f< E5d< E6p 。
可以按徐光宪的近似公式n+0.7 l计算能级。
“能级交错”和“能级分裂”现象都是由于“屏蔽效应”和“钻穿效应”引起的。
2、屏蔽效应和钻穿效应⑴屏蔽效应:由于其它电⼦对某⼀电⼦的排斥作⽤⽽抵消了⼀部分核电荷,使有效核电荷降低,消弱了核电荷对该电⼦的吸引,这种作⽤称为屏蔽作⽤或屏蔽效应。
屏蔽效应使原⼦轨道能量升⾼。
⑵钻穿效应:外层电⼦钻到内部空间⽽靠近原⼦核的现象,通常称为钻穿作⽤。
由于电⼦的钻穿作⽤的不同⽽使它的能量发⽣变化的现象称为钻穿效应,钻穿效应使原⼦轨道能量降低。
高中化学竞赛辅导讲座配位化合物共47页文档

谢谢!
高中化学竞赛辅导讲座配位化合物
36、如果我们国家的法律中只有某种 神灵, 而不是 殚精竭 虑将神 灵揉进 宪法, 总体上 来说, 法律就 会更好 。—— 马克·吐 温 37、纲纪废弃之日没有公众舆论的支持,法律 是丝毫 没有力 量的。 ——菲 力普斯 39、一个判例造出另一个判例,它们 迅速累 聚,进 而变成 法律。 ——朱 尼厄斯
40、人类法律,事物有规律,这是不 容忽视 的。— —爱献 生
61、奢侈是舒适的,否则就不是奢侈 。——CocoCha nel 62、少而好学,如日出之阳;壮而好学 ,如日 中之光 ;志而 好学, 如炳烛 之光。 ——刘 向 63、三军可夺帅也,匹夫不可夺志也。 ——孔 丘 64、人生就是学校。在那里,与其说好 的教师 是幸福 ,不如 说好的 教师是 不幸。 ——海 贝尔 65、接受挑战,就可以享受胜利的喜悦 。——杰纳勒 尔·乔治·S·巴顿
高中化学奥林匹克竞赛辅导讲座 第5讲 分子结构-典型例题与知能训练

高中化学奥林匹克竞赛辅导讲座 第5讲 分子结构【典型例题】例1、写出POCl 3的路易斯结构式。
分析:应当明确在POCl 3里,P 是中心原子。
一般而言,配位的氧和氯应当满足八偶律。
氧是二价元素,因此,氧原子和磷原子之间的键是双键,氯是1价元素,因此,氯原子和磷原子之间的键是单键。
然而使配位原子满足八偶律,即画出它们的孤对电子。
解:例2、给出POCl 3的立体构型。
分析:应用VSEPR 模型,先明确中心原子是磷,然后计算中心原子的孤对电子数:n = 5 - 2 -3 × 1 = 0所以,POCl 3属于AX 4E 0 = AY 4型。
AY 4型的理性模型是正四面体。
由于氧和磷的键是双键,氯和磷的键是单键,所以∠POCl >109°28’,而∠ClPCl <109°28’。
解:POCl 3,呈三维的四面体构型,而且,∠POCl >109°28’,而∠ClPCl <109°28’。
例3、给出POCl 3的中心原子的杂化类型。
分析:先根据VSEPR 模型确定,POCl 3属于AY 4型(注意:不能只考虑磷原子周围有四个配位原子,杂化类型的确定必须把中心原子的孤对电子考虑在内。
本题恰好AX n + m = AY n (m = 0),如果不写解题经过,可能不会发现未考虑孤对电子的错误。
)AY 4的VSEPR 模型是正四面体。
因此,POCl 3属于三维的不正的四面体构型。
解:POCl 3是四配位的分子,中心原子上没有孤对电子,所以磷原子取sp 3杂化类型,但由于配位原子有两种,是不等性杂化(∠POCl >109°28’, 而∠ClPCl <109°28’ )。
例4、BF 3分子有没有p –p 大π键?分析:先根据VSEPR 模型确定BF 3分子是立体构型。
然后根据立体构型确定BF 3分子的B 原子的杂化轨道类型。
再画出BF 3分子里的所有轨道的图形,确定有没有平行的p 轨道。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高中化学竞赛辅导专题讲座——三维化学 第三节 正八面体与正方体 前文我们学习了正方体与正四面体,现在我们来学习另一种空间正多面体——正八面体。由于在高中立体几何中并未涉及这种立体图形,使同学们在理解上存在一定的困难,那么就让我们先来讨论一下正八面体吧!
【讨论】顾名思义,正八面体应该有八个完全相同的面,如右图3-1所示,每个面都是正三角形;另外正八面体有六个顶点,十二条棱。让我们与正方体作一对比,它们都有十二条棱,正方体有六个面(正八面体六个顶点)、八个顶点(正八面体八个面),与正八面体的面数和顶点数正好相反,它们是否存在内在的空间关系呢?我们连接正方体六个面的面心形成的是什么空间图形呢?它就是正八面体(能理解了吧!我们也可以将空间直角坐标系xyz轴上与原点等距的六个点连起来构成正八面体)。正八面体与正方体都是十二条棱,它们的空间位置显然是不一样的,但它们的十二条棱的棱心的空间位置又如何呢?应该是一样的吧。先让我们看个例题再讨论吧!
【例题1】已知[Co(NH3)6]3+的立体结构如图3-2所示,其中1~6处的小圆圈表示NH3分子,且各相邻的NH3分子间的距离相等(图中虚线长度相同)。Co3+位于八面的中心,若其中两个NH3被Cl-取代,所形成的[Co(NH3)4Cl2]+的同分异构体的数目是 ① A 1 B 2 C 3 D 4 【分析】正八面体每个顶点在空间是完全等价的,当选定一个顶点后,另五个顶点就在空间形成两种相对的位置,四个是相邻的,一个是相对的,故二氯取代物是两种,两个氯的距离分别是边长和对角线长。 【解答】B 【练习1】SF6是一种无色气体,具有很强的稳定性,可用于灭火。SF6的分子结构如图3-3所示,呈正八面体型。如果F元素有两种稳定的同位素,则SF6的不同分子种数为 ② A 6种 B 7种 C 10种 D 12种 【讨论】用同位素考察分子的空间结构是一种新方法,也是一种好方法。本题中主要来确定SaF3bF3的种数,三个aF在空间也只有两种形式,即△和├;另外SaF2bF4与SaF4bF2的种数应该是一样的吧?(想想为什么)! 【练习2】正方体ABCD—A1B1C1D1中截取最大正八面体,再从该正八
图1-1 1 2 5
3 4 6 图3-2
F F F S F F F 图3-3 面体中截取最大正方体A’B’C’D’—A1’B1’C1’D1’,计算它们的体积比。
【讨论】本题是用来巩固正方体与正八面体的关系,利用立体几何知识并不难解决。 如果我们连接大正方体的对角线,则该对角线也正好通过小正方体的对角线和正八面体的两个面的面心,且与正八面体这两个面正好垂直。我们沿这条对角线观察正八面体,可得如图3-4所示的图形,它是我们从另一种角度观察得到的图形,也是一种很重要的图形,请看例题2:
【例题2】如图3-5所示,[Co(en)3]3+螯合离子是正八面体构型的,六个配位点被三个双齿配体乙二胺(en)所占据,请问该离子是否存三重轴(该离子绕轴旋转120º与原离子图形完全重合) 【分析】按图3-5所给的图形,我们很难找出三重轴,能否换一种角度去看呢?如图3-6所示,这是我们垂直某个面的方向去看,由于是正三角形,这就有存在三重轴的可能性,我们以过三角形重心垂直纸面方向为轴,旋转120º,则1→3→5→1,2→4→6→2,所得图形与原图形完全重合,en位置也显然是一样的。 【解答】存在三重轴,过任意两个相对面(假想)的面心的连线,都是我们所需要的三重轴。 【练习3】在例题2中,与已知三重轴垂直的二重轴(绕轴旋转180º后与原图形完全重合)有几条。 【讨论】二重轴也应该是过八面体体心的,能否让1→6→1,2→5→2,3→4→3呢?类似的轴有几条呢? 正八面体构型的微观物质在化学在是很常见的,请看例题3判别一下吧:
【例题3】以下各组指定微粒构成正八面体顶点的是 ③ A 乙烷分子中的氢原子 B XeF6分子中的F原子 C NaCl晶体中与一个Na+最近的Cl- D NaCl晶体中与一个Na+最近的Na+ E CsCl晶体中与一个Cs+最近的Cl- F CsCl晶体中与一个Cs+最近的Cs+ G P4在少量O2中燃烧产物分子中的O原子 H 高碘酸根离子中的O原子 【分析】先看A,乙烷分子中的六个氢原子通过碳氢并非作用与一个碳原子上,中间有根碳碳键,不可能构成正八面体;看B,Xe原子最外层有8个电子,六个参与成键,还有一对孤对电子,会对Xe—F产生排斥作用,故F原子也不可能构成正八面体;看C、D,在NaCl晶体中,与一个Na+最近
图3-4 图3-5 图3-6 的Cl-正好有六个,位于Na+的上下前后左右,显然构成正八面体,与一个Na+最近的Na+有十二个,不会构成八面体;看E、F,在CsCl晶体中,与一个Cs+最近的Cl-有八个,构成的是正方体,与一个Cs+最近的Cs+有六个,也构成了正八面体;看G,P4在少量O2中燃烧得到P4O6,我们一般看到的这六个氧原子的构型与我们的第二种正八面体模型比较相似;看H,IO65-中I是sp3d2杂化,这是正八面体构型的(后面会再讨论)。 【解答】C、F、G、H 【练习4】将Nb2O5与苛性钾共熔后,可以生成溶于水的铌酸钾,将其慢慢浓缩可以得到晶体Kp[NbmOn]·16H2O,同时发现在晶体中存在[NbmOn]p
-离子。该离子结构由6个NbO6正八面体构成的。每个NbO6八面体中的6
个氧原子排布如下:4个氧原子分别与4个NbO6八面体共顶点;第5个氧原子与5个八面体共享一个顶点;第6个氧原子单独属于这个八面体的。列式计算并确定该晶体的化学式。计算该离子结构中距离最大的氧原子间的距离是距离最短的铌原子间距离的多少倍?④ 【讨论】这是一个涉及正八面体堆积的问题,我们先根据题意来计算。对一个铌氧八面体,有一个氧原子完全属于这个八面体,有四个氧原子分别与一个八面体共用氧原子,即属于这个八面体的氧原子是1/2个,另一个氧原子是六个八面体共用的,自然是1/6了。故对一个铌而言,氧原子数为1+4×1/2+1/6=19/6。 在正方体中,我们用八个小正方体可堆积成一个大正方体;在正八面体中,我们也可以用六个小正八面体堆积成一个大正八面体,在这里,六个小正八面体的体心也构成一个小正八面体。不知大家是否考虑到一个问题:八个正方体堆积,边长变为原来的两倍,体积自然是原来的八倍了;而正八面体堆积后,边长也是变为两倍,而体积仅变为原来的六倍。请注意:正方体堆积时,是共顶点、共棱、共面的;而正八面体堆积时,是共顶点、共棱,但不共面的。也就是说:正八面体堆积以后,面与面之间是存在较大空隙的。
【例题4】钼有一种含氧酸根[MoxOy]z-,式中x、y、z都是正整数;Mo的氧化态为+6,O呈-2。可按下面的步骤来理解该含氧酸根(如图3-7所示)的结构: (A)所有Mo原子的配位数都是6,形成 [MoO6]n-,呈正八面体,称为“小八面体”(图3-8-A); (B)6个“小八面体”共棱连接可构成一个“超八面体”(图3-8-B); (C)2个”超八面体”共用2个“小八面体”可构成一个“孪超八面体”(图3-8-C); (D)从一个“孪超八面体”里取走3个“小八面体”,得到的“缺角孪超八面体”(图D)便是本题的[MoxOy]z-(图D中用虚线表示的小八面体是
图3-7 被取走的)。 回答了列问题: 1.小八面体的化学式[MoO6]n-中的n= 2.超八面体的化学式是 。 3.孪超八面体的化学式是 。 4.缺角孪超八面体的化字式是 。⑤ 【分析】1.根据化合价代数和即可求得n值; 2.利用练习4中的分析,我们也可以轻易写出化学式,当然我们也可以将该图形看成如图3-9所示的图形,图中清晰标出两个原子; 3.观察图3-8-C可见,“孪超八面体”各由10个小八面体构成,则应有10个Mo原子,其八个项角应各有1个O原子;二个小八面体共用顶角的点共有14个,应有14个O原子;三个小八面体共用的项角点有4个,有4个O原子;6个小八面体共用的项角点有2个,有2个O原子。故共有Mo原子10个,O原子28个。通上题一样,我们也可以画出如图3-10所示的图形。 4.怎么考虑最后一小题呢?拿走了三个小正八面体,我们只需在图3-10中,在中间一层中移走一排三个Mo原子和与它们平行的一排外侧四个O原子就可以了。 【解答】1.[MoO6]6- 2.[Mo6O19]2- 3.[Mo10O28]4+ 4.[Mo7O24]6- 【练习5】如图3-11所示为八钼酸的离子结构图,请写出它的化学式 【讨论】请考虑一下,怎样从图3-10中移走小正八面体呢? 【练习6】晶体[Nb6Cl12]SO4·7H2O中阳离
A B C D 图3-8
图3-9 图3-10 图3-11 子[Nb6Cl12]2+的的结构(如图3-12所示)为:6个金属原子构成八面体骨架,每个卤离子形成双桥基位于八面体的每条棱边上。借助右边的立方体,画出氯离子在空间的排布情况(用·表示)。另有一种含卤离子[Nb6Ix]y+,6个Nb原子形成八面体骨架结构,碘原子以三桥基与与Nb原子相连。确定x的值,并也在右图上画出I原子的空间分布情况(用×表示)。x= ⑥ 【讨论】通过本例,我们将本节学过的知识巩固一下。铌原子构成了正八面体,氯原子通过两个键与两个铌原子去连,由于最近两个铌原子相连是条棱,且共有12条棱,因此氯原子应有12个,在每条棱对出的地方。怎样考虑碘原子呢?碘通过三键去与三个铌原子相连,是否应该在每个面对出的地方呢?请大家参考如图3-13所示的两幅图。
【练习参考答案】 1.C 2.27:1 3.3条 4.6:19 K8[Nb6O19]·16H2O 22 5.[Mo8O26]4- 6.图略,12条棱的中点画· x=8 图略,8个顶点画× 【附录】 ① 1998年慈溪中学高考化学模拟试卷第3题(已上传) ② 1999年慈溪中学高考化学模拟试卷第20题(即将上传) ③ 1998年全国化学竞赛预赛模拟试卷(二)第一题第5题(已上传) ④ 1999年全国化学竞赛预赛模拟试卷(五)第四题第2题(已上传) ⑤ 1999年全国化学竞赛预赛模拟试卷(六)第六题(已上传) ⑥ 1999年全国化学竞赛预赛模拟试卷(五)第四题第3题(已上传) 图3-12 图3-13
