1.3.3阿伏加德罗定律推导
阿伏伽德罗定律及其推论ppt课件.ppt
1.下列说法中正确的是 [
]
A.相同状况下,
气体的摩尔体积约等于22.4L/mol
B.标准状况下,22.4L的任何气体中都
约含有6.02×1023个分子
C.0℃,101kPa条件下,5.6LNH3中约 含有6.02×1023个原子
D.100℃、101kPa条件下,
22.4L水蒸气的质量等于18g
2.同温同压下,物质的量为0.2mol的 N2O(气)和NO2(气),它们的 [ CD ] A.质量相同,体积不同 B.体积相同,分子数不同 C.分子数相同,质量不同 D.体积相同,原子数相同
m
M
n X NA
N
XM
NA
ρ Vm X
ρX
Vm
V
1.利用气体摩尔体积,进行质量与体积 间的相互计算
【例题1】8.5g氨在标准状况时体积是多少升? 解:氨的式量是17,氨的摩尔质量是17g/mol
n(NH3)=
m(NH3) M(NH3) =
8.5g 17g/mol = 0.5mol
V(NH3)=22.4L/mol×0.5mol=11.2L
等于摩尔质量比。
练习:
ρ1∶ρ2=M 1∶M 2
在标准状况下,空气的平均式量为29,
相同条件下的下列气体密度比空气密度大的是(①③④ )
①CO2②H2③Cl2④HCl⑤N2
推论5
恒温恒容下,
气体的压强比等于它们的物质的量之比。
即:p1∶p2=n1∶n2
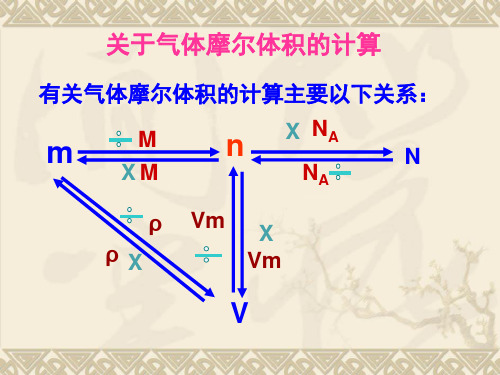
三、关于气体摩尔体积的计算
有关气体摩尔体积的计算主要以下关系:
解得:x=8g m(CO2)=30g-8g=22g
V(CO2)=17.6L-6.4L=11.2L
答:CO的质量为8g,CO2的质量为22g; CO的体积为6.4L,CO2的体积为11.2L。
阿伏伽德罗定律

V1 n1 N1 = = V2 n2 N2
2、同T、同V时,P与n 的关系 、 、 时 与
P1 n1 = P2 n 2
3、同T、同n时,P与V的关系 、 、 时 与 的关系
P1 V 2 = P2 V1
4、同T、同P时, ρ与M的关系 、 、 时 与 的关系
ρ1 M 1 = ρ2 M 2
5、同T、同P时,两种气体的相对密度 、 、 时 两种气体的相对密度
ρ1 M 1 D= = ρ2 M 2
例 某混合气体的密度是相同条件下氢气密度 的12倍,该气体可能为( ) 倍 该气体可能为( A、CO,CO2 B、 CH 4 ,CO 2 、 , 、 C、NO 2,Cl 2 D、 Cl 2 , O 2 、 、
例 题
1、在常温常压下,a mol N2 和 b mol CO相比较,下列叙 、在常温常压下, 相比较, 相比较 述不正确的是( 述不正确的是( BD ) A 气体的体积之比为 a : b C 质量之比为 a : b B 摩尔质量之比为 a : b D 密度之比为 a : b
2、同温同压下,a g 气体 X 和 b g 气体 Y 含有相同的 、同温同压下, 分子数,下列说法中不正确的是( 分子数,下列说法中不正确的是( D ) A X与Y摩尔质量比为 ∶b 与 摩尔质量比为 摩尔质量比为a∶ B 同温同压下,X与Y的密度比为 ∶b 同温同压下, 与 的密度比为 的密度比为a∶ C 相同质量的 与Y的分子数比为 ∶a 相同质量的X与 的分子数比为 的分子数比为b∶ D 相同质量的 与Y在同温同压下体积之比为 ∶b 相同质量的X与 在同温同压下体积之比为 在同温同压下体积之比为a∶
克拉珀珑方程 ①克拉珀珑方程又称为理想气体的状态方 程,它同样忽略了气体分子本身的大小 克拉珀珑方程: ②克拉珀珑方程:
阿伏加德罗定律及其推论精选教学PPT课件

阿伏加德罗定律推导 PPT课件 人教课标版

化学课堂演示
29.04.2019
气体摩尔体积 是阿伏加德罗定律的特例
温度 阿伏加德 罗定律 气体摩尔 体积 同温 压强 同压 气体的量 同分子数 气体的 体积 同体积
0℃
1大气压
1mol
22.4L
深圳市西乡中学房燕玲
29.04.2019
介绍:克拉珀龙方程:PV=nRT
R=8.314 Pa· m 3· mol-1· K-1
2. 同温同压下,任何气体密度比
1 M 1 2 M 2
(T、P相同)
练习二
三、阿伏加德罗定律的推论:
依据:=nRT 或
m RT PV= M
3. 同温同压下,气体体积之比 等于物质的量之比
V1 n1 V2 n2
(T、P相同)
练习三
三、阿伏加德罗定律的推论:
依据:PV=nRT 或
深圳市西乡中学房燕玲
推导五
29.04.2019
练习五
1. 在一定温度和压强下,10体积气体A2跟30体 积B2化合生成20体积某气体C,则C的化学式 为( C ) (A)AB (B)A2B (C)AB3 (D)AB2 2. 关于同温同压下等体积的CO2和CO的叙述: ①质量相等②密度相等③所含分子数相等④ 所含碳原子数相等,其中正确的是( C ) (A)①②③④ (B)②③④ (C)③④ (D)③
深圳市西乡中学房燕玲
推导四
29.04.2019
练习四
3. 在某温度时,一定量的元素 A的气态氢 化物(AH3),在一定体积的密闭容器 中完全分解成两种气态单质,此时压强
增 加 75% , 则 A 的 单 质 的 一 个 分 子 中
有 4 个A原子。
阿伏加德罗定律及推论

阿伏加德罗定律及推论一、[教学目的]:1、理解阿伏加德罗定律及其推论。
2、会运用阿伏加德罗定律及推论进行相关的分析、推断及有关计算。
二、[知识导学]:1、阿伏加德罗定律:在相同温度相同压强下,相同体积的任何气体都含有相同数目的分子。
即同T、P、V同N。
推而广之,三个因素相同时,第四个因素必然相同,又称为“四同定律”。
该定律适用任何气体。
2、阿伏加德罗定律的推论:据阿伏加德罗定律及气态方程(PV=nRT),限定不同条件,便可得到阿伏加德定律的多种形式,熟练并掌握它们对于解答有关问题可达到事半功倍的效果。
[附:克拉贝龙方程PV=nRT,P一压强,单位kPa,V—指体积,单位L,n指物质的量,单位mol,T一指开氏温度,单位K,R为常数8.314,单位kPa·L/(mol·K),此关系式适用于各状态下的气体,三、[例题评析]:[例1]:两个体积相同的容器,一个盛NO,另一个盛N2和O2,在同温同压下两容器中气体一定具有相同的( )A.原子总数B.质子总数C.分子总数D.质量[练习1]关于同温同压下,等体积的CO2和CO的叙述:其中正确的是( )①质量相等②密度相等③含分子数相等山所有败原子数相等A.①②③④ B.②③④C.③④D.③[例二]同温同压下,500mLR气体质量为1.2g,1.5LO2质量为2.4 g则R的相对分子质量为( ) A.24 B.26 C.48 D.60[练习2]同温同压下,某气体对空气的密度为2,该气体是( )A.CH4B.C2H4C.C2H2D.C4H10[例3]在同温同压下,某瓶充满O2时重116g,充满CO2重122g,充满某气体A时重114g,则气体A 的相对分子质量为( )A,60 B.44 C.32 D.28[练习3]同温同压下,m l克A气体和m2克B气体具有相同的分子数,下列说法正确的是( ) A.A、B两气体的体积比为1:1 B.A、B两气体的相对分子质量比为m l:m2C.A、B两气体的体积比m1:m2D.A、B两气体的密度比为m2:m1[例4]同温同压下,等质量的SO2和CO2相比较,下列叙述中正确的是( ) A.密度之比为16:11 B.密度之比为11:16C、体积之比为1:1 D.体积比为1l:16[练习4]在标准状况下,相同质量的下列气体中体积最大的是( )分子数最小的是( )A、O2B.Cl2C.N2D.CO2[练习5]某物质A,在一定条件下加热分解,产物都是气体。
阿伏伽德罗定律推论及应用

阿伏伽德罗定律应用
• • 1. 下列叙述正确的是 ( ) A.同温同压下,相同体积的物质,其物质的量必 然相等 • B.任何条件下,等物质的量的乙烯 (C2H4) 和一氧 化碳所含的分子数必然相等 • C.1 L一氧化碳气体一定比1 L氧气的质量小 • D.同温同压下,等体积的物质所含的分子数一定 相等
结论 语言表达 同温、同压下,气体的密度与其 相对分子质量成正比 同温、同压、相同体积的气体, 其质量与相对分子质量成正比
相同条件 公式
结论 语言表达
T、p、m V1 M2 同温、同压下,等质量的气体,其 = V M1 体积与相对分子质量成反比 2 相同 T、V、m p1 M2 同温、同体积下,等质量的气体, = p M1 其压强与相对分子质量成反比 2 相同
阿伏伽德罗定律及其推论
学习目标
• • • • • 【知识目标】 1. 进一步巩固物质的量的概念及其与质量、摩 尔质量、物质的量、物质的粒子数之间的相互 关系 2.知道阿伏伽德罗定律及其推论的概念,学 会有关阿伏伽德罗定律及其推论的应用的简单 计算 【能力目标】 初步学会分析处理数据、推. 相同条件下,同质量的X、Y两种气体, 相对分子质量分别为A、B;则: • (1)X与Y的体积比为________,分子个 数比为________,密度比为________; • (2)相同条件下的X、Y两种气体体积相 同,则X与Y的质量比为________,物质的 量比为________。
阿伏加德罗定律:
同温同压下,相同体积的任何气体都 具有相同的分子数
阿伏加德罗定律:
同温同压下,相同体积的任何气体都 具有相同的分子数
• 例:同温、同压下,CO2与CO的体积分别 为12 mL 、6 mL ,则CO2与CO 物质的量之 比为 2:1
阿伏伽德罗定律及其推论PPT学习教案
第2页/共21页
1、有关气体体积的计算
请列出标准状况下求算气体体积可能的方法:
1、V=m/ ρ
2、V=n×Vm (V=m/M×Vm
V=N/NA×Vm)
标准状况下,Vm =22.4L/mol
第3页/共21页
2.有关气体摩尔体积的
请大计家以算物:质的量(n)为中心,
阿伏伽德罗定律及其推论PPT课件
会计学
1
气体摩尔体积 定义:单位物质的量的 气体所占的体积 Vm=V/n 单位:L/mol
第1页/共21页
[注意]
★ 气体摩尔体积的数值不是固定不变的,它与 温度和压强有关
★ 气体摩尔体积只适用于气态物质,对于固态 物质和液态物质来讲,都是不适用的。
★ 标准状况下气体摩尔体积约为22.4L/mol (标准状况:T=0 ℃,P=101KPa)
第11页/共21页
相同 条件 n、T 相同
T、p 相同 T、p、V
相同
公式 pp12=VV21 ρρ12=MM12 MM12=mm12
结论 语言叙述
物质的量相等、温度相同的气体, 其压强与体积成反比 同温、同压下,气体的密度与其摩 尔质量成正比 同温、同压下,体积相同的气体, 其摩尔质量与质量成正比
第16页/共21页
5. 气体的相对分子质量(M)的计算
(1)已知标准状况下气体密度ρ标
M= ρ标 . 22.4
(2)已知两种气体的相对密度D
M(A)=D . M(B)
(3)混合气体的平均相对分子质量(M)
M=
m总 n总
=
n1. MA+ n2. MB n1+n2
阿伏加德罗定律及推论
0℃
1大气压 1mol
22.4L
课堂练习
1.判断下列说法是否正确?为什么?
(1)1L N2 和1L O2 在同温同压下所含分子数相同; (2)1mol N2 和1mol O2 所占体积相同; (3)1mol N2 和1mol O2 所含分子数相同; 2. 3mol O2 和2mol O3 分子数之比为————;
①CO2 ②H2 ③Cl2 ④HCl ⑤N2
例5、某气体A对氧气的相对密度为0.5,求 ①A的是式量是多少? ②A气体对空气的相对密度是多少?(同温同压
下)
A的式量为:16;
A气体对空气的相对密度为:0.55
练一练
1.同温同压下,等质量的二氧化硫和二氧化 碳相比较,下列叙述中,正确的是(AD) (A)密度比为16:11 (B)密度比为11:16 (C)体积比为1:1 (D)体积比为11:16
2. 一个密闭容器中盛有11gCO2时,压强为 1×104Pa.如果在相同温度下,把更多的CO2充 入容器中,使容器内压强增至5×104Pa,这时容 器内气体的分子数约为( C)
A.3.3×1025
B. 3.3×1024
C. 7.5×1023
D. 7.5×1022
气体状态方程: PV= n R T
1.505x1023个氧分子在标准状况下所占
的体积约是
A
A.5.6 L C.2.8L
B.0.56 L D.11.2L
2.同温同压下两个容积相等的贮气瓶,一 个装有C2H4,另一个装有C2H2和C2H6的混 合气体,两瓶内的气体一定具有相同的
A.质量 C.碳原子数
B.原子总数 C
D.密度
一、阿伏加德罗定律
P1V1 = n1RT1
阿伏加德罗定律及其推论
状态1:P1M1=ρ1RT1 状态2:P2M2=ρ2RT2
① ②
① PM RT T —: 1 1 1 1 1 1 ② P2 M 2 2 RT2 2T2
3
第二部分 经典例题赏析 第二部分:经典例题 德 律 其推 考查 1.(1999年上海)由CO2、H2和CO组成的混合气在同温 同压下与氮气的密度相同 则该混合气体中CO2、 同压下与氮气的密度相同。则该混合气体中 H2和CO的体积比为( ) A.29∶8∶13 B.22∶1∶14 C.13∶8∶29 D.26∶16∶57
知识点回顾 阿伏加德罗定律及其推论的内容 4.阿伏伽德罗定律的推论3: 同温、同压、同体积时: 气体质量之比等于构成气体物质分子的摩尔质量之比。 5.阿伏伽德罗定律的推论4: 同温、同体积、同质量时: 气体的压强之比等于构成气体物质分子的摩尔质量的反比。 气体的压强之比等于构成气体物质分子的摩尔质量的反比 6.阿伏伽德罗定律的推论5: 同温、同压时: 气体的密度之比等于构成气体物质分子的摩尔质量之比。
4
m1 M 1 m2 M 2
知识点精讲 ① P1V1 m1M2RT1 m1M2T1 —— : —— = ———— = ———— ② P2V2 m2M1RT2 m2M1T2 5.阿伏伽德罗定律的推论4: 同温、同体积、同质量时: 体 质量时 (T1 = T2,V1 = V2,m1 = m2 )
P1 M 2 P2 M 1
知识点精讲 克拉伯龙方程的变形形式 m PV RT M m1 状态1:PV RT 1 1 M1 1 状态2: P2V2
m2 RT2 M2
知识点精讲 ① P1V1 m1M2RT1 m1M2T1 —— : —— = ———— = ———— ② P2V2 m2M1RT2 m2M1T2 3.阿伏伽德罗定律的推论2: 同温 同压 同质量时:(T1 = T2,P1 = P2,m1 = m2 ) 同温、同压、同质量时:
