蛋白酶活力的测定
米曲霉的蛋白酶活力测定
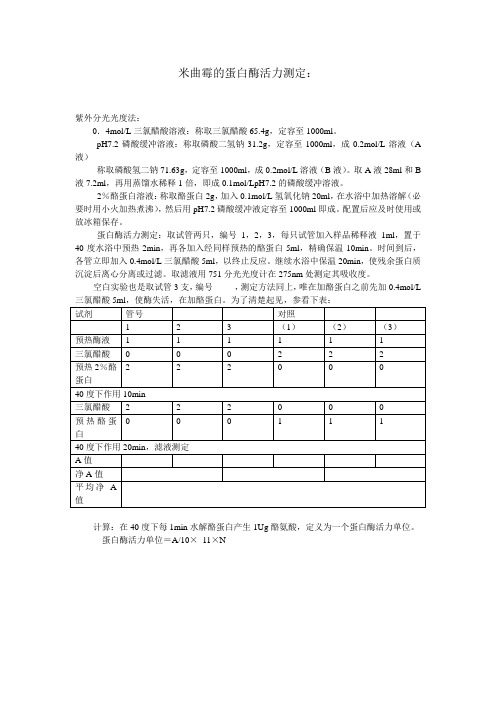
米曲霉的蛋白酶活力测定:
紫外分光光度法:
0.4mol/L三氯醋酸溶液:称取三氯醋酸65.4g,定容至1000ml。
pH7.2磷酸缓冲溶液:称取磷酸二氢钠31.2g,定容至1000ml,成0.2mol/L溶液(A 液)
称取磷酸氢二钠71.63g,定容至1000ml,成0.2mol/L溶液(B液)。
取A液28ml和B 液7.2ml,再用蒸馏水稀释1倍,即成0.1mol/LpH7.2的磷酸缓冲溶液。
2%酪蛋白溶液:称取酪蛋白2g,加入0.1mol/L氢氧化钠20ml,在水浴中加热溶解(必要时用小火加热煮沸),然后用pH7.2磷酸缓冲液定容至1000ml即成。
配置后应及时使用或放冰箱保存。
蛋白酶活力测定:取试管两只,编号1,2,3,每只试管加入样品稀释液1ml,置于40度水浴中预热2min,再各加入经同样预热的酪蛋白5ml,精确保温10min。
时间到后,各管立即加入0.4mol/L三氯醋酸5ml,以终止反应。
继续水浴中保温20min,使残余蛋白质沉淀后离心分离或过滤。
取滤液用751分光光度计在275nm处测定其吸收度。
空白实验也是取试管3支,编号,测定方法同上,唯在加酪蛋白之前先加0.4mol/L 三氯醋酸5ml,使酶失活,在加酪蛋白。
为了清楚起见,参看下表:
计算:在40度下每1min水解酪蛋白产生1Ug酪氨酸,定义为一个蛋白酶活力单位。
蛋白酶活力单位=A/10×11×N。
蛋白酶活力测定方法-大肠杆菌生长曲线的测定

实验材料
• 1.实验器材 电热恒温水浴槽;分析天平;容量瓶;移液管; 721分光光度计
• 2.实验试剂 (1) 缓冲液:pH 7.5-8.0的 50 mM Tris-Cl缓冲液。 (2) 2%酪蛋白溶液 (3) 三氯醋酸溶液( TCA ):10% TCA (4) 酪氨酸标准溶液:1000μg/mL;100μg/mL (5) 碱性蛋白酶溶液:发酵液上清夜
➢将被测溶液推入光路,显示器显示为被测样 品的吸光值。
在600 nm波长下,用未接种的LB液体培养 基作空白对照,分别对培养了0、4、8、12、 16和20 h的大肠杆菌培养液,进行光电比浊 测定。对于高浓度的大肠杆菌培养液,要用未 接种的LB培养基进行稀释,使其吸光值不超 过1。
比色皿经蒸馏水清洗后,必须经待测样品润 洗。比色皿的毛面用吸水纸擦干,而光面只 能用吸水纸吸干,以免光面被划破。
➢取出档光体,按100%T/OA键调100%透射 比。
2.样品测定
➢将参比溶液以及被测溶液倒入比色皿中。
➢打开样品室盖,将参比溶液放在样品架的第 一个槽位中,将被测溶液依次放入其它槽位。
➢将参比溶液推入光路,按100%T/OA键调满 度。
➢按 MODE , 将 测 试 方 式 调 至 吸 光 度 方 式 (A)。此时,显示器显示“0.000”。
• 福林酚反应:福林试剂在碱性条件下极其不稳定, 容易定量地被酚类化合物还原,生成钨蓝和钼蓝的 混合物,而呈现出不同深浅的蓝色。
• 利用比色法即可测定酪氨酸的生成量,用碱性蛋白 酶在单位时间内水解酪蛋白产生的酪氨酸的量来表 示酶活力。
2. 紫外分光光度计法
• 蛋白质、酪氨酸等氨基酸在200~320nm范围内 有光吸收,最大吸收波长在280nm处,故选此波 长作为测定波长。
蛋白酶酶活测定方法

蛋白酶酶活测定方法一、实验原理:一定条件下不仅能够水解蛋白质中的肽键,也能够水解酰胺键和酯键,因此可用蛋白质或人工合成的酰胺及脂类化合物作为底物来测定蛋白酶的活力。
本实验选用酪蛋白为底物,测定微生物蛋白酶水解肽键的活力。
酪蛋白经蛋白酶作用后,降解成相对分子质量较小的肽和氨基酸,在反应混合物中加入三氯醋酸溶液,相对分子质量较大的蛋白质和肽沉淀下来,相对分子质量较小的肽和氨基酸仍留在溶液中,溶解于三氯醋酸(TCA)溶液的肽的数量与酶的数量和反应时间成正比。
在280nm波长下测定溶液吸光度的增加,计算酶的活力。
一分钟内1mg牛血清蛋白(BSA)相当的非蛋白性Lowry试液显色物质的增量值定义为一个蛋白酶活性单位(IU)。
二、试剂配制:A溶液:含2%KCl,1%TrltonX-100的50mM磷酸盐缓冲溶液(pH 6.0)试样TG酶溶液:直接取发酵样12000rpm离心5min,取上清测定。
底物溶液:精确称取底物二甲基酪蛋白0.250g,加入50mM PB缓冲溶液(pH 6.0)10mL,常温搅拌30min使其溶解后备用。
三、操作步骤:1. 试样1)将底物溶液放入37℃恒温水浴中预热备用2)试管中加入试样TG酶溶液0.2mL后放入恒温水浴中,10min后加入已预热的底物溶液1mL,立即振荡混合,于37℃反应60min3)反应结束后,加入12% TCA溶液1mL,再于37℃反应30min,使反应终止4)20℃,3000rpm,20min离心后取上清备用。
2.空白1)试管中加入已预热底物溶液1mL,再加入12% TCA溶液1mL,振荡混合后,于37℃反应60min2)加入试样TG酶溶液0.2mL,振荡混合后,于37℃反应30min3)20℃,3000rpm,20min离心后取上清备用。
四、Lowry法显色反应试管中分别加入试样清液和空白清液各0.2mL,加入A溶液1mL,振荡混合后室温下放置10min,然后加入试剂B 0.1mL,振荡混合后,于37℃反,空白的吸应30min。
碱性蛋白酶活力的测定

实验四碱性蛋白酶活力的测定一、实验原理以酪蛋白为底物测定碱性蛋白酶的活力。
酪蛋白经蛋白酶作用后,会降解成相对分子质量较小的肽和氨基酸,在反应混合物中加入三氯醋酸溶液,相对分子质量较大的蛋白质和肽就沉淀下来,相对分子质量较小的肽和氨基酸仍留在溶液中。
溶解于三氯醋酸溶液中的肽的数量正比于酶的数量和反应时间。
因而采用Folin法测定上清液中肽的含量就可以计算酶的活力。
二、试剂和仪器试剂:0.1mol/L碳酸钠-碳酸氢钠缓冲液(pH10)、5%三氯醋酸、1%酪蛋白溶液(称取5g酪蛋白置于500mL 0.1mol/L碳酸钠-碳酸氢钠缓冲液(pH10)中,加热使其溶解)、0.4mol/L碳酸钠溶液、100μg/mL酪氨酸溶液、Folin试剂,稀释3倍使用仪器:水浴锅、721分光光度计(含比色皿)、秒表、常规玻璃仪器三、实验步骤1、酶液的萃取称取1g粗酶制剂置于研钵中,加少量缓冲液一起研磨,然后定容至100mL,从容量瓶中取出5mL酶液(视酶活而定)再定容至100mL,稀释后的酶液经滤纸过滤后得到澄清的酶液。
2、酶活力的测定样品管:取不同量的酶液(0.1~1.0mL:0.2mL、0.4mL、0.6mL),用0.1mol/L 碳酸钠-碳酸氢钠缓冲液(pH10)(对应为0.8mL、0.6mL、0.4mL)补足体积到1.0mL,然后在每个样品管中再加入1mL预先在40℃保温的1%酪蛋白溶液,混匀,在40℃准确保温10min,加入2mL 5%三氯醋酸溶液,迅速摇匀,于室温静置半小时。
空白管:先在每支试管中各加入1.0mL 1%酪蛋白溶液和2.0mL 5%三氯醋酸溶液,摇匀后,再加入1.0mL的酶液,酶液浓度分别与对应的样品管相同,在40℃下准确保温10min,以下操作同样品管。
将酶反应混合物过滤后收集滤液,在1mL滤液中加5mL 0.4mol/L碳酸钠溶液和1mL Folin试剂,摇匀后在40℃恒温水浴中显色20 min,以相应的空白管中的反应液为对照,在680nm下测定样品管中反应液的吸光度。
蛋白酶活性的测定方法

蛋白酶活性的测定方法(GB/T23527-2009)1 原理蛋白酶对酪蛋白、乳清蛋白、谷物蛋白等都有很好的水解作用。
磷钨酸和磷钼酸混合试剂,即福林-酚试剂,碱性条件下极不稳定,易被酚类化合物还原而呈蓝色反应(钨兰和钨兰混合物)。
由于蛋白质中含有具有酚基的氨基酸(酪氨酸、色氨酸、苯丙氨酸),因此,蛋白质及其水解产物也呈此反应。
利用蛋白酶分解酪素(底物)生成含酚基氨基酸的呈色反应,来间接测定蛋白酶的活力。
2 仪器和设备2.1 分析天平:精度0.0001g2.2 恒温水浴:精度±0.2℃2.3 计时表2.4 分光光度计2.5 沸水浴器2.6 振荡混合器2.7 pH计: 精度0.01pH单位3 试剂和溶液3.1 乳酸缓冲液(pH=3.0)适用于酸性蛋白酶甲液:称取乳酸(80%-90%)10.6g,加水溶解并定容至1000ml。
乙液:称取乳酸钠(70%)16g,加水溶解并定容至1000ml.使用溶液:取甲液8ml,加乙液1ml,摇匀,稀释一倍,即成0.05mol/L乳酸缓冲溶液。
3.2 磷酸缓冲液的制备(pH=7.5)适用于中性蛋白酶准确称取磷酸氢二钠(Na2HPO3.12H2O)6.02和磷酸二氢钠(NaH2PO3.2H2O)0.5g,加水定容至1000ml3.3 硼酸缓冲液(pH=10.5) 适用于碱性蛋白酶甲液:称取硼酸钠19.08g,加水溶解并定容至1000ml。
乙液:称取氢氧化钠4.0g,加水溶解并定容至1000ml.使用溶液:取甲液500ml,加乙液400ml,摇匀,用水稀释至1L。
3.4 0.4mol/L碳酸钠溶液:准确称取无水碳酸钠42.4g,以蒸馏水溶解定溶至1000ml.3.5 0.4mol/L的三氯醋酸液:准确称取65.4三氯醋酸,以蒸馏水溶解定溶至1000ml3.6 0.5mol/L的NaOH:准确称取2g NaOH溶解并定至100ml3.7 10.00mg/ml酪素溶液称取酪素1.000g,准确至0.001g,用少量的0.5mol/L的氢氧化钠溶液(若为酸性蛋白酶则用浓乳酸2-3滴)润湿,,加入适量的各适宜的缓冲液约80ml,在沸水浴中边加热边搅拌,直至完全溶解,冷却后,转入100ml容量瓶中,用适宜的缓冲液稀释至刻度,此溶液在冰箱内贮存,有效期为三天.3.8 100μg/ml酪氨酸标准溶液3.8.1 准确称取预先于105℃干燥至恒重的L-酪氨酸0.1000g ,用1mol/L 的盐酸60ml 溶解后定容至100ml,即为1.00mg/ml的酪氨酸溶液.3.8.2 吸取1.00mg/ml酪氨酸标准溶液10.00ml,用0.1mol/L盐酸定容至100ml,即得100.0μg/ml L-酪氨酸标准溶液.3.9 酶样的制备准确称取1.000g固体酶或移取1ml液体酶样,用少量的适宜缓冲液溶解并用玻璃棒捣研,然后将上清液倒入100ml容量瓶,沉渣中再添入少量缓冲液捣研多次,最后全部移入容量瓶,稀释到刻度,用四层纱布过滤。
福林酚法测定蛋白酶活力原理

福林酚法测定蛋白酶活力原理福林酚法测定蛋白酶活力的原理,就像是一个魔术师手中的神奇道具,让你在一瞬间就能感受到蛋白质的“生命力”。
这个神奇的工具叫做福林酚试剂,它是由福林酚和氢氧化钠组成的。
当福林酚试剂遇到蛋白质时,就像一位魔法师施展魔法一样,将蛋白质分解成一个个小小的分子,然后释放出一种叫做“生命”的信号。
这个信号就像是一场盛大的派对,吸引了无数观众——也就是我们手上的蛋白酶。
这些观众们兴奋地跳起了舞蹈,释放出了一个个小小的气泡,这就是所谓的“生命之舞”。
而那些能够捕捉到这些信号的蛋白酶,就像是最擅长跳舞的人,他们能够准确地识别出这些信号,并将它们转化为自己的能量。
这个过程就像是一场奇妙的化学反应,蛋白质就像是一个个小精灵,而福林酚试剂就像是一位神秘的魔法师。
当两者相遇时,就像是一部精彩的电影,充满了惊喜和激动人心的时刻。
而那些能够捕捉到这些信号的蛋白酶,就像是最勇敢的探险家,他们勇敢地探索未知的世界,寻找着生命的奥秘。
福林酚法测定蛋白酶活力的原理,就像是一场充满魔力的冒险之旅。
在这个过程中,你不仅能够感受到蛋白质的“生命力”,还能够体验到科学的魅力和趣味。
这就像是一场视觉和听觉的双重盛宴,让你在享受的也能够了解到更多的知识。
所以,当你下次看到福林酚试剂和蛋白酶时,不妨停下脚步,想象一下这场奇妙的化学反应。
或许你会发现,原来生活之中处处都有魔法的存在,而科学就是那把打开魔法世界的钥匙。
蛋白酶活力福林测定法
乙酸钠缓冲液 (pH=4.7)
称取4.10 g无水乙酸钠于900 mL水中,充分溶解后,加入3.00g 冰醋酸。再用 1 mol/L醋酸溶液或0.5 mol/L氢氧化钠溶液(B.3.5)调整pH=4.7±0.05,定容至 1000 mL。
磷酸盐缓冲液 (pH=6.0)
称取十二水合磷酸氢二钠(Na2HP04·12H20) 17.9g于800mL水中,充分溶解后, 0.1mol/L盐酸溶液调节pH至6.0±0.05,在加水定容至1000 mL。
3 试剂和溶液
本方法中所用的水,在未注明其他要求时,应符合 GB/T 6682 中水的规格,所用试剂,在未注明其 他规格时,均指分析纯(AR)。分析中所用标准滴定溶液、杂质测定用标准溶液、制剂及制品,在没有 注明其它要求时,均按 GB/T 601、GB/T 602、GB/T 603 的规定制备。 3.1 福林(Folin)试剂
µg/mL的L-酪氨酸标准储备溶液。
4 分析步骤
4.1 标准曲线的绘制 a) L-酪氨酸标准溶液:按表1 配制。 表1 L-酪氨酸标准溶液
管号
酪氨酸标准溶液的浓度
酪氨酸标准储备溶液(B.3.9)的体积
加水的体积
µg/mL
mL
mL
0
0
0
10
1
10
1
9
2
20
2
8
3
30
3
7
4
ห้องสมุดไป่ตู้
40
4
6
5
50
5
5
b) 分别取上述溶液各 1.00 mL(须做平行试验),各加碳酸钠溶液(B.3.3)5.00 mL、福林试剂使用 溶液(B.3.2)1.00 mL,振荡均匀,置于 40℃±0.2℃水浴中显色 20 min,取出,用分光光度计于波长 680 nm,10 mm 比色皿,以不含酪氨酸的 0 管为空白,分别测定其吸光度。以吸光度 A 为纵坐标,酪 氨酸的浓度 c 为横坐标,绘制标准曲线。
实验六 枯草杆菌蛋白酶活力的测定
实验六枯草杆菌蛋白酶活力的测定【实验目的】1. 观察并理解酶催化反应的基本规律。
2. 掌握枯草杆菌蛋白酶的基本性质及其测定方法。
3. 加深对酶底物浓度、酶浓度、温度、pH值等因素对酶活力影响的认识。
枯草杆菌蛋白酶是一种胃蛋白酶(pepsin)类酶,广泛存在于动物消化系统中。
它能水解蛋白质,对胃中蛋白质进行初步消化。
在实验中,我们可以通过枯草杆菌蛋白酶对蛋白质分子的水解作用来研究酶活力。
当枯草杆菌蛋白酶与底物蛋白质缓慢接触时,底物分子与酶分子结合,形成酶底物复合物。
酶通过水解底物的化学反应将底物分子分解成较小的肽链分子,最终生成氨基酸。
酶在每一次反应中保持不变,只有底物分子在反应过程中逐渐减少。
酶活力的测定基于酶对底物的水解能力。
实验中通过测定酶对底物的水解速度,进而推算出酶活力。
1. 枯草杆菌蛋白酶(Pepstatin;Sigma-Aldrich公司)2. BSA3. pH 2.0、pH4.0及 pH 6.0 缓冲液(各 100 mM)4. 显色剂 1%酸性比色液5. 离心管、酒精灯、1.5 mL离心管、定量移液器6. 紫外分光光度计1. 准备酶底物混合液将100 mg的BSA加入到10 mL的pH 2.0缓冲液中,经过充分溶解得到BSA 10 mg/mL 的底物混合液。
2. 准备不同浓度的酶测定溶液从枯草杆菌蛋白酶购买的酶粉中取出适量加入pH 2.0缓冲液中,加入一定比例的甘油制成10mg/mL 的酶浓度溶液。
通过逐步稀释酶液,制成0.01、0.03、0.05、0.07和0.1 mg/mL约 5 个不同浓度的酶测定溶液。
3. 测定酶活力将pH 6.0缓冲液从20 mL的烧杯中吸取3 mL加入每个1.5 mL离心管中标记成A、B、C、D、E。
向其中的 A 离心管中加入 0.4 mL 的酶浓度溶液, 加入X μL底物混合液赋为0.2,摇晃并放置于37℃浸泡水浴中,在不同时间点取出 0.2mL混合物分别放入另一组题号相同但无加酶的 1.5 mL 离心管中:底物控制酶底物反应液加等体积 pH6.0缓冲液停反应相同时间混合混合20minA0B0B1B2B3B4将反应液在 30度下水浴,10min 后放入 UV–3600 UV-VIS spectrophotometer测定比色后液体的吸光度。
蛋白质酶活力的测定
蛋白质酶活力的测定蛋白质酶活力的测定是生物化学实验中很重要的一项实验。
酶是一种催化剂,能够加速反应的速率而不参与反应本身。
蛋白质酶最显著的特点是具有酶活力,也就是能够催化特定的蛋白质分子降解为较小的分子。
测定蛋白质酶活力的目的是为了确定酶的催化效率,提高酶的纯度和测定酶的反应条件等方面提供依据。
一、实验原理蛋白质酶催化降解蛋白质分子时,会产生对应的氨基酸,这些氨基酸可以与试剂发生反应。
蛋白质酶的酶活力大小可以通过反应中产生的氨基酸数量来表示。
常用的测定方法有以下两种:1.二肽基(p-nitroaniline)法该方法的原理是利用蛋白质酶在一定的反应条件下(如适宜温度、pH值等)催化蛋白质水解生成相应的氨基酸,进而与试剂p-nitroaniline反应,生成黄色的产物p-nitroaniline,根据产生的p-nitroaniline的吸光度可以测定蛋白质酶的活力。
该方法具有操作简单、结果可靠、灵敏度高等优点。
但该方法并不适用所有类型的蛋白质酶,且试剂p-nitroaniline有毒性,需要避免吸入和接触。
2.钠二氢茚三硫酸法该方法的原理是利用蛋白质酶催化蛋白质水解产生的氨基酸与酚类试剂钠二氢茚三硫酸(TNBS)反应,生成黄色的产物,根据产生的色谱法或比色法来测定酶的活性。
该方法操作较复杂且对反应体系条件较为苛刻,但适用于大多数蛋白质酶。
二、实验步骤1.制备酶样溶液:取少量蛋白质酶,加入足量的缓冲液,并在适宜的催化条件下(如pH、温度等),静置30分钟左右。
2.制备底物溶液:将p-nitroaniline溶于缓冲液中,制备一定浓度的p-nitroaniline底物溶液。
3.将相应的底物溶液加入到酶样液中,保持一定的条件,如时间、温度、摇床等,反应20-30分钟。
4.添加止反应液,阻止反应继续进行。
5.测定反应液中产生的p-nitroaniline的吸光度,计算蛋白质酶的酶活力。
2.制备底物溶液:将相应的血红蛋白等蛋白质溶解于缓冲液中,制备一定浓度的蛋白质底物溶液。
蛋白酶比活力实验报告
蛋白酶比活力实验报告蛋白酶比活力实验报告引言:蛋白酶是一类能够水解蛋白质的酶,广泛存在于生物体内。
通过测定蛋白酶的比活力,可以评估其催化反应的速率和效率。
本实验旨在通过比较不同条件下蛋白酶的活力,探究影响蛋白酶活性的因素。
实验方法:1. 实验材料准备:- 蛋白酶溶液:从动物组织中提取的蛋白酶溶液,浓度为10 mg/mL。
- 底物溶液:使用明胶作为蛋白酶的底物,浓度为1%。
- 缓冲液:pH值为7.4的磷酸盐缓冲液。
- 试管:用于混合反应液的透明试管。
- 恒温水浴:用于控制反应温度的设备。
2. 实验步骤:- 步骤一:在不同温度下测定蛋白酶的活力。
- 将5 mL蛋白酶溶液和5 mL底物溶液混合,并放置于恒温水浴中,分别设置不同温度条件(如25℃、37℃、50℃)。
- 在反应开始后的1分钟、2分钟、3分钟等时间点,取出一定量的反应液,立即停止反应。
- 使用布拉德福法测定反应液中未被水解的底物浓度,计算蛋白酶的比活力。
- 步骤二:在不同pH条件下测定蛋白酶的活力。
- 在不同pH值的缓冲液中,重复上述步骤一的实验操作。
- 测定不同pH条件下蛋白酶的比活力,并比较其差异。
实验结果:1. 温度对蛋白酶活力的影响:- 在25℃、37℃和50℃下进行实验,测得蛋白酶的比活力分别为0.05 U/mg、0.1 U/mg和0.02 U/mg。
- 结果显示,蛋白酶的活力随着温度的升高而增加,但当温度过高时(如50℃),蛋白酶的活力反而下降。
2. pH值对蛋白酶活力的影响:- 在pH为7.4、8.0和9.0的缓冲液中进行实验,测得蛋白酶的比活力分别为0.08 U/mg、0.06 U/mg和0.04 U/mg。
- 结果显示,蛋白酶的活力在中性条件下(pH 7.4)最高,而在酸性和碱性条件下,蛋白酶的活力均降低。
讨论与结论:通过本实验,我们可以得出以下结论:1. 温度对蛋白酶活力有显著影响,适宜的温度可以提高蛋白酶的催化效率,但过高的温度会导致酶的变性,从而降低活力。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
蛋白酶活力的测定
一、实验目的
1、了解碱性蛋白酶活力测定的原理;
2、掌握碱性蛋白酶活力测定的方法。
二、实验原理
蛋白酶在一定条件下不仅能够水解蛋白质中的肽键,也能够水解酰胺键和酯键,因此可用蛋白质或人工合成的酰胺及酯类化合物作为底物来测定蛋白酶的活力。
本实验选用酪蛋白为底物,测定微生物蛋白酶水解肽键的活力。
酪蛋白经蛋白酶作用后,降解成相对分子质量较小的肽和氨基酸,在反应混合物中加入三氯醋酸溶液,相对分子质量较大的蛋白质和肽就沉淀下来,相对分子质量较小的肽和氨基酸仍留在溶液中,溶解于三氯醋酸溶液中的肽的数量正比于酶的数量和反应时间。
在280nm波长下测定溶液吸光度的增加,就可计算酶的活力。
三、实验步骤
1、将5%TCA溶液和1%酪蛋白溶液在37℃下保温。
2、取四支15ml具塞试管,分别标上记号A1,A0,B1和B0。
在A1和A0试管中各吸入0.20ml酶液,在B1和B0试管中各吸入0.40ml酶液,分别用0.2mol/L 磷酸盐缓冲液定容至2.00ml。
在A0和B0试管中各吸入6.00ml5%三氯醋酸溶液,上述四支试管都置于37℃水浴中保温。
3、在各试管中吸入2.00ml1%酪蛋白溶液,在37℃下保温10min(准确计时)后,再向A1和B1试管中吸入6.00ml5%三氯醋酸溶液。
4、奖试管从水浴中取出,在室温下放置1h,用少量上清液润湿滤纸后过滤,保留滤出液。
5、在280nm波长下,分别以A0和B0滤液为空白,测定A1和B1滤液的吸光度。
三、实验试剂
①微生物蛋白酶萃取液(0.01g/ml):称取1.0g酶制剂,加100ml蒸馏水搅拌30min,在4℃下离心分离后,将上层清夜置于冰箱中保存,使用前稀释一定倍数;
②0.02mol/L磷酸盐缓冲液(PH7.5);
③1%酪蛋白溶液:取1.0g酪蛋白,加100ml 0.2mol/L磷酸盐缓冲液
(PH7.5),加热并搅拌使它完全分散,然后置于冰箱中保存;
④5%三氯醋酸(TCA)溶液。
四、计算
1、在规定的实验条件下,以每分钟增加0.001吸光度定义为一个酶单位。
2、每克酶制剂中没活力的计算:
∆A × 1000 / (t × w) 酶活力单位/克酶制剂
式中,∆A——样品与空白吸光度差值(即A1和B1的吸光值);
t ——酶作用时间(本实验为10min); w——反应中酶的用量,g
五、说明
1、微生物蛋白酶粗提取液在较宽广的PH范围表现出活力,但是在接近中性条件下最有最高活力。
2、微生物蛋白酶在45℃以下可保持较长时间的稳定性。
六、数据记录与处理
A1 = 0.279 B1 = 0.573 酶含量为0.001g/ml
酶活力1 = ∆A × 1000 / (t × w)
= 0.279×1000/10/0.001/0.20=1.395×105酶活力单位/克酶制剂酶活力2= ∆A × 1000 / (t × w)
= 0.573×1000/10/0.001/0.40=1.4325×105酶活力单位/克酶制剂平均值= (1.395×105 + 1.4325×105)=141375酶活力单位/克酶制剂
平均相对相差= (143250 - 139500)/141375 × 100%=2.65%
七、思考题
1、蛋白酶有哪几类?
答:①按蛋白酶水解蛋白质的方式:A内肽酶:切开蛋白质分子内部肽键,生成相对分子质量较小的多肽类;B外肽酶:切开蛋白质或多肽分子氨基或羧基末端的肽键,而游离出氨基酸的酶类;C水解蛋白质或多肽的酯键;D水解蛋白质或多肽的酰胺键。
②按酶的来源可分为:动物蛋白酶、植物蛋白酶、微生物蛋白酶
③微生物蛋白酶又可分为:细菌蛋白酶、霉菌蛋白酶、酵母蛋白酶和放线菌蛋白酶
④按蛋白酶作用的最适PH可以分为(A)PH2.5~5.0的酸性蛋白酶,(B)
PH9.5~10.5的碱性蛋白酶,(C)PH7~8的中性蛋白酶
2、影响酶活力的因素有哪些?
答:酶活力是酶催化某一化学反应的速率来表示的。
酶活力的大小即酶含量的多少,可以用每克酶制剂或每毫升酶制剂含有多少酶单位来表示,酶活力的测定也就是测定酶促反应的速率。
①酶浓度对酶活力的影响:酶促反应速率与酶分子的浓度呈正比,在一定范围内,当底物分子浓度足够时,酶分子越多,底物转化的速度越快。
②底物浓度对酶活力的影响:若酶的浓度为定值,底物的起始浓度越低时,酶促反应速度与底物浓度呈正比,即随地物浓度的增加而增加。
当所有的酶与底物结合生成中间产物后,即使再增加底物浓度,中间产物浓度也不会增加,酶促反应速度也不会增加。
③温度对酶活力的影响:在适宜的温度范围内,酶促反应速度随温度升高而增加,超过最适反应温度,酶活力将会下降。
④PH对酶活力的影响:酶在最适PH范围内表现出活性,大于或小于最适PH,都会降低酶活性。
⑤激活剂对酶活力的影响:某些无机阳离子、阴离子、有机化合物可作为激活剂,能够激活酶,使其表现出催化活性或强化其催化活性。
⑥抑制剂对酶活力的影响:酶的抑制剂能够减弱、抑制甚至破坏酶的活力,它可降低酶促反应速度。
3、使用紫外分光光度计时应注意哪些问题?
答:①使用的比色皿必须洁净,并注意配对使用。
手指应拿毛玻璃面的两侧,装盛样品量以2/3为度。
透光面要用擦镜纸擦拭干净。
②比色皿使用前应用试样润洗,使用后应立即用自来水冲洗干净,倒置晾干。
③测定溶液的吸光度值应在0.1~0.7间最符合吸收定律,线性好,读数误差小。
④吸光值在测定前应用空白溶液校正调零,再进行测定。
