18.4 波尔的原子模型
18.4 波尔的原子模型 课件1

[例1]
练习:对玻尔理论的下列说法中,正确的是 ( ) A、继承了卢瑟福的原子模型,但对原子能 量和电子轨道引入了量子化假设 B、对经典电磁理论中关于“做加速运动的 电荷要辐射电磁波”的观点表示赞同 C、用能量转化与守恒建立了原子发光频率 与原子能量变化之间的定量关系 D、玻尔的两个公式是在他的理论基础上利 用经典电磁理论和牛顿力学计算出来的
2、能量量子化假设 : 电子在不同的轨道运动对应着 不同的状态,原子在不同的状 n 量子数 E /eV 态中具有不同的能量,即能量 ∞ E ∞ 是量子化的
5 4 3 2 1
E5 E4 E3 E2
(1)能级:这些量子化的能量值叫做能级. (2)定态:在这些状态中原子是稳的, 电
子虽然绕核运动,但并不向外辐射能量。 这些状态叫定态。
h v= Em -En (m>n)
反之电子吸收光子时会 从能量较低的轨道跃迁到能 量较高的轨道,同样满足上 式关系
1
-13.6
?
能级图
问题:氢原子的电子从 n=3的轨道,跃迁到基态发射的 光子频率为多少?
二、玻尔理论对氢光谱的解释
n E/eV ∞--------- 0
5 4 3
2
赖曼系(紫外线)
巴耳末系(可见
被氢原子吸收全部或部分动能而使氢原子向高能级跃迁,
二、玻尔理论对氢光谱的解释
思考与讨论: 根据氢原子的能级图,说明:
(1)氢原子从高能级向低能级跃迁时,发出的光子的频率如 何计算? (2)如图所示,是氢原子的能级图,若有一群处于 n=4 的激 发态的氢原子向低能级跃迁时能辐射出多少种频率不同的 光子?
?
一、玻尔的原子模型 1、轨道量子化假设: 围绕原子核运动的电子轨道半径只
人教版高二物理选修3-5 18.4 波尔的原子模型 课件(17张PPT)

行
星
轨
道•围绕原子核运动的电子轨道半径只能是
半某些分立的数值。
径•且电子在这些轨道上绕核的转动是稳定
1
是的,不产生电磁辐射 连
2
3 4
续
的
一、波尔原子模型的三个假设
1,电子轨道量子化
针对原子核式结构模型提出
2,原子能量量子化
针对原子的稳定性提出
能级:量子化的能量值 定态:原子中具有确定能量的稳定状态
基态:能量最低的状态 E (离核最近)
激发态:其他的状态 E E E
v
m r
5 4 3
量2 子 数
1
能级图
EEE345
激发态
E2
E1——基态
vm
r
轨道图
一、波尔原子模型的三个假设
1,电子轨道量子化
针对原子核式结构模型提出
2,原子能量量子化
针对原子的稳定性提出
3,跃迁条件(频率条件)
针对原子光谱是线状谱提出
察
立
思想:必与须彻底放弃经典概念? 出科现矛盾
α粒关子键散射:实验用实验电子否定云概念汤 瓜姆 模取孙 型代的西经典的建立轨道学 模 型 概卢式念瑟结福构的模核型
所
出现提矛盾
获 得 原子稳定性事实 否定
氢光谱实验
的
卢瑟福的核 式结构模型
? 出
建立 科 玻尔模型 出现学矛盾
事
假
实 复杂(氦)原电子在某处否单定位体积内出玻现尔的模概型率——电建子立云
e
v
F
r + e
认 终落在原子核上,而使 为 原子变得不稳定.
e
事
实
e +
经 由于电子轨道的变 典 化是连续的,辐射 理 电磁波的频率等于 论 绕核运动的频率, 认 连续变化,原子光 为 谱应该是连续光谱
18.4玻尔的原子模型
在普朗克关于黑体辐射的量子论和爱因斯坦关于光子 概念的启发下,波尔于1913年把微观世界中物理量取 分立值的观念应用到原子系统,提出了自己的原子结 构假说。
他是卢瑟福的学生,在其影响下具有严谨的科学态 度,勤奋好学,平易近人,后来很多的科学家都有 纷纷来到他身边工作。当有人问他,为什么能吸引 那么多科学家来到他身边工作时,他回答说:“因 为我不怕在青年面前暴露自已的愚蠢”。这种坦率 和实事求是的态度是使当时他领导的哥本哈根理论 研究所永远充满活力,兴旺发达的原因。
F、原子从一种定态跃迁到另一种定态时,一定是辐射 一定频率的光子
G、原子的每一个能量状态都对应一个电子轨道,并且 这些轨道是不连续的
根据玻尔理论,氢原子中,能级数n越大,则下列 说法中正确的是 ACD
A、电子轨道半径越大 B、核外电子的速率越大 C、氢原子能级的能量越大 D、核外电子的电势能越大
“大量”和“一个”的区别
0
则其他的能级就是负的。
-0.54 -0.85 -1.51
-3.4
1
基态
-13.6
波尔理论对氢光谱的解释
n
E/eV
∞----------------- 0
5
-0.54
4
-0.85
3
-1.51
激 发
2
-3.4
态β
Hα
n=1 n=2 n=3 n=4
n=5 n=6
巴尔末系 氢原子发
道引入了量子化假设
ACDEG
B、对经典电磁理论中关于“做加速运动的电荷要辐射 电磁波”的观点表示赞同
C、用能量转化与守恒建立了原子发光频率与原子能量 变化之间的定量关系
D、原子只能处于一系列不连续的状态中,每个状态都 对应一定的能量。
选3-5-18.4玻尔的原子模型教案

18.4玻尔的原子模型★新课标要求(一)知识与技能1.了解玻尔原子理论的主要内容。
2.了解能级、能量量子化以及基态、激发态的概念。
(二)过程与方法通过玻尔理论的学习,进一步了解氢光谱的产生。
(三)情感、态度与价值观培养我们对科学的探究精神,养成独立自主、勇于创新的精神。
★教学重点玻尔原子理论的基本假设。
★教学难点玻尔理论对氢光谱的解释。
★教学方法教师启发、引导,学生讨论、交流。
★教学用具:投影片,多媒体辅助教学设备★课时安排1 课时★教学过程(一)引入新课复习提问:1.α粒子散射实验的现象是什么?2.原子核式结构学说的内容是什么?3.卢瑟福原子核式结构学说与经典电磁理论的矛盾教师:为了解决上述矛盾,丹麦物理学家玻尔,在1913年提出了自己的原子结构假说。
(二)进行新课1.玻尔的原子理论(1)能级(定态)假设:原子只能处于一系列不连续的能量状态中,在这些状态中原子是稳定的,电子虽然绕核运动,但并不向外辐射能量。
这些状态叫定态。
(本假设是针对原子稳定性提出的)(2)跃迁假设:电热管原子从一种定态(设能量为E n )跃迁到另一种定态(设能量为E m )时,它辐射(或吸收)一定频率的光子,光子的能量由这两种定态的能量差决定,即 n m E E h -=ν(h 为普朗克恒量)(本假设针对线状谱提出)(3)轨道量子化假设:原子的不同能量状态跟电子沿不同的圆形轨道绕核运动相对应。
原子的定态是不连续的,因此电子的可能轨道的分布也是不连续的。
(针对原子核式模型提出,是能级假设的补充)2.玻尔根据经典电磁理论和牛顿力学计算出氢原子的电子的各条可能轨道半径和电子在各条轨道上运动时的能量(包括动能和势能)公式:轨道半径:12r n r n = n=1,2,3……能 量: 121E nE n = n=1,2,3……式中r 1、E 1、分别代表第一条(即离核最近的)可能轨道的半径和电子在这条轨道上运动时的能量,r n 、E n 分别代表第n 条可能轨道的半径和电子在第n 条轨道上运动时的能量,n 是正整数,叫量子数。
18.4 玻尔的原子模型

18.4 玻尔的原子模型教学目标(1)了解玻尔原子理论的主要内容;(2)了解能级、能量量子化以及基态、激发态的概念。
引入新课提问:(1)α粒子散射实验的现象是什么?(2)原子核式结构学说的内容是什么?(3)卢瑟福原子核式结构学说与经典电磁理论的矛盾?为了解决上述矛盾,丹麦物理学家玻尔,在1913年提出了自己的原子结构假说。
一、玻尔的原子理论1.巴耳末公式1885年,瑞士物理学家巴耳末首先发现氢原子光谱中可见光区的四条谱线的波长,可用一经验公式来表示:n=3,4,5……式中为波长,R=1.0967758×10 7米-1称为里德伯恒量,上式称为巴耳末公式。
2.里德伯公式1889年,里德伯发现氢原子光谱德所有谱线波长可用一个普通的经验公式表示出来:式中n=m+1,m+2,m+3……,上式称为里德伯公式。
对于每一个m,上式可构成一个光谱系:m=1,n=2,3,4……赖曼系(紫外区)m=2,n=3,4,5……巴尔末系(可见光区)m=3,n=4,5,6……帕邢系(红外区)m=4,n=5,6,7……布喇开系(远红外区)3.玻尔的氢原子理论卢瑟福的原子核式结构模型能成功地解释粒子散射实验,但无法解释原子的稳定性和原子光谱是明线光谱等问题。
为此,1913年玻尔提出了开创性的三个假设:(1)定态(能级)假设:原子只能处于一系列不连续的能量的状态中,在这些状态中原子是稳定,电子虽然绕原子核做圆周运动,但并不向外辐射能量,这些状态叫定态。
(本假设是针对原子稳定性提出的)(2)跃迁假设:电子从一个定态轨道跃迁到另一个定态轨道上时,会辐射或吸收一定频率的光子,光子的能量由这两种定态的能量差来决定,即(h为普朗克恒量)(本假设针对线状谱提出)(3)角动量量子化假设:电子绕核运动,其轨道半径不是任意的,只有电子的轨道角动量(轨道半径r和电子动量mv的乘积)满足下列条件的轨道才是可能的:n=1,2,3……式中的n是正整数,称为量子数。
18.4玻尔的原子模型h
人们早在了解原子内部结构之前就已经观 察到了气体光谱,不过那时候无法解释为什么气 体光谱只有几条互不相连的特定谱线
经 典 理 论 认 为 事 实
电子绕核运动将不断 向外辐射电磁波,电 子损失了能量,其轨 道半径不断缩小,最 终落在原子核上,而使 原子变得不稳定.
注意夫兰克一赫兹实验 ①方法和原理:使加速的电子通过低压汞蒸气,与汞原子 发生碰撞。测量电子损失的能量和汞原子获得的能量。
②实验的结果,表现在接收极电流随K—G间电压的 变化关系图,会分析此图,是做出结论的关键。 证明了汞原子能量量子化。该实 验卓越的设计思想和实验技巧, 以及它在建立原子量子学说方面 做出的贡献,受到人们的赞誉。
拓展与提高
否定 建立
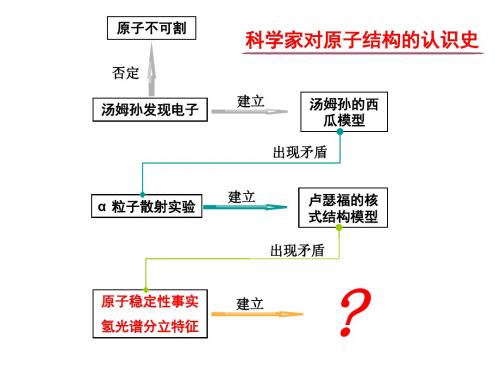
原子结构的认识史
汤姆孙的西 建 原子不可割 观 汤姆孙发现电子 瓜模型 怎样修改玻尔模型? 立 察 出现矛盾 科 思想:必须彻底放弃经典概念? 与 学 实 否定 汤姆孙的西 卢瑟福的核 建立 关键:用电子云概念取代经典的轨道概念 α 粒子散射实验 模 瓜模型 式结构模型 验 型 出现矛盾 所 提 获 出 原子稳定性事实 卢瑟福的核 建立 得 否定 玻尔模型 式结构模型 科 氢光谱实验 的 学 出现矛盾 假 事 否定 量子力学 建立 玻尔模型 复杂(氦)原子 电子在某处单位体积内出现的概率——电子云 说 理论 实 光谱
根据:E=hv,λ=c/v
n=1 n=2 n=3 n=4 n=5
又Eδ =1.89eV= 3.03 ×10-19J 所以, λ δ=hc/ Eδ = 6.63×10-34 ×3.0 ×10-8 / 3.03 ×10-19J
n=6
= 6.57 ×10-7(m)
18.4玻尔的原子模型 2
讨论回答其他几个问题:
问题3:试解释原子光谱为什么是线状光谱?
问题4:不同元素的原子为什么具有不同的特征谱线?
四、玻尔模型的局限性
玻尔理论成功的解释并预言了氢原子辐射
的电磁波的问题,但是也有它的局限性.
在解决核外电子的运动时 成功引入了量子化的观念
同时又应用了“粒子、 轨道”等经典概念和
有关牛顿力学规律
-3.4
-13.6
赖曼系
三、玻尔理论对氢原子的其他谱线系的解释
E/eV ∞ --------- 0
赖曼系(紫外线)
n
5 4 3 2
-0.54 -0.85 -1.51 -3.4
巴耳末系(可见光)
N=1 N=2 N=3 N=4 N=5 N=6
帕邢系(红外线)
布喇开系
逢德系
成功解释了氢光谱的所有谱线。
1
n=1 n=2 n=3 n=4 n=5
根据:Em-En=hv,λ=c/v
又Eδ =1.89eV= 3.03 ×10-19J 所以, λ δ=hc/ Eδ = 6.63×10-34 ×3.0 ×10-8 / 3.03 ×10-19J = 6.57 ×10-7(m)
n=6
三.玻尔理论对氢光谱的解释
Hδ
除了氢原子光谱外,在解决其他问 题上遇到了很大的困难.
量子化条件的 引进没有适当 的理论解释。 氦原子光谱
拓展与提高
否定 建立
原子结构的认识史
汤姆孙的西 建 原子不可割 观 汤姆孙发现电子 瓜模型 怎样修改玻尔模型? 立 察 出现矛盾 科 思想:必须彻底放弃经典概念? 与 学 实 否定 汤姆孙的西 卢瑟福的核 建立 关键:用电子云概念取代经典的轨道概念 α 粒子散射实验 模 瓜模型 式结构模型 验 型 出现矛盾 所 提 获 出 原子稳定性事实 卢瑟福的核 建立 得 否定 玻尔模型 式结构模型 科 氢光谱实验 的 学 出现矛盾 假 事 否定 量子力学 建立 电子在某处单位体积内出现的概率 玻尔模型 ——电子云 复杂(氦)原子 说 理论 实 光谱
玻尔的原子模型
针对原子的稳定性提出
一、玻尔原子模型的基本假设
三个重要假设
能级:量子化的能量值。 定态:原子中具有确定能量的稳定状态 基态:能量最低的状态(离核最近) 激发态:其他的状态
E∞
5 4 3
量 子 数
E5 E4 E3
激发态
1
2
3
2
E2
轨道与能级相对应
1 E1
——基态
能级图
一、玻尔原子模型的基本假设
立的数值。
•且电子在这些轨道上绕 核的转动是稳定的,不产 生电磁辐射,也就是说, 电子的轨道也是量子化的
一、玻尔原子模型的基本假设
三个重要假设
电子在不同的轨道 上运动,原子处于不同 的状态.玻尔指出,原 子在不同的状态中具有 不同的能量,所以原子 的能量也是量子化的。 在这些状态中原子是稳 定的。
问题1:巴尔末公式有正整数n出现,这里我们也用正整数n来 标志氢原子的能级。它们之间是否有某种关系?
1 1 1 巴尔末公式: R λ 22 n 2
n 3, 4,5,
0 -0.54 eV -0.85 eV -1.51 eV
氢 原 子 能 级 跃 迁 与 光 谱 图
说明3. 原子的跃迁问题 对于量子数为n的一 群氢原子,向较低的激 发态或基态跃迁时,可 能产生的谱线条数为 N=
E/eV ∞ --------- 0
5 4 3 2 -0.54 -0.85 -1.51 -3.4
n
n( n 1) 2. 跃迁与电离的问题
原子跃迁时.不管是吸收还是辐射光 子,其光子的能量都必须等于这两个能级 的能量差.若想把处于某一定态上的原子 的电子电离出去,就需要给原子一定的能 量.如基态氢原子电离,其电离能为13.6 eV,只要能量等于或大于13.6 eV的光子 都能被基态氢原子吸收而电离,只不过入 射光子的能量越大,原子电离后产生的电 子具有的动能越大.
高中物理人教版选修3-5 18.4 波尔的原子模型
18.4 玻尔的原子模型(人教版)★中学物理学科核心素养玻尔原子理论的基本假设★教学难点玻尔理论对氢光谱的说明。
★教学方法老师启发、引导,学生探讨、沟通。
★教学用具:投影片,多媒体协助教学设备★课时支配1 课时★教学过程(一)引入新课依据卢瑟福的原子核式结构模型,以及经典物理学,我们知道核外的电子在库仑力的作用下将绕原子核高速旋转。
在前面的学习中,我们知道运动的电子可以形成等效电流,→又依据电流磁效应,我们可以推导出这个高速运动的电子四周会产生周期性变更的电磁场,从而向外辐射电磁波→导致原子的能量削减→,这个能量削减,我们可以看成是电子的动能削减了,那电子的动能削减了,速度就要变少,速度变小了,电子将半径减小的向心运动,最终落入原子核中,这样的话原子结构将是不稳定的。
但是事实上这个理论推导结果跟试验是不符合的,因为我们原子结构是稳定的,这是经典物理学没有方法说明的,这是第一个冲突的地方师:其次,假如做这样的向心运动,向外辐射的电磁波的能量是连续的还是分立的生:连续的师:这与试验符合吗?生:不符合,因为我们知道原子光谱是不连续的师:所以,经典的电磁理论不能说明核外的电子的运动状况和原子的稳定性.须要新的理论来说明。
老师:在普朗克关于黑体辐射的量子论和爱因斯坦关于光子概念的启发下,波尔于1913年把量子化这个观念应用到原子系统,提出了自己的原子结构假说。
(二)进行新课1.玻尔的原子理论(1)轨道量子化假设:原子中的电子在库仑力的作用下,绕原子核做圆周运动但是,电子轨道半径不是随意的,只有当半径大小符合肯定条件时,这样的轨道才是可能的。
即电子的轨道是量子化的。
电子在这些轨道上绕核的转动是稳定的,不产生电磁辐射。
(2)能级(定态)假设:当电子在不同轨道上运动时,原子处于不同状态,具有不同能量,所以原子能量也是量子化的。
这些量子化的能量值叫能级;原子中这些具有确定能量的稳定状态叫定态。
能量最低的状态叫基态,其他状态叫激发态。
18.4 波尔的原子模型
同时又应用了“粒子、 轨道”等经典概念和 有关牛顿力学规律
除了氢原子光谱外,在解决其他 问题上遇到了很大的困难.
氦原子光谱
量子化条件的引进没有 适当的理论解释。
电子在某处单位体积内出 现的概率——电子云
科学足迹
夫兰克—赫兹实验的历史背景及意义:
1911年,卢瑟福根据α 粒子散射实验,提出了原 子核式结构模型。1913年,玻尔将普朗克量子假说运用 到原子核式结构模型,建立了与经典理论相违背的两个 重要概念:原子定态能级和能级跃迁概念。电子在能级 之间跃迁时伴随电磁波的吸收和发射,电磁波频率的大 小取决于原子所处两定态能级间的能量差。随着英国物 理学家埃万斯对光谱的研究,玻尔理论被确立。但是任 何重要的物理规律都必须得到至少两种独立的实验方法 的验证。随后,在1914年,德国科学家夫兰克和他的助 手赫兹采用电子与稀薄气体中原子碰撞的方法(与光谱 研究相独立),简单而巧妙地直接证实了原子能级的存 在,从而为玻尔原子理论提供了有力的证据。
3、频率条件:电子从一种定态轨道(设能量为Em)跃 迁到另一种定态(设能量为En)时,它辐射(或吸收)
一定频率的光子,光子的能量由这两种定态的能量差 决定,即(本假设针对线状谱提出)
h v Em En
玻尔
1
43 2
定态 假设
4 3 21
跃迁
43 2
E4
假设 E4
E3
E3 E2
E2
1
E1 E1
轨道
假设 hν=E初 – E未
1925年,由于他二人的卓越贡献,他们获得了当 年的诺贝尔物理学奖(1926年于德国洛丁根补发)。 夫兰克-赫兹实验至今仍是探索原子内部结构的主要 手段之一。所以,在近代物理实验中,仍把它作为传 统的经典实验。
