中考复习《溶液》
考点07 溶液及其质量分数(课件)2023年中考化学一轮复习

两物质在该点温度下的溶解度相等
70
考点5、溶解度和溶解度曲线
陡升型
大部分固体物质, 其溶解度随温度变化影响较大,如:KNO3
线
缓升型
少数物质
其溶解度随温度变化影响较小,如:氯化钠
下降型
极少数物质 随温度升高溶解度反而减小,如:熟石灰
考点5、溶解度和溶解度曲线
曲线下方的面上的点
面
表示对应温度下该物质的不饱和溶液
2.t4℃时,将25gA物质加入到50g水中,充分溶 解,得到A的__饱__和__(饱和/不饱和)溶液__7_0__g。 溶液的溶质的质量分数为__2_0_/_7__0_。(只列算式)
技巧三:计算溶液质量或浓度时,应先利用__溶___解__度__判断溶质是否 完全溶解,未溶解或析出的不算作溶质质量,不能计入溶液总质量。
A. t1℃时,50g甲能完全溶于50g水 C. t2℃时,丙和丁的溶解度相同
B. 乙的溶解度随温度升高而降低 D. 加压或升温能增加戊的溶解度
真题演练
4.(2020.广州)硝酸钾的溶解度曲线如图所示,将100g60℃的KNO3饱和 溶液分别进行如下操作后,所得溶液与原溶液相比,变化结果完全正确的是
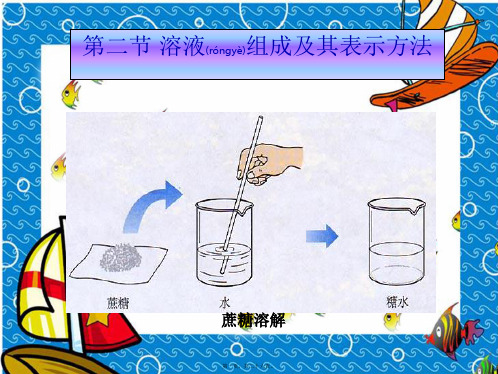
组成: 溶剂:_能__溶___解__其__他__物__质___的__物__质__(__1_种_ ) 水是常用的溶剂。酒精、汽油也可作溶剂。
【易错提醒】1.凡是均一稳定的液体都是溶液( × )例如:水。 2.冰溶于水形成溶液。( × )
考点2、除污方法及原理
1.乳化作用
洗洁精乳化油渍
2.溶解
汽油溶解油渍
I2
H2O H2O H2O H2O H2O C2H5OH
考点3、溶解时的吸热、放热现象
中考复习溶液

学科教师辅导学案进门测试1.20C时,溶解度在10g以上的物质为易溶物质;溶解度在1~10g的物质为可溶物质;溶解度在0.01~1g的物质为微溶物质;溶解度小于0.01g的物质为难溶物质。
查阅资料可知硝酸钾在不同温度下的溶解度如表。
下列说法正确的是()℃时可以配制出溶质质量分数为13.3%的硝酸钾溶液℃时硝酸钾是可溶物质C.在0-100℃之间,硝酸钾的溶解度随温度的升高而增大℃的饱和硝酸钾溶液降温至20℃会变成不饱和溶液2.向盛有等量水的烧杯中加入等质量的氯化钾固体,充分溶解后现象如图所示。
下列说法错误的是()A.向 A 烧杯中加水可以继续溶解剩余固体 B.B 烧杯中一定是氯化钾不饱和溶液C.两杯溶液溶质质量分数关系:A<B D.氯化钾的溶解度随温度升高而增大3.如图所示,用恒温蒸发氯化钠溶液模拟海水晒盐的过程,已知图②中的溶液恰好是氯化钠的饱和溶液,则下列说法错误的是()A.图①和图②中溶液的溶质质量相等B.图②和图④中溶液的溶质质量分数相等C.图①和图④溶解度保持相等D.质量分数大小关系①<②<③=④4.下列有关溶液的说法正确的是()A.同一种溶质的水溶液,饱和溶液中溶质的质量分数一定大于不饱和溶液中溶质的质量分数B.③中的溶液一定是不饱和溶液C.溶液②的溶质质量分数大于溶液③的溶质质量分数D.若②中的溶液恒温蒸发,溶质的质量分数不变5.用MgCl2溶液喷洒路面可融雪。
已知20°C时,MgCl2的溶解度为54.6克,若按表中数据配制溶液(温度均为20°C),则下列说法正确的是()序号①②③④MgCl2的质量/克40 50 60 70H2O的质量/克100 100 100 100A.①所得溶液,其溶质和溶剂的质量比为2:7B.②所得溶液,其溶质的质量分数为50%C.③④所得溶液均为20°C时MgCl2的饱和溶液D.③所得溶液的溶质质量分数小于④所得溶液6.如图是KNO3的溶解度曲线,在20℃时进行了如下实验,则下列说法不正确的是()A.B、E为饱和溶液B.质量分数的大小关系为D>C>B=E>AC.D溶液中最多还能溶解KNO325.5gD.D的质量分数为52.38%7.20℃时,将45g氯化钠均分成五份,依次加入到盛有100g水的烧杯中,充分溶解。
中考专题复习-第8课时溶液的分类溶解度

·人教版
│ 考点聚焦
考点3 气体的溶解度
1.101 kPa 时,某 1.概念: 是指在一定温度下,压强为__________ 1ห้องสมุดไป่ตู้气体溶解在 ______ 体积的水中达到 ________ 饱和 状态时的气体 体积 。 ________ 2.影响因素: ①内因:气体的性质;②外因:主要是温 越小 ,压强越大, 度和压强。温度越高,气体的溶解度 ________ 越大 。 气体的溶解度________
·人教版
│ 考点聚焦
[注意] ①某饱和溶液是对相应的溶质不能继续溶解的溶液, 但还可以溶解其他的物质。如某饱和食盐水中还可以继续溶解 硝酸钾固体。 ②对多数固体溶质而言,通过降低温度可实现由不饱和溶 液向饱和溶液的转化,但对溶解度随温度升高而减小的物质 ( 如气体、熟石灰等 ) ,则需升高温度将其不饱和溶液转化为饱 和溶液。 ③对某饱和溶液进行降温或蒸发溶剂,往往会有溶质从溶 液中以晶体形式析出。
·人教版
│ 归类示例
[解析] 接近饱和的硝酸钾溶液即为硝酸钾的不饱和 溶液,向其中加少量的硝酸钾晶体或降温或蒸发溶剂 均可使其变成饱和溶液。
·人教版
│ 考点聚焦
[注意] ①物质溶解度大小与溶质质量、溶剂质量的多少无 关,在一定温度下,某物质的溶解度是一个定值。 ②判断某一数值是不是溶解度,关键是看它是否同时满足 四个条件“一定温度、100 g 溶剂、饱和状态、溶解的溶质质 量”。 ③只有在饱和溶液中才存在如下关系: 溶解度 溶质质量 溶解度 溶质质量 = ; = 100 g 溶剂质量 溶解度+100 g 溶液质量
·人教版
│ 考点聚焦
2.判断方法 不再减少 (1)当溶液中有固态溶质时,若固体__________________ , 减少 那么该溶液是饱和的,若固体________ ,那么该溶液是不 饱和的; (2) 当溶液中没有固态溶质时,向溶液中加入少量相应的 不再溶解 , 则 原 溶 液 是 饱 和 的 , 若 溶 质 溶 质 , 若 溶 质 __________ 继续溶解 ,则原溶液是不饱和的。 __________ (3) 当溶液中有晶体析出时,析出晶体后的溶液一定是饱 和溶液。
(安徽省)中考化学总复习课件【第15讲】溶液的形成及溶解度

【例 2】(2014,安徽 )甲、乙两种物质的溶解度曲线如下图所 示。t 1℃时, 在两支试管中分别加入等质量的两种物质,再分别加 入等量的蒸馏水 ,充分振荡后 ,试管底部均有未溶解的固体。再将 两支试管升温到 t2℃(不考虑溶剂质量变化 )。由 t1℃到 t2℃的过程 中,下列说法正确的是( )
A.甲溶液中溶质的质量分数减小 B.装有乙物质的试管中剩余的固体增多 C.甲、乙两种物质的溶解度都增大 D.两支试管里剩余的固体质量相同
[答案]B 解析:本题考查溶解度曲线的应ห้องสมุดไป่ตู้,难度较大。由图中 甲、乙两物质的溶解度曲线可知:在t1 ℃时,甲、乙两种 物质的溶解度相等、甲的溶解度随温度的升高而增大、乙 的溶解度随温度的升高而降低;t1 ℃时两种物质均形成了 饱和溶液并且容器底部有固体剩余,将两种物质在t1 ℃时 剩余有未溶解固体的饱和溶液升温到t2 ℃后,盛甲溶液的 试管中的溶质会继续溶解,其溶质质量分数会增大,盛乙 溶液的试管中的饱和溶液会随温度的升高而有乙晶体析出 ,使乙试管中固体增多,固体质量变大。
[答案 ]D 解析:t 1 ℃时 ,甲、乙的溶解度相等 ,A 正确; t1 ℃时甲、乙的溶 解度为 30 g,故 30 g 乙加到 100 g 水中刚好形成饱和溶液 ,B 正确; t2 ℃时各 100 g 饱和溶液降温至 t1 ℃析出晶体甲比乙多 ,C 正确; t2 ℃时 75 g 甲的饱和溶液中所含溶质为 25 g,向 t2 ℃ 75 g 甲的饱 25 和溶液加 100 g 水所得溶质质量分数为 ×100%≈ 14.3%, D 75+ 100 错。故选 D。
溶解时的吸热或放热现象
1.过程分析 (1)溶质分子(或离子)_向水中扩散__,这是一个_吸收__热 量的过程,属于物理变化。 (2)溶质分子(或离子)与_水分子__作用,形成_水合分子__( 或_水合离子 __) , 这是一个_放出 __热量的过程 ,属于化学 变化。 2.溶解时的吸热或放热现象 (1) 扩散吸热>水合放热 , 溶液温度 _ 下降 __ , 如 NH4NO3 溶解。 (2)扩散吸热=水合放热,溶液温度_不变__,如NaCl溶解 。 (3)扩散吸热<水合放热,溶液温度_升高__,如NaOH、 H2SO4溶解。
2023年中考化学总复习:第九单元溶液(一)

第1页(共7
页)2023年中考化学总复习:第九单元
溶液(一)
一、单项选择题(共18小题)
1.下列物质加入足量的水,充分搅拌后能形成溶液的是(
)A .氯化钠B .碘C .面粉D .汽油
2.若衣服上不慎沾上油污,可用洗涤剂或汽油除去,两者的去污原理分别为(
)A .乳化、溶解B .溶解、乳化C .溶解、溶解D .乳化、乳化
3.王亚平在太空做了油和水“难分难舍”的神奇实验:她用力摇晃装有油和水的瓶子,让油水充分混合、静置,发现油水不分层。
下列说法不正确的是(
)
A .太空中水不能作溶剂
B .在地面油水混合物会产生分层现象
C .在不同环境中同一实验可能现象不同
D .在地面向油水混合物中加入洗涤剂会产生乳化现象
4.科学探究通常需要控制变量,根据生活经验,当我们探究食盐颗粒大小对溶解快慢的影响时,涉及以下因素。
①水量多少
②温度高低②是否搅拌,你认为需要控制的因素有(
)A .①B .②C .③D .全部5.如图所示,向小试管中分别加入下列一定量的物质,右侧U 型管中的液面a 高于b ,该物质是()
A .氢氧化钠固体
B .浓硫酸
C .氯化钠晶体
D .硝酸铵晶体
6.下列属于乳浊液的是()
A .蒸馏水
B .娃哈哈纯净水
C .伊利纯牛奶
D .统一果粒橙(果肉型)7.某温度时,将20gKNO 3溶解在100g 水中恰好饱和,关于该饱和溶液的叙述不正确的是()
A .m (溶质):m (溶剂)=20:100
B .升温可继续溶解部分溶质。
中考化学冲刺总复习 8.2《溶液组成及其表示方法》课件
12%
32%
第十五页,共二十六页。
请你思考
谢谢合作!!
第十六页,共二十六页。
三、溶液的溶质质量(zhìliàng)分数的计算
1、可以作为溶质的是
D
A.只有固体 B.只有液体
C.只有气体 D.气、液、固体均可
2、20%的蔗糖溶液中溶质、溶剂(róngjì)、溶液之间的质量比是
第十二页,共二十六页。
例2、
在农业生产上,常用质量分数为10%-
20%氯化钠溶液(róngyè)来选种。现要配制 150KG质量分数为16%的氯化钠溶液,需要 氯化钠和水的质量各是多少?
解:溶质的质量=150KG×16%
=24KG
溶剂(ró ngjì)的质量=150KG-24KG
=126KG 答:配制150KG质量分数为16%的氯化钠溶液
溶的液一组种成方法(fāngfǎ),其数学意义是
之比。现有溶质质质量量与分溶数液为质20量%的氯化钠溶液,其20%表示的含义
就是每 g氯化钠溶液中含有氯化钠 g。
100
20
5、医疗上的生理盐水是溶质质量(zhìliàng)分数约为0.9%的氯化钠
溶液,现用1000g生理盐水给某病人输液,则有 克氯化9 钠和
A. 1∶4∶5
B. 5∶4∶1
A
C. 4∶1∶5
D. 20∶80∶100
3、在常温下,向100g5%的氯化钠溶液中加入5g硝酸钾粉末完全 溶解后,氯化钠的溶质质量分数将
A.增大 B.减小 C.不变 D.无法确定 B
第十七页,共二十六页。
三、溶液的溶质质量分数(fēnshù)的计算
4、溶质质量分数是表示
中考化学总复习《溶液》专项试题附答案
中考化学总复习《溶液》专项试题一、单选题1.把少量下列物质分别放入水中,充分搅拌,可以得到溶液的是A.花生油B.面粉C.泥土D.食盐2.下列有关溶液的说法中正确的是A.蔗糖溶液的下层比上层甜B.溶质都以分子形式溶解在溶剂里C.温度不变,则某物质饱和溶液的浓度不变D.溶质溶解时均无明显的温度变化3.室温下,向一定质量的KNO3溶液中加入10g KNO3固体,充分搅拌后,尚有部分固体未溶解,加入10g水后,固体全部溶解,下列判断不正确的是A.原溶液一定是室温下的不饱和溶液B.加水前可能是室温下的饱和溶液C.加水后可能是室温下的饱和溶液D.加水后所得溶液的溶质质量分数一定比原溶液的大4.下列有关溶液的说法错误的是A.溶液是均一、稳定的混合物B.溶液中的溶质可以是固体、液体或气体C.饱和溶液一定是浓溶液,不饱和溶液一定是稀溶液D.洗涤剂能洗去衣服上的油污,原因是洗涤剂具有乳化作用5.下列有关溶液的说法正确的是A.硝酸铵溶于水,溶液温度降低B.固体物质的溶解度都随温度的升高而增大C.饱和溶液就是不能再继续溶解任何物质的溶液D.喝下汽水后常会打嗝,说明气体的溶解度随温度的升高而增大6.把少量的下列物质分别放入水中,充分搅拌,不能形成溶液的是A.面粉B.乙醇C.蔗糖D.高锰酸钾7.某同学“配制50g溶质质量分数为5%的NaCl溶液”的实验示意图如下,其中正确的操作是()A.取用NaCl B.称取2.5gNaClC.量取50mL水D.溶解NaCl8.下图是KC1、KNO3两种固体物质的溶解度曲线,下列说法正确的是A.KNO3的溶解度大于KCl的溶解度B.t1℃时KNO3的溶解度是70C.在t1℃时,100gKNO3饱和溶液和100gKCl饱和溶液,KCl饱和溶液中的溶剂质量大于KNO3饱和溶液中的溶剂质量D.在t2℃时,欲使KNO3、KCl两种物质的溶液分别降到t℃时,析出晶体的质量KCl一定小于KNO39.实验室配制质量分数为6%的NaCl溶液。
中考初三化学溶液复习知识点
中考初三化学溶液复习知识点一、溶液(一)溶解1、物质以分子或离子的形式均匀分散到另一种物质中的过程,叫物质的溶解,物质溶解后形成的均一、稳定的混合物叫做溶液。
2、悬浊液、乳浊液、溶液都是混合物,悬浊液静置后易沉淀,乳浊液静置后易分层。
3、溶液的特征。
均一性:溶液中各部分性质相同。
稳定性:若外界条件不变,溶液可以永久存在。
透明:由于溶液中存在的主要为单个分子、离子,肉眼不可见,也不阻碍光线透过,所以溶液透明。
注:①溶液可以有不同的颜色,溶液中有Fe2+呈浅绿色,有Cu2+呈蓝色,有Fe3+呈黄色,有MnO4-呈紫红色。
②均一稳定的液体不一定是溶液。
4、物质在形成溶液过程中常伴有热量的变化,有些物质溶于水,能使溶液温度升高,如氢氧化钠(NaOH)等,有些物质溶于水导致温度降低。
如:硝酸铵(NH4NO3)等。
5、加快物质溶解速度的方法有:⑴加热(或升温);⑵搅拌(或振荡);⑶将固体研成粉末。
(二)溶液的组成1、溶质:被溶解的物质叫溶质。
溶质可以是固体、液体或气体。
2、溶剂:溶解其它物质的物质叫溶剂。
溶剂通常为液体,常见的有水、酒精、汽油等。
⑴气体、固体溶于液体时,气体、固体是溶质,液体是溶剂。
⑵两种液体互溶时,通常认为量多的是溶剂,量少的是溶质。
但当液体和水互溶时,一般把水作为溶剂,另一种液体作为溶质。
⑶同一种物质在不同溶液中,有时做溶质,有时做溶剂。
如碘酒中,酒精是溶剂,而在酒精的水溶液中,酒精又作溶质了。
⑷若没有指明溶剂,一般指的是水溶液。
3、常见溶液中的溶质和溶剂:溶液名称溶质溶剂石灰水氢氧化钙Ca(OH)2水H2O盐酸氯化氢HCl水H2O碘酒碘I2酒精C2H50H4、溶液的质量=溶质质量+溶剂质量5、溶质的质量分数(1)定义:溶液中溶质质量与溶液质量的比值叫做溶质的质量分数。
(2)数学表达式溶质质量分数(①)(3)理解:①溶质的质量分数只表示溶质质量与溶液质量之比,并不代表具体溶液质量和溶质质量。
最新中考化学大一轮单元总复习 第九单元 溶液 课件
其中,溶液质量=____溶__质___质量+____溶__剂___质量
2.配制一定质量分数的溶液(见【实验突破 强化探究力】 ) 3.有关溶液稀释或浓缩的计算:
常见方法
计算依据
溶液的 稀释
加水稀释
加水稀释前后,溶液中溶 质的质量不变
①原溶液中的溶质与后加
溶液的 浓缩
①添加溶质; ②蒸发溶剂
65 6.5 g x 9.8 g 9.8 g 100% 19.6%
98 x
50 g
答:该稀硫酸中溶质的质量分数为19.6%。
【一例一练】(2020·江西中考)“二氧化碳的实验室制取与性质”实验活 动产生的废液中含稀盐酸,需先测定其溶质质量分数后进行处理。(杂质不参 加反应) (1)实验时需配制50 g 5%的氢氧化钠溶液,若用氢氧化钠固体和水来配制, 则需称量氢氧化钠固体的质量为___2_._5___g。
溶解度 100 g
3.两种溶液混合,所得溶液的质量等于两种溶液质量之和,但所得溶液体积不
等于两种溶液体积之和。
考点研磨·提升审题力
考点一 溶解度及溶解度曲线 【典例1】 (2020·扬州中考)KNO3与NaCl的溶解度曲线如图所示。下列说法正确的是 (C) A.NaCl的溶解度受温度影响的程度比KNO3的大
化学 利用化学反应,使污垢与某些 盐酸除铁锈;利用纯碱或氢氧 变化 物质发生反应,从而去除污垢 化钠除去油烟机上的油污
【微提醒】 1.溶液不一定是无色的,如CuSO4溶液为蓝色。 2.一种溶剂里可以溶解多种溶质。 3.溶液的体积≠溶质的体积+溶剂的体积 4.溶质溶剂的判断: 固体、气体溶于液体,液体为溶剂;液体溶于液体,若溶剂为水,则水为溶 剂;若无水,则量多的为溶剂。
中考化学专题复习溶液饱和溶液与不饱和溶液溶解度考点测试
《溶液、饱和溶液与不饱和溶液、溶解度》专题班级 姓名 学号一、知识梳理 1. 溶液的形成 (1)溶液:①概念:一种或几种物质分散到另一种物质里,形成 的、 的混合物。
②组成:溶质: 的物质,可以是固体、液体或气体。
溶剂: 的物质, 是最常用的溶剂,汽油和酒精也可以作溶剂。
③特征: 性、 性、 物。
(2)溶解时的吸热或放热现象:①放热:有些物质在溶解时使溶液温度升高,如 (固)、 (液)等。
②吸热:有些物质在溶解时使溶液温度降低,如 (固)等。
③吸放热不明显:有些物质在溶解时无明显的温度变化,如 (固)等。
(3)乳化:①乳浊液:一种液体以 形式分散到另一种不相溶的液体里形成的混合物,如牛奶和豆浆。
乳浊液不 ,静置后会分层。
②乳化剂:能使乳浊液 性增强的物质。
③乳化现象:洗涤剂等乳化剂使植物油在水中分散成无数细小的液滴,而不聚成大的液滴,从而使油和水不再分层的现象。
其中洗涤剂所起的作用叫 作用。
注意:用乳化剂去油污是利用了乳化剂的 作用;用汽油洗去衣物上的油渍用的是 原理;用氢氧化钠去油污利用的是 。
2.饱和溶液与不饱和溶液(1)定义:在一定 下,一定量的 里, 继续溶解某种溶质的溶液,叫做这种溶质的饱和溶液; 继续溶解某种溶质的溶液,叫做这种溶质的不饱和溶液。
(2)判断:①若有未溶解的溶质(充分搅拌后),则该溶液一定为该溶质的 溶液。
②若无未溶解的溶质,保持温度、溶剂的量不变,向溶液中 ,若 ,则为该溶质的饱和溶液,反之则为不饱和溶液。
(3)相互转化:不饱和溶液饱和溶液2不饱和溶液饱和溶液(4)结晶:①定义:从溶液中的过程。
②方法:蒸发结晶:适用于所有溶质的溶液,特别适用于溶解度受温度影响的物质,如NaCl。
降温结晶(冷却):只适用于溶解度随温度升高而的物质,如KNO3。
3.溶解度和溶解度曲线(1)溶解度①概念:在一定下,某固态物质在 g溶剂里达到状态时所溶解的。
②影响因素:内因:、本身的性质;外因:温度多数固体物质的溶解度随温度的升高而 ,如KNO3。
