南京工业大学-化工学院化工09--反应工程大作业
南京工业大学-化学反应工程-2005-2006试题B

南京工业大学 化学反应工程 试题B (开)卷2005—2006学年第一学期 使用班级1.反应器中等温进行着A →P(1)和A →R(2)两个反应,当降低A 的浓度后,发现反应生成P 的量显著降低,而R 的生成量略降低,表明( )A .反应(1)对A 的反应级数大于反应(2)B .反应(1)对A 的反应级数小于反应(2)C .反应(1)的活化能小于反应(2)D .反应(1)的反应速率常数大于反应(2)2.四只相同体积的全混釜串联操作,其无因次停留时间分布的方差值2θσ为( ) A . 1.0 B. 0.25 C .0.50 D .03.对一平行—连串反应R A Q P A −→−−→−−→−)3()2()1(,P 为目的产物,若活化能次序为:E 2<E 1<E 3,为了目的产物的收率最大,则最佳操作温度序列为( )。
A .先高后低 B.先低后高 C .高温操作 D .低温操作4.两个等体积的全混流反应器进行串联操作,反应为一级不可逆,则第一釜的反应速率-r A1与第二釜的反应速率-r A2之间的关系为( )。
两釜反应温度相同。
A .-r A1 > -r A2B .-r A1 = -r A2C .-r A1 < -r A2 D.不能确定何者为大5. 已知一闭式反应器的1.0=r auL D ,该反应器若用多釜串联模型来描述,则模型参数N 为( )。
A . 4.5 B. 5.6 C .3.5 D .4.06.固体催化剂之所以能起催化作用,是由于催化剂的活性中心与反应组分的气体分子主要发生( )。
A .物理吸附B .化学反应C .化学吸附D .质量传递7.包括粒内微孔体积在内的全颗粒密度称之为( )A .堆(积)密度B .颗粒密度C .真密度D .平均密度8.在气固催化反应动力学研究中,内循环式无梯度反应器是一种( )。
A .平推流反应器 B. 轴向流反应器 C. 全混流反应器 D. 多釜串联反应器9.某液相反应,其反应式可写成A+C R+C 这种反应称为( )A .均相催化反应B .自催化反应C .链锁反应 D.可逆反应10.高径比不大的气液连续鼓泡搅拌釜,对于其中的气相和液相的流动常可近似看成( )A .气、液均为平推流B .气、液均为全混流C .气相平推流、液相全混流D .气相全混流、液相平推流二、填空题(每题5分,共30分)1.一不可逆反应,当反应温度从25℃升高到35℃时,反应速率增加一倍,则该反应的活化能为 。
甲醇气相羰化合成醋酸的反应机理及本征动力学

甲醇气相羰化合成醋酸的反应机理及本征动力学刘金红;刘志军;黄艳芳;姚虎卿【摘要】Complex catalyst Ni-Mo-La/AC was prepared by impregnation method. And kinetic data of acetic acid catalytic synthesized by methanol carbonylation in gas phase were measured in a plug flow reactor. The results indicated that methyl acetate was the first order product of the vapour phase carbonylation of methanol, and acetic acid was the second order product of the sequential reaction by hydrolysis from methyl acetate. The dimethyl ether was obtained through dehydration of methanol. Methyl iodide and activated carbon had the catalysis effect together on this reaction. The dimethyl ether could also produce methyl acetate by carbonlylation; methane was obtained by reaction of methyl iodide and the production of methanol decomposition. On the base of above analysis, a reaction kinetics model was set up and model parameters were obtained by linear regression of data.%用浸渍法制备了负载型Ni-Mo-La/AC复合催化剂,并在平推流反应器中对甲醇气相羰基化催化反应进行了动力学数据的测定.实验证明,醋酸甲酯是甲醇气相羰基化反应的中间产物,醋酸显示连串反应最终产物的特征由醋酸甲酯水解生成;二甲醚通过甲醇脱水生成,碘甲烷和活性炭共同对该反应起催化作用,二甲醚可进一步羰化生成醋酸甲酯;甲烷由甲醇分解后的产物氢气与碘甲烷反应生成.根据反应机理建立了幂函数动力学模型,由实验数据线性回归计算得到了动力学参数.【期刊名称】《化学反应工程与工艺》【年(卷),期】2011(027)005【总页数】7页(P418-424)【关键词】甲醇;醋酸;羰基化;复合催化剂;动力学【作者】刘金红;刘志军;黄艳芳;姚虎卿【作者单位】南京工业大学化学化工学院,江苏南京210009;南通职业大学化学工程系,江苏南通226007;南通职业大学化学工程系,江苏南通226007;南通职业大学化学工程系,江苏南通226007;南京工业大学化学化工学院,江苏南京210009【正文语种】中文【中图分类】O643醋酸是重要的有机化工原料,目前工业生产醋酸的主要技术路线是甲醇液相羰基化合成法。
《化学反应工程》课后习题答案

(2)放热反应吸热反应
(3)M点速率最大,A点速率最小M点速率最大,A点速率最小
(4)O点速率最大,B点速率最小H点速率最大,B点速率最小
(5)R点速率大于C点速率C点速率大于R点速率
(6)M点速率最大根据等速线的走向来判断H,M点的速率大小。
2.7在进行一氧化碳变换反应动力学研究中,采用B106催化剂进行试验,测得正反应活化能为 ,如果不考虑逆反应,试问反应温度是550℃时的速率比反应温度是400℃时的速率大多少倍?
(1)(1)以反应体积为基准的速率常数kV。
(2)(2)以反应相界面积为基准的速率常数kg。
(3)(3)以分压表示反应物系组成时的速率常数kg。
(4)(4)以摩尔浓度表示反应物系组成时的速率常数kC。
解:利用(2.10)式及(2.28)式可求得问题的解。注意题中所给比表面的单位换算成m2/m3。
2.4在等温下进行液相反应A+B→C+D,在该条件下的反应速率方程为:
原料气和冷凝分离后的气体组成如下:(mol)
组分
原料气
冷凝分离后的气体
CO
26.82
15.49
H2
68.25
69.78
CO2
1.46
0.82
CH4
0.55
3.62
N2
2.92
10.29
粗甲醇的组成为CH3OH 89.15%,(CH3)2O 3.55%,C3H9OH 1.10%,H2O 6.20%,均为重量百分率。在操作压力及温度下,其余组分均为不凝组分,但在冷凝冷却过程中可部分溶解于粗甲醇中,对1kg粗甲醇而言,其溶解量为CO29.82g,CO 9.38g,H21.76g,CH42.14g,N25.38g。若循环气与原料气之比为7.2(摩尔比),试计算:
最新南京工业大学生物反应工程试卷(A)
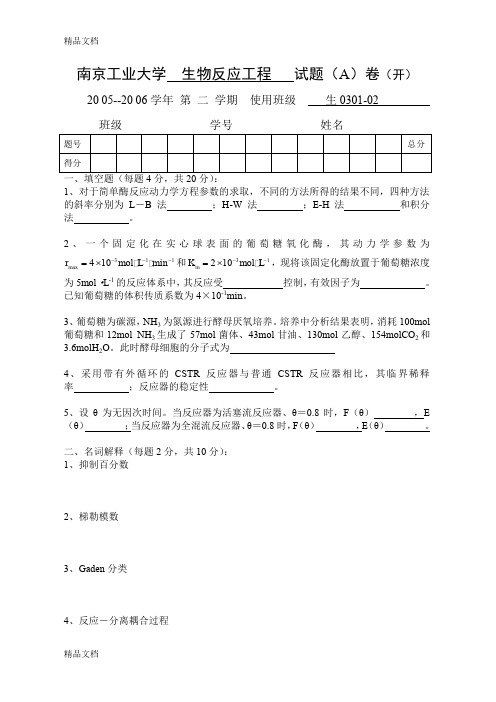
南京工业大学 生物反应工程 试题(A )卷(开)20 05--20 06学年 第 二 学期 使用班级 生0301-02 班级 学号 姓名1、对于简单酶反应动力学方程参数的求取,不同的方法所得的结果不同,四种方法的斜率分别为L -B 法 ;H-W 法 ;E-H 法 和积分法 。
2、一个固定化在实心球表面的葡萄糖氧化酶,其动力学参数为311max 410min r mol L ---=⨯和31210m K mol L --=⨯,现将该固定化酶放置于葡萄糖浓度为5mol ·L -1的反应体系中,其反应受 控制,有效因子为 。
已知葡萄糖的体积传质系数为4×10-1min 。
3、葡萄糖为碳源,NH 3为氮源进行酵母厌氧培养。
培养中分析结果表明,消耗100mol 葡萄糖和12mol NH 3生成了57mol 菌体、43mol 甘油、130mol 乙醇、154molCO 2和3.6molH 2O 。
此时酵母细胞的分子式为4、采用带有外循环的CSTR 反应器与普通CSTR 反应器相比,其临界稀释率 ;反应器的稳定性 。
5、设θ为无因次时间。
当反应器为活塞流反应器、θ=0.8时,F (θ) ,E (θ) ;当反应器为全混流反应器、θ=0.8时,F (θ) ,E (θ) 。
二、名词解释(每题2分,共10分): 1、抑制百分数2、梯勒模数3、Gaden 分类4、反应-分离耦合过程5、停留时间分布密度函数三、简答题(每题5分,共30分):1、细胞生长的Monod方程的基本假设和适用范围是什么?什么是均衡生长?2、反应器内流体停留时间分布函数有那些?如何采用实验方法测定停留时间分布?实验方法中的各自缺陷是什么?停留时间分布函数的统计特征值是什么?3、在固定化酶反应中,若存在底物抑制采用什么样反应器较为合适?若存在产物抑制,采用何种反应器较好?为什么?4、什么叫做“返混”?根据返混的不同可以将理想反应器分为几种?其各自特征参数值有什么特点?5、一般情况下微生物的间歇培养采用什么方法考察菌体的增殖情况,发酵过程分为那些阶段?如何改变迟滞期的长短?如何计算倍增时间t d?6、k L a 测定方法有哪几种?简述各方法的基本原理。
化学反应工程测试习题集(精心整理)

第一章 绪论1. 化学反应工程是一门研究______________的科学。
2. 化学反应工程是一门研究化学反应的工程问题的科学,既以_______作为研究对象,又以_______为研究对象的学科体系。
3. _______是化学反应工程的基础。
)4. 化学反应过程按操作方法分为_______、_______、_______操作。
5. 化学反应工程中的“三传一反”中的三传是指_______、_______、_______。
6. 不论是设计、放大或控制,都需要对研究对象作出定量的描述,也就要用数学式来表达个参数间的关系,简称_______。
7. 在建立数学模型时,根据基础资料建立物料、热量和动量衡算式的一般式为_______。
8.“三传一反”是化学反应工程的基础,其中所谓的一反是指_______。
A .化学反应 B. 反应工程 C. 反应热力学 D. 反应动力学 9.“三传一反”是化学反应工程的基础,下列不属于三传的是_______。
A. 能量传递B. 质量传递C. 热量传递D. 动量传递 第二章 均相反应动力学 1. 均相反应是指_。
2. 对于反应,则_______。
3.着眼反应组分K 的转化率的定义式为_______。
4.当计量方程中计量系数的代数和等于零时,这种反应称为_______,否则称为_______。
5. 化学反应速率式为,用浓度表示的速率常数为,假定符合理想气体状态方程,如用压力表示的速率常数,则=_______。
6. 化学反应的总级数为n ,如用浓度表示的速率常数为,用逸度表示的速率常数,则=_______。
7. 化学反应的总级数为n ,如用浓度表示的速率常数为,用气体摩尔分率表示的速率常数,则=_______。
8.在构成反应机理的诸个基元反应中,如果有一个基元反应的速率较之其他基元反应慢得多,他的反应速率即代表整个反应的速率,其他基元反应可视为处于_______。
9.当构成反应机理的诸个基元反应的速率具有相同的数量级时,既不存在速率控制步骤时,可假定所有各步基元反应都处于_______。
南京工业大学《反应工程》试题

南京⼯业⼤学《反应⼯程》试题南京⼯业⼤学《反应⼯程》试题(A)卷⼀、判断题:(正确的打“√”,错误的打“X”)1.在全混流釜式反应器中进⾏液相反应,由于返混程度最⼤,故反应速率⼀定最⼩。
( ) 2.因为单⼀反应就是基元反应,因此反应级数与化学计量系数是相同的。
( ) 3.在间歇反应器(BR)中和活塞流反应器(PFR)中等温进⾏同⼀反应,若C A0、x Af 相同时,则t BR=t PFR( )4.⼀⾃催化反应A?→k P,若其反应速率与反应物A和产物P的反应级数均⼤于零,则在达到相同的转化率时,所需的V PFR总是⼩于V CSTR。
( ) 5.⽆论是⼀级反应还是⼆级反应,流体的混合态对反应结果⽆影响。
( )6.对⽓固催化反应,由于外扩散阻⼒的存在,使得C AS7.设计固定床反应器时需考虑内扩散对反应的影响,⽽设计流化床反应器时,则不必考虑内扩散的影响。
( )8.多段绝热式固定床反应器的最优化结果是各段催化剂⽤量相等。
( )⼆、选择题:1.由⽰踪法测得⼀反应器的停留时间分布密度函数E(t)=10/t1e-min-1,可判别该反应器10的流型为( )A.平推流B.全混流巳轴向·分散趴多级混合2.在⽓固催化反应动⼒学研究中,为了消除内扩散阻⼒,⼀般采⽤( )⽅法。
A.增⼤器内流速 B. 改变反应器流型 C . 改变反应器结构D.减⼩催化剂粒径3. 下图中阴影⾯积表⽰为( )A.F(t)B.E(t)C.tσD.2θ4.对于⽓固催化反应,催化剂粒径(A增⼤B减⼩)反应温度(A升⾼,B降低)可使催化剂的η增⼤。
5.对于热效应不⼤,反应温度的允许变化范围⼜⽐较宽的情况,⽤反应器最为⽅便,A单段绝热床 B 多段绝热床 C. 换热式固定床 D. ⾃热式固定床三、填空题1. 某液相复合反应,A+2B?→1k P,若:r P=k1C A0.5C B1.52A+B?→2k Q,r Q= k1C A1.5C B0.5为使⽬的产物P的选择性⾼,应选择:①若采⽤间歇反应釜,其加料⽅式为,②若采⽤管式反应器,其进料⽅式为。
南京工业大学
南京工业大学 生物反应工程 试题(A )卷(开)20 05--20 06学年 第 二 学期 使用班级 生0301-02 班级 学号 姓名题号 总分得分一、填空题(每题4分,共20分):1、对于简单酶反应动力学方程参数的求取,不同的方法所得的结果不同,四种方法的斜率分别为L -B 法 ;H-W 法 ;E-H 法 和积分法 。
2、一个固定化在实心球表面的葡萄糖氧化酶,其动力学参数为311max 410min r mol L −−−=× 和31210m K mol L −−=× ,现将该固定化酶放置于葡萄糖浓度为5mol ·L -1的反应体系中,其反应受 控制,有效因子为 。
已知葡萄糖的体积传质系数为4×10-1min 。
3、葡萄糖为碳源,NH 3为氮源进行酵母厌氧培养。
培养中分析结果表明,消耗100mol 葡萄糖和12mol NH 3生成了57mol 菌体、43mol 甘油、130mol 乙醇、154molCO 2和3.6molH 2O 。
此时酵母细胞的分子式为4、采用带有外循环的CSTR 反应器与普通CSTR 反应器相比,其临界稀释率 ;反应器的稳定性 。
5、设θ为无因次时间。
当反应器为活塞流反应器、θ=0.8时,F (θ) ,E (θ) ;当反应器为全混流反应器、θ=0.8时,F (θ) ,E (θ) 。
二、名词解释(每题2分,共10分): 1、抑制百分数2、梯勒模数3、Gaden 分类4、反应-分离耦合过程5、停留时间分布密度函数三、简答题(每题5分,共30分):1、细胞生长的Monod方程的基本假设和适用范围是什么?什么是均衡生长?2、反应器内流体停留时间分布函数有那些?如何采用实验方法测定停留时间分布?实验方法中的各自缺陷是什么?停留时间分布函数的统计特征值是什么?3、在固定化酶反应中,若存在底物抑制采用什么样反应器较为合适?若存在产物抑制,采用何种反应器较好?为什么?4、什么叫做“返混”?根据返混的不同可以将理想反应器分为几种?其各自特征参数值有什么特点?5、一般情况下微生物的间歇培养采用什么方法考察菌体的增殖情况,发酵过程分为那些阶段?如何改变迟滞期的长短?如何计算倍增时间t d?6、k L a 测定方法有哪几种?简述各方法的基本原理。
南京工业大学《反应工程》试题卷2008
南京工业大学《反应工程》试题卷2008(A )学号 姓名 得分一、判断题:(正确的打“√”,错误的打“X ”)1.因为单一反应就是基元反应,因此反应级数与化学计量系数是相同的。
( ) 2.一自催化反应A −→−kP ,若其反应速率与反应物A 和产物P 的反应级数均大于零,则在达到相同的转化率时,所需的V PFR 总是小于V CSTR 。
( ) 3.已知某反应器的停留时间实验测定中,得到σt 2=10000min 2,则可知流型接近全混流。
( ) 4.由于零级反应中反应速率与浓度无关,故流体的混合态对反应结果无影响。
( ) 5.对气固催化A ->P ->S 反应(P 为目的产物),由于外扩散阻力的存在,使得C AS <C AG ,因此必定使反应的选择性下降。
( )6.气固催化反应的本征速率是排除了吸附和脱附阻力后的速率方程。
( )7.设计流化床反应器时,催化剂粒径很小,一般不必考虑内扩散的影响,可按平推流反应器进行计算。
( )8.用空气液相氧化环己烷,该过程为慢反应,因而采用鼓泡塔较板式塔较有利于氧化反应。
( )二、选择题1.在V=100 L/min 流量下对三只反应器分别进行示踪实验,测得如下数据:反应器 A B C 体积(L) 1000 2000 30002t σ(min 2) 50 100 250则三只釜的返混大小顺序为( )A .A>B>C B. A>C>B C. C>B>A D. C>A>B2.一个全混流反应器,其有效容积v 1=1m 3,进行0级不可逆反应,出口转化率为x A1,现用二个有效容积各为0.5m 3的全混流反应器串联操作进行同上反应,进料容积流速Q o 和反应温度与上相同,出口转化率为x A2,则x A1与x A2的相对比较为 ( ) A .x A1>x A2 B .x A1=x A2 C .x Al <x A2 D .视进料浓度C A0而定3.液相等温反应:r p =k l P 为目的产物r R =k 2C Ar s =k 3C A 2可有四种反应器可供选择:(1)平推流反应器,(2)全混流反应器,(3) 三台全混流反应器串联,(4)四台全混流反应器串联。
化学反应工程作业
The Final Examination of Chemical Reaction Engineering Used by graduate students of 20102011-6Name:Class:Grade:Student Number:1: For a gas reaction at 400 K the rate is reported as23.66A A dp p dt-= /a t m h r (a)What are the units of the rate constant?(b)What is the value of the rate constant for this reaction if the rate equation is expressed as231,/.A A A dN r kC mol m s V dt-=-=2: For the elementary reactions in series1201200,,00A A k k R S C C A R S k k att C C =⎧−−→−−→==⎨==⎩ find the maximum concentration of R and when it is reached.3:Given a gaseous feed, T0=1000 K, π0=5 atm, C A0=100, C B0=200, +→, T=400 K, π=4 atm, C A=20. Find X A, X B, C B.5A B R4: A gaseous feed of pure A (1 mol/liter) enters a mixed flow reactor (2 liters) and reacts as follows:22,0.05secA A A R mol r C liter →-=∙ Find what feed rate (liter/min) will give an outlet concentration C A =0.5mol/lliter.5:The kinetics of the aqueous-phase decomposition of A is investigated in two mixed flow reactors in series, the second having twice the volume of the first reactor. At steady state with a feed concentration of 1mol A/liter and mean residence time of 96 sec in the first reactor, the concentration in the first reactor is 0.5 mol A/liter and in the second is 0.25 mol A/liter.Find the kinetic equation for the decomposition.6: T is the desired product and C A0=5.Under ultraviolet radiation, reactant A of C A0=10 kmol/m3in a process stream (v=lm3/min) decomposes as follows.We wish to design a reactor setup for a specific duty. Sketch the scheme selected, and calculate the fraction of feed transformed into desired product as well as the volume of reactor needed.7:When oxygen is bubbled through a high-temperature batch of A-containing liquid material, A oxidizes slowly to give a slowly decomposing intermediate X and final product R. Here are the results of an experiment:We have no way of analyzing for X; however, we are safe in assuming that at any time C A+C R+C X=C A0.What can we say about the mechanism and kinetics of this oxidation? Hint: plot the data and examine the plot.8:Phthalic Anhydride from Naphthalene. The accepted mechanism for the highly exothermic solid catalyzed oxidation of naphthalene to produce phthalic anhydride isand whereA=naphthalene (reactant)R=naphthaquinone (postulated intermediate)S=phthalic anhydride (desired product)T=CO2+H2O (waste products)and the Arrenhius activation energy is given in units of J/mol. Thisreaction is to be run somewhere between 900 K and 1200 K.A local optimum reactor setup discovered by the computer [see example 1, Chem. Eng. Sci., 49, 1037-1051(1994) l is shown in Fig.P10.19.Figure P10.19(a) Do you like this design? Could you do better? If so, how ?(b)If you could keep the whole of your reactors at whatever temperature and 7 value desired, and if recyle is allowed, how much phthalic anhydride could be produced per mole of naphthalene reacted? Suggestion: Why not determine the values of k1, k2, k3,and k4, for both extremes of temperature, look at the values, and then proceed with the solution?。
南京工业大学反应工程题集
一、是非题:(正确的打“√”,错误的打“×”)1.对化学反应来说,温度越高,反应速率越大,因此高温操作,可使反应器体积最小。
( )2.多个PFR 串联或多个CSTR 串联,其流型仍为活塞流或全混流。
( )3.对于零级反应,由于反应速率与反应物浓度无关,因此催化剂内扩散阻力对宏观反应速率无影响。
( )4.在进行均相反应动力学实验时,既可以在间歇反应器中进行,也可以在连续流动反应器中进行,但由于反应器操作方式不同,因此所得的反应动力学方程形式也是不同的。
( )5. 间歇釜式反应器改成连续操作后,由于省去了辅助时间,因此一定能提高产量。
( )6.在绝热式固定床反应器中进行一级不可逆反应,由于西勒(Thiele )模数与反应物浓度无关,因此内扩散有效因子在床内为常数。
( )7.由于全混釜的停留时间分布比任意非理想流动反应器的都宽,因此NFR t CSTR t )()(22σσ>。
( )8.在一绝热反应器中,仅当进行一级反应时,其反应温度和转化率的关系才呈线性。
( )9.在任意转化率下,一级不可逆连串反应在全混流反应器中进行的收率总是低于在间歇釜中进行的收率。
( )10.在相同的温度下,一级连串不可逆反应A →P →Q ,在间歇反应器中进行时P 的收率总是高于在全混流中进行的P 的收率。
( )11.在全混流釜式反应器中进行液相反应,由于返混程度最大,故反应速率一定最小。
( )12.因为单一反应就是基元反应,因此反应级数与化学计量系数相同。
( )13.一自催化反应P A k −→−,若(-R A )=kC A C P ,由于反应级数大于零,则在达到相同的转化率时,所需的V PFR 总是小于V CSTR 。
( )14.在间歇反应器(BR )中和活塞流反应器(PFR )中等温进行同一反应,若C A0、x Af 相同时,则t BR = τPFR 。
( )15.无论是一级反应还是二级反应,流体的混合态对反应结果无影响。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
反应工程作业
化工
090328 浦绍瑞
4.7在径为 1.22m 的绝热管式反应器中进行乙苯催化脱氢反应
22565256H CH CH H C H C H C +=-⇔-。
进料温度为898K ,若在活塞流反应器中
进行该反应,进料为乙苯和水蒸气的混合物,其摩尔比为1:20。
反应速率常数与温度的关系为)/(),/10983ex p(10452.35Pa kg s kmol T k ⋅⋅⨯=-,不同温度下的化学平衡常数值可根据下列近似式估算Pa T K ),/14520ex p(1096.311-⨯=。
反应物的平均比热容为)/(77.12K kg kJ ⋅,反应热等于mol J /109.315⨯。
催化剂床层的堆密度为3kg/m 1440。
试计算反应器的轴向温度及转化率分布。
一、题目背景
苯乙烯是用苯取代乙烯的一个氢原子形成的有机化合物,乙烯基的电子与苯环共轭,不溶于水,溶于乙醇、乙醚中,暴露于空气中逐渐发生聚合及氧化。
工业上是合成树脂、离子交换树脂及合成橡胶等的重要单体。
由于苯乙烯的重要性, 乙苯脱氢反应动力学和反应器的模拟及优化的研究备受世人瞩目。
通过模拟获得乙苯脱氢反应器的轴向温度分布和转化率分布,可以在生产过程中以此为依据优化工艺操作条件。
二、解决问题过程
将乙苯转化速率转变为转化率的函数:])21()102.1(21)1(102.1[22
55A A A A A x K x x x k r +⨯-+-⨯=
绝热操作,为变温情况,将题目中所给的k 及K 与温度的关系代入上式得:
])
21)(/14520exp(1096.3102.1211[102.11440)/10983exp(10452.32
62
55
5
A A
A A A x T x x x T r +-⨯⨯-+-⨯⨯⨯⨯-⨯=-
进料中乙苯与水蒸气的摩尔比为1/20,则21/1)120/(10=+=A y ,绝热温升为:
K C H y C M H pt
r A pt
A T r A 13719.22177.2211039.1)()(5
00
0-=⨯⨯⨯-=∆-∆-=
恒容ωλ
又由A x T T λ=-0,可得反应过程温升与转化率的关系为:A x T 137898-=
由
)(0A A A A A x R dZ dx M G -=ω,其中)/(10454.122.14
107.13323
0s m kmol M G A
A ⋅⨯=⨯⨯=--πω可得轴向转化率的分布为:
)]137********
exp(211003.31[)137********exp(211004.142
76A A A A A A A x x x x x x dZ dx -+⨯--⨯--+⨯=- 上式初值条件为:00==A x Z 时,。
上式分离变量,采用Metlab 中Simpson 法积分,程序如下: function dx=fun1(t,x)
dx=[4.104*10^6/(21+x(1))*exp(-10983/(898-137*x(1)))*(1-x(1)-3.03*10^(-7)*x(1)^2/(21+x(1))*exp(14520/(898-137*x(1))));
-137*(4.104*10^6/(21+x(1))*exp(-10983/(898-137*x(1)))*(1-x(1)-3.03*10^(-7)*x(1)^2/(21+x(1))*exp(14520/(898-137*x(1)))))]; end
clear;clc; xa=[0;898]
z=linspace(0,3.2,32); [t,y]=ode45('fun1',z,xa) plot(t,y(:,1)) figure() plot(t,y(:,2))
result=[t y(:,1) y(:,2)]
由于绝热反应过程的温度与转化率成线性关系,由式A x T 137898-=可算出给定转化率下的温度,同样在下表中列出相应的计算结果。
将计算结果及计算结果与课本理论值误差分析如下表所示:
表1 乙苯脱氢反应器轴向转化率及温度分布
和T对Z做图,如下图所示。
图中的两条曲线分根据上表中的数据,分别以x
A
别为轴向温度分布曲线和轴向转化率分布曲线:
0.0
0.1
0.2
0.3
0.4
0.5
0.6
Z/m
X A
图1 绝热条件下乙苯脱氢反应器的轴向温度及转化率分布
4.8采用144根直径为0.1016m 的反应管并联操作,以代替上题中直径为
1.22m 的绝热管式反应器进行乙苯催化脱氢反应。
这些反应管外用温度恒定为1100K 的烟道气加热,烟道气与反应管反应气体间的总传热系数为
)/(5.822K m W ⋅。
其他条件和要求同上题,试计算反应器的轴向转化率及温度分
布,以及甲苯转化率达60%时所需的催化剂量。
解题过程:
由题意知此反应器为非绝热变温管式反应器,144根管并联只考虑一根反应管即可。
因为144根并联反应管的总横截面积正好与上题中的直径为1.22m 的绝热反应器的截面积相等,所以两者都是在同意质量速度下操作,且进料组成又相同,因此上题由物料衡算建立的轴向转化率分布方程式也适用于本题。
差别在于温度T 与转化率x A 不再成线性关系,而为:
)]14520
exp(211003.31)[10983exp(211004.142
76T
x x x T x dZ dx A A A A A +⨯---+⨯=- 乙苯的进料量为s kmol /107.13-⨯,而乙苯与水蒸气的摩尔比为1/20,故水蒸气
的加入量为s kmol /104.32-⨯,因此反应物料的质量速度为:
)/(678.04
/106.014418
104.3106107.122
23s m kg G ⋅=⨯⨯⨯+⨯⨯=--π 又由上题中
)/(10454.122.14
107.13323
0s m kmol M G A
A ⋅⨯=⨯⨯=--πω, 将式)(40c t
A A A pt
T T d U
dZ dx M G dZ dT GC --=ω两边同除以GC pt ,并将相关数值代入得轴向温度分布方程:
dZ
dx T T dZ dx A A 137-)1100(7605.00)1100(016.1077.1278.60105.824-77.1278.601054.41109.31-dZ dT 33-6-=-⨯⨯⨯⨯⨯⨯⨯⨯=
初值条件为Z=0,x A =0,T=898K 。
采用Metlab 用数值法求解,程序如下:
function dx=fun2(t,x)
dx=[4.104*10^6/(21+x(1))*exp(-10983/x(2))*(1-x(1)-3.03*10^(-7)*x(1)^2/(21+x(1))*exp(-14520/x(2)));
0.07605*(1100-x(2))-137*(4.104*10^6/(21+x(1))*exp(-10983/x(2))*(1-x(1)-3.03*10^(-7)*x(1)^2/(21+x(1))*exp(-14520/x(2))))]; end
clear ;clc; xa=[0;898]
z=linspace(0,3.8,38); [t,y]=ode45('fun2',z,xa); plot(t,y(:,1)) figure()
plot(t,y(:,2))
result=[t y(:,1) y(:,2)]
将计算结果、计算值与课本理论值进行误差分析列于下表: 表2 乙苯催化脱氢反应器的轴向转化率及温度分布
根据上表的数据,分别以转化率x
和温度T对轴向距离Z做图,得到反应器的
A
轴向转化率分布和轴向温度分布曲线如下图所示:
1
2
3
40.0
0.2
0.4
0.6
0.8
Z/m
X A
810
820
830840
850860
870880
890T /K
图2 非绝热变温条件下乙苯脱氢反应器的转化率及温度分布。
