A基于三维荧光和平行因子分析法的太湖水体CDOM组分光学特征
【国家自然科学基金】_cdom_基金支持热词逐年推荐_【万方软件创新助手】_20140801
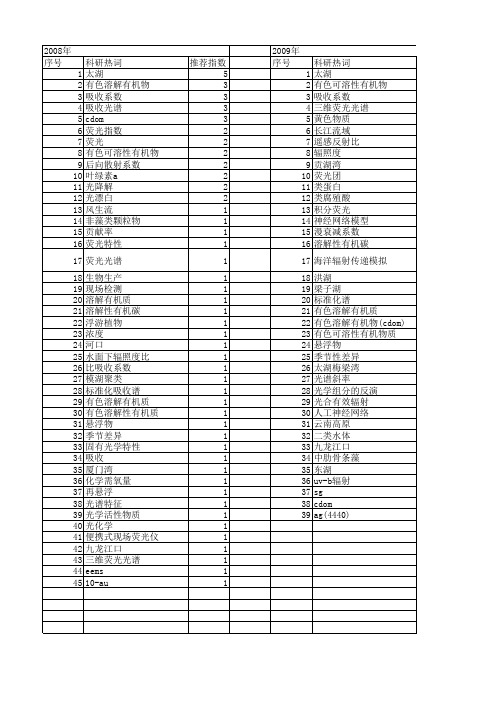
科研热词 推荐指数 有色溶解有机物 6 吸收系数 5 三维荧光光谱 5 平行因子分析 4 有机污染 3 太湖 3 吸收 3 有色溶解有机质 2 光谱斜率 2 黄色物质 1 验证 1 雨水 1 遥感监测 1 透射率 1 远洋压舱水交换 1 近紫外区 1 蒙特卡罗模拟 1 荧光激发-发射矩阵光谱 1 荧光指数 1 荧光基团 1 荧光 1 筼筜湖 1 筄筜湖 1 珠江口 1 溶解有色物质 1 混合行为 1 海洋光学 1 浮游藻类 1 河口行为 1 水质参数 1 水色遥感 1 水体环境 1 有色溶解有机物(cdom) 1 有色溶解性有机物 1 有色可溶性有机物 1 引江济太 1 平行因子法 1 巢湖 1 大型丝状绿藻 1 北部湾 1 分离方法 1 光降解 1 光谱耦合效应 1 光谱微分 1 光致生成 1 光脱色 1 信号处理 1 交互作用 1 二向性 1 九龙江口 1 三维荧光光谱(eems) 1 三维荧光 1
2011年 序号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52
科研热词 推荐指数 吸收系数 4 太湖 3 光谱斜率 3 遥感 2 碳循环 2 有色可溶性有机物 2 cdom 2 黄色物质 1 长江口 1 遥感反演 1 遥感反射率 1 边缘海 1 衰减系数 1 表层沉积物 1 荧光指数 1 经验正交分解 1 石油类污染 1 真光层深度 1 盐度 1 珠江口 1 漫射衰减系数 1 溶解有色物质 1 溶解有机质 1 溶解有机碳(doc) 1 溶解有机碳 1 浅水湖泊 1 河口 1 水色 1 水动力 1 有色溶解有机物 1 有色可溶性有机物(cdom谱 1 吸光度 1 后向散射系数 1 反演模式 1 博斯腾湖 1 北极峡湾 1 冰川 1 内陆水体 1 光谱指纹 1 光致生成 1 中等分辨率成像光谱仪 1 三维荧光光谱 1 一氧化碳 1 salinity 1 pearl river estuary 1 medium resolution imaging spectrometer 1 instrument field spectral data 1 doc 1
长江溶解有机质三维荧光光谱的平行因子分析_甘淑钗

中国环境科学2013,33(6):1045~1052China Environmental Science 长江溶解有机质三维荧光光谱的平行因子分析甘淑钗,吴莹*,鲍红艳,张经(华东师范大学河口海岸学国家重点实验室,上海200062)摘要:利用三维荧光光谱(EEMs)研究了2009年9月长江上游至河口近4000km主流区域溶解有机质(DOM)的荧光组分特征及分布变化,结合紫外可见吸收光谱a350,旨在认识长江DOM的组成、来源和迁移转化过程.通过平行因子法(PARAFAC)解谱,得到3个类腐殖质组分H1、H2、H3及2个类蛋白质组分P1、P2.溶解有机碳(DOC)在上游浓度最低,在三峡库区万州附近明显增加,而后趋于稳定.荧光组分峰值之和(∑Fluo)呈类似趋势,和DOC相关性分析(R2=0.92)说明EEMs-PARAFAC可有效示踪溶解有机质的分布.其中蛋白质信号∑P约占∑Fluo 的1/4,叶绿素a与∑P、DOC的弱相关性说明自生源不能主导DOM荧光组分分布;不同类腐殖质组分变化趋势不同,H3(E x/E m:250/450~485nm)在库区后的水体有明显富集,而H1、H2占∑Fluo百分比则有所下降,a350也呈优先降解的趋势,反映了长江DOM 迁移转化过程的选择性.关键词:溶解有机质;三维荧光;平行因子分析;长江中图分类号:X132文献标识码:A文章编号:1000-6923(2013)06-1045-08Characterization of DOM(dissolved organic matter)in Yangtze River using3-D fluorescence spectroscopy and parallel factor analysis.GAN Shu-chai,WU Ying*,BAO Hong-yan,ZHANG Jing(State Key Laboratory of Estuarine and Coastal Research,East China Normal University,Shanghai200062,China).China Environmental Science, 2013,33(6):1045~1052Abstract:Water samples were collected from Yangtze River basin across4000km during September,2009.Five fluorescence components(3humic-like and2protein-like components)were identified by3-dimension fluorescence spectroscopy(EEMs)combined with parallel factor analysis(PARAFAC)combined with a350to elucidate composition, source and transformation processes of dissolved organic matter(DOM)in the Yangtze River.Dissolved organic carbon (DOC)increased remarkably from Wanzhou to the Three Gorge Dam and thereafter remained constant in the lower reach. The sum of all5components(∑Fluo)showed the similar trend of variation,which correlated linearly with DOC(R2=0.92) indicating that EEMs is a powerful tool to trace DOM in the Yangtze River.The protein-like component(∑P)accounted for1/4of∑Fluo with apparently weak correlations with DOC and chlorophyll-a,which implied that the riverine DOM is not dominated by autochthonous production.Humic-like(H1,H2,H3)components showed different correlations with DOC, especially in the lower reach,where H3(E x/E m:250/450~485nm)was accumulated,while the other components(H1,H2) and a350seemed to be degraded faster than H3.All the fact indicated that DOM might be subjected to selective biological and photochemical degradation processes in Yangtze River.Key words:dissolved organic matter;3-D fluorescence spectroscopy;parallel factor analysis;Yangtze River溶解有机质(DOM)是全球碳循环的重要组成,对水体的碳、生源要素等的生物地球化学循环具有重要意义,河流是陆源DOM的传输者和反应池,自然、人文等环境因素在其组成上有所反映.由于成分复杂,已能在分子水平鉴别的DOM成分不到11%[1],且操作繁琐,仪器要求较高,对新的组分识别手段提出了迫切需要.三维荧光—激发发射矩阵光谱(EEMs)是近年来广泛用于研究DOM来源及动力学特征的一种荧光光谱分析技术[2-6]通过平行因子法(PARAFAC)解谱[5,7]提取荧光特征,可对不同荧光组分进行定性、定量分析,具有操作便捷、灵敏度高、样品量少且无需富集等优点,已有学者通过此手段在亚马逊河[8]、刚果河[9]、珠江[10]、九龙江[11]等流收稿日期:2012-09-20基金项目:国家自然科学基金(41021064,41076052,41276081);国家“973”项目(2011CB409802);科技部国际合作项目(2010DFA24590)∗责任作者,教授,wuying@1046中国环境科学33卷域对水体DOM 进行了研究.长江是我国最大的河流,占东海所有河流径流输入的90%~95%[12],其有机碳输送对整个东海特别是近岸海域的物质循环和生态系统具有重要意义[13-14].对长江颗粒态有机质的研究虽已有报道[13-15],但通过三维荧光以及平行因子法解谱来认识长江流域溶解态有机质分布规律的报道鲜见,对DOM 生物地球化学过程的认识还不明确.本文利用EEMs -PARAFAC,探讨了长江上游至河口水体DOM 的组成、来源、生物地球化学过程以及人文活动的影响.1采样区域与方法2009年9月9日~10月13日采集长江口至上游近4000km 区域表层水样(图1),时间顺序为依次从上游至下游进行采样.32°N28°N100°E 104°E 108°E 112°E116°E120°EHH HS 武汉 东海XLJ 上海YZ WHWZ-YC3WZ-YC2WZ WZ-YC1三峡大坝JJNX JSJ-3 JSJ-2JSJ-1 AQ 图1采样站位示意Fig.1Map of sampling site in Yangtze River站位JSJ 、HH 无荧光和a 350数据DOC:水样用0.45µmol/L 的尼龙膜过滤,滤液保存至安培瓶,于-20℃冰箱冷冻保存,测试方法见文献[14].叶绿素a:GF/F 膜过滤,滤膜用90%丙酮萃取18h,萃取液在F2500荧光计上进行测定.紫外可见吸收光谱[16-17]:采样方法同DOC,避光冷冻保存,用Cary100(Varian,美国)测定,以Milli -Q 水为空白,经散射校正,换算为350nm 处的吸收系数a 350(m -1).三维荧光光谱与平行因子法[7]:采样方法同a 350,测试前于4℃冰箱避光解冻,再恢复至室温,用F4500(Hitachi)荧光分光光度计进行测定,激发波长(E x )范围250~410nm 、发射波长(E m )范围300~550nm(波长增量均为3nm),以Milli -Q 水为空白,校正散射后,利用软件MATLAB,采用平行因子法对112个三维荧光光谱谱图进行模拟识别,得到5组分,用折半分析验证结果可靠性.各个组分的值以荧光峰最高处的荧光强度即F max (RU)来表示.2结果与讨论2.1DOC 与a 350分布长江DOC 均值为90.7µmol/L,其中上、中、下游分别为76.7,115.8,108.3µmol/L.水体向下游迁移过程中,距长江口2200km 处DOC 开始迅速增加(图2),对应区域为万州至宜昌之间的库区,三峡大坝则落在此区间末.中下游DOC 浓度相当且较稳定,高出上游约50%.80.0010002000 3000 4000距长江口距离(km)40.00.0D O C (μm o l /L )2.0 1.0 1.5 0.50.0α350(m -1)0.3000.100.20ΣP (R U )距长江口距离(km)0.60 0.2 0.4ΣH (R U )图2水体DOC 和a 350,∑P 和∑H 随河口距离的变化Fig.2Variation of DOC and a 350,∑P and ∑H alongYangtze River虚线处代表库区前后分界处本文用a 350表征有色溶解有机质(CDOM)的浓度,发现a 350与DOC 的分布较相似(图2a),上、中、下游平均值分别为1.21,1.63m,1.34m -1,而6期甘淑钗等:长江溶解有机质三维荧光光谱的平行因子分析1047DOC 浓度在上游亦逐渐增加.a 350在库区后趋于平缓,其中,三峡库区所在的万州至宜昌段增加最为迅速,这一趋势和DOC 一致,不同的是库区后a 350下降的幅度更大,相比库区下降近18%.总体上,在宜昌及以上区域即库区及库前,DOC 和a 350逐渐增加,说明有机质从上游向库区迁移的过程中有明显添加富集作用;从三峡库区至库后a 350下降了18%,幅度大于DOC(6.5%),CDOM 对DOC 的贡献有所下降.2.2三维荧光组分识别和分布结合平行因子法(PARAFAC)解谱,分析得到3种类腐殖质H 1、H 2、H 3及2种蛋白质组分P 1、P 2(图3),结合已有文献报道[18-23]对峰的类型及指示意义的判断如表1.∑P 、∑H 分别为类蛋白质峰、类腐殖质峰之和,上游∑P 的均值为0.11RU,万州至宜昌有所增加,∑H 在此区间增幅较为明显,库区以后即宜昌至河口段维持在0.49RU 左右.∑P 均值明显小于∑H,约为后者的1/3,这与许多河流以腐殖质信号为优势的结果相近[2,5],该比值小于受人文活动影响较大的水体,如珠江口∑P/∑H 约2~3,污染地下水则达到9(来自实验室未发表数据).500400350450400 350300250 300 E X (nm)E m (n m )0.10.050(a)P 1500400350450400350300250300 E X (nm)E m (n m )(b)P 20.0800.060.040.02 500400350450400350300250300 E X (nm)E m (n m )(c)H 10.04 00.03 0.02 0.01500400350450400350300250300E X (nm)E m (n m )(d)H 20.04 00.03 0.02 0.01 500400350450400350300250300E X (nm)E m (n m )(e)H 30.08 00.06 0.04 0.02图3平行因子法得到的五个荧光组分P 1,P 2,H 1,H 2,H 3Fig.3Five fluorescent components P 1,P 2,H 1,H 2,H 3identified by PARAFAC model表1五种荧光峰位置及指示意义[18-23]Table 1Fluorescence groups and implications注:F max 列括号数字指次高荧光峰的激发波2.3DOC 、CDOM 相关性分析综上,DOC 和光谱信号说明三峡库区前后水体差异显著,本文将长江干流分为3个区域进行分析讨论:库前,三峡库区(分别以万州、宜昌为始组分F max -E x /E m (nm)峰类型指示意义主要来源与性质P 1270/315UVB 类蛋白质现场生产、人为排放污废水——生物可降解P 2285/350UVB 类蛋白质现场生产、人为排放污废水——生物可降解H 1315(250)/400UVA(UVC)类腐殖质农用地、污水中较明显——易光降解,生物可利用性差H 2350(280)/460UVA 类腐殖质陆源为主、自生源——易光降解,生物可利用性差H 3250/450~485UVC类腐殖质陆源为主、自生源——降解程度相对较充分,在水体中广泛存在,可光降解1048中国环境科学33卷末点),库后即宜昌至河口的区域.宜昌及以上区域水体a 350与DOC 的线性相关较好(R ²=0.94),可见空间差异并没有引起CDOM 比重的差异,说明水体条件或DOM 来源具有相似性.而宜昌以下区域数据明显偏离趋势线(图4a),而a 350指征的CDOM 是一类易于吸收光而发生光漂白或降解的物质,这暗示长江的DOM 在空间上有明显成分差异以及可能存在不同的降解、转化主导过程,浊度较低且径流量较大的中下游,水体自净能力相对较强[15],较低的a 350可能与更强的光降解有关[2].2.50 α350(m -1)2.001.50 1.00 0.50 0 50.0 150.0130.0110.090.070.0DOC(μmol/L)y =0.02x -0.24R 2=0.94(a)0.800.60 0.40 0.20 0 50.0150.0130.0110.090.070.0DOC(μmol/L)(b)ΣF l u o (R U )y =0.005x +0.08R 2=0.85图4a 350、∑Fluo 与DOC 的相关性Fig.4Correlation analysis between DOC and a 350,∑Fluo●代表库区及库前;○代表库后,即宜昌至河口,不计入线性分析;重合点为宜昌站有研究者[23-24]曾通过a 350、DOC 二者的相关性来说明CDOM 预测DOC 的可行性,或指示河口区咸淡水的混合,本文的结果说明,对于具有来源和成分差异显著的水体二者的线性相关不明显,成分差异可能与物源和选择性降解有关[19-20,25].Stedmon [19]在研究Horsens 河时发现,水体流经湖泊后对DOC 浓度无影响,但引起了CDOM 吸收系数的下降并认为光降解是重要原因,这与本文的结论相符.而宜昌及以上区域∑Fluo(5组分F max 之和)与DOC 相关性亦较高,与a 350不同的是,库区后的数据没有明显偏离趋势线(图4b),将该区域数据并入线性计算,R 2达0.92.a 350、∑Fluo 两种信号的差异在于,∑Fluo 是不同激发发射波段峰强的总和,代表了不同类别的荧光性有机物,这说明在水体差异较大的情况下,相对a 350,三维荧光作为综合指标仍可以较好地示踪DOC,从侧面说明对各组分信息的综合反映优于吸收光谱,为了更明确这一点,后面将四类荧光峰(两个类蛋白质峰不能分别作物源示踪因而合并为一类峰∑P)与DOC 进行相关性分析.2.4三维荧光对DOM 组成的反映蛋白质峰三峡库区后均值高于库前,增幅近30%,略小于类腐殖质,对比发现,库区后的∑P/∑H 从0.36降至0.33,说明类蛋白质组分在荧光信号的比重有所下降.与a 350不同,∑P 在库区及以库前水体与DOC 无明显线性相关(R 2=0.17).类蛋白质组分的生物可利用性较高,在水体中的消耗速度较快,是水体较为活跃的一部分DOM,从来源上看,这一组分可能与现场生产的贡献有关,另外来自外源输入如生活污水等也可能影响∑P 的大小[18-19],虽然可以通过类蛋白质组分来判断有机质来源,但在有限的输入和较大的径流下,可能被相对快速的迁移转化过程削弱来源的信号,或对水体总体特征的反映可能较不敏感.0.250.200.150.100.05ΣH (R U )50.070.090.0 110.0 130.0 DOC(mmol/L)图5类腐殖质峰与DOC 的线性相关关系Fig.5Correlation between 3Humic -like componentsand DOC■●▲依次代表H 1,H 2,H 3;实心代表三峡库区前(含库区),空心代表三峡库区后不同类腐殖质峰与DOC 线性相关关系不同6期甘淑钗等:长江溶解有机质三维荧光光谱的平行因子分析1049(图5),三峡库区及库前类腐殖质随水体向下迁移而增加,H1、H2所代表的长波激发类腐殖质与DOC呈显著线性正相关,R2分别为0.93、0.95.库区后水体类腐殖质峰偏离趋势线,其中H1、H2数据均落于趋势线下方,这一分布与a350相仿,而相对难降解成份(H3代表的短波激发类腐殖质)呈相反趋势,在向河口迁移的过程中比重增大,这反映了长江水体组成在空间分布上的差异,这种差异可能与物质来源以及选择性的降解转化过程有关[20].具体的来源和迁移转化过程将在后面讨论.2.5DOM来源分析不同来源(如现场生产、人为污染物排放、土壤淋溶与植物碎屑衍生等)的有机质组成有所差异,可以通过三维荧光光谱来反映DOM的来源信息.自生源是水体DOM来源之一,库区后叶绿素a(表2)高于库前两倍,相应区域的类蛋白质峰增加了30%,已有研究说明在浮游植物丰度较高的水体(如水华区)蛋白质峰明显较高,体现了现场生产对水体蛋白质类物质的贡献[2,25-27],但本文中叶绿素a与∑P(R2=0.40)、DOC(R2=0.53)的弱正相关说明现场生产并不能主导类蛋白质组分和DOM的分布.如表2所示,比较发现上游水体的悬浮颗粒物浓度(TSM)较大(高于库区及库后近10倍,这一差异可能与三峡大坝有关,且随季节气候而变[14]),可能导致光限制而使现场生产下降,尤其是浮游植物的贡献减少,因此现场生产对库前DOM的贡献小于库后.总的来说,由于浊度对光的限制,加上快速的消耗利用及大量陆源DOM的输入,浮游植物衍生有机质的贡献量十分有限,这与Wu等[13]通过碳稳定同位素13C 分析颗粒态有机质物源所得到的结论一致.以上结果说明,现场生产对DOC浓度应为非主导性因素,长江水体的DOM组成和转化包括了其他外源DOM的影响,如土壤淋溶、人为排放等.FI是在370nm激发波处450nm与500nm 发射波强度的比值,可用来表征陆源物质和微生物降解的比重,大于1.9说明主要来源于微生物等过程,小于1.4说明陆源占主要贡献,长江干流水体FI均值1.65,体现了两个端元同时贡献[28].类腐殖质峰H1在海水中被认为直接或间接源自现场生产,在陆源水体,一般认为在受外源的农田、废水影响的水体中峰较明显[18-19],库前H1为0.10RU,库区增加至0.16RU,与人文活动的影响增大的事实相符.与此相应的是,文献报道[29]水体污染对三峡库区的影响十分严重,重庆市每年排放的工业废水约10亿吨,Liu等[30]发现,长江距河口2000~3000km段溶解无机氮迅速增加,本文中DOC以及a350、荧光信号最大增幅区亦始于库前即距河口2100km左右,随后趋于平缓,说明库区及其附近人文活动的增加导致了水体的变化,在有机质组成和含量上已有所反映.Wu等[13]通过长江不同支流人口密度与DOC的线性正相关认为DOC的增加与流域非点源污染的贡献增加有关,这也辅助说明了人为因素对有机质分布的影响.表2TSM、叶绿素a、荧光信号在长江三峡库区及前后的平均值Table2TSM,Chlorophyll-a,Fluorescence average valueof Yangtze River区域TSM(mg/L)Chla(μg/L)∑P/∑H H1(RU)H3/H2FI总均值215.5-0.340.14 1.83 1.65库前368.10.060.360.10 1.63 1.77库区23.94-0.300.16 1.57 1.69库后47.800.120.330.15 2.18 1.50注:不同区间的样品数与站位图统一;-代表无数据;FI是370nm激发波处450nm与500nm发射波强度的比值2.6DOM的迁移转化过程以及三峡大坝的潜在影响光降解和生物作用是水体DOM降解转化的两个重要途径,中下游水体浊度较低、停留时间较长、径流量较大,在三峡大坝的作用下,水体动力条件差异更加明显,DOM光降解的速度和比重明显大于上游地区,迁移过程中发生了陆源土壤淋溶等难降解的物质的累积,在海洋表层也观察到了由于光降解导致的类腐殖质H3的积累[23],3类腐殖质不同趋势从侧面说明了光降解的存在和选择性.而生物可利用性较大的物质则优先被生物降解,如类蛋白质组分[20-21],对土壤衍生的以腐殖质为主的DOM降解能力较小,库区1050中国环境科学33卷前后光限制条件的差异将导致对腐殖质的光降解能力不同,因此在长时间的迁移过程中导致了DOM选择性降解和库区前后的成分差异.Hong等[2]对九龙江的研究中提出了大坝对DOM的截留和停留时间的改变导致的DOM组成和循环的变化,这一观点与库区溶解有机质的持续增加相符,虽然附近没有大的支流汇入,但沿岸城市及小支流仍带来大量外源物质,可能截留于坝区无法及时降解转化[14].2.7长江与其他河流的DOM分布特征对比长江的DOC浓度范围55.9~124.8µmol/L,明显低于人文活动影响较大的珠江[38](表3),亦小于流经热带雨林、陆源输入通量较大的亚马逊河以及高纬度地区的育空河(Yukon)(尤其在春季)[37],a350表征的CDOM浓度亦如此.比较a350/ DOC后发现,育空河和阿查法拉亚河(Atchafalaya)最高,亚马逊河、长江、珠江次之(表3),该比值反映了CDOM对溶解有机质的贡献或者有机质的光吸收能力,与物源和光降解程度有关,如寒带河流——育空河在春季冰融汛期比值达0.29[L/(µmol⋅m)],该时期土壤层和植被碎屑层冰融后释放大量有机质,未经水体充分降解,可能导致CDOM相对贡献较大;而长江地处温带,上游植被覆盖较小、土壤风化导致有机质较老[13],经历充分淋溶降解,在下游较大的径流和较长的停留时间下有机质降解更加充分,可能导致CDOM对DOC的贡献减小,而同纬度的密西西比河支流——阿查法拉亚河(Atchafalaya)该比值均值0.023[L/(µmol⋅m)],相对干流明显增加,该支流流域遍布沼泽水洼等湿地,有研究出沼泽地植被及富含有机质的土壤对CDOM有重要贡献[32-33];对于热带河流——亚马逊河,物源以植物碎屑和富含有机质的新鲜土壤居多,但较充分的光照和有限的浊度可能导致CDOM有效降解,故而比值仅略高于长江.长江中下游DOC与荧光信号较为稳定,这一特征与亚马逊河和奥里诺科河(Orinoco)[34]等世界性大河相仿.从FI值看物源,发现长江DOM的陆源特征明显低于热带河流——刚果河(FI1.22~1.44)[9],高于人文活动影响较明显的珠江,后者这一值达1.86,与之相应的是,类蛋白质在湖泊和人文活动影响较大的河流较高,而类腐殖质信号在长江、亚马逊河、麦肯吉河(Mackenzie)[35]等河流中占优势,后者均为陆源土壤淋溶、植物碎屑输入占主导的水体.以上结果反映了a350及三维荧光能够对不同河流的人文影响和物源植被特征进行表征,是示踪DOM 的有效手段.表3长江及其他区域的DOC、a350、荧光信号对比Table3DOC、a350、fluorescence of Yangtze River and other regions指标亚马逊河[36-38]育空河[39]珠江[2,40]长江*阿查法拉亚河[32]太湖[41] DOC(µmol/L)350±25141~1332136~188111.6~124.8343~599182±82 a350(m-1)4~6(a355) 2.34~39.2 1.93(a355) 1.30~1.90 6.45~17.52 2.46±0.69a350/DOC[µmol/(L⋅m)]0.013~0.0190.016~0.0290.012~0.0160.012~0.0170.019~0.0290.012~0.017 FI-- 1.86* 1.49--优势峰Humic-UVC-Protein Humic-UVC Humic-UVC Protein注:*代表来自本研究中下游数据.-代表无数据.a350/DOC非原始数据,a355则通过长江的a355/a350比换算为a350,加上数据源文献不统一,计算存在一定误差,不对小范围差异讨论3结论3.1上游至河口的∑Fluo与DOC的良好相关性说明三维荧光比吸收光谱更能有效预测、表征DOC的浓度,并可灵敏示踪反演DOM来源和转化过程.3.2长江DOM荧光组分以腐殖质为主,陆源特征明显,蛋白质峰∑P小于∑Fluo的1/4,这与人为排放和现场生产有限的DOM受稀释或快速降解转化有关.3.3上游至河口,DOM有明显降解程度和来源的空间差异:库区及以上水体DOM来源或者转6期甘淑钗等:长江溶解有机质三维荧光光谱的平行因子分析1051化途径相似性大于下游,DOC、CDOM信号的增强说明了迁移过程中外源的添加;库后信号趋于稳定,体现了中下游水体通过多种生物地化过程(光降解、生物、物理等)对有机质组成有较强的平衡能力.3.4不同荧光组分的变化趋势有所差异,说明了长江向河口输送过程中DOM迁移转化的选择性,三峡大坝可能加剧了上游和中下游水体环境差异,进而影响区域物质结构和循环.本文未能对季节差异进行对比,而在不同季节气候下DOM的来源和转化过程有所不同,或将在三维荧光上有所反映.参考文献:[1]Dittmar T,Paeng J.A heat-induced molecular signaturein marine dissolved organic matter[J].Nature Geoscience, 2010,2:175-179.[2]Hong H S,Yang L Y,Guo W D,et al.Characterizationof dissolved organic matter under contrasting hydrologic regimes in a subtropical watershed using PARAFAC model[J].Biogeochemistry,2012,109:163-174.[3]Yamashita Y,Kloeppel B D,Knoepp J,et al.Effects ofwatershed history on dissolved organic matter characteristics in Headwater Streams[J].Ecosystems,2011,14:1110-1122.[4]郭卫东,程远月,吴芳.海洋荧光溶解有机物研究进展[J].海洋通报,2007,26(1):98-106.[5]郭卫东,杨丽阳,王福利,等.水库型河流溶解有机物三维荧光光谱的平行因子分析[J].光谱学与光谱分析, 2011,31(2):427-430.[6]姚萌,罗红元,谢小青,等.城市污水厂活性污泥胞外聚合物的三维荧光特性分析[J].中国环境科学,2012,32(1):94-99.[7]Stedmon C A,Bro R.Characterizing dissolved organicmatter fluorescence with parallel factor analysis:a tutorial[J].Limnology and Oceanography:Methods,2008:572-579.[8]Del Vecchio R.Influence of the Amazon River on thesurface optical properties of the western tropical North Atlantic Ocean[J].Journal of Geophysical Research,2004,109(C11):1-13.[9]Spencer R G M,Hernes P J,Ruf R,et al.Temporalcontrols on dissolved organic matter and lignin biogeochemistry in a pristine tropical river,Democratic Republic of Congo[J].Journal of Geophysical Research,2010,115(G3):1-12.[10]Hong H,Wu J,Shang S,et al.Absorption andfluorescence of chromophoric dissolved organic matter in the Pearl River Estuary,South China[J].Marine Chemistry, 2005,97(1/2):78-89.[11]Yang L Y,Hong H S,Guo W D,et al.Effects of changing land use on dissolved organic matter in a subtropical river watershed,southeast China[J].Regional Environmental Change,2011,12(1):145-151.[12]Zhang J,Liu S M,Ren J L,et al.Progress in oceanography nutrient gradients from the eutrophic Changjiang (Yangtze River)Estuary to the oligotrophic Kuroshio waters and re-evaluation of budgets for the East China Sea Shelf[J].Progress in Oceanography,2007,74:449-478.[13]Wu Y,Zhang J,Liu S M,et al.Sources and distribution of carbon within the Yangtze River system[J].Estuarine,Coastal and Shelf Science,2007,71:13-25.[14]林晶,吴莹,张经,等.长江有机碳通量的季节变化及三峡工程对其影响[J].中国环境科学,2007,27(2):246-249.[15]Müller B,Berg M,Ping Z,et al.How polluted is the Yangtze river?Water quality downstream from the Three Gorges Dam[J].Science of the Total Enviorenment,2008,402:232-247.[16]Bricaud A,Morel A,Prieur L.Absorption by dissolved organic matter of the sea(yellow substance)in the UV and visible domain[J].Limnology and Oceanography,1981,26(1):43-53.[17]Granskog M A.Changes in spectral slopes of colored dissolved organic matter absorption with mixing and removal in a terrestrially dominated marine system[J].Marine Chemistry,2012,134-135:10-17.[18]Coble P G.Marine optical biogeochemistry:the chemistry of ocean color[J].Chemical reviews,2007,107(2):402-418.[19]Stedmon C A,Markager S.Resolving the variability in dissolved organic matter fluorescence in a temperate estuary and its catchment using PARAFAC analysis[J].Environmental Research,2005a,50(2):686-697.[20]Stedmon C A,Markager S.Tracing the production and degradation of autochthonous fractions of dissolved organic matter by fluorescence analysis[J].Limnology and Oceanography,2005b,50(5):1415-1426.[21]Jørgensen L,Stedmon C A,Kragh T,et al.Global trends in the fluorescence characteristics and distribution of marine dissolved organic matter[J].Marine Chemistry,2011,126:139-148.[22]Ishii S K L,Boyer T H.Behavior of reoccurring PARAFAC components in fluorescent dissolved organic matter in natural and engineered systems:A critical review[J]. Environmental Science and Technology,2012,46(4):2006–2017.[23]Stedmon C A,Tallec N L,Waul C K,et al.A potential approach for monitoring drinking water quality from groundwater systems using organic matter fluorescence as an early warning for contamination events [J].Environmental Research,2011,45:6030-6038.[24]Fichot C G,Benner R.A novel method to estimate DOC concentrations from CDOM absorption coefficients in coastal waters[J].Geophysical Research Letters,2011,38:1-5.1052中国环境科学33卷[25]Spencer R G M,Stubbins A,Hernes P J,et al. Photochemical degradation of dissolved organic matter and dissolved lignin phenols from the Congo River[J].Journal of Geophysical Research,2009,114(G3):1-12.[26]Fellman J B,Hood E D,Amore D V,et al.Seasonal changes in the chemical quality and biodegradability of dissolved organic matter exported from soils to streams in coastal temperate rainforest watersheds[J].Biogeochemistry,2009a,95(2):277–293.[27]Fellman J B,Hood E,Edwards R T,et al.Changes in the concentration,biodegradability,and fluorescent properties of dissolved organic matter during stormflows in coastal temperate watersheds[J].Journal of Geophysical Research,2009b,114: G01021.[28]Mcknight D M,Boyer E W,Westerhoff P K,et al. Spectrofluorometric characterization of dissolved organic matter for indication of precursor organic material and aromaticity[J]. Limnology and Oceanography,2001,46(1):38-48.[29]张殿发,王世杰,李瑞玲.土地利用/土地覆被变化对长江流域水环境的影响研究[J].地域研究与开发,2003,22(1):69-72.[30]Liu S M,Zhang J,Chen H T,et al.Nutrients in the Changjiang and its tributaries[J].Biogeochemistry,2003,62:1-18.[31]Lønborg C,Álvarez-Salgado X A,Davidson K,et al. Production of bioavailable and refractory dissolved organic matter by coastal heterotrophic microbial populations[J]. Estuarine,Coastal and Shelf Science,2009,82(4):682-688.[32]Shen Y,Fichot C G,Benner R.Floodplain influence on dissolved organic matter composition and export from the Mississippi–Atchafalaya River system to the Gulf of Mexico[J]. Limnology and Oceanography,2012,57(4):1149-1160.[33]Clark C D,Litz L P,Grant S B.Salt marshes as a source of chromophoric dissolved organic matter(CDOM)to Southern California coastal waters[J].Limnology and Oceanography, 2008,53:923-1933.[34]Battin T J.Dissolved organic matter and its optical properties in a blackwater tributary of the upper Orinoco river, Venezuela[J].Organic Geochemstry,1998,28(9):561-569.[35]Tank S E,Lesack L F W,Gareis J L,et al.Multiple tracers demonstrate distinct sources of dissolved organic matter to lakes of the Mackenzie Delta,western Canadian Arctic[J]. Limnology and Oceanography,2011,56(4):1297-1309.[36]Hedges J I,Cowie G L,Richey J E,et al.Origins and processing of organic matter in the Amazon River as indicated by carbohydrates and amino acids[J].Limnology and Oceanography, 1994,39(4):743-761[37]Del V R.Influence of the Amazon River on the surface optical properties of the western tropical North Atlantic Ocean[J].Journal of Geophysical Research,2004,109(C11):1-13.[38]Coble P G.Characterization of marine and terrestrialDOM in seawater using excitation-emission matrix spectroscopy [J].Marine Chemistry,1996,51:325-346.[39]Spencer R G M,Aiken G R,Wickland K P,et al.Seasonal and spatial variability in dissolved organic matter quantity and composition from the Yukon River basin,Alaska[J].Global Biogeochemical Cycles,2008,22(4):1-13.[40]Callahan J,Dai M,Chen R F,et al.Distribution ofdissolved organic matter in the Pearl River Estuary,China[J].Marine Chemistry,2004,89(1-4):211-224.[41]Yao X,Zhang Y,Zhu G,et al.Resolving the variabilityof CDOM fluorescence to differentiate the sources and fate of DOM in Lake Taihu and its tributaries[J].Chemosphere, 2011,82(2):145-155.作者简介:甘淑钗(1988-),女,福建宁德人,华东师范大学硕士研究生,主要从事有机地球化学方面的研究.。
太湖蓝藻水华期可溶有机物的生物降解

中国环境科学 2018,38(9):3494~3501 China Environmental Science 太湖蓝藻水华期可溶有机物的生物降解许明*,刘伟京,白永刚,涂勇(江苏省环境科学研究院,江苏省环境工程重点实验室,江苏南京 210036)摘要:以太湖蓝藻水华期产生的可溶有机物(DOM)为代表,研究溶解性有机碳(DOC)、有色DOM(CDOM)以及荧光DOM(FDOM)的生物降解,并结合平行因子分析和二维相关图谱分析(2D–COS)揭示独立FDOM组分的变化特征.结果表明,降解初期DOC浓度剧烈下降,而后缓慢降低,且与CDOM浓度线性相关.G模型拟合确定DOC中活性、半活性以及非活性部分分别占40%,37%,23%,表明藻华期DOC中大部分(77%)可在短期内降解.SUV A254、S R、HIX等指标变化说明生物降解中DOM的芳香度、平均分子质量、腐殖度等逐渐升高.4个独立FDOM组分的生物活性大小为:类色氨酸组分>类酪氨酸组分>类富里酸组分>类腐殖酸组分,其中类色氨酸和类酪氨酸是活性和半活性FDOM的主要组成,而类富里酸和类腐殖酸组分是非活性FDOM的主要组成.结合2D–COS进一步发现激发波长较低的荧光组分优先被微生物降解.关键词:蓝藻水华;可溶性有机质;生物降解;三维荧光光谱;二维相关分析中图分类号:X524 文献标识码:A 文章编号:1000–6923(2018)09–3494-08Biodegradation of dissolved organic matter in Lake Taihu during cyanobacterial blooms. XU Ming*, LIU Wei-jing, BAI Yong-gang, TU Yong (Jiangsu Key Laboratory of Environmental Engineering, Jiangsu Provincial Academy of Environmental Science, Nanjing 210036, China). China Environmental Science, 2018,38(9):3494~3501Abstract:Occurrence of cyanobacterial blooms can induce considerable patchiness in the quantity and quality of dissolved organic matter (DOM). The present study investigated the changes of dissolved organic carbon (DOC), chromophoric DOM (CDOM) and fluorescent DOM (FDOM) in an inoculated 32-day laboratory incubation. The biodegradation of individual FDOM components was further studied using parallel factor analysis (PARAFAC) and two dimension correlation spectroscopy (2D-COS). The results showed that the DOC concentration decreased significantly initially, followed by a slow biodegradation. Fitting by G model successfully separated the DOC into labile (40%), semi-labile (37%) and refractory (23%) pools, suggesting that 77% of the DOC can be metabolized quickly after its production. The values of SUV A254, spectral slope ratio, and HIX indicated that the aromaticity, molecular weight, and humic degree of DOM increased with biodegradation. The bioavailability of 4PARAFAC components followed the order of: tyrosine- > tryptophan- > fulvic acid- > humic acid-like component. Tyrosine- and tryptophan-like component accounted for a large proportion of the labile and semi-labile DOM, while the refractory DOM was mainly composed of fulvic-acid- and humic acid-like component. Synchronous fluorescence spectra combined with 2D-COS revealed that the fluorescent compounds with lower excitation wavelengths were preferentially biodegraded.Key words:cyanobacterial blooms;dissolved organic matter;biodegradation;EEM;2D-COS目前水体中浮游藻类暴发式生长,大量的代谢产物和藻体降解产物作为可溶有机物(DOM)进入水体[1-2].DOM成分复杂,主要包含糖类、蛋白质以及腐殖质等[3].生物降解作为DOM主要环境行为之一,不仅与DOM浓度和结构密切相关[4],而且对微生物群落和营养网结构具有重要影响[5].此外,DOM生物降解可消耗溶解氧,促进湖泛形成[6],而新兴有机污染物的自然消减也受DOM生物活性调控[7].由于DOM在化学组成和结构上具有高度的异质性,不同组分对环境条件与生物降解的响应显著不同,故有必要探究不同组分的具体演化机制.然而,目前关于藻华期不同DOM组分在生物降解中动态变化的异质性研究较少.DOM结构复杂,按一定的组成特性分析有利于认识DOM的降解特征.目前DOM的主要示踪方法包括溶解性有机碳(DOC)、发色DOM(CDOM)及荧光DOM(FDOM)等[8-9].其中DOC可衡量DOM的宏观碳含量,而CDOM(吸收光谱)和FDOM(荧光光谱)可深层地揭示DOM的组成、分子结构、来源及演化[10-11].除了特定波长处的绝对吸收值和荧光强度、不同波段的比例、光谱指数以及特定区域斜率等指标,光谱联合数学模型也可加深对DOM环境演变的收稿日期:2018–02–01基金项目:江苏省科技厅社会发展-面上项目(BE2017765);南京市科技计划项目(201716004)* 责任作者, 高级工程师, yexumingbai@9期 许 明等:太湖蓝藻水华期可溶有机物的生物降解 3495理解.三维荧光光谱结合平行因子分子(EEM– PARAFAC)能够分离出独立荧光组分,有效解决不同荧光团的区域重叠问题[12-13].二维相关光谱分析(2D–COS)可揭示不同DOM 结构应对外部因素的敏感度和反应顺序[14].关于2D–COS 应用于DOM 生物降解目前仍未见报道.本研究以太湖藻华期DOM 为研究对象,通过生物培养测定,结合多种分析手段,考察溶解性有机碳(DOC)、CDOM 以及FDOM 等在生物降解中的演化特征,旨在理解藻华期DOM 的生物化学特征以及环境归趋. 1 材料与方法 1.1 样品采集及准备于2017年7月在太湖梅梁湾蓝藻暴发区用棕色玻璃瓶(450℃预烧4h)采集5L 含有藻浆的湖水,先用0.70μm 孔径的预烧玻璃纤维滤膜(Whatman)过滤,再用0.22μm 孔径的聚碳酸酯滤膜(Millipore)过滤,滤液冷冻备用.设置两个平行实验,取平均值.在同样点位用抓泥斗采集表层沉积物样品,添加100g 沉积物到800mL 过滤湖水中,振荡培养过夜后用0.22μm 的聚碳酸酯滤膜过滤,将滤膜上的微生物洗脱至无菌水中,作为接种液备用. 1.2 生物培养测定DOM 的生物降解按文献[15-16]方法执行,具体如下:将48mL 过滤湖水分别置于15个锥形瓶中(450℃预烧4h),添加2mL 接种液,并添加一定浓度的无机营养盐,使得最终氨氮、硝酸盐氮和磷浓度分别为9.5, 9.8, 2.0mmol/L.用通气橡胶塞封口,在黑暗条件下恒温(25℃)振荡.分别于0, 4, 8, 16, 32d 取出3个锥形瓶,立即过滤,测定滤液的DOC 浓度、吸收光谱以及荧光光谱.另外,对照实验表明接种液产生的DOM 可忽略不计. 1.3 DOM 分析表1 常用CDOM 和FDOM 的相关指标描述Table 1 Description of commonly used optical properties of CDOM and FDOM指标计算方法作用参考文献SUV A 254 254nm 处的吸收系数除以DOC 浓度 该值较高表明CDOM 中芳香物较多 [18] S 275-295,S 350-400 用指数函数对相应波长范围内的吸收光谱进行非线性拟合该值较高表明CDOM 中低分子质量物质较多或者芳香度降低[19]S RS 275-295与S 350-400之比该值与CDOM 分子质量负相关 [19]r (A,T) A 峰(EX260/EM450)与T 峰(EX275/EM304)荧光强度之比该值表明FDOM 中类富里酸(低活性)组分与类蛋白(高活性)组分含量之比[20] r (C,A) C 峰(EX340/EM440)与A 峰(EX260/EM450)荧光强度之比该值表明FDOM 中类腐殖酸组分与类富里酸组分含量之比[21] r (C,T) C 峰(EX340/EM440)与T 峰(EX275/EM304)荧光强度之比该值表明FDOM 中类腐殖酸(低活性)组分与类蛋白质(活性)组分含量之比[20]荧光指数(FI) EX370/E M 470处与EX370/EM520处的荧光强度之比 该值表明FDOM 中陆源组分和微生物来源组分含量之比 [21]腐殖指数(HIX)EX254/EM(435–480)区域内的荧光强度与EX254/EM(300–345)+EM(435–480)区域内的荧光强度之比该值较高表明FDOM 中腐殖质组分含量较高或腐殖化程度较高[22]生源指数(BIX) EX310/E M 430处与EX310/EM380处的荧光强度之比 该值大于1表明FDOM 中自生性组分含量较高 [22]DOC 浓度由TOC -Vcph 型总有机碳分析仪(岛津,日本)通过高温燃烧(680℃)联用非色散红外检测测定.吸收光谱由UV -2550型紫外可见分光光度计(岛津,日本)测定,光程路径10cm,测试波段200~ 800nm,间隔1nm,以700nm 处吸收值校正基线,Milli -Q 水为参比.吸收系数a λ(m -1)按式(1)计算:2.303A a r λλ= (1) 式中:A λ为波长λ处吸光度,r 为光程路径(m).荧光光谱由F -7000型荧光分光光度计(日立,日本)测定,激发光源为150W 氙弧灯,光电倍增管电压为700V .同步荧光光谱的扫描波段200~450nm,间隔1nm,发射波长与激发波长差值∆λ为60nm,扫描速度240nm/ min.EEM 光谱的激发扫描波段200~450nm,间隔5nm,发射扫描波段250~550nm,间隔1nm,狭缝宽度5nm,扫描速度1200nm/min.采集光谱后,首先按仪器相关方法修正内部误差,继而通过瑞利效应赋值和拉曼散射综合区域标准化消除干扰峰.将EEM 数据导入MATLAB(R2012a 版本)软件,用drEEM 工具箱(1.0版本)进行:(1)内滤效应修正;(2)扣除空白修正;(3)将荧光强度归一化为激发波长350nm 处的拉曼信号强度(RU 350)[17].内滤效应修正公式为:3496 中 国 环 境 科 学 38卷Ex Em ()/2cor obs 10A A F F +=× (2)式中:F obs 和F cor 分别为修正前后的荧光强度,A Ex 和A Em 分别为相应激发和发射波长处的吸光度.按表1计算吸收光谱和荧光光谱的相关指标. 1.4 数据分析1.4.1 生物降解模型 G 模型基于一级降解动力学理论,假定DOM 中活性组分和半活性组分的生物降解遵循一级动力学,而非活性组分不会被降解,且与水质、微生物、培养方式无关[23].采用G 模型拟合DOM 的生物降解,如式(3)所示:120123DOC e e e k t k t C C C −−=++ (3)式中:t 为降解时间(d),C 1、C 2、C 3分别为活性、半活性和难降解DOC 的浓度(mg/L),k 1、k 2为降解系数(d -1).采用SigmaPlot 软件(12.0版本)对不同降解时间t 的DOC 浓度进行非线性拟合,得到C 1、C 2、C 3. 1.4.2 PARAFAC 分析 通过交替最小二乘算法,把整个EEM 数据矩阵分离为相互独立的荧光组分,每个组分代表一个单独的荧光团或者一组强烈共变化的荧光团.采用drEEM 工具箱对样品的EEM 数据进行PARAFAC 运算,该工具箱以N -way 工具箱中的PARAFAC 算法为内核.通过比较不同组分数量的残差分布以及S4C6T3半检验分析验证模型有效性,并将最终得到的每个组分最大荧光强度(F max )作为其相对浓度[17].1.4.3 2D–COS 分析 2D–COS 分析可通过信号峰之间变化的关系揭示不同DOM 组分在生物降解中的反应顺序.以降解时间为外部扰动因素,用2D Shige 软件(关西大学,日本)对同步荧光光谱进行2D–COS 分析,并将同步图和异步图用Matlab 软件重新绘制.1.4.4 统计学分析 用Origin 8.5软件计算平均值和标准差.采用单样本T 检验比较结果,若P < 0.05,认为具有显著性. 2 结果与讨论2.1 生物降解中DOC 变化如图1所示,藻华期湖水的初始DOC 浓度为(29.10 ± 2.37) mg/L,经过32d 生物降解后,降低至(7.11 ± 0.51) mg/L,去除率达76%.其中前8d 平均降解速率为2.35mg C/(L·d),而后24d 平均降解速率仅为0.13mg C/(L·d).因此,降解初期DOM 中活性组分被微生物快速利用,但随时间推移,非活性组分难以被降解.通过G 模型拟合,发现活性,半活性以及非活性DOC 浓度分别为11.74, 11.16, 6.65mg/L (R 2= 0.9776).与河水、城镇污水以及土壤等陆源DOC 相比[15,24-25],藻华DOC 的生物活性较高(77%).文献报道藻源DOM 在生物反应器中5d 内DOC 浓度可降低40%[26].这些值意味着藻华产生的DOC 中活性组分(40%)可在湖泊表层短期内降解,半活性组分(37%)的降解需要数十天,经水团交换后更可能发生湖泊深层[23].然而,非活性组分(23%)降解周期未知,可作为碳库长期存在.降解时间(d)51015 20 25 3035D O C 浓度(m g /L )5101520253035图1 经历不同生物降解时间后的DOC 浓度变化以及G 模型拟合Fig.1 Concentrations of DOC after biodegradation withvarying time, along with the G –model fitting2.2 生物降解中CDOM 变化如图2a 所示,藻华期湖水CDOM 的吸收系数250~600nm 呈指数式降低,其中波长小于300nm 的CDOM 与蛋白发色团有关,而300~400nm 之间的CDOM 则可能来自于蓝藻体内的紫外线保护剂[27].以a 254表征CDOM 的浓度,在32d 的生物降解中从(33.37 ± 2.26)m -1降低至(22.55 ± 0.47)m -1(表2),且与DOC 浓度显著相关(P < 0.05)(图2b).藻华CDOM 的初始SUV A 254值为(0.51 ± 0.21)L/(mg C·m),低于常见地表水的SUV A 254值(1.0~6.0L/(mg C·m))[9],说明其主要包含254nm 处无吸收的小分子脂肪族物质.极低的SUV A 254值也证实了蓝藻生物量是藻华期湖水CDOM 的主要来源.微生物消耗小分子脂肪族物质,而大分子腐殖类物质不易被降解,故腐殖类物质比例升高,SUV A 254值升高.9期许 明等:太湖蓝藻水华期可溶有机物的生物降解 3497250 300 350 400 450 5005吸收系数(m -1)波长(nm)5 10 15 20 25 30351620 24 28 32 36 a254(m -1)DOC(mg/L)图2 经历不同生物降解时间后的DOM 吸收光谱变化Fig.2 Absorption characterization of DOM afterbiodegradation with varying timea 为吸收系数变化;b 为a 254与DOC 浓度的线性拟合CDOM 的吸收光谱斜率S 和斜率比S R 与其相对分子质量和芳香度密切相关[20].地表水CDOM 的S 275–295值为0.012~0.023nm -1,其值越低意味着DOM的相对分子质量越高[9].本研究中S 275–295值随生物降解而逐渐降低,而S 350–400值逐渐升高.这不仅与小分子脂肪族物质降解有关,而且在降解后期微生物残体累积也可能造成S 350–400值升高.S R 值可用来鉴定天然水体CDOM 的来源,其值大于1说明藻体和水生植物是主要来源[9].S R 值从1.71±0.20降低至0.82±0.07,与SUV A 254值变化一致.前人研究也发现河水DOM 在生物降解过程中低波长段CDOM 的损失高于长波长段CDOM [4]. 2.3 生物降解中FDOM 变化2.3.1 FDOM 指标 一般来说,陆源FDOM 的FI 值较低,而微生物来源的FDOM 的FI 值较高[22].藻华期湖水FDOM 的初始FI 值为1.83 ± 0.01,接近于蓝藻胞内有机质的FI 值(1.2~1.8)[28].FI 值在生物降解中变化不明显,但HIX 值显著升高(P <0.05).HIX 值表征FDOM 腐殖化程度,其原理是由于腐殖化过程中H/C 值降低,荧光分子的发射光谱向长波长移动,故HIX 值升高.虽然第16~32d 内DOC 浓度变化较低,但HIX 值显著升高,表明微生物可将低腐殖度组分转化高腐殖度组分.初始BIX 值大于1,证实藻华期湖水FDOM 的自生性.随着自生性物质被降解, BIX 值逐渐降低,但在降解后期呈现波动式变化.前人研究藻体生物降解过程中发现了类似的结果[2].与BIX 类似,r (C,T)和r (A,T)可表征FDOM 中类腐殖组分与类蛋白组分的相对含量,这两个比值越高,意味着类腐殖组分相对含量越高.藻华期湖水FDOM 的初始r (C,T)和r (A,T)较低,并随生物降解而升高,表明类蛋白组分含量降低.虽然峰A 和峰C 都与类腐殖物质有关,但两者生物降解中的行为不同.降解初期(前8d)峰A 相对于峰C 优先被降解,从而r (C,A)从0.78 ± 0.08升高到0.91 ± 0.04.然而,降解末期r (C,A)降低至0.87 ± 0.02,说明峰A 和峰C 的总体损失相似.表2 经历不同生物降解时间后CDOM 和FDOM 相关指标变化(平均值±标准偏差) Table 2 Optical properties of CDOM and FDOM after biodegradation with varying time (means ± SD )CDOM 指标 FDOM 指标降解 时间(d) a 254 (m –1) SUV A 254 [L/(mg C ⋅m)]S 275-295(×10-2nm -1) S 350-400(×10-2nm -1)S Rr (A,T) r (C,A) r (C,T) FI HIX BIX0 33.37 ± 2.26 0.51 ± 0.21 1.62 ± 0.20 0.95 ± 0.15 1.71 ± 0.200.70 ± 0.150.78 ± 0.080.54 ± 0.08 1.83 ± 0.01 0.96 ± 0.03 1.07 ± 0.074 29.67 ± 0.26 0.60 ± 0.14 1.32 ± 0.02 1.04 ± 0.08 1.27 ± 0.120.73 ± 0.120.89 ± 0.010.65 ± 0.11 1.85 ± 0.01 1.10 ± 0.06 1.02 ± 0.018 26.12 ± 1.24 1.08 ± 0.05 1.20 ± 0.04 1.13 ± 0.08 1.06 ± 0.05 1.00 ± 0.330.91 ± 0.040.90 ± 0.27 1.86 ± 0.01 1.16 ± 0.110.91 ± 0.0116 24.49 ± 0.93 1.28 ± 0.16 1.17 ± 0.03 1.20 ± 0.060.98 ± 0.02 1.24 ± 0.060.90 ± 0.03 1.12 ± 0.03 1.86 ± 0.01 1.38 ± 0.040.92 ± 0.013222.55 ± 0.471.25 ± 0.141.15 ± 0.02 1.40 ± 0.120.82 ± 0.07 1.54 ± 0.130.87 ± 0.02 1.34 ± 0.15 1.85 ± 0.02 1.65 ± 0.020.96 ± 0.02虽然FI 、HIX 、SUV A 254都与DOM 分子质量、芳香度和生物活性有关,但相关性分析表明它们之3498 中 国 环 境 科 学 38卷间不存在线性关系.如图3所示,表征类腐殖组分和类蛋白组分比例的r (C,T)、r (A,T)、r (C,A)、BIX 以及HIX 之间,r (C,T)和r (A,T)以及HIX 显著相关(P <0.05).这些复杂的相关性表明DOM 结构复杂,各指标代表了不同的组分.然而,由于不同荧光团可能存在覆盖,这些指标只能宏观上体现DOM 的结构变化,无法进一步量化不同荧光组分的具体变化.0.0 0.2 0.4 0.6 0.8 1.0 1.2 1.41.6r (A , T )r (C, T)0.0 0.2 0.4 0.6 0.8 1.0 1.2 1.41.60.30.6 0.9 1.2 1.5 H I Xr (C, T)图3 r (C,T)和r (A,T)以及HIX 的线性相关拟合 Fig.3 Linear relationships between values of r (C,T), r (A,T)and HIXa 为r (C,T)和r (A,T);b 为r (C,T)和HIX2.3.2 PARAFAC 组分变化 通过PARAFAC 运算,共得到4个独立荧光组分,半检验分析表明它们的激发光谱和发射光谱高度重叠(图4).组分C1激发最大值在235nm 处,发射最大值在400nm 处,与文献中的类富里酸组分相似[29].组分C2在235和265nm 处存在激发最大值,在302nm 处存在发射最大值,可归为类蛋白质中的酪氨酸组分[30].组分C3也具有2个激发最大值,分别在235, 275nm 处,一个发射最大值在330nm 处,代表类蛋白质中的色氨酸组分[30].组分C4的2个激发最大值分别位于265, 365nm 处,发射最大值位于460nm 处,与类腐殖酸荧光组分相似[30].以四个荧光组分的F max 之和表示FDOM 浓度,发现C1、C2、C3以及C4分别占21%、20%、40%以及19%,即类色氨酸组分相对含量最高.可以看出,PARAFAC 不仅能够得到具体的独立荧光因子,还可以定量比较不同组分的含量.如图5a 所示,FDOM 浓度在生物降解中降解了60%,不同荧光因子的响应不同.其中C2和C3的F max 值分别从(1.13 ± 0.18) RU 和(2.27 ± 0.13) RU 降低至(0.38 ± 0.03) RU 和(0.52 ± 0.05) RU,去除率分别为66%和77%,而C1和C4的去除率则分别为40%和34%.换言之,4个荧光组分的生物活性大小为C3 > C2 > C1 > C4.进一步用G 模型拟合4个组分的生物降解,结合DOC 的拟合结果可知,活性和半活性DOM 中C3是主要组成,分别占54%和49%,其次为C2(25%和22%),而难降解DOM 中C1和C4各占31%.DOM 中类蛋白组分的含量与活性DOM 组分含量正相关,并且自由态氨基酸能够被异养微生物快速利用[4].但在本研究中,相当一部分的C2和C3(44%和33%)不能被降解,这可能是由于类蛋白组分与类腐殖组分之间潜在的络合作用限制了它们对微生物的利用性,但荧光性并未抑制[31].前人研究发现类色氨酸和类酪氨酸组分含量之和与活性DOC 浓度相关,而类酪氨酸组分含量与半活性DOC浓度相关,说明类酪氨酸组分的生物活性比类色氨酸组分低[32].因此,类蛋白组分中只有活性部分可表征FDOM 的生物活性.如图5b 所示,随着类蛋白组分的快速降解,类腐殖组分相对含量逐渐升高,表明难降解FDOM 主要为类腐殖物质.有文献指出类腐殖物质在生物降解中基本没有变化[4],而在本研究中类腐殖组分也具有一定程度的生物活性.虽然藻华期湖水FDOM 与陆源高度腐殖化FDOM 的荧光光谱相似,但藻华期湖水FDOM 相对新鲜,生物降解程度低,所以更易被降解.类腐殖组分的活性规律取决于其化学组成和降解历史[18].相较而言,组分C1比C4的生物活性高,这主要是因为腐殖酸比富里酸的分子质量高,结构更紧实,难以被微生物分解.总体来说,藻华期湖水FDOM 的活性程度与其他来源的FDOM 不同,具体组分的生物活性有待进一步研究.9期许 明等:太湖蓝藻水华期可溶有机物的生物降解 3499E m(nm)250 300 350 400 450 500 550E x(n m )250300 350 400 450 C1250 300 350 4004505005500.000.05 0.10 0.15 0.20 0.25 0.30 0.35 组分C1荷载 波长(nm)E m(nm)250300350400450500550E x(n m )250300350400450C2250 300 350 400 4505005500.00.1 0.2 0.3 0.4 0.5 0.6 组分C2荷载波长(nm)E m(nm)250 300 350 400 450 500 550E x(n m ) 250300 350 400 450 C3250 300 350 4004505005500.00.1 0.2 0.3 0.4 0.5 组分C3荷载波长(nm)E m(nm)250300350400450500550E x(n m )250300350400450C4 250 300 350 400 4505005500.000.050.10 0.15 0.20 0.250.30 荷载 波长(nm)组分C4图4 PARAFAC 组分的EEM 光谱及半检验分析Fig.4 EEM spectrum of the four PARAFAC components and the highly overlaid excitation and emission spectra estimated usingthe split -half validation procedure0 5 10 15 20 25 30降解时间(d)荧光强度(R U350)4816 32102030405060708090100含量百分比(%)降解时间(d)C1C2C3C4(b)图5 经历不同生物降解时间后PARAFAC 组分变化Fig.5 Changes in the four PARAFAC components after biodegradation with varying timea 为F max 值;b 为含量百分比2.3.3 2D–COS 分析 藻华期湖水FDOM 的同步荧光光谱如图6a 所示,232nm 处的荧光峰为类酪氨酸物质,275nm 处的荧光峰为类色氨酸物质,而326, 364nm 处的2个肩峰可分别归为类富里酸和类腐殖酸物质.以降解时间为外部干扰因素,对荧光光谱进行2D–COS 分析(图6b 和6c).同步图的对角线上,分别在235, 275, 326, 364nm 处观察到4个正交峰,而在235/275nm 、235/364nm 以及275/364nm 附近的3个正交叉峰表明类酪氨酸、类色氨酸和类腐殖酸荧光峰的荧光强度变化一致(随生物降解而降低).根据Noda 规则[33],异步图可以揭示不同波长处光谱变化的顺序.若λ1/λ2处的光谱信号为正,则λ1处的光谱变化比λ2处的更迅速;若λ1/λ2处的光谱信号为负,则λ1处的光谱变化落后于λ2处.在异步图对角线下存在两个负交叉峰,分别位于364/235和364/275nm,而在275/235、326/275以及364/326nm 处的光谱信号均为负,这些光谱特征表明四个荧光峰的变化顺序为:235 > 275 > 326 > 364nm.换言之,低激发波长的FDOM 对生物降解的敏感性更强.结合PARAFAC 结果,虽然类酪氨酸物质对生物降解的敏感度高于类色氨酸物质,但类色氨酸组分的生物活性较高.这可能是因为藻华期DOM 中类色氨酸的底物浓度高于类酪氨酸物质,而降解速率一般与底物浓度成正比.与此不同,2D–COS 分析中采用通过标准化排除3500 中 国 环 境 科 学 38卷了底物浓度的影响.200 250 300350 400 45050100 150 200250 荧光强度波长(nm) 波长(nm)波长(n m )200 250 300 350 400 4500.5×1041×1041.5×1042×1042.5×1043×104波长(nm)波长(n m )200250 300 350 400 450-3000-2000-10000100020003000图6 经历不同生物降解时间后FDOM 的同步荧光光谱变化以及2D–COS 分析Fig.6 Changes in the synchronous fluorescence spectra ofFDOM and 2D–COS analysisa 为同步荧光光谱;b 为同步图;c 为异步图3 结论3.1 藻华期湖水DOM 生物活性很高,生物降解符合G 模型,活性,半活性以及非活性DOC 分别占40%、37%以及23%.大量活性组分的生物降解将消耗大量溶氧,增加湖泛风险.3.2 CDOM 和FDOM 的光谱指标变化说明小分子脂肪族组分生物活性很高,而大分子芳香族组分生物难以被微生物降解,从而DOM 腐殖度升高. 3.3 EEM–PARAFAC 表明4个荧光组分的生物活性大小为:类色氨酸组分C3>类酪氨酸组分C2>类富里酸组分C1>类腐殖酸组分C4,结合2D–COS 进一步发现四个组分的降解顺序为C2 > C3 > C1 > C4.类蛋白组分与类腐殖组分生物活性的异质性表明藻华暴发可改变湖泊水体中的碳源结构,进而影响微生物群落结构.参考文献:[1] 王成林,潘维玉,韩月琪,等.全球气候变化对太湖蓝藻水华发展演变的影响 [J]. 中国环境科学, 2010,30(6):822-828.[2] Zhang Y L, Liu X H, Wang M Z, et al. Compositional differences ofchromophoric dissolved organic matter derived from phytoplanktonand macrophytes [J]. Organic Geochemistry, 2013,55:26-37.[3] Philippe A, Schaumann G E. Interactions of dissolved organic matterwith natural and engineered inorganic colloids: A review [J]. Environmental Science & Technology, 2014,48(16):8946-8962. [4] Cory R M, Kaplan L A. Biological lability of streamwater fluorescentdissolved organic matter [J]. L imnology and Oceanography, 2012,57(5):1347-1360.[5] Wear E K, Carlson C A, James A K, et al. Synchronous shifts indissolved organic carbon bioavailability and bacterial community responses over the course of an upwelling -driven phytoplankton bloom [J]. Limnology and Oceanography, 2015,60(2):657-677. [6] 李佐琛,段洪涛,张玉超,等.藻源型湖泛发生过程水色变化规律 [J].中国环境科学, 2015,35(2):524-532.[7] Tan D T, Temme H R, Arnold W A, et al. Estrone degradation: Doesorganic matter (quality), matter? [J]. Environmental Science & Technology, 2015,49(1):498-503.[8] 闫金龙,江 韬,赵秀兰,等.含生物质炭城市污泥堆肥中溶解性有机质的光谱特征 [J]. 中国环境科学, 2014,34(2):459-465.[9] Hansen A M, Kraus T E C, Pellerin B A, et al. Optical properties ofdissolved organic matter (DOM): Effects of biological and photolytic degradation [J]. L imnology and Oceanography, 2016,61(3):1015- 1032.[10] 崔东宇,何小松,席北斗,等.牛粪堆肥过程中水溶性有机物演化的光谱学研究 [J]. 中国环境科学, 2014,34(11):2897-2904.[11] 李 丹,何小松,高如泰,等.紫外-可见光谱研究堆肥水溶性有机物不同组分演化特征 [J]. 中国环境科学, 2016,36(11):3412-3421. [12] 沈 烁,王育来,杨长明,等.南淝河不同排口表层沉积物DOM 光谱特征 [J]. 中国环境科学, 2014,(9):2351-2361.[13] 刘丽贞,黄 琪,吴永明,等.鄱阳湖CDOM 三维荧光光谱的平行因子分析 [J]. 中国环境科学, 2018,38(1):293-302.[14] Hur J, Jung K Y , Jung Y M. Characterization of spectral responses ofhumic substances upon UV irradiation using two -dimensional correlation spectroscopy [J]. Water Research, 2011,45(9):2965-2974. [15] Hosen J D, Mcdonough O T, Febria C M, et al. Dissolved organic9期许明等:太湖蓝藻水华期可溶有机物的生物降解 3501matter quality and bioavailability changes across an urbanization gradient in headwater streams [J]. Environmental Science & Technology, 2014,48(14):7817-7824.[16] Mcdowell W H, Zsolnay A, Aitkenhead-Peterson J A, et al. Acomparison of methods to determine the biodegradable dissolved organic carbon from different terrestrial sources [J]. Soil Biology & Biochemistry, 2006,38(7):1933-1942.[17] Murphy K R, Stedmon C A, Graeber D, et al. Fluorescencespectroscopy and multi-way techniques. PARAFAC [J]. Analytical Methods, 2013,5(23):6557-6566.[18] Weishaar J L, Aiken G R, Bergamaschi B A, et al. Evaluation ofspecific ultraviolet absorbance as an indicator of the chemical composition and reactivity of dissolved organic carbon [J].Environmental Science & Technology, 2003,37(20):4702-4708. [19] Helms J R, Stubbins A, Ritchie J D, et al. Absorption spectral slopesand slope ratios as indicators of molecular weight, source, and photobleaching of chromophoric dissolved organic matter [J].Limnology and Oceanography, 2008,53(3):955-969.[20] Baker A, Bolton L, Newson M, et al. Spectrophotometric properties ofsurface water dissolved organic matter in an afforested upland peat catchment [J]. Hydrological Processes, 2008,22(13):2325-2336. [21] Cory R M, Mcneill K, Cotner J P, et al. Singlet oxygen in the coupledphotochemical and biochemical oxidation of dissolved organic matter [J]. Environmental Science & Technology, 2010,44(10):3683-3689. [22] Huguet A, Vacher L, Relexans S, et al. Properties of fluorescentdissolved organic matter in the Gironde Estuary [J]. Organic Geochemistry, 2009,40(6):706-719.[23] Sleighter R L, Cory R M, Kaplan L A, et al. A coupled geochemicaland biogeochemical approach to characterize the bioreactivity of dissolved organic matter from a headwater stream [J]. Journal of Geophysical Research-Biogeosciences, 2014,119(8):1520-1537. [24] Saadi I, Borisover M, Armon R, et al. Monitoring of effluent DOMbiodegradation using fluorescence, UV and DOC measurements [J].Chemosphere, 2006,63(3):530-539.[25] Ohno T, Parr T B, Gruselle M C I, et al. Molecular composition andbiodegradability of soil organic matter: A case study comparing two new England forest types [J]. Environmental Science & Technology, 2014,48(13):7229-7236.[26] Nguyen M L, Westerhoff P, Baker L, et al. Characteristics andreactivity of algae-produced dissolved organic carbon [J]. Journal of Environmental Engineering-Asce, 2005,131(11):1574-1582.[27] Maie N, Scully N M, Pisani O, et al. Composition of a protein-likefluorophore of dissolved organic matter in coastal wetland and estuarine ecosystems [J]. Water Research, 2007,41(3):563-570.[28] Korak J A, Wert E C, Rosario-Ortiz F L. Evaluating fluorescencespectroscopy as a tool to characterize cyanobacteria intracellular organic matter upon simulated release and oxidation in natural water [J]. Water Research, 2015,68:432-443.[29] 李晓洁,高红杰,郭冀峰,等.三维荧光与平行因子研究黑臭河流DOM[J]. 中国环境科学, 2018,38(1):311-319.[30] Lee B M, Seo Y S, Hur J. Investigation of adsorptive fractionation ofhumic acid on graphene oxide using fluorescence EEM-PARAFAC [J].Water Research, 2015,73:242-251.[31] Zang X, Van Heemst J D H, Dria K J, et al. Encapsulation of protein inhumic acid from a histosol as an explanation for the occurrence of organic nitrogen in soil and sediment [J]. Organic Geochemistry, 2000,31(7/8):679-695.[32] Guillemette F, Del Giorgio P A. Reconstructing the various facets ofdissolved organic carbon bioavailability in freshwater ecosystems [J].Limnology and Oceanography, 2011,56(2):734-748.[33] Noda I, Ozaki Y. Two-dimensional correlation spectroscopy:applications in vibrational and optical spectroscopy [M]. London: John Wiley and Sons Inc., 2005.作者简介:许明(1982–),男,江苏连云港人,高级工程师,博士,主要从事水污染控制工程.发表论文20余篇.。
天目湖流域DOM和CDOM光学特性的对比

基金项目: 江苏省杰出青年基金项目 ( BK2012050 ) ; 国家水体污染控 制与治理科技重大专项 ( 2012ZX07101 - 010 ) ; 中国科学 院南 京 地 理 与 湖 泊 研 究 所“ 一 三 五 ”重 点 布 局 项 目 ( NIGLAS2012135003 ) hhuniucheng@ 163. com. 作者简介: 牛城( 1984 - ) , 男, 内蒙古赤峰人, * 责任作者, 张运林( 1976 - ) , 男, 湖南邵阳人, 研究员, 博士, 博导, 主 要从事湖泊光学、 水色遥感、 溶解性有机物生物地球化学循环 、 湖泊 ylzhang@ niglas. ac. cn 生态学的研究,
第9 期
牛
城等: 天目湖流域 DOM 和 CDOM 光学特性的对比
999
showed marked seasonal variations. The characteristics of a350 and S R value in DOM and CDOM samples showed the same seasonal variation; the samples can be used as references for each other. Key words: Lake Tianmuhu catchment; dissolved organic matter; absorption coefficient; spectral slope coefficient
天目湖流域 DOM 和 CDOM 光学特性的对比
牛
1, 2 1* 1 1, 2 1, 2 1, 2 城 ,张运林 ,朱广伟 ,王明珠 ,周永强 ,刘笑菡
1. 中国科学院南京地理与湖泊研究所 ,江苏 南京 210008 2. 中国科学院大学,北京 100049 CDOM( 有色可溶性有机物) 的光学特性进行了研究 , 摘要: 对 2011 年 1 —12 月天目湖流域河流及湖体中 DOM( 可溶性有机物) 、 CDOM 的 a350 ( 350 nm 处的吸收系数) 、 S280 ~ 500 ( 280 ~ 500 nm 波段指数函数拟合曲线斜率 ) 、 SR ( 光 对比分析了河流和湖体 DOM、 谱斜率比) 以及 M( a250 a365 ) 值. 结果表明, 天目湖流域 a350 ( CDOM) a350 ( DOM ) 的年均值为 0. 856 4 , 说明 CDOM 对光的吸收占 CDOM 的 a350 年均值分别为 ( 4. 24 ± 1. 89 ) 、 ( 3. 40 ± 1. 48 ) m - 1 , ( 2. 22 ± 0. 83 ) 主导. 河流 DOM、 明显大于湖体的 ( 2. 42 ± 0. 84 ) 、 m -1, CDOM 的 S280 ~ 500 年均值分别为 ( 15. 98 ± 0. 83 ) 、 ( 17. 96 ± 0. 81 ) 表明外源河流输入是天目湖中 DOM 的主要来源. 河流 DOM、
太湖有色可溶性有机物荧光的空间分布及其与吸收的关系

太湖有色可溶性有机物荧光的空间分布及其与吸收的关系
太湖有色可溶性有机物荧光的空间分布及其与吸收的关系
利用紫外分光光度法和荧光法测定了2004年12月到2005年3月太湖不同湖区有色可溶性有机物(CDOM)的吸收和荧光,分析了CDOM荧光发光光谱、空间分布及其与吸收系数、溶解性有机碳(DOC)浓度之间的关系.结果表明,在355 nm光激发下,CDOM在450nm处荧光峰值相当明显.CDOM荧光值存在明显空间差异,高值出现在竺山湾、梅梁湾、五里湖等湖区,低值出现在东太湖、贡湖湾等湖区,污染严重的北部湖区一般高于南部湖区.定标后的荧光值Fn(355)、CDOM吸收系数a(355)、DOC浓度4个月均值分别为(11.87±3.49)N.FL.U、(3.45±1.33)m-1、(9.50±2.79)mg·L-1.Fn(355)与CDOM吸收系数、DOC浓度存在非常显著的线性关系,并且随波长降低相关性逐渐增加.4次观测到的a(355)与Fn(355)线性关系式的斜率值相差很小,相对比较稳定,a(355)与Fn(355)的比值在30%左右.
作者:张运林秦伯强龚志军ZHANG Yun-lin QIN Bo-qiang GONG Zhi-jun 作者单位:中国科学院南京地理与湖泊研究所,江苏,南京,210008 刊名:农业环境科学学报ISTIC PKU英文刊名:JOURNAL OF AGRO-ENVIRONMENT SCIENCE 年,卷(期):2006 25(5) 分类号:X524 关键词:太湖有色可溶性有机物荧光溶解性有机碳。
河流水体中溶解性有机物构成的三维荧光光谱解析

河流水体中溶解性有机物构成的三维荧光光谱解析赵胜楠【期刊名称】《《黑龙江科技信息》》【年(卷),期】2017(000)014【总页数】2页(P95-96)【关键词】大石河; 溶解性有机物; 三维荧光; 荧光指数【作者】赵胜楠【作者单位】河南理工大学资源环境学院河南焦作454000【正文语种】中文溶解性有机物(DOM)由大量的有机分子组成,广泛存在于天然水体中,是一种复杂的混合物。
DOM中主要含有腐殖质、富里酸等各种亲水性有机酸等[1]。
如DOM与水体中有机污染物、金属离子等反应,则影响水体中污染物的毒性、生物降解性及迁移转化特性[2],从而对于水体的生态环境产生重要影响[3]。
因此研究水体中的DOM得到越来越多的关注。
在研究各种水体DOM的中,目前应用三维荧光光谱(Three Dimensional Excitation Emission Matrix,3DEEM)研究DOM特性较多,因其灵敏度高、信息量高、所需样品量少且不破坏样品结构的优点,在如湖泊、河流、海洋等水体的DOM荧光特性的研究中广泛应用,被用于解析DOM在各种水体中的来源、分布等并由此判断水体的水质[4]。
2.1 河流概况大石河位于焦作市区西部的中站区,平水年在距出山口10km范围内河水全部漏失完毕,只在个别丰水年份才有洪水排泄。
大石河所处地形略向南和南东倾斜,坡降10~17‰,北部为坡洪积斜地,南部为冲洪积扇,河流两侧土壤以黏土夹砾石为主,地下水主要蕴藏于第四系细砂、中细砂、粗砂和砂砾石含水层中。
目前,中站工业园区内,一些工矿企业排放的污水多流入大石河,大石河成为纳污河流。
而大石河附近村庄分布较多,人口集聚,居民生产生活废水流入大石河。
大石河两岸附近村民多以第四系地下水作为饮用水源,因此解析河流中DOM的构成对于河流两岸居民饮用水源的保护及地表水污染的防治具有重要的意义。
2.2 水样采集与分析依据大石河的流向及周围村庄的分布情况,在上游、中游、下游共设置了6个采样点,分别编为佰利联(1#)、焦克路(2#)、人民路(3#)、丰收路(4#)、陆村(5#)、灵泉湖(6#)。
三维荧光结合平行因子分析在东海溶解有机物研究中的应用
年东海春季航次 、秋季 航次 采集 的 , 采 样站 位如 图 1所 示。 采集表层 、中层 和底 层水 样 3 0 0 mL,经 G F / F滤 膜 ( wh a t —
收稿 日期 : 2 0 1 2 — 0 7 — 2 2 。修订 日期 : 2 0 1 2 — 1 0 — 3 0
重 。 l o
F i g . 1 S a mp l i n g l o c a t i o n s
1 . 2 三维荧光光谱 的测定
三维荧光光 谱用 HI T AC HI F - 4 5 0 0型荧 光分 光光 度计 进行测定 ,激发和发射 狭缝宽度分别 为 5和 1 0 n n 2 ,扫描 波
*通 讯 联 系 人 e - ma i l : wh z h a o @ ms . q d i o . a c . c n
e - ma i8 7 @1 6 3 . c o n r
第 3期
0
光谱学与光谱分析
6 5 7
n' 扫一 昌 I | } 8口 8∞ a J 0 I ;
O O O O O O
m 鸲 ∞
0
0
呈 o
【 工一
2 0
2 5
3 0
3 5
4 0
2 O
2 5
3 0
3 5
4 0
S a l i n i t y / P s u 0
S a l i n i t y / P s u
莹 。
( c 0M) 的荧 光组分特征 , 并对其种类 、 分布和来源进行了分析和讨论 。 共识别出三个荧光组分 , 分别为类 蛋
白荧光组分 C 1 ( 2 3 5 , 2 8 0 / 3 3 0 ) 、 陆 源或 海源 类腐 殖 质组 分 C 2 ( 2 5 5 , 3 3 0 / 4 0 0 ) 以及 陆源类 腐 殖质 组分 C 3 ( 2 7 5 , 3 6 0 / 4 8 0 ) 。 两个类腐殖质组分 c 2和 C 3之间呈显著正相关 , 表明他们有相同的来源或在结构上存在某 种联 系。 三组分在两个季节不 同水层 的分布总体呈现近岸高 , 远海低 的特点 。 各组分与叶绿素 a 和盐度 的关 系表明调查海域的 D OM 受现存浮游植物的直接影响很小 , 夏季长 江输入是 长江 口三组分 的重要来源 ,而秋
《2024年乌梁素海CDOM时空分布特征及其组分来源分析》范文
《乌梁素海CDOM时空分布特征及其组分来源分析》篇一一、引言乌梁素海,作为我国重要的内陆湖泊之一,其水质状况及水体中化学成分的分布特征一直是环境科学领域研究的热点。
其中,有色溶解有机物(CDOM)作为水体中一种重要的光学活性物质,对水体光化学过程、营养盐循环及生态环境有着深远的影响。
本文将就乌梁素海CDOM的时空分布特征进行详细的分析,并对其组分来源进行深入探讨。
二、研究区域与方法2.1 研究区域乌梁素海位于我国某地,具有独特的地理环境和气候特点。
本文将针对乌梁素海的水体进行CDOM的时空分布及组分来源分析。
2.2 研究方法(1)采样方法:在乌梁素海的不同区域、不同时间点进行水样采集,确保样品的代表性。
(2)CDOM测定:采用紫外-可见光谱扫描法对水样中的CDOM进行测定。
(3)数据分析:运用统计学方法对CDOM的时空分布特征进行分析,并结合组分来源进行综合评价。
三、乌梁素海CDOM的时空分布特征3.1 时间分布特征通过对乌梁素海不同时间点的CDOM数据进行统计分析,发现CDOM的浓度在一年四季中呈现出明显的变化趋势。
其中,春季和夏季CDOM浓度较高,可能与此时期水体中生物活动增强有关;而秋冬季节CDOM浓度相对较低,可能与水温降低、生物活动减弱有关。
3.2 空间分布特征在空间上,乌梁素海CDOM的分布也呈现出一定的规律。
靠近岸边的区域CDOM浓度较高,而远离岸边的深水区CDOM浓度相对较低。
这可能与岸边区域人类活动频繁、污染源较多有关。
四、乌梁素海CDOM组分来源分析4.1 自然来源乌梁素海CDOM的自然来源主要包括水生植物的自养作用、微生物分解作用等。
这些过程会产生大量的溶解性有机物,其中一部分具有颜色,构成了CDOM的一部分。
4.2 人为来源人为来源主要包括生活污水、农业污水、工业废水等。
这些污水中含有大量的有机物,进入水体后经过一系列的物理、化学和生物过程,部分有机物会转化为CDOM。
五、结论通过对乌梁素海CDOM的时空分布特征及组分来源进行分析,我们得出以下结论:(1)乌梁素海CDOM的时间分布受到季节变化的影响,春季和夏季浓度较高,秋冬季节浓度较低。
太湖蓝藻水华期可溶有机物的生物降解
太湖蓝藻水华期可溶有机物的生物降解许明;刘伟京;白永刚;涂勇【摘要】以太湖蓝藻水华期产生的可溶有机物(DOM)为代表,研究溶解性有机碳(DOC)、有色DOM(CDOM)以及荧光DOM(FDOM)的生物降解,并结合平行因子分析和二维相关图谱分析(2D-COS)揭示独立FDOM组分的变化特征.结果表明,降解初期DOC浓度剧烈下降,而后缓慢降低,且与CDOM浓度线性相关.G模型拟合确定DOC中活性、半活性以及非活性部分分别占40%,37%,23%,表明藻华期DOC中大部分(77%)可在短期内降解.SUVA254、SR、HIX等指标变化说明生物降解中DOM的芳香度、平均分子质量、腐殖度等逐渐升高.4个独立FDOM组分的生物活性大小为:类色氨酸组分>类酪氨酸组分>类富里酸组分>类腐殖酸组分,其中类色氨酸和类酪氨酸是活性和半活性FDOM的主要组成,而类富里酸和类腐殖酸组分是非活性FDOM的主要组成.结合2D-COS进一步发现激发波长较低的荧光组分优先被微生物降解.【期刊名称】《中国环境科学》【年(卷),期】2018(038)009【总页数】8页(P3494-3501)【关键词】蓝藻水华;可溶性有机质;生物降解;三维荧光光谱;二维相关分析【作者】许明;刘伟京;白永刚;涂勇【作者单位】江苏省环境科学研究院,江苏省环境工程重点实验室,江苏南京210036;江苏省环境科学研究院,江苏省环境工程重点实验室,江苏南京 210036;江苏省环境科学研究院,江苏省环境工程重点实验室,江苏南京 210036;江苏省环境科学研究院,江苏省环境工程重点实验室,江苏南京 210036【正文语种】中文【中图分类】X524目前水体中浮游藻类暴发式生长,大量的代谢产物和藻体降解产物作为可溶有机物(DOM)进入水体[1-2].DOM成分复杂,主要包含糖类、蛋白质以及腐殖质等[3].生物降解作为DOM主要环境行为之一,不仅与DOM浓度和结构密切相关[4],而且对微生物群落和营养网结构具有重要影响[5].此外,DOM生物降解可消耗溶解氧,促进湖泛形成[6],而新兴有机污染物的自然消减也受DOM生物活性调控[7].由于DOM 在化学组成和结构上具有高度的异质性,不同组分对环境条件与生物降解的响应显著不同,故有必要探究不同组分的具体演化机制.然而,目前关于藻华期不同DOM组分在生物降解中动态变化的异质性研究较少.DOM结构复杂,按一定的组成特性分析有利于认识DOM的降解特征.目前DOM 的主要示踪方法包括溶解性有机碳(DOC)、发色DOM(CDOM)及荧光DOM(FDOM)等[8-9].其中DOC可衡量DOM的宏观碳含量,而CDOM(吸收光谱)和FDOM(荧光光谱)可深层地揭示DOM的组成、分子结构、来源及演化[10-11].除了特定波长处的绝对吸收值和荧光强度、不同波段的比例、光谱指数以及特定区域斜率等指标,光谱联合数学模型也可加深对DOM环境演变的理解.三维荧光光谱结合平行因子分子(EEM– PARAFAC)能够分离出独立荧光组分,有效解决不同荧光团的区域重叠问题[12-13].二维相关光谱分析(2D–COS)可揭示不同DOM结构应对外部因素的敏感度和反应顺序[14].关于2D–COS应用于DOM生物降解目前仍未见报道.本研究以太湖藻华期DOM为研究对象,通过生物培养测定,结合多种分析手段,考察溶解性有机碳(DOC)、CDOM以及FDOM等在生物降解中的演化特征,旨在理解藻华期DOM的生物化学特征以及环境归趋.于2017年7月在太湖梅梁湾蓝藻暴发区用棕色玻璃瓶(450℃预烧4h)采集5L含有藻浆的湖水,先用0.70μm孔径的预烧玻璃纤维滤膜(Whatman)过滤,再用0.22μm孔径的聚碳酸酯滤膜(Millipore)过滤,滤液冷冻备用.设置两个平行实验,取平均值.在同样点位用抓泥斗采集表层沉积物样品,添加100g沉积物到800mL过滤湖水中,振荡培养过夜后用0.22μm的聚碳酸酯滤膜过滤,将滤膜上的微生物洗脱至无菌水中,作为接种液备用.DOM的生物降解按文献[15-16]方法执行,具体如下:将48mL过滤湖水分别置于15个锥形瓶中(450 ℃预烧4h),添加2mL接种液,并添加一定浓度的无机营养盐,使得最终氨氮、硝酸盐氮和磷浓度分别为9.5, 9.8, 2.0mmol/L.用通气橡胶塞封口,在黑暗条件下恒温(25℃)振荡.分别于0, 4, 8, 16, 32d取出3个锥形瓶,立即过滤,测定滤液的DOC浓度、吸收光谱以及荧光光谱.另外,对照实验表明接种液产生的DOM可忽略不计.DOC浓度由TOC-Vcph型总有机碳分析仪(岛津,日本)通过高温燃烧(680℃)联用非色散红外检测测定.吸收光谱由UV-2550型紫外可见分光光度计(岛津,日本)测定,光程路径10cm,测试波段200~ 800nm,间隔1nm,以700nm处吸收值校正基线,Milli-Q水为参比.吸收系数aλ(m-1)按式(1)计算:(1)式中:Al为波长l处吸光度,r为光程路径(m).荧光光谱由F-7000型荧光分光光度计(日立,日本)测定,激发光源为150W氙弧灯,光电倍增管电压为700V.同步荧光光谱的扫描波段200~450nm,间隔1nm,发射波长与激发波长差值∆λ为60nm,扫描速度240nm/ min.EEM光谱的激发扫描波段200~450nm,间隔5nm,发射扫描波段250~550nm,间隔1nm,狭缝宽度5nm,扫描速度1200nm/min.采集光谱后,首先按仪器相关方法修正内部误差,继而通过瑞利效应赋值和拉曼散射综合区域标准化消除干扰峰.将EEM数据导入MATLAB(R2012a版本)软件,用drEEM工具箱(1.0版本)进行:(1)内滤效应修正;(2)扣除空白修正;(3)将荧光强度归一化为激发波长350nm处的拉曼信号强度(RU350)[17].内滤效应修正公式为:式中:Fobs和Fcor分别为修正前后的荧光强度,AEx和AEm分别为相应激发和发射波长处的吸光度.按表1计算吸收光谱和荧光光谱的相关指标.1.4.1 生物降解模型 G模型基于一级降解动力学理论,假定DOM中活性组分和半活性组分的生物降解遵循一级动力学,而非活性组分不会被降解,且与水质、微生物、培养方式无关[23].采用G模型拟合DOM的生物降解,如式(3)所示:式中:t为降解时间(d),C1、C2、C3分别为活性、半活性和难降解DOC的浓度(mg/L),k1、k2为降解系数(d-1).采用SigmaPlot软件(12.0版本)对不同降解时间t的DOC浓度进行非线性拟合,得到C1、C2、C3.1.4.2 PARAFAC分析通过交替最小二乘算法,把整个EEM数据矩阵分离为相互独立的荧光组分,每个组分代表一个单独的荧光团或者一组强烈共变化的荧光团.采用drEEM工具箱对样品的EEM数据进行PARAFAC运算,该工具箱以N-way工具箱中的PARAFAC算法为内核.通过比较不同组分数量的残差分布以及S4C6T3半检验分析验证模型有效性,并将最终得到的每个组分最大荧光强度(Fmax)作为其相对浓度[17].1.4.3 2D–COS分析 2D–COS分析可通过信号峰之间变化的关系揭示不同DOM 组分在生物降解中的反应顺序.以降解时间为外部扰动因素,用2D Shige软件(关西大学,日本)对同步荧光光谱进行2D–COS分析,并将同步图和异步图用Matlab软件重新绘制.1.4.4 统计学分析用Origin 8.5软件计算平均值和标准差.采用单样本T检验比较结果,若P < 0.05,认为具有显著性.如图1所示,藻华期湖水的初始DOC浓度为(29.10 ± 2.37) mg/L,经过32d生物降解后,降低至(7.11 ± 0.51) mg/L,去除率达76%.其中前8d平均降解速率为2.35mg C/(L·d),而后24d平均降解速率仅为0.13mg C/(L·d).因此,降解初期DOM中活性组分被微生物快速利用,但随时间推移,非活性组分难以被降解.通过G 模型拟合,发现活性,半活性以及非活性DOC浓度分别为11.74, 11.16, 6.65mg/L (R2= 0.9776).与河水、城镇污水以及土壤等陆源DOC相比[15,24-25],藻华DOC 的生物活性较高(77%).文献报道藻源DOM在生物反应器中5d内DOC浓度可降低40%[26].这些值意味着藻华产生的DOC中活性组分(40%)可在湖泊表层短期内降解,半活性组分(37%)的降解需要数十天,经水团交换后更可能发生湖泊深层[23].然而,非活性组分(23%)降解周期未知,可作为碳库长期存在.如图2a所示,藻华期湖水CDOM的吸收系数250~600nm呈指数式降低,其中波长小于300nm的CDOM与蛋白发色团有关,而300~400nm之间的CDOM则可能来自于蓝藻体内的紫外线保护剂[27].以a254表征CDOM的浓度,在32d的生物降解中从(33.37 ± 2.26)m-1降低至(22.55 ± 0.47)m-1(表2),且与DOC浓度显著相关(P < 0.05)(图2b).藻华CDOM的初始SUVA254值为(0.51 ± 0.21)L/(mg C·m),低于常见地表水的SUVA254值(1.0~6.0L/(mg C·m))[9],说明其主要包含254nm处无吸收的小分子脂肪族物质.极低的SUVA254值也证实了蓝藻生物量是藻华期湖水CDOM的主要来源.微生物消耗小分子脂肪族物质,而大分子腐殖类物质不易被降解,故腐殖类物质比例升高,SUVA254值升高.CDOM的吸收光谱斜率S和斜率比SR与其相对分子质量和芳香度密切相关[20].地表水CDOM的S275–295值为0.012~0.023nm-1,其值越低意味着DOM的相对分子质量越高[9].本研究中S275–295值随生物降解而逐渐降低,而S350–400值逐渐升高.这不仅与小分子脂肪族物质降解有关,而且在降解后期微生物残体累积也可能造成S350–400值升高.SR值可用来鉴定天然水体CDOM的来源,其值大于1说明藻体和水生植物是主要来源[9].SR值从1.71±0.20降低至0.82±0.07,与SUVA254值变化一致.前人研究也发现河水DOM在生物降解过程中低波长段CDOM的损失高于长波长段CDOM[4].2.3.1 FDOM指标一般来说,陆源FDOM的FI值较低,而微生物来源的FDOM的FI值较高[22].藻华期湖水FDOM的初始FI值为1.83 ± 0.01,接近于蓝藻胞内有机质的FI值(1.2~1.8)[28].FI值在生物降解中变化不明显,但HIX值显著升高(P<0.05).HIX值表征FDOM腐殖化程度,其原理是由于腐殖化过程中H/C值降低,荧光分子的发射光谱向长波长移动,故HIX值升高.虽然第16~32d内DOC浓度变化较低,但HIX值显著升高,表明微生物可将低腐殖度组分转化高腐殖度组分.初始BIX值大于1,证实藻华期湖水FDOM的自生性.随着自生性物质被降解, BIX值逐渐降低,但在降解后期呈现波动式变化.前人研究藻体生物降解过程中发现了类似的结果[2].与BIX类似,r(C,T)和r(A,T)可表征FDOM中类腐殖组分与类蛋白组分的相对含量,这两个比值越高,意味着类腐殖组分相对含量越高.藻华期湖水FDOM的初始r(C,T)和r(A,T)较低,并随生物降解而升高,表明类蛋白组分含量降低.虽然峰A和峰C都与类腐殖物质有关,但两者生物降解中的行为不同.降解初期(前8d)峰A相对于峰C优先被降解,从而r(C,A)从0.78 ± 0.08升高到0.91 ± 0.04.然而,降解末期r(C,A)降低至0.87 ± 0.02,说明峰A和峰C的总体损失相似.虽然FI、HIX、SUVA254都与DOM分子质量、芳香度和生物活性有关,但相关性分析表明它们之间不存在线性关系.如图3所示,表征类腐殖组分和类蛋白组分比例的r(C,T)、r(A,T)、r(C,A)、BIX以及HIX之间,r(C,T)和r(A,T)以及HIX显著相关(P<0.05).这些复杂的相关性表明DOM结构复杂,各指标代表了不同的组分.然而,由于不同荧光团可能存在覆盖,这些指标只能宏观上体现DOM的结构变化,无法进一步量化不同荧光组分的具体变化.2.3.2 PARAFAC组分变化通过PARAFAC运算,共得到4个独立荧光组分,半检验分析表明它们的激发光谱和发射光谱高度重叠(图4).组分C1激发最大值在235nm处,发射最大值在400nm处,与文献中的类富里酸组分相似[29].组分C2在235和265nm处存在激发最大值,在302nm处存在发射最大值,可归为类蛋白质中的酪氨酸组分[30].组分C3也具有2个激发最大值,分别在235, 275nm处,一个发射最大值在330nm处,代表类蛋白质中的色氨酸组分[30].组分C4的2个激发最大值分别位于265, 365nm处,发射最大值位于460nm处,与类腐殖酸荧光组分相似[30].以四个荧光组分的Fmax之和表示FDOM浓度,发现C1、C2、C3以及C4分别占21%、20%、40%以及19%,即类色氨酸组分相对含量最高.可以看出,PARAFAC不仅能够得到具体的独立荧光因子,还可以定量比较不同组分的含量. 如图5a所示,FDOM浓度在生物降解中降解了60%,不同荧光因子的响应不同.其中C2和C3的Fmax值分别从(1.13 ± 0.18) RU和(2.27 ± 0.13) RU降低至(0.38 ± 0.03) RU和(0.52 ± 0.05) RU,去除率分别为66%和77%,而C1和C4的去除率则分别为40%和34%.换言之,4个荧光组分的生物活性大小为C3 > C2 > C1 > C4.进一步用G模型拟合4个组分的生物降解,结合DOC的拟合结果可知,活性和半活性DOM中C3是主要组成,分别占54%和49%,其次为C2(25%和22%),而难降解DOM中C1和C4各占31%.DOM中类蛋白组分的含量与活性DOM组分含量正相关,并且自由态氨基酸能够被异养微生物快速利用[4].但在本研究中,相当一部分的C2和C3(44%和33%)不能被降解,这可能是由于类蛋白组分与类腐殖组分之间潜在的络合作用限制了它们对微生物的利用性,但荧光性并未抑制[31].前人研究发现类色氨酸和类酪氨酸组分含量之和与活性DOC浓度相关,而类酪氨酸组分含量与半活性DOC浓度相关,说明类酪氨酸组分的生物活性比类色氨酸组分低[32].因此,类蛋白组分中只有活性部分可表征FDOM的生物活性.如图5b所示,随着类蛋白组分的快速降解,类腐殖组分相对含量逐渐升高,表明难降解FDOM主要为类腐殖物质.有文献指出类腐殖物质在生物降解中基本没有变化[4],而在本研究中类腐殖组分也具有一定程度的生物活性.虽然藻华期湖水FDOM 与陆源高度腐殖化FDOM的荧光光谱相似,但藻华期湖水FDOM相对新鲜,生物降解程度低,所以更易被降解.类腐殖组分的活性规律取决于其化学组成和降解历史[18].相较而言,组分C1比C4的生物活性高,这主要是因为腐殖酸比富里酸的分子质量高,结构更紧实,难以被微生物分解.总体来说,藻华期湖水FDOM的活性程度与其他来源的FDOM不同,具体组分的生物活性有待进一步研究.2.3.3 2D–COS分析藻华期湖水FDOM的同步荧光光谱如图6a所示,232nm处的荧光峰为类酪氨酸物质,275nm处的荧光峰为类色氨酸物质,而326, 364nm处的2个肩峰可分别归为类富里酸和类腐殖酸物质.以降解时间为外部干扰因素,对荧光光谱进行2D–COS分析(图6b和6c).同步图的对角线上,分别在235, 275, 326, 364nm处观察到4个正交峰,而在235/275nm、235/364nm以及275/364nm 附近的3个正交叉峰表明类酪氨酸、类色氨酸和类腐殖酸荧光峰的荧光强度变化一致(随生物降解而降低).根据Noda规则[33],异步图可以揭示不同波长处光谱变化的顺序.若λ1/λ2处的光谱信号为正,则λ1处的光谱变化比λ2处的更迅速;若λ1/λ2处的光谱信号为负,则λ1处的光谱变化落后于λ2处.在异步图对角线下存在两个负交叉峰,分别位于364/235和364/275nm,而在275/235、326/275以及364/326nm处的光谱信号均为负,这些光谱特征表明四个荧光峰的变化顺序为:235 > 275 > 326 > 364nm.换言之,低激发波长的FDOM对生物降解的敏感性更强.结合PARAFAC结果,虽然类酪氨酸物质对生物降解的敏感度高于类色氨酸物质,但类色氨酸组分的生物活性较高.这可能是因为藻华期DOM中类色氨酸的底物浓度高于类酪氨酸物质,而降解速率一般与底物浓度成正比.与此不同,2D–COS分析中采用通过标准化排除了底物浓度的影响.3.1 藻华期湖水DOM生物活性很高,生物降解符合G模型,活性,半活性以及非活性DOC分别占40%、37%以及23%.大量活性组分的生物降解将消耗大量溶氧,增加湖泛风险.3.2 CDOM和FDOM的光谱指标变化说明小分子脂肪族组分生物活性很高,而大分子芳香族组分生物难以被微生物降解,从而DOM腐殖度升高.3.3 EEM–PARAFAC表明4个荧光组分的生物活性大小为:类色氨酸组分C3>类酪氨酸组分C2>类富里酸组分C1>类腐殖酸组分C4,结合2D–COS进一步发现四个组分的降解顺序为C2 > C3 > C1 > C4.类蛋白组分与类腐殖组分生物活性的异质性表明藻华暴发可改变湖泊水体中的碳源结构,进而影响微生物群落结构. [1] 王成林,潘维玉,韩月琪,等.全球气候变化对太湖蓝藻水华发展演变的影响[J]. 中国环境科学, 2010,30(6):822-828.[2] Zhang Y L, Liu X H, Wang M Z, et al. Compositional differences of chromophoric dissolved organic matter derived from phytoplankton and macrophytes [J]. Organic Geochemistry, 2013,55:26-37.[3] Philippe A, Schaumann G E. Interactions of dissolved organic matter with natural and engineered inorganic colloids: A review [J]. Environmental Science & Technology, 2014,48(16):8946-8962.[4] Cory R M, Kaplan L A. Biological lability of streamwater fluorescent dissolved organic matter [J]. Limnology and Oceanography, 2012,57(5):1347-1360.[5] Wear E K, Carlson C A, James A K, et al. Synchronous shifts in dissolved organic carbon bioavailability and bacterial community responses over the course of an upwelling-driven phytoplankton bloom [J].Limnology and Oceanography, 2015,60(2):657-677.[6] 李佐琛,段洪涛,张玉超,等.藻源型湖泛发生过程水色变化规律 [J]. 中国环境科学, 2015,35(2):524-532.[7] Tan D T, Temme H R, Arnold W A, et al. Estrone degradation: Does organic matter (quality), matter? [J]. Environmental Science & Technology, 2015,49(1):498-503.[8] 闫金龙,江韬,赵秀兰,等.含生物质炭城市污泥堆肥中溶解性有机质的光谱特征 [J]. 中国环境科学, 2014,34(2):459-465.[9] Hansen A M, Kraus T E C, Pellerin B A, et al. Optical properties of dissolved organic matter (DOM): Effects of biological and photolytic degradation [J]. Limnology and Oceanography, 2016,61(3):1015- 1032. [10] 崔东宇,何小松,席北斗,等.牛粪堆肥过程中水溶性有机物演化的光谱学研究[J]. 中国环境科学, 2014,34(11):2897-2904.[11] 李丹,何小松,高如泰,等.紫外-可见光谱研究堆肥水溶性有机物不同组分演化特征[J]. 中国环境科学, 2016,36(11):3412-3421.[12] 沈烁,王育来,杨长明,等.南淝河不同排口表层沉积物DOM光谱特征[J]. 中国环境科学, 2014,(9):2351-2361.[13] 刘丽贞,黄琪,吴永明,等.鄱阳湖CDOM三维荧光光谱的平行因子分析 [J]. 中国环境科学, 2018,38(1):293-302.[14] Hur J, Jung K Y, Jung Y M. Characterization of spectral responses of humic substances upon UV irradiation using two-dimensional correlation spectroscopy [J]. Water Research, 2011,45(9):2965-2974.[15] Hosen J D, Mcdonough O T, Febria C M, et al. Dissolved organic matter quality and bioavailability changes across an urbanization gradientin headwater streams [J]. Environmental Science & Technology,2014,48(14):7817-7824.[16] Mcdowell W H, Zsolnay A, Aitkenhead-Peterson J A, et al. A comparison of methods to determine the biodegradable dissolved organic carbon from different terrestrial sources [J]. Soil Biology & Biochemistry, 2006,38(7):1933-1942.[17] Murphy K R, Stedmon C A, Graeber D, et al. Fluorescence spectroscopy and multi-way techniques. PARAFAC [J]. Analytical Methods, 2013,5(23):6557-6566.[18] Weishaar J L, Aiken G R, Bergamaschi B A, et al. Evaluation of specific ultraviolet absorbance as an indicator of the chemical composition and reactivity of dissolved organic carbon [J]. Environmental Science & Technology, 2003,37(20):4702-4708.[19] Helms J R, Stubbins A, Ritchie J D, et al. Absorption spectral slopes and slope ratios as indicators of molecular weight, source, and photobleaching of chromophoric dissolved organic matter [J]. Limnology and Oceanography, 2008,53(3):955-969.[20] Baker A, Bolton L, Newson M, et al. Spectrophotometric properties of surface water dissolved organic matter in an afforested upland peat catchment [J]. Hydrological Processes, 2008,22(13):2325-2336.[21] Cory R M, Mcneill K, Cotner J P, et al. Singlet oxygen in the coupled photochemical and biochemical oxidation of dissolved organic matter [J]. Environmental Science & Technology, 2010,44(10):3683-3689.[22] Huguet A, Vacher L, Relexans S, et al. Properties of fluorescentdissolved organic matter in the Gironde Estuary [J]. Organic Geochemistry, 2009,40(6):706-719.[23] Sleighter R L, Cory R M, Kaplan L A, et al. A coupled geochemical and biogeochemical approach to characterize the bioreactivity of dissolved organic matter from a headwater stream [J]. Journal of Geophysical Research-Biogeosciences, 2014,119(8):1520-1537.[24] Saadi I, Borisover M, Armon R, et al. Monitoring of effluent DOM biodegradation using fluorescence, UV and DOC measurements [J]. Chemosphere, 2006,63(3):530-539.[25] Ohno T, Parr T B, Gruselle M C I, et al. Molecular composition and biodegradability of soil organic matter: A case study comparing two new England forest types [J]. Environmental Science & Technology,2014,48(13):7229-7236.[26] Nguyen M L, Westerhoff P, Baker L, et al. Characteristics and reactivity of algae-produced dissolved organic carbon [J]. Journal of Environmental Engineering-Asce, 2005,131(11):1574-1582.[27] Maie N, Scully N M, Pisani O, et al. Composition of a protein-like fluorophore of dissolved organic matter in coastal wetland and estuarine ecosystems [J]. Water Research, 2007,41(3):563-570.[28] Korak J A, Wert E C, Rosario-Ortiz F L. Evaluating fluorescence spectroscopy as a tool to characterize cyanobacteria intracellular organic matter upon simulated release and oxidation in natural water [J]. Water Research, 2015,68:432-443.[29] 李晓洁,高红杰,郭冀峰,等.三维荧光与平行因子研究黑臭河流DOM [J]. 中国环境科学, 2018,38(1):311-319.[30] Lee B M, Seo Y S, Hur J. Investigation of adsorptive fractionation of humic acid on graphene oxide using fluorescence EEM-PARAFAC [J]. Water Research, 2015,73:242-251.[31] Zang X, Van Heemst J D H, Dria K J, et al. Encapsulation of protein in humic acid from a histosol as an explanation for the occurrence of organic nitrogen in soil and sediment [J]. Organic Geochemistry, 2000,31(7/8):679-695.[32] Guillemette F, Del Giorgio P A. Reconstructing the various facets of dissolved organic carbon bioavailability in freshwater ecosystems [J]. Limnology and Oceanography, 2011,56(2):734-748.[33] Noda I, Ozaki Y. Two-dimensional correlation spectroscopy: applications in vibrational and optical spectroscopy [M]. London: John Wiley and Sons Inc., 2005.【相关文献】[1] 王成林,潘维玉,韩月琪,等.全球气候变化对太湖蓝藻水华发展演变的影响[J]. 中国环境科学, 2010,30(6):822-828.[2] Zhang Y L, Liu X H, Wang M Z, et al. Compositional differences of chromophoric dissolved organic matter derived from phytoplankton and macrophytes [J]. Organic Geochemistry, 2013,55:26-37.[3] Philippe A, Schaumann G E. Interactions of dissolved organic matter with natural and engineered inorganic colloids: A review [J]. Environmental Science & Technology, 2014,48(16):8946-8962.[4] Cory R M, Kaplan L A. Biological lability of streamwater fluorescent dissolved organic matter [J]. Limnology and Oceanography, 2012, 57(5):1347-1360.[5] Wear E K, Carlson C A, James A K, et al. Synchronous shifts in dissolved organic carbon bioavailability and bacterial community responses over the course of an upwelling-driven phytoplankton bloom [J]. Limnology and Oceanography, 2015,60(2):657-677.[6] 李佐琛,段洪涛,张玉超,等.藻源型湖泛发生过程水色变化规律 [J]. 中国环境科学,2015,35(2):524-532.[7] Tan D T, Temme H R, Arnold W A, et al. Estrone degradation: Does organic matter (quality), matter? [J]. Environmental Science & Technology, 2015,49(1):498-503.[8] 闫金龙,江韬,赵秀兰,等.含生物质炭城市污泥堆肥中溶解性有机质的光谱特征 [J]. 中国环境科学, 2014,34(2):459-465.[9] Hansen A M, Kraus T E C, Pellerin B A, et al. Optical properties of dissolved organic matter (DOM): Effects of biological and photolytic degradation [J]. Limnology and Oceanography, 2016,61(3):1015- 1032.[10] 崔东宇,何小松,席北斗,等.牛粪堆肥过程中水溶性有机物演化的光谱学研究 [J]. 中国环境科学, 2014,34(11):2897-2904.[11] 李丹,何小松,高如泰,等.紫外-可见光谱研究堆肥水溶性有机物不同组分演化特征[J]. 中国环境科学, 2016,36(11):3412-3421.[12] 沈烁,王育来,杨长明,等.南淝河不同排口表层沉积物DOM光谱特征[J]. 中国环境科学, 2014,(9):2351-2361.[13] 刘丽贞,黄琪,吴永明,等.鄱阳湖CDOM三维荧光光谱的平行因子分析 [J]. 中国环境科学, 2018,38(1):293-302.[14] Hur J, Jung K Y, Jung Y M. Characterization of spectral responses of humic substances upon UV irradiation using two-dimensional correlation spectroscopy [J]. Water Research, 2011,45(9):2965-2974.[15] Hosen J D, Mcdonough O T, Febria C M, et al. Dissolved organic matter quality and bioavailability changes across an urbanization gradient in headwater streams [J]. Environmental Science & Technology, 2014,48(14):7817-7824.[16] Mcdowell W H, Zsolnay A, Aitkenhead-Peterson J A, et al. A comparison of methods to determine the biodegradable dissolved organic carbon from different terrestrial sources [J]. Soil Biology & Biochemistry, 2006,38(7):1933-1942.[17] Murphy K R, Stedmon C A, Graeber D, et al. Fluorescence spectroscopy and multi-way techniques. PARAFAC [J]. Analytical Methods, 2013,5(23):6557-6566.[18] Weishaar J L, Aiken G R, Bergamaschi B A, et al. Evaluation of specific ultraviolet absorbance as an indicator of the chemical composition and reactivity of dissolved organic carbon [J]. Environmental Science & Technology, 2003,37(20):4702-4708.[19] Helms J R, Stubbins A, Ritchie J D, et al. Absorption spectral slopes and slope ratios as indicators of molecular weight, source, and photobleaching of chromophoric dissolved organic matter [J]. Limnology and Oceanography, 2008,53(3):955-969.[20] Baker A, Bolton L, Newson M, et al. Spectrophotometric properties of surface water dissolved organic matter in an afforested upland peat catchment [J]. HydrologicalProcesses, 2008,22(13):2325-2336.[21] Cory R M, Mcneill K, Cotner J P, et al. Singlet oxygen in the coupled photochemical and biochemical oxidation of dissolved organic matter [J]. Environmental Science & Technology, 2010,44(10):3683-3689.[22] Huguet A, Vacher L, Relexans S, et al. Properties of fluorescent dissolved organic matter in the Gironde Estuary [J]. Organic Geochemistry, 2009,40(6):706-719.[23] Sleighter R L, Cory R M, Kaplan L A, et al. A coupled geochemical and biogeochemical approach to characterize the bioreactivity of dissolved organic matter from a headwater stream [J]. Journal of Geophysical Research-Biogeosciences,2014,119(8):1520-1537.[24] Saadi I, Borisover M, Armon R, et al. Monitoring of effluent DOM biodegradation using fluorescence, UV and DOC measurements [J]. Chemosphere, 2006,63(3):530-539. [25] Ohno T, Parr T B, Gruselle M C I, et al. Molecular composition and biodegradability of soil organic matter: A case study comparing two new England forest types [J]. Environmental Science & Technology, 2014,48(13):7229-7236.[26] Nguyen M L, Westerhoff P, Baker L, et al. Characteristics and reactivity of algae-produced dissolved organic carbon [J]. Journal of Environmental Engineering-Asce, 2005,131(11):1574-1582.[27] Maie N, Scully N M, Pisani O, et al. Composition of a protein-like fluorophore of dissolved organic matter in coastal wetland and estuarine ecosystems [J]. Water Research, 2007,41(3):563-570.[28] Korak J A, Wert E C, Rosario-Ortiz F L. Evaluating fluorescence spectroscopy as a tool to characterize cyanobacteria intracellular organic matter upon simulated release and oxidation in natural water [J]. Water Research, 2015,68:432-443.[29] 李晓洁,高红杰,郭冀峰,等.三维荧光与平行因子研究黑臭河流DOM [J]. 中国环境科学, 2018,38(1):311-319.[30] Lee B M, Seo Y S, Hur J. Investigation of adsorptive fractionation of humic acid on graphene oxide using fluorescence EEM-PARAFAC [J]. Water Research, 2015,73:242-251.[31] Zang X, Van Heemst J D H, Dria K J, et al. Encapsulation of protein in humic acid from a histosol as an explanation for the occurrence of organic nitrogen in soil and sediment [J]. Organic Geochemistry, 2000,31(7/8):679-695.[32] Guillemette F, Del Giorgio P A. Reconstructing the various facets of dissolved organic carbon bioavailability in freshwater ecosystems [J]. Limnology and Oceanography, 2011,56(2):734-748.[33] Noda I, Ozaki Y. Two-dimensional correlation spectroscopy: applications in vibrational and optical spectroscopy [M]. London: John Wiley and Sons Inc., 2005. Biodegradation of dissolved organic matter in Lake Taihu during cyanobacterial blooms.。
大汶河-东平湖CDOM的荧光特征及与营养物质的耦合关系
大汶河-东平湖CDOM的荧光特征及与营养物质的耦合关系吕伟伟;姚昕;张保华【摘要】东平湖作为南水北调东线工程最后一级调蓄水湖以及山东省西水东调的水源地,其水质状况对受水区的用水安全起着决定性作用.结合2014年夏季对大汶河和东平湖有色可溶性有机物(CDOM)三维荧光的测定分析,探讨了夏季大汶河输入对东平湖CDOM的贡献及荧光强度与叶绿素a(Chla)、化学需氧量(COD)和溶解态有机碳(DOC)的关系.利用平行因子分析法对CDOM三维荧光图谱进行解析,获得4种荧光组分,其中组分1和组分3为类腐殖质荧光、组分2和组分4为类蛋白荧光;从大汶河汶口坝到东平湖出湖口处,类腐殖质荧光强度逐渐增强,类蛋白荧光强度呈递减趋势,且大汶河类蛋白荧光较东平湖高(t=2.408,P=0.032),反映了夏季丰水期大汶河主要向东平湖输入类蛋白荧光物质.东平湖类腐殖质荧光组分C1(r=0.927,P=0.003)、C3(r=0.763,P=0.046)均与DOC具有显著相关性,这表明类腐殖质是东平湖DOC的重要组成部分;而大汶河CDOM各组分与DOC相关性均不显著(P>0.05),可能是因为CDOM在大汶河中受光降解、微生物降解等作用以及水体pH的影响,造成大汶河CDOM组分中的腐殖酸、富里酸、蛋白类物质以及一些非荧光类物质在DOC中所占比例不同.东平湖荧光组分C1(r=0.804,P=0.029)、大汶河荧光组分C2(r=0.912,P=0.002)均与COD具有相关性,说明荧光强度可以间接反映水体中被氧化的有机物含量.大汶河 CDOM 类蛋白荧光组分 C2(r=0.937,P=0.001)、C4 (r=0.782,P=0.022)均与Chla存在相关性,说明浮游植物是大汶河类蛋白物质的重要来源.%As the last reservoir in the East Route of South-to-North Water Transfer Project and the water source of the West-to-East Water Transfer Project, the water quality of Dongping Lake plays a decisive role on water security for the receiving area. Thethree-dimensional fluorescence of chromophoric dissolved organic matter (CDOM) in Dawen River and Dongping Lake were determined. Moreover, the CDOM influence of Dawen River on Dongping Lake and the correlations between fluorescence intensity and Chla, COD and DOC were studied. Four fluorescent components were obtained through Parallel Factor Analysis on the Three-dimensional Excitation-Emission Matrix Fluorescence Spectra, in which, C1 and C3 were humic-like fluorescence, and C2 and C4 were protein-like fluorescence. From Dawen River to Dongping Lake, the intensity of humic-like fluorescence increased and the intensity of protein-like fluorescence decreased. Furthermore, the intensity of protein-like fluorescence in Dawen River was higher than that in Dongping Lake (t=2.408, P=0.032), indicating that the protein-like fluorescence in Dongping Lake was mainly from Dawen River in summer. The humic-like components C1 (r=0.927, P=0.003) and C3 (r=0.763,P=0.046) of Dongping Lake were all significantly related with DOC, indicating that humic-like substances were the main components of DOC in Dongping Lake. However, the correlations between fluorescent components and DOC were not significant in Dawen River (P>0.05), probably because of the different proportions of humic acid, fulvic acid, protein-like matter of CDOM and some non-fluorescent substances in DOC caused by microbial degradation, light degradation and the effect of pH in the water. Significant correlations between C1 (r=0.804, P=0.029) of Dongping Lake, C2 (r=0.912, P=0.002) of Dawen River and COD were found, suggesting that CDOM could reflect the organic matter contentoxidated in the water. C2 (r=0.937, P=0.001) and C4 (r=0.782, P=0.022) of Dawen River were all significant related with Chla, indicating that phytoplankton was the main source of protein-like substances in Dawen River.【期刊名称】《生态环境学报》【年(卷),期】2018(027)003【总页数】8页(P565-572)【关键词】有色可溶性有机物;河流输入;三维荧光;平行因子分析法【作者】吕伟伟;姚昕;张保华【作者单位】聊城大学环境与规划学院,山东聊城 252000;聊城大学环境与规划学院,山东聊城 252000;中国科学院南京地理与湖泊研究所//湖泊与环境国家重点实验室,江苏南京 210008;聊城大学环境与规划学院,山东聊城 252000【正文语种】中文【中图分类】X12;X13有色可溶性有机物(Chromophoric Dissolved Organic Matter,CDOM)是水体中重要的有机碳库,占DOC的60%以上(段洪涛等,2009),在全球碳循环过程中起着重要的作用;并极大地影响光在水生环境中的传播等相关过程,对紫外辐射具有强烈的吸收作用,能够减少紫外线辐射对水生生态系统的影响(Williamson et al.,1996;Laurion et al.,2000)。
