精编苏教版化学选修5学案:专题4第三单元第二课时羧酸地性质和应用Word版含解析汇报
【三维设计】高中化学 第一部分 专题4 第三单元 第二课时 羧酸的性质和应用课件 苏教选修5

三类羟基的比较
羟基类型 醇羟基
比较项目
酚羟基
羧羟基
氢原子活泼性
电离
极难电离 微弱电离 部分电离
酸碱性
中性 很弱的酸性 弱酸性
羟基类型 比较项目
醇羟基
酚羟基
羧羟基
与Na反应 与NaOH反应
反应放出H2 反应放出H2 反应放出H2
不反应
反应
反应
与NaHCO3反应
不反应
不反应
反应放 出CO2
质的物质的量之比是
()
A.3∶4∶2
B.3∶5∶2
C.3∶5∶1
D.3∶4∶1
[解析] 醇、酚、羧酸能和Na单质反应,1 mol该有 机物能和3 mol的金属钠反应;酚羟基、卤代烃、羧基、 酯都能和氢氧化钠溶液反应,注意酯水解后生成了羧酸 和酚,羧酸和酚均能和氢氧化钠溶液反应,所以1 mol该 有机物能和5 mol的氢氧化钠;NaHCO3只能和羧基反应。
1.一定质量的某有机物和足量的金属钠反应,可得到气体
V1 L,等质量的该有机物与足量的纯碱溶液反应,可得
到气体V2 L。若在同温同压下V1>V2,那么该有机物可
能是
()
A.HO(CH2)3COOH C.HOOC—COOH
B.HO(CH2)2CHO D.CH3COOH
解析:—OH、—COOH都能与金属钠反应生成H2,1 mol—OH或1 mol —COOH与钠反应可产生0.5 mol H2; 仅—COOH与Na2CO3反应生成CO2,1 mol—COOH与 Na2CO3反应可产生0.5 mol CO2.题设有机物与金属钠反应 产生的气体的体积多于与纯碱反应产生的气体的体积,则 有机物结构中既有—COOH又有—OH。 答案:A
配套K12高中化学专题4烃的衍生物第三单元醛羧酸第2课时羧酸的性质和应用教学案苏教版选修5

第2课时羧酸的性质和应用[目标导航] 1.通过回忆及观看模型了解乙酸的分子结构及官能团——羧基。
2.通过实验观察及探究掌握乙酸的酸性并能了解羧酸具有酸性的原因。
3.通过实验和结构分析理解乙酸的酯化反应,并能了解验证酯化反应机理的方法。
4.通过阅读课本了解几种常见的羧酸。
一、乙酸1.组成和结构2.物理性质3.化学性质(1)酸性:电离方程式为CH3COOH CH3COO-+H+。
(2)酯化反应如乙酸与乙醇的反应:CH 3COOH +CH 3CH 2OH 浓硫酸△CH 3COOC 2H 5+H 2O 。
议一议1.乙酸、碳酸、苯酚的酸性由强到弱的顺序是什么?试用反应的离子方程式证明。
答案 酸性强弱:乙酸>碳酸>苯酚。
2CH 3COOH +CO 2-3==2CH 3COO -+H 2O +CO 2↑CO 2+H 2O +―→HCO -3+。
2.若用同位素18O 示踪法确定乙酸和乙醇发生酯化反应的断键方式,已知18O 存在于CH 3CH 182OH中,反应后18O 存在于哪些物质中?若18O 存在于中,反应后18O 存在于哪些物质中?答案 存在于乙醇和乙酸乙酯中。
存在于乙酸和水中。
3.在制取乙酸乙酯的实验中,如何提高乙酸乙酯的产量?酯在碱性条件下的水解程度为什么比在酸性条件下水解程度大?答案 为了提高乙酸乙酯的产量,可以增大反应物(如乙醇)的物质的量,也可以把产物中乙酸乙酯及时分离出来。
乙酸乙酯水解生成的酸在碱性条件下被碱中和,减少了酸的浓度,使平衡向正反应方向移动,从而使酯的水解趋于完全。
4.怎样提纯乙酸乙酯?答案 用饱和Na 2CO 3溶液除去乙酸乙酯中的乙酸和乙醇,然后采取分液的方法进行分离。
二、羧酸 1.概念由烃基(或氢原子)和羧基相连构成的有机化合物。
2.官能团羧基:。
3.通式R —COOH(或),饱和一元羧酸通式为C n H 2n +1COOH(n ≥0)。
4.分类(1)按分子中烃基的结构分类羧酸⎩⎪⎨⎪⎧ 脂肪酸⎩⎨⎧低级脂肪酸:如乙酸:CH 3COOH高级脂肪酸⎩⎪⎨⎪⎧ 硬脂酸:C 17H 35COOH 软脂酸:C 15H 31COOH油酸:C 17H 33COOH 芳香酸:如苯甲酸:,俗名安息香酸(2)按分子中羧基的数目分类羧酸⎩⎪⎨⎪⎧一元羧酸:如甲酸HCOOH ,俗名蚁酸二元羧酸:如乙二酸,俗名草酸多元羧酸:如柠檬酸5.化学性质羧酸的化学性质主要取决于羧基。
2019-2020学年苏教版高中化学选修5课时通:4.3.2羧酸 Word版含答案.doc
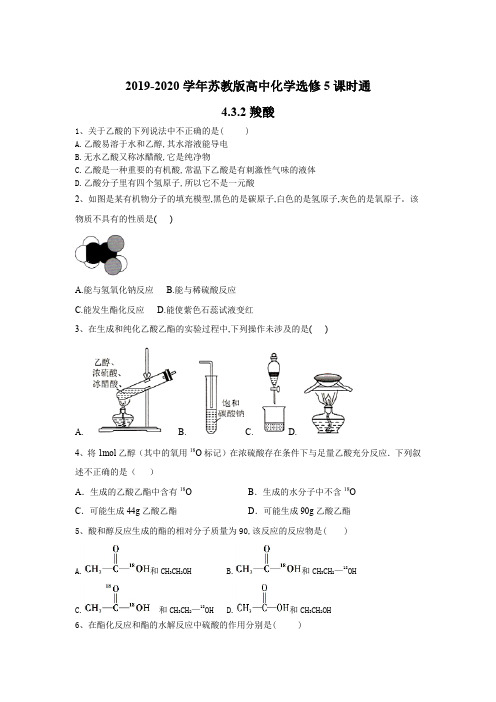
2019-2020学年苏教版高中化学选修5课时通4.3.2羧酸1、关于乙酸的下列说法中不正确的是( )A.乙酸易溶于水和乙醇,其水溶液能导电B.无水乙酸又称冰醋酸,它是纯净物C.乙酸是一种重要的有机酸,常温下乙酸是有刺激性气味的液体D.乙酸分子里有四个氢原子,所以它不是一元酸2、如图是某有机物分子的填充模型,黑色的是碳原子,白色的是氢原子,灰色的是氧原子。
该物质不具有的性质是( )A.能与氢氧化钠反应B.能与稀硫酸反应C.能发生酯化反应D.能使紫色石蕊试液变红3、在生成和纯化乙酸乙酯的实验过程中,下列操作未涉及的是( )A. B. C. D.4、将1mol乙醇(其中的氧用18O标记)在浓硫酸存在条件下与足量乙酸充分反应.下列叙述不正确的是()A.生成的乙酸乙酯中含有18O B.生成的水分子中不含18OC.可能生成44g乙酸乙酯D.可能生成90g乙酸乙酯5、酸和醇反应生成的酯的相对分子质量为90,该反应的反应物是( )A.和CH3CH2OHB.和CH3CH2—18OHC.和CH3CH2—18OHD.和CH3CH2OH6、在酯化反应和酯的水解反应中硫酸的作用分别是( )A.催化剂、脱水剂催化剂B.都作催化剂C.催化剂、吸水剂催化剂D.吸水剂催化剂7、要使有机物转化为,最佳试剂是( )A.NaB.NaHCO3C.Na2CO3D.NaOH8、将含有一个羟基的化合物A10g,与乙酸反应生成乙酸某酯11.85g,并回收到未反应的A 1.3g,则A的相对分子质量约为( )A.98B.116C.158D.2789、乙酸分子的结构式为.下列反应及断键部位正确的是( ) Ⅰ.乙酸的电离及与酸的通性有关的反应是①键断裂Ⅱ.乙酸与乙醇的酯化反应是②键断裂Ⅲ.在红磷存在时,Br2与CH3COOH的反应为CH3COOH+Br2CH2BrCOOH,是③键断裂Ⅳ.乙酸变成乙酸酐的反应为2CH3COOH→,是①②键断裂A.仅Ⅰ、Ⅱ、Ⅲ B.Ⅰ、Ⅱ、Ⅲ、ⅣC.仅Ⅱ、Ⅲ、ⅣD.仅Ⅰ、Ⅲ、Ⅳ10、下图为实验室制取乙酸乙酯的装置。
苏教版高二化学选修五专题4 烃的衍生物 第三单元 醛 羧酸 第二课时 羧酸性质和应用 随堂基础巩固

[随堂基础巩固]1.关于乙酸的下列说法不.正确的是() A.乙酸是一种重要的有机酸,是具有强烈刺激性气味的液体B.乙酸分子中含有四个氢原子,所以乙酸是四元酸C.无水乙酸又称冰醋酸,它是纯净物D.乙酸易溶于水和乙醇解析:羧酸是几元酸是根据酸分子中所含的羧基的数目来划分的,一个乙酸分子中含一个羧基,故为一元酸。
答案:B2.有机物①CH2OH(CHOH)4CHO②CH3CH2CH2OH③CH2===CH—CH2OH④CH2===CH—COOCH3⑤CH2===CH—COOH中,既能发生加成反应、酯化反应,又能发生氧化反应的是() A.③⑤B.②④C.①③⑤D.①③解析:凡含有不饱和碳碳键和醛基的有机物均能发生加成反应,含有—OH或—COOH基团的有机物能发生酯化反应,可燃有机物均可发生氧化反应。
答案:C3.由—CH3、—OH、、—COOH四种基团两两组合而成的化合物中,其水溶液能使石蕊试液变红的有() A.2种B.3种C.4种D.5种解析:题给四种基团两两组合的化合物中,显酸性的有CH3COOH、HO—COOH(即H2CO3)。
其中能使石蕊试液变红的有CH3COOH、和H2CO3;不能使石蕊试液等酸碱指示剂变色。
答案:B4.已知某有机物X的结构简式为,下列有关叙述不.正确的是() A.1 mol X分别与足量的Na、NaOH溶液、NaHCO3溶液反应,消耗这三种物质的物质的量分别为3 mol、4 mol、1 molB.X在一定条件下能与FeCl3溶液发生显色反应C.X在一定条件下能发生消去,酯化反应D.X的化学式为C10H10O6解析:苯环上的氢原子不能消去,故不能发生消去反应,与Na反应的有—OH和—COOH,与NaHCO3反应的只有—COOH,与NaOH反应的有酚羟基、羧基和酯基。
答案:C5.可用图示装置制取少量乙酸乙酯(酒精灯等在图中均已略去)。
请填空:(1)试管a中需加入浓硫酸、冰醋酸和乙醇各2 mL,正确的加入顺序及操作是___________________________________________________________________________________________。
2020-2021学年化学苏教版选修5:4-3-2 羧酸的性质和应用

(3)化学性质:由于具有双官能团,甲酸既有羧酸的一般通 性,也有醛类的某些性质。因此,能发生银镜反应的不一定是 醛。
① 酸 性 : HCOOH + NaHCO3―→HCOONa + H2O + CO2↑。
2.通式:一元羧酸的通式为 R—COOH,饱和一元脂肪酸
的通式为 CnH2nO2。
3.分类 (1)按分子中烃基的结构分
低级脂肪酸:如乙酸:CH3COOH
①脂肪酸高级脂肪酸软硬脂脂酸酸::CC1157HH3315CCOOOOHH
油酸:C17H33COOH
②芳香酸如苯甲酸: C6H5COOH ,俗名安息香酸。
2.物理性质
3.化学性质 ①酸性:一元 弱 酸比碳酸酸性 强 。
a.与 CaCO3 反应: CaCO3+2CH3COOH―→Ca(CH3COO)2+H2O+CO2↑ 。
b.与金属 Na 反应:2Na+2CH3COOH―→2CH3COONa +H2↑。
②酯化反应(或 取代 反应) a.含义:酸和 醇 作用生成 酯和水 的反应。 b.断键方式:酸脱 —OH ,醇脱 —
第2课时 羧酸的性质和应用
01课前自主学习 03随堂基础巩固
02课堂互动探究 课时作业
一、羧酸 1.概念:由 烃基与羧基 相连构成的化合物。
注意:(1)羧基(
或—COOH)是羧酸的官能团。
(2)甲酸(
)是分子组成和结构最简单的羧酸。甲酸
的分子组成有特殊性,即甲酸分子里没有烃基,但有醛基。
。
②与乙醇发生酯化反应,化学方程式为
HCOOH+CH3CH2OH浓△硫酸HCOOCH2CH3+H2O
2020—2021学年高中化学三维设计江苏专版选修五课件:专题4第三单元第二课时羧酸的性质和应用

子活泼性 在水溶液中
电离程度 酸碱性
醇
极难 电离 中性
水
酚
难电离
微弱 电离
中性 很弱的酸性
羧酸
部分 电离 弱酸性
含羟基的物质 醇
比较项目
与Na反应
与NaOH 反应
反应放 出H2
不反应
与NaHCO3 反应
不反应
能否由酯水 解生成
能
水
反应放 出H2 不反应
不反应
不能
酚
羧酸
反应放 出H2
结构简式
比例模型
(特征基团)
C2H4O2
结构简式 __________ _________
名称____
乙酸(CH3—COOH)
乙醇(CH3—CH2— 18OH)
方式a 酸脱羟基,醇脱氢,产物:CH3CO18OC2H5,H2O
方式b 酸脱H,醇脱—OH,产物:CH3COOC2H5、HO
含羟基的物质
反应
反应放 能
能
缩聚物 方法 单体
饱和一元酸 同分异构体
碳数 数目
饱和一元醇
饱和一元酯的
同分异构体的 碳数 同分异构体数目
数目
1
1
4
4
1×4=4
2
1
3
3
1
2
2
1×2=2 共9
1
1×1=1 种酯
4
2
1
1
2×1=2
“课时跟踪检测”见“课时跟踪检测(十五)” (单击进入电子文档)
2020—2021学年高中化 学三维设计江苏专版选 修五课件:专题4第三单 元第二课时羧酸的性质
和应用
2020/9/13
高中化学选修5课件(苏教版)_4-3-2_羧酸的性质和应用
自主探究
精要解读
实验探究
活页规范训练
1.写出乙醛催化氧化的化学方程式。 提示 催化剂 2CH3CHO+O2 ― ― → 2CH3COOH △
2.写出乙酸发生下列反应的化学方程式 (1)乙酸与 CaCO3 反应 2CH3COOH+CaCO3→Ca(CH3COO)2+CO2↑+H2O。 (2)乙酸与乙醇在浓 H2SO4 作用下,加热
活页规范训练
(2)性质 ①酸的通性 乙酸是一种 弱 酸,酸性比碳酸 强 。电离方程式为: CH3COOH CH3COO-+H+。
自主探究
精要解读
实验探究
活页规范训练
②酯化反应
如乙酸与乙醇的反应:
自主探究
精要解读
实验探究
活页规范训练
2.甲酸 (1)组成和结构
分子式 CH2O2
结构简式 HCOOH
自主探究
精要解读
实验探究
活页规范训练
1.了解羧酸的结构特点及通性。 2.能从官能团的角度理解乙酸的性质,并能类比学习羧酸的 化学性质。 3.认识酯化反应的特点,认识酯的结构,会写酯的同分异构 体。 4.了解羧酸与醇之间发生的缩聚反应。
自主探究
精要解读
实验探究
活页规范训练
笃学一
羧酸的概念和分类
1.概念:由烃基(或氢原子)和 羧基 相连的化合物。 2.一元羧酸的通式: R—COOH ,官能团 —COOH 。
自主探究
精要解读
实验探究
活页规范训练
(1)利用羟基的活动性不同,可判断分子结构中羟基的类型。(2) 水分子中也有—OH,可看作—OH 上连有氢原子;醇分子可以 看作—OH 连在链烃基上,链烃基使—OH 中的 H 原子活性变
高中化学专题4烃的衍生物第三单元醛羧酸第2课时羧酸的性质和应用课件苏教版选修5
_____________
3.按要求回答下列问题。
(1)甲酸是最简单的羧酸,根据甲酸的结构分析,它除具有羧酸的通性外还应具有
什么性质?
答案 甲酸的结构简式为 更容易被强氧化剂氧化。 ,它既含有羧基,又含有醛基,因此它还应 具有醛的性质,能被氧化,如发生银镜反应,与新制Cu(OH)2悬浊液反应;甲酸
答案
(2)按分子中羧基的数目分类
一元羧酸:如甲酸 HCOOH ,俗名蚁酸 二元羧酸:如乙二酸 ,俗名草酸 羧酸 多元羧酸:如柠檬酸
答案
5.化学性质
羧酸的化学性质主要取决于羧基。在羧基结构中有2个部位的键易断裂: 。
(1)羧基比醇羟基易断裂O—H键①(羟基受羰基影响),容易电离出H+,
索引
基础知识导学 重点难点探究 随堂达标检测
基础知识导学
一、乙酸 1.组成和结构
俗称 分子式 C2H4O2 结构简式 CH3COOH 官能团
醋酸
2.物理性质 颜色 状态 气味
溶解性
熔点
无色 液态 有刺激性气味 易溶于水和乙醇 ______________
16.6 ℃,温度低于熔点时凝结
成冰一样的晶体,又称冰醋酸
△ CH COONa+C H OH 3 2 5 (2)碱性条件:CH3COOC2H5+NaOH——→ 。
答案
议一议
有机物
在一定条件下发生水解反应生成两种有机物,
它在水解时断裂的键是哪一处? 答案 ③⑤
答案
返回
重点难点探究
一、醇、酚、羧酸分子中羟基的活性比较 醇、酚、羧酸的结构中均有—OH,由于—OH所连的基团不同,—OH受相
专题4
第三单元 醛 羧酸
第2课时
高中化学 专题4 烃的衍生物 4.3.2 羧酸的性质和应用课件 苏教版选修5
• 【考试标准】
知识条目
加试要求
1.羧酸的组成、结构和性质特点
b
2.缩聚反应
b
•自主预习
• 知识点烃一基 羧酸概念和羧基乙酸组成结构
• 分子中
(或氢原子)跟
醋酸 (
)相连的化合物属于羧酸。人们最熟悉的羧酸
是乙酸(aceCti2cH4aOc2 id),俗称
,
CH3COOH
• (2)若用同位素18O示踪法确定乙酸和乙醇发生 酯 化 反 应 的 断 键 方 式 , 已 知 18O 存 在 于 CH3CHOH中,反应后18O存在于哪些物质
• 中?若18O存在于 存在于哪些物质中?
中,反应后18O
• 答案 存在于乙醇和乙酸乙酯中。存在于乙 酸和水中。
• 2.羧酸的性质
• Ⅰ.羧酸的化学性质:羧酸具有酸的通性和 能发生酯化反应
分子化合物
和
•
,像这种由有机化合物分子间
获得高分子化合物的反应称为缩聚反应
(condensation polymerization reaction)。
•
+
nHO—
• 即时自测 • 判断正误: •1 . 乙 酸 的 比 例 模 型 为
()
• 2.乙酸分子中所有原子均位于同一平面上 ()
• 探究一 乙酸与羧酸的性质 • 1.乙酸的性质 • Ⅰ.乙酸的物理性质 • 纯净的乙酸是无色有强烈刺激性气味的液
• (1)你能观察到的实验现象是在饱和的碳酸钠 溶液的上方有透明的油状液体产生,并可闻 到香味。
• (2)你能得出的实验结论是在浓硫酸存在、加 热的条件下,乙酸和乙醇发生酯化反应,生 成无色、透明、不溶于水,且有香味的乙酸 乙酯。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
实用标准 文案大全 第二课时 羧酸的性质和应用 [课标要求] 1.认识羧酸的组成和结构特点。 2.以乙酸为例,掌握羧酸的化学性质。 3.掌握酯的水解反应机理。
1.羧酸是由烃基与羧基相连构成的有机化合物,其官能团是羧基(—COOH)。四种常见的高级脂肪酸为硬脂酸(C17H35COOH)、软脂酸(C15H31COOH)、油酸(C17H33COOH)、亚油酸(C17H31COOH)。 2.甲酸的结构简式为HCOOH,分子中含有醛基(—CHO)和羧基(—COOH),具有羧酸和醛的化学性质。 3.由有机化合物分子间脱去小分子获得高分子化合物的反应称为缩聚反应。
乙酸的结构与性质 1.物理性质 俗称 颜色 气味 状态 熔沸点 挥发性 溶解性 醋酸(纯净的乙酸称为冰醋酸) 无色 刺激性 液 低 易 易溶于水和有机溶剂 2.组成与结构 分子式 (化学式) 结构式 结构简式 官能团 (特征基团) 比例模型
C2H4O2 CH3COOH 结构简式 —COOH 名称羧基
3.化学性质 (1)弱酸性 ①乙酸在水溶液里部分电离产生H+,电离方程式为CH3COOHCH3COO-+H+,从而使乙酸具有酸的通性。 实用标准 文案大全 ②乙酸的酸性强于碳酸,常见几种物质的酸性强弱顺序为:乙酸>碳酸>苯酚>HCO-3。 (2)酯化反应 ①乙酸与醇反应的化学方程式为
②羧酸与醇发生酯化反应时,酸脱羟基,醇脱氢;酯化反应一般是可逆反应。 ③乙酸和乙醇反应时,增大乙酸乙酯产率的方法:移去产物乙酸乙酯或增大乙醇的浓度。
1.如何通过实验证明乙酸、碳酸、苯酚的酸性强弱? 提示:
实验装置如图所示。乙酸与Na2CO3反应,放出CO2气体,说明乙酸的酸性比碳酸强;将产生的CO2气体通入苯酚钠溶液中,生成苯酚,溶液变浑浊,说明碳酸的酸性比苯酚强。反应的化学方程式如下: 2CH3COOH+Na2CO3―→2CH3COONa+CO2↑+H2O CO2+H2O+C6H5ONa―→C6H5OH+NaHCO3。 2.用什么方法证明乙酸发生酯化反应时断裂的是C—O键? 提示:使用同位素示踪法探究乙酸酯化反应中可能的脱水方式。 乙酸(CH3—COOH) 乙醇(CH3—CH2—18OH) 方式a 酸脱羟基,醇脱氢,产物:CH3CO18OC2H5,H2O 方式b 酸脱H,醇脱—OH,产物:CH3COOC2H5、H182O
在乙酸乙酯中检测到了同位素18O,证明乙酸与乙醇在浓硫酸作用下发生酯化反应的机理是“酸脱羟基,醇脱氢”。
1.羟基氢原子的活泼性比较 实用标准 文案大全 含羟基的物质 比较项目 醇 水 酚 羧酸
羟基上氢原 子活泼性 ――――――→逐渐增强
在水溶液中 电离程度 极难电离 难电离 微弱电离 部分电离
酸碱性 中性 中性 很弱的酸性 弱酸性 与Na反应 反应放 出H2 反应放 出H2 反应放 出H2 反应放 出H2 与NaOH 反应 不反应 不反应 反应 反应
与NaHCO3 反应 不反应 不反应 不反应 反应放出 CO2 能否由酯水 解生成 能 不能 能 能
2.酯化反应的原理及类型 (1)反应机理 羧酸与醇发生酯化反应时,一般是羧酸分子中的羟基与醇分子中羟基上的氢原子结合生成水,其余部分结合生成酯,用示踪原子法可以证明。
(2)基本类型 ①一元醇与一元羧酸之间的酯化反应。 CH3COOH+C2H5OH浓硫酸△CH3COOC2H5+H2O ②二元羧酸与一元醇之间的酯化反应。 HOOC—COOH+2C2H5OH浓硫酸△ C2H5OOC—COOC2H5+2H2O ③一元羧酸与二元醇之间的酯化反应。 2CH3COOH+HOCH2CH2OH浓硫酸△CH3COOCH2CH2OOCCH3+2H2O 实用标准 文案大全 ④二元羧酸与二元醇之间的酯化反应。 此时反应有两种情况:
⑤羟基酸的自身酯化反应。 此时反应有两种情况[以乳酸(CH3CHCOOHOH)为例]:
1.、分别与CH3CH2OH反应,生成的酯的相对分子质量大小关系( ) A.前者大于后者 B.前者小于后者 C.前者等于后者 D.无法确定 解析:选C 酯化反应原理,有机酸脱羟基,醇脱羟基氢,所以两者的反应方程式为 CH3CO16OH+CH3CH2OH――→浓硫酸△ CH3COOCH2CH3+H162O; CH3CO18OH+CH3CH2OH――→浓硫酸△ CH3COOCH2CH3+H182O。 2.在同温同压下,某有机物和过量Na反应得到V1 L氢气,另一份等量的有机物和足量的NaHCO3反应得V2 L二氧化碳,若V1=V2≠0,则此有机物可能是( ) 实用标准 文案大全 A. B.HOOC—COOH C.HOCH2CH2OH D.CH3COOH 解析:选A Na既能与羟基反应,又能与羧基反应。NaHCO3只与羧基反应,不与羟基反应,因此,能使生成的CO2和H2的量相等的只有A项。
羧酸的结构与性质
1.概念 羧酸是由烃基与羧基相连构成的有机化合物。 2.分类 (1)按羧酸中烃基的不同分为:脂肪酸(如乙酸)和芳香酸(如苯甲酸C6H5COOH)等。 (2)按羧酸中羧基的数目分为:一元羧酸(如乙酸)、二元羧酸(如乙二酸HOOC—COOH)和多元羧酸等。 (3)分子中含碳原子数较多的脂肪酸称为高级脂肪酸,它们的酸性很弱,在水中溶解度不大,甚至难溶于水。常见高级脂肪酸结构简式:硬脂酸C17H35COOH,软脂酸C15H31COOH,油酸C17H33COOH,亚油酸C17H31COOH。 (4)一元羧酸的通式为R—COOH,当R为烷基(或氢原子)时称为饱和一元羧酸,饱和一元羧酸的分子通式为CnH2nO2(或CnH2n+1COOH)。 3.化学性质 (1)酸性 羧酸都具有酸性,但分子中烃基不同,酸性也不同。对于饱和一元羧酸,随着碳原子数增多,酸性逐渐减弱。 (2)酯化反应 羧酸都可以发生酯化反应:
1.通过哪种方法可获得高级脂肪酸? 实用标准
文案大全 提示:油脂的水解反应(酸性条件下)。 2.甲酸的分子结构有什么特点? 提示:既含有羧基又含有醛基。 3.苯甲酸的分子结构中是否含醛基? 提示:否。
1.高级脂肪酸 在一元羧酸中,烃基中含有较多碳原子的脂肪酸叫高级脂肪酸。高级脂肪酸的酸性很弱,不能使指示剂变色,但能与碱反应生成盐和水。 2.甲酸
甲酸()又叫蚁酸,可看作分子中含有羧基和醛基两种官能团,所以甲酸不仅有羧酸的通性,还兼有醛的性质。 (1)甲酸是弱酸,但比乙酸酸性强。 (2)甲酸可以与醇发生酯化反应。 (3)甲酸可以发生银镜反应,并在一定条件下能使蓝色的氢氧化铜还原为红色的氧化亚铜沉淀。而甲酸中的醛基被氧化为羧基。 3.苯甲酸 苯甲酸(C6H5COOH)俗称安息香酸,分子里有苯基和羧基。苯甲酸是白色晶体,微溶于水,易升华。其钠盐是温和的防腐剂。苯甲酸的酸性较乙酸强,较甲酸弱。 [特别提醒] 甲酸、甲酸某酯(HCOOR)、甲酸盐(如HCOONa)结构中都有醛基,因此,它们在一定的条件下都可以与银氨溶液和新制氢氧化铜反应。
1.下列物质不属于羧酸的是( ) A.HCOOH B.C15H31COOH
C. D. 解析:选D 根据羧酸的定义可知羧酸是由烃基和羧基相连接形成的化合物,A、B、C都符合。 2.苹果酸是一种常见的有机酸,结构简式为HOOCCHOHCH2COOH,苹果酸可能发生的反应是( ) ①与NaOH溶液反应 ②与石蕊试液作用变红 ③与金属钠反应放出气体 ④一定条件下与乙酸酯化 实用标准 文案大全 ⑤一定条件下与乙醇酯化 A.①②③ B.①②③④ C.①②③⑤ D.①②③④⑤ 解析:选D 苹果酸中含有羧基、羟基两种官能团。羧基具有酸的性质,能使石蕊试液变红,与碱、金属反应,与乙醇酯化。羟基的存在能与乙酸酯化。
缩聚反应
(1)有机化合物分子间脱去小分子获得高分子化合物的反应称为缩聚反应。发生缩聚反应时,单体中应含有多个官能团。 (2)对苯二甲酸与乙二醇发生酯化反应可生成高分子化合物聚对苯二甲酸乙二酯和水,反应方程式为
(3)由乳酸( )合成聚乳酸:
。 1.缩聚反应和加聚反应有什么区别? 提示:①相同点:都是由小分子生成高分子化合物的反应。 ②不同点:加聚反应没有小分子生成,而缩聚反应除了生成高分子化合物外,还有小分子生成。 2.能发生缩聚反应的物质其分子结构有什么特点? 提示:至少有两个相同的或不同的官能团。
1.缩聚反应常见类型 (1)聚酯类:—OH与—COOH间的缩聚。 实用标准 文案大全 (2)聚酰胺类: (3)酚醛树脂类:
2.由缩聚产物推断单体的方法 (1)方法——“切割法”(以聚酯类为例): 断开羰基和氧原子上的共价键,然后在羰基碳原子上连接羟基,在氧原子(或氮原子)上连接氢原子。 (2)实例:
缩聚物
方法 单体
1.下列物质能发生加成反应、加聚反应和缩聚反应的是( )
