结晶水合物中结晶水含量的测定
3.4如何测定硫酸铜晶体中结晶水的含量(备教案)

3.4如何测定硫酸铜晶体中结晶水的含量一.教学目标
掌握结晶水合物中结晶水含量的测定原理和方法,初步学会用称重的方法(重量法)解决简单化学测定的实验设计;知道瓷坩埚、研钵的用途和操作方法。
通过问题的分析理解硫酸铜晶体中结晶水含量测定的原理,通过对实验方案及仪器选择的讨论、评价与优化感受探究过程中渗透的科学美,培养严密的逻辑思维能力与严谨的科学态度。
二.教学重点和难点
教学重点
实验原理、方案设计、恒重操作。
教学难点
恒重操作以及实验误差分析
三、教学内容
1.教学过程
数据处理
1、实验冷却瓷坩埚未放入干燥器
本节课中我想传授给学生的内容较多:实验研究对象的选择标准、实验方案筛选的标准、加热及称重过程中的要点及装置等,教学内容多了后,重点就不够突出,这在之后教学中需要更用心的筛选教学内容,语言更加精炼。
测定1mol气体体积、硫酸铜结晶水含量的测定

① 装配好化学反应气体体积测定仪,作气密性检查。
② 用砂皮擦去镁带表面的氧化物,然后称取
0.100g~0.110g 的镁带,把数据记录于表格。
③ 取下 A 瓶加料口的橡皮塞,用小烧杯加入
20mL 水,再把称量的镁带加到 A 瓶的底部,
用橡皮塞塞紧加料口。
④ 用注射器从 A 瓶加料口处抽气,使 B 瓶导管内
一、测定 1mol 气体的体积
【例题】学生甲利用下图所示实验装置来测定镁元素的相对原子质量。图中仪器 C 称为液体
量瓶,瓶颈上有 110~130mL 刻度线。将一定质量的镁带和过量稀硫酸在仪器 A 中完全反应,
产生的 H2 把仪器 B 中的液体压入液体量瓶中,根据液体的体积可以转换成 H2 的体积,通过 计算测出 H2 的气体摩尔体积。 实验步骤:
A、称取 7.68 g 无水硫酸铜,加入 500 mL 水
B、称取 12.0 g 胆矾配成 500 mL 溶液
C、称取 8.0 g 无水硫酸铜,加入 500 mL 水
D、称取 12.5 g 胆矾配成 500 mL 溶液
2、测定硫酸铜晶体中结晶水含量时,下列情况有可能造成测试结果偏高的是( )
A、加热后在空气中冷却称量固体
电子天平置 0 2.056 g 1.345 g
F.未冷却到室温
G.反应速度太快
H.装置气密性不好
1
(5)若用此装置测定常温下 1molCO2 的体积。提供试剂:Na2CO3 粉未、2mol/LH2SO4 溶液、 饱和 NaHCO3 溶液。
①仪器 B 中盛放的液体是
②仪器 A 中先放入的试剂是
,再用注射器向 A 中注入的是
。反应的化学
方程式:
。
温下 1 摩尔氧气的体积测定值是_________。
实验七 氯化钡中结晶水含量的测定(气化法)
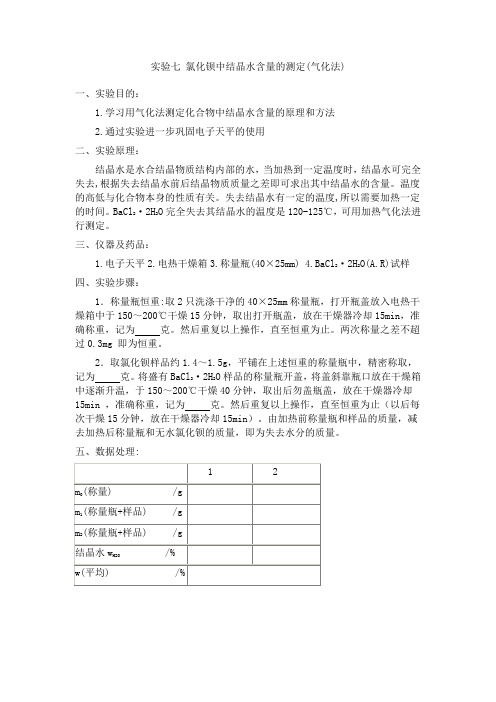
实验七氯化钡中结晶水含量的测定(气化法)一、实验目的:1.学习用气化法测定化合物中结晶水含量的原理和方法2.通过实验进一步巩固电子天平的使用二、实验原理:结晶水是水合结晶物质结构内部的水,当加热到一定温度时,结晶水可完全失去,根据失去结晶水前后结晶物质质量之差即可求出其中结晶水的含量。
温度的高低与化合物本身的性质有关。
失去结晶水有一定的温度,所以需要加热一定的时间。
BaCl2·2H2O完全失去其结晶水的温度是120-125℃,可用加热气化法进行测定。
三、仪器及药品:1.电子天平2.电热干燥箱3.称量瓶(40×25mm)4.BaCl2·2H2O(A.R)试样四、实验步骤:1.称量瓶恒重:取2只洗涤干净的40×25mm称量瓶,打开瓶盖放入电热干燥箱中于150~200℃干燥15分钟,取出打开瓶盖,放在干燥器冷却15min,准确称重,记为克。
然后重复以上操作,直至恒重为止。
两次称量之差不超过0.3mg 即为恒重。
2.取氯化钡样品约1.4~1.5g,平铺在上述恒重的称量瓶中,精密称取,记为克。
将盛有BaCl2·2H2O样品的称量瓶开盖,将盖斜靠瓶口放在干燥箱中逐渐升温,于150~200℃干燥40分钟,取出后勿盖瓶盖,放在干燥器冷却15min ,准确称重,记为克。
然后重复以上操作,直至恒重为止(以后每次干燥15分钟,放在干燥器冷却15min)。
由加热前称量瓶和样品的质量,减去加热后称量瓶和无水氯化钡的质量,即为失去水分的质量。
五、数据处理:六、注意事项:(1)称取的BaCl2·2H2O样品在放入烘箱前应水平方向轻摇称量瓶,使堆积的样品平铺于瓶底而利于干燥, 烘干时应将瓶盖斜放于瓶口(2)从烘箱中取物时小心烫伤,烘干物品不可直接用手接触(3)烘干物品在干燥器中放置至室温时方可称量, 且每次放置时间应一致(4)称量烘干物品应称一个就从干燥器中取一个, 而且称量速度要快,不可一次全部取出(称量后是否放回干燥器中应视实验具体情况而定)(5)可溶性钡盐有毒(6)称量应准确至0.0001mg(小数点后第4位)(7)在加热的情况下,称量瓶盖子不要盖严,以免冷却后盖子不易打开。
实验4五水合硫酸铜结晶水测定

实验四五水合硫酸铜结晶水的测定一、实验目的1、了解结晶水合物中结晶水含量的测定原理和方法2、进一步熟悉分析天平的使用3、练习使用研钵、坩埚、干燥器等仪器4、掌握沙浴加热、恒重等基本操作二、实验原理结晶水合物受热时,可以脱去结晶水。
CUSO4 • 5H2O在不同温度下按下列反应逐步脱水:CuSO4 5H2O ^48^ CuSO4 3H2O + 2H2OCuSO4 3H2O CuSO4 H2O + 2H2O218 £CuSO4 H2O CuSO4 + H2O加热CUSO4 • 5H2O控制温度为260C〜280C, CuSO • 5H2O可以脱去全部结晶水。
精确称量CuSO的质量可以计算出结晶水的含量。
三、基本操作1、热浴:当被加热物质需要受热均匀又不能超过一定温度时,可用特定热浴间接加热。
(1)水浴(水浴锅、大烧杯)当要求被加热的物质受热均匀,而温度不超过100 c时,使用水浴加热。
只需加热在80 C以下者,容器受热部分可浸入水中,但不接触浴底。
在80 C以上者,可利用蒸气加热。
水浴是用灯具把水浴中的水煮沸(水浴内盛水的量保持容量2/3左右的水量)用水蒸气来加热器皿。
实验室常用大烧杯代替水浴锅加热。
(水量占烧杯容积的1/3)(2)甘油浴(石蜡浴)当要求被加热的物质受热均匀,温度又需高于100 C时,可使用油浴。
用油代替水浴中的水,即是油浴。
其中甘油浴用于150C以下的加热,石蜡浴用于200 C以下的加热。
(3)沙浴沙浴是一个铺有一层均匀的细沙的铁盘。
先加热铁盘,器皿的被加热部位埋入细沙中,若要测量沙浴的温度,可把温度计水银球部分埋入靠近器皿处的沙中(不要触及底部)。
用煤气灯或酒精喷灯加热沙盘。
其特点是升温比较缓慢,停止加热后,散热也比较缓慢。
2、研钵的使用研钵是用来研磨硬度不大的固体及固体物质混合的仪器。
种类有:铁质、氧化铝、玛瑙、瓷质和玻璃等。
使用注意事项(1)研磨时,应使研杵在钵内缓慢而稍加压力地转动。
高三化学《测定硫酸铜结晶水含量实验》PPT课件

总结恒重操作需要注意的问题:
加热时;(1)坩埚要斜放在泥三角上。
(2)小火加热,晶体平铺于坩埚中并适 当搅拌,注 意颜色变化。 冷却时: (1) 干燥器要平移打开、关上密封。
(2) 要用坩埚钳将坩埚移入干燥器 中。
称量时: 称量时注意保留小数点后3位。
这是一个较精确的定量实验,为 了减少实验误差,实验操作中应 注意那些事项?
硫酸铜结晶水中 结晶水含量的测定
到目前为止,我们都学习过哪些结晶水 合物。
目标: 学习硫酸铜晶体中 结晶水含量测定的 方法
魏晋时期, 《神农本草经》记载“石胆能化铁为铜.”
如何翻译 成化学用 语呢?
Fe+CuSO4
FeSO4+Cu
一、硫酸铜晶体的组成、性质 及用途。
CuSO4· 2O,是一种蓝 5H 色固体,固体受热时变为 白色粉末,用作染料、农 业杀虫剂(波尔多液) 、 水的杀菌剂,饲料添加剂, 并用于镀铜。
应该如何幻灯片 24 正确操作呢?
4、颜色变化从蓝色到白色,如有灰 色物质出现说明什么问题呢?
温度过高使无水CuSO4进一步分解变 为CuO,实验失败。
5、为了减少实验误差,无水硫酸铜的 质量至少应该称量两次或两次以上??
恒重操作
对盛有无水硫酸铜的瓷坩埚再加热,再冷却。 将冷却后的瓷坩埚再次称量,两次称量质量相 差控制在0.001g内。(电子天平的精确度是 0.001克)由此,可以 判断结晶水已全部逸出。
试管夹
药匙
实验中会用到的仪器:
电子天平 、研钵、干燥器、(瓷坩 埚、坩埚钳 )、(泥三角、三脚 架)、药匙、玻璃棒。
p54
1.硫酸铜晶体的称量用什么仪器?倒入瓷坩埚中? 不可以,多次称量会扩大误差值。
五水硫酸铜结晶水含量的测定(综合实验)实验报告

五水硫酸铜结晶水含量的测定一、实验目的要求:1.了解制备五水硫酸铜晶体的方法。
2.测定硫酸铜的结晶水含量。
二、实验内容:1.五水硫酸铜的提纯。
2.五水硫酸铜晶体自由水的脱去。
3.测定硫酸铜晶体里的结晶水含量。
三、主要仪器设备及药品:仪器设备:电子天平,称量瓶,不锈钢锅(薄壁,内装食盐用于盐浴),温度计(量程在350℃,测量盐浴温度),烘箱(烘干自由水),电炉,滤纸,皮筋。
药品:五水硫酸铜,3公斤食盐左右(用于盐浴加热),无水乙醇。
四、实验原理五水硫酸铜结构:图1 CuSO4·5H2O的晶体结构一般性质硫酸铜CuSO4(硫酸铜晶体:CuSO4·5H2O)分子量249.68。
深蓝色大颗粒状结晶体或蓝色颗粒状结晶粉末,略透明。
有毒,无臭,带有金属涩味。
密度2.2844g/cm-3。
干燥空气中会缓慢风化。
易溶于水,水溶液呈弱酸性。
不溶于乙醇,缓缓溶于甘油。
150℃以上将失去全部水结晶成为白色粉末状无水硫酸铜。
五水硫酸铜有极强的吸水性,把它投入95%乙醇成含水有机物(即吸收水分)而恢复为蓝色结晶体。
失水过程五水硫酸铜晶体失水分三步。
上图中两个仅以配位键与铜离子结合的水分子最先失去,大致温度为102摄氏度。
两个与铜离子以配位键结合,并且与外部的一个水分子以氢键结合的水分子随温度升高而失去,大致温度为113摄氏度。
最外层水分子最难失去,因为它的氢原子与周围的硫酸根离子中的氧原子之间形成氢键,它的氧原子又和与铜离子配位的水分子的氢原子之间形成氢键,总体上构成一种稳定的环状结构,因此破坏这个结构需要较高能量。
失去最外层水分子所需温度大致为258摄氏度。
五、实验步骤:1、在常温下将适量的CuSO4溶解于少量的水中,配置成过饱和溶液,倒掉上层溶液,取未溶解的五水硫酸铜加少量水洗涤三次,再用无水乙醇洗涤三次,将所得试剂尽量滴干(为节约实验时间,可用滤纸将大部分自由水吸干)。
2、将1所得试剂加入称量瓶(不带瓶盖)中,再覆盖上滤纸和皮筋,称重(事先称量无盖称量瓶、滤纸和皮筋的总质量为m0)。
硫酸铜晶体中结晶水含量测定的实验分析
1 资源信息表 标 题: 硫酸铜晶体中结晶水含量测定的实验分析
关键词: 硫酸铜晶体 测定 误差分析
描述: 通过对硫酸铜结晶水含量的测定实验分析、反思,加深对硫酸铜结晶水含量的测定目的、原理、方法以及误差分析方法的认识;理清目的、原理、方法、仪器选用以及误差形成的内在联系。 学科: 化学高中二年级第一学期使用本>上科版>第十章>第二节>第三课时 作者: 姚秋平 单 位: 上海市徐汇区教师进修学院 地址: 上海市中山南二路800号 Email: qiupingyao@yahoo.com.cn 2
10.2 结晶水合物中结晶水含量的测定(共2+1课时) 第3课时 硫酸铜晶体中结晶水含量测定的实验分析 [设计思想] 通过对硫酸铜结晶水含量的测定实验分析、反思,加深对硫酸铜结晶水含量的测定目的、原理、方法以及误差分析方法的认识;理清目的、原理、方法、仪器选用以及误差形成的内在联系。教学重点放在引导学生对实验的反思与拓展上,通过学生实验报告的交流,帮助学生反思操作中的失误,对实验结果的影响;对原理、方法进行拓展,激活学生思维,认识间接测量的一般思想方法。 一、教学目标
1.知识与技能 (1)按操作程序分析操作不当引起实验误差的技能(C)。 (2)误差分析与判断(如读数、加热、称量不当引起的误差分析)(B)。 2.过程与方法 (1)通过实验反思,认识实验条件的控制、数据处理等科学方法。 (2)通过实验报告的交流,认识实验报告的一般要求、规范与格式。 3.情感态度与价值观 通过对实验的反思,体验实事求是、严肃认真科学精神的意义(A)。 二.教学重点和难点
误差分析与判断。 三.教学用品
药品:CuSO4·5H2O 、CuSO4 仪器:电子天平、研钵、玻璃棒、三脚架、泥三角、瓷坩埚、坩埚钳、干燥器、酒精灯、药匙。 四.教学流程
1.流程图 3
2.流程说明 引入:前一课我们测定硫酸铜晶体结晶水含量,下面请交流你们的实验报告。 学生交流: 交流实验报告。
胆矾结晶水的测定实验原理
胆矾结晶水的测定实验原理胆矾(化学式:CuSO4·5H2O)是一种常见的含水结晶物质,其水合物中的结晶水含量对于化学实验和工业生产具有重要意义。
因此,准确测定胆矾结晶水的含量是一项必要的实验工作。
本文将介绍胆矾结晶水的测定实验原理及方法。
实验原理:胆矾结晶水的测定是通过加热胆矾样品,使其失去结晶水,从而计算出结晶水的含量。
具体原理如下:1. 胆矾加热失去结晶水:胆矾样品加热至一定温度时,结晶水会从晶体中脱离,转化为水蒸气,并逸出系统。
2. 恒定重量:当样品失去结晶水后,其重量将保持不变,称为恒定重量。
此时,胆矾中的水分已完全脱除。
3. 计算结晶水含量:根据样品的质量损失和结晶水的摩尔质量,可以计算出胆矾样品中结晶水的含量。
实验步骤:1. 称取胆矾样品:准确称取一定质量的胆矾样品,放入称量瓶中,并记录质量。
2. 加热样品:将称取好的胆矾样品放入预先烧燃的坩埚中,并用三脚架和铁网固定。
使用酒精灯或其他加热装置,对样品进行加热。
3. 加热至恒定重量:加热过程中,持续加热直至样品重量不再发生变化,称为恒定重量。
记录样品的恒定重量。
4. 计算结晶水含量:根据样品的质量损失和结晶水的摩尔质量,可以计算出胆矾样品中结晶水的含量。
实验注意事项:1. 加热过程中要注意控制加热温度,避免过高温度引起样品的分解或溅出。
2. 在称取样品时要注意准确称取,并避免样品受潮。
3. 在加热过程中要保持加热均匀,避免样品局部过热或不加热。
4. 在记录样品质量时要注意准确记录,避免误差的产生。
实验结果分析:根据实验中记录的样品质量变化和计算得到的结晶水含量,可以得出胆矾样品中结晶水的含量。
与理论值进行比较,可以评估实验结果的准确性和实验操作的可靠性。
总结:通过胆矾结晶水的测定实验,可以准确测量胆矾样品中结晶水的含量。
这项实验方法在化学实验和工业生产中具有重要意义,可以帮助人们更好地理解和应用胆矾这一常见物质。
同时,在实验中需要注意操作规范和准确性,以保证实验结果的可靠性。
高三化学结晶水测定实验报告
一、实验名称:硫酸铜晶体中结晶水含量的测定
二、实验目的:结晶水含量的测定、热重曲线分析
三、实验原理:CuSO4xH2O=(加热)=CuSO4+xH2O
1mol xmol
称取一定质量的硫酸铜晶体,将其加热失去全部结晶水后再进行称量,就可以得到硫酸铜的质量和结晶水的质量。再根据各自的摩尔质量,就可以求出物质的量。
①仪器B的名称是。
②将下列实验操作步骤正确排序__________(填标号);
重复上述操作步骤,直至A恒重,记为m3g。
a.点燃酒精灯,加热b.熄灭酒精灯c.关闭K1和K2
d.打开K1和K2,缓缓通入N2e.称量A f.冷却到室温
③根据实验记录,计算绿矾化学式中结晶水数目x=(列式表示)。若实验时按a、d次序操作,则使x(填“偏大”“偏小”或“无影响”)。
④称量待坩埚在干燥器里冷却后,将坩埚放在天平上称量,记下坩埚和无水硫酸铜总质量m2。
⑤再加热冷却再称量至恒重把盛有无水硫酸铜的坩埚再加热,然后放在干燥器里冷却后再称量,记下质量,直到连续两次称量的质量差不超过0.1g为止,称得质量为m3。
⑥计算根据实验数据计算硫酸铜晶体里结晶水的质量分数和化学式中x的实验值。
⑨晶体未完全变白,就停止加热
⑩加热时间太长,部分变黑
1.绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
为测定绿矾中结晶水含量,将石英玻璃管(带两端入石英玻璃管中,再次将装置A称重,记为m2g。按下图连接好装置进行实验。
1.实验仪器和试剂:
仪器:托盘天平、研钵、坩埚、坩埚钳、三脚架、泥三角、玻璃棒、酒精灯、干燥器、石棉网
硫酸铜结晶水含量的测定(最全)word资料
硫酸铜结晶水含量的测定【原理】利用加热水合硫酸铜使之失去结晶水的方法测硫酸铜结晶水的含量。
【用品】托盘天平、酒精灯、瓷坩埚、干燥器、泥三角、铁架台硫酸铜晶体。
【操作】(1)称量把托盘天平调零点后,准确称量清洁干燥(包括内外壁)瓷坩埚的质量(设为W1),并用这坩埚称取约2g(准确到0.1g)已经研碎的硫酸铜晶体(设坩埚和硫酸铜晶体总质量为W2)(2)加热把坩埚放在铁圈的泥三角上,用酒精灯的外焰慢慢加热,直至硫酸铜晶体由蓝全变白。
然后,用坩埚钳取下坩埚放入干燥器内冷却。
(3)称量待坩埚冷却后,把坩埚放在天平上称量(记下总质量)(4)再加热再称量把坩埚再加热数分钟,放在干燥器里冷却后再称量(记下总质量)到两次称量的质量相差不超过0.1g为止(设最后恒定总质量为W3)(5)计算如要求测定硫酸铜晶体的化学式,则计算式为:解出x(取近似整数),则化学式为CuSO4·xH2O。
这个实验产生误差主要有以下几个因素:【备注】(1)托盘天平的感量一般为0.1g,精确度不高,致使出现正误差或负误差,都有可能。
(2)如以由蓝变白作为硫酸铜晶体失水完全的标志,是不可靠的。
坩埚里硫酸铜的表面虽已全变白,而内部可能尚有未失水完全的硫酸铜,这样实验结果偏低。
以加热后两次称量的质量差不超过天平的感量(0.1g)为失水完全的标志,则可避免了上述偏低的误差。
(3)在加热硫酸铜晶体过程中,如用玻璃棒搅拌,常因玻璃棒端沾有少许硫酸铜晶体或无水硫酸铜而使实验结果偏大。
故不允许搅拌。
(4)硫酸铜晶体如未研碎,加热时可能发生迸溅损失,致使实验结果偏大。
(5)用酒精灯加热坩埚时,由于酒精燃烧不完全常在坩埚底部积碳而导致实验结果偏小。
故发现有积碳时,应在坩埚冷却后,用干纱布擦净后再称量。
牛奶中三聚氰胺的含量测定一.样品分子结构中文名英文名分子结构三聚氰胺Melamine二. 样品来源记录样品商品名:样品测定描述:主成分含量测定生产厂家:三. 液相方法条件方法来源:自主开发;具体方法:色谱柱:AQ-C18,5um,4.6×250mm流动相:10mmol/L辛烷磺酸钠和20mmol/L磷酸氢二铵(用磷酸调节pH=3.3):乙腈=90:10;检测波长:236nm;温度:室温29度;流速:1.0ml/min;进样量:20ul;流动相的配制:准确称取10mmol的辛烷磺酸钠和20mmol的磷酸氢二铵溶于1000ml水中,用磷酸调节pH至3.3准确量取该溶液450ml与50ml乙腈混合均匀,超声脱气;样品处理方法:标准品处理:准确称量250mg三聚氰胺标准品加入250ml容量瓶中,用一定量的水:乙腈=50:50超声溶解,然后用水:乙腈=50:50溶液稀释至刻度,配制成1000ug/ml的三聚氰胺溶液,得溶液BZ1;量取BZ1标准溶液1.0ml,加入100ml容量品中,用乙腈:水=50:50稀释至刻度,摇匀的标准溶液BZ2(此时浓度为10ug/ml);样品处理:准确称取2.000g奶粉,加入到10ml容量瓶中,加入乙腈:水=50:50至刻度以下,摇匀,超声20min;用乙腈:水=50:50溶液稀释至刻度;离心或静置分层,取上层清夜用纯水稀释至原来浓度的1/5倍,针筒过滤,进样20ul;注意事项:1. 分析前,先用纯水以1.0ml/min流速冲洗色谱柱30min;分析完成后,先用纯水以1.0ml/min流速反向冲洗色谱柱45min,然后再用乙腈:水=90:10以1.0ml/min流速反向冲洗色谱柱45min;反向冲洗,正向使用;2. 缓冲溶液,隔天需重新配制。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
筹办航空事宜
处
三、从驿传到邮政 1.邮政 (1)初办邮政: 1896年成立“大清邮政局”,此后又设 , 邮传邮正传式部脱离海关。 (2)进一步发展:1913年,北洋政府宣布裁撤全部驿站; 1920年,中国首次参加 万国。邮联大会
2.电讯 (1)开端:1877年,福建巡抚在 架台设湾第一条电报线,成为中国自 办电报的开端。
3.发展 (1)原因: ①甲午战争以后列强激烈争夺在华铁路的 修。筑权 ②修路成为中国人 救的亡强图烈存愿望。 (2)成果:1909年 京建张成铁通路车;民国以后,各条商路修筑 权收归国有。 4.制约因素 政潮迭起,军阀混战,社会经济凋敝,铁路建设始终未入 正轨。
二、水运与航空
1.水运 (1)1872年,
轮船正招式成商立局,标志着中国新式航运业的诞生。
(2)1900年前后,民间兴办的各种轮船航运公司近百家,几乎都是
在列强排挤中艰难求生。
2.航空
(1)起步:1918年,附设在福建马尾造船厂的海军飞机工程处开始
研制 。
(2)发展水:上1飞918机年,北洋政府在交通部下设“
”;此后十年间,航空事业获得较快发展。
无影响
10、硫酸铜晶体中混有受热分解的杂质
偏大
历史ⅱ岳麓版第13课交通与通讯 的变化资料
精品课件欢迎使用
[自读教材·填要点]
一、铁路,更多的铁路 1.地位 铁路是 交通建运设输的重点,便于国计民生,成为国民经济 发展的动脉。 2.出现 1881年,中国自建的第一条铁路——唐山 至开胥平各庄铁 路建成通车。 1888年,宫廷专用铁路落成。
质量(g)
第一次
第二次
44.520 44.670
47.020 48.358
46.070 47.004
2.500
3.688
1.550
2.334
0.950
1.354
用表格数据计算X值;第一次: 5.45 ,第二次: 5.16 ,平均值: 5.31
实验误差=
= 6.2%
(8)误差分析 理论值——5
相对误差=
结晶水合物中结晶水含量的测定
问题
加热5克硫酸铜晶体(CuSO4·x H2O)至完全失去结 晶水,称得剩余固体质量为3.2克,求硫酸铜晶体
的化学式。
CuSO4·xH 2O △CuSO4 xH 2O
160 + 18x
160
18x
3.2
பைடு நூலகம்
5-3.2
X=5
CuSO4·5 H2O
测定硫酸铜晶体(CuSO4·x H2O)中结晶水 的含量的思路
加热晶体至晶体完全失去结晶水,固体前后质量 差就是结晶水的质量。计算公式:
CuSO4·xH 2O △CuSO4 xH 2O
1mol
m(CuSO4)∶m(H 2O) 1∶x M (CuSO4) M (H 2O)
xmol
m(CuSO4)∶m(CuSO4·xH 2O) m(CuSO4) 1∶x
干燥器 (常用干燥剂:无水氯化 钙、硅胶)
实验数据的记录和处理
x m1 m2 160 m2 m0 18
名称
瓷坩锅质量(m0) 瓷坩埚+硫酸铜晶体的质量(m1) 瓷坩埚+无水硫酸铜粉末的质量(m2)
硫酸铜晶体的质量(m1—m0) 无水硫酸铜粉末的质量(m2—m0)
结晶水的质量(m1—m2)
[合作探究·提认知] 电视剧《闯关东》讲述了济南章丘朱家峪人朱开山一家, 从清末到九一八事变爆发闯关东的前尘往事。下图是朱开山 一家从山东辗转逃亡到东北途中可能用到的四种交通工具。
依据材料概括晚清中国交通方式的特点,并分析其成因。 提示:特点:新旧交通工具并存(或:传统的帆船、独轮车, 近代的小火轮、火车同时使用)。 原因:近代西方列强的侵略加剧了中国的贫困,阻碍社会发 展;西方工业文明的冲击与示范;中国民族工业的兴起与发展; 政府及各阶层人士的提倡与推动。
泥三角 坩埚钳
坩埚
(4)冷却后再称:在干燥器内冷却后, 称量瓷坩埚+硫酸铜粉末的质量(m2)
(5)再加热:把盛有硫酸铜的瓷坩埚再加 热,再冷却 (6)再称重:将冷却后的盛有硫酸铜的 瓷坩埚再次称量
恒重操作:(连续两次加热、冷却、称量)
(两次称量差不得超过0.001g)
(7)计算:根据实验测得的结果进行计算
(2)特点:进程曲折,发展缓慢,直到20世纪30年代情况才发生变 化。
3.交通通讯变化的影响 (1)新式交通促进了经济发展,改变了人们的通讯手段和 ,出行 方式转变了人们的思想观念。
(2)交通近代化使中国同世界的联系大大增强,使异地传输更为便 捷。
(3)促进了中国的经济与社会发展,也使人们的生活 多。姿多彩
偏大
3、加热前称量坩埚时未完全干燥
偏大
4、晶体试样受潮
偏大
5、加热温度过低固体未完全变白
偏小
6、加热时质量未至恒重就停止
偏小
m(H2O)
x m1 m2 160 m2 m0 18
m (CuSO4)
7、加热后坩埚未放在干燥器中冷却
偏小
8、晶体中混有受热不分解的杂质
偏小
9、坩埚中有受热不分解的杂质
(1)称量:准确称量一干燥洁净的瓷坩埚 质量(m0),精确至0.001g
(电子天平、瓷坩埚、坩埚钳)
(2)称量:瓷坩埚+硫酸铜晶体(2g左右) 的质量(m1)
(3)加热:加热至蓝色晶体全部变为白色 粉末 (酒精灯、铁架台、铁圈、泥三角、玻璃棒 )
电子天平
托盘天平可精 确至0.1克
电子天平可精 确至0.001克
M (CuSO4)
M (H 2O)
需要测定:硫酸铜晶体质量和失去结晶水后硫酸铜质量
一、结晶水含量测定的原理
实验 原理
CuSO4·xH2O
化学反应
CuSO4·xH2O
CuSO4 + xH2O
所测数据 计算公式
硫酸铜晶体质量 无水硫酸铜质量
m (H2O)
X=
18 m (CuSO4)
160
二、实验方案与步骤
实验测定值5
5
×100%
绝对误差= 实验测定值- 5
合理测定值范围:4.90~5.10
为了减少偶然误差,可采用多次平行实验求平 均值的方式来解决
平行实验:在相同条件下,作多次测定取 其平均值
尽可能多的找出实验误差的原因
(1)加热要充分但不“过头”(加热不充分,硫酸铜晶体没有完 全分解;加热温度过高CuSO4也分解)要进行恒重操作
(2)称量读数要正确 (3)加热时搅拌不当使晶体溅出坩埚外或被玻璃棒少量带走 (4)硫酸铜晶体研碎 (5)晶体加热后一定要将坩埚放在干燥器中冷却
m(H2O)
实验误差分析:
x m1 m2 160 m2 m0 18
m (CuSO4)
1、加热温度过高或时间过长,固体部分变为黑色
偏大
2、加热时搅拌不当使晶体溅出坩埚或黏在玻璃棒上
