离子方程式正误
专题2离子方程式正误的判断与离子共存

专题2:离子方程式正误的判断与离子共存【思维提示】1、离子方程式正误判断的“七看”一看:反应是否符号客观事实二看:物质的改写是否正确(把可溶的强电解质拆写成离子形式,其它物质都不拆)三看:方程式是否守恒(电荷守恒与原子守恒)四看:基本格式如“====”、“”、“—→”、“↑”、“↓”等是否正确五看:方程式是否完整如Ba(OH)2与CuSO4溶液反应如果写成Ba2++SO42-==BaSO4就是不完整的。
六看:反应物或生成物的离子配比是否正确如H2SO4与Ba(OH)2反应如果写成Ba2++OH-+H++SO4-==H2O+BaSO4,则Ba2+与OH-、H+与SO42-都不符合物质中配比关系。
七看:是否符合题设条件及要求。
如“少量”、“过量”、“等物质的量”、“适量”、“任意量”以及滴加顺序等条件和要求。
(难点)2、离子共存(一)判断的原则:能反应则不能大量共存,不能反应则可以大量共存(二)判断的方法1、发生复分解反应:生成难溶(或微溶)、难电离、易挥发或气体(1)弱酸根离子(如CO32-、SO32-、CH3COO-、S2-、ClO-、AlO2-等)、OH-与H+不能大量共存(2)弱碱阳离子(如Cu2+、Fe3+、Mg2+等)、H+与OH-不能大量共存(3)多元弱酸的酸式根(HCO3-、HSO3-、HPO42-、H2PO4-、HS-、HC2O4-等)与H+、OH-都不能大量共存(4)生成难溶物或微溶物(A)Ba2+、Ca2+与CO32-、SO42-、SO32-、PO43-、SiO32-(B)Ag+与Cl-、Br-、I-、PO43-、CO32-、SO42-、S2-(C)Fe3+、Cu2+、Al3+、Mg2+、Fe2+与OH-(5)生成挥发性物质H+与CO32+、SO32-、S2-、HCO3-、HSO3-、HS-2、发生双水解反应,如Al3+、Fe3+分别不与CO32-、HCO3-、AlO2-等共存,Al3+不与S2-共存。
高一化学离子方程式的书写及正误判断试题答案及解析

高一化学离子方程式的书写及正误判断试题答案及解析1.下列离子方程式书写错误的是()A.Na投入到水中:2Na+2H2O====2Na++2OH-+H2↑B.Al(OH)3溶于NaOH溶液中:Al(OH)3+OH-====Al+2H2OC.NaAlO2溶液中通入足量的CO2:2Al+CO2+3H2O====2Al(OH)3↓+CD.Al2O3粉末溶于NaOH溶液中:Al2O3+2OH-====2Al+H2O【答案】C【解析】 NaAlO2溶液中通入足量的CO2应该生成碳酸氢钠。
【考点】铝的氧化物与氢氧化物从铝土矿中提取铝2.与离子方程式H++OH-====H2O相对应的化学方程式是()A.Ba(OH)2+2HCl====BaCl2+2H2OB.NaOH+NaHSO4====Na2SO4+H2OC.Ba(OH)2+H2SO4====BaSO4↓+2H2OD.NaOH+CH3COOH====CH3COONa+H2O【答案】A、B【解析】离子方程式H++OH-====H2O所表示的含义是可溶性强碱和强酸反应生成可溶性盐和水的反应。
NaHSO4是强酸的酸式盐,在水溶液中完全电离出H+,相当于强酸,A和B选项都正确;Ba(OH)2溶液和H2SO4溶液反应生成的BaSO4是难溶性物质,C选项错误;醋酸属于弱酸,不能拆成离子的形式,D选项错误。
【考点】离子反应3.仔细分析下列实验:实验1:实验2:A、B、C试管中的现象如下表所示:写出A、B、C试管中发生反应的离子方程式。
(1)A: ;(2)B: ;(3)C:。
【答案】(1)Ba2++====BaSO4↓ (2)Cu2++2OH-====Cu(OH)2↓(3)Ba2++Cu2++2OH-+====BaSO4↓+Cu(OH)2↓【解析】BaCl2溶液和CuSO4溶液混合Ba2+和结合成BaSO4白色沉淀,Cu2+和Cl-不反应,所以溶液仍然呈现蓝色;向A试管中得到的滤液中加入NaOH溶液,Cu2+和OH-反应结合成Cu(OH)2蓝色沉淀。
离子方程式的正误判断和离子共存

6、(00)在水溶液可以大量共存的是( A )
A、,Ca2+、HCO3-、Cl-、K+ B、Al3+、AlO2-、HCO3-、 K+ C、Fe2+、NH4+、SO42- 、 S2D、Fe3+、SCN-、Na+、CO32-
7、(01)在强碱性溶液中可能大量共存的是( AC )
A、I-、AlO2-、Cl-、S2B、Na+、NH4+、K+ 、Ba2+ C、Br-、 S2- 、 Cl-、CO32D SO32- 、NO3-、SO42- 、HCO3-
离子方程式正误判断
(4)铝溶于硫酸铜溶液: Al Cu2 Al3 Cu
(5)氯气使湿润的淀粉碘化钾试纸变蓝: Cl2 I Cl I2
(6)二氧化锰与浓盐酸反应: MnO2 4H 2Cl Mn2 Cl2 2H2O
离子方程式正误判断
解: (1)错误,反应应生成Fe2+, 方程式违背了客观事实。
如:H+相ClO-、H+和OH-、H+和CH3COO-,H+和 PO43-等。
3、生成挥发性而不能共存
判断原则:有不稳定酸或不稳定碱生成。
如:H+和OH-、H+和CO32-,H+和SO32-,H+和HSO3-, NH4+和OH-等都不能在溶液中大量共存。
4、发生氧化-还原反应而不能大量共存
判断原则:常见的强氧化性离子和强还原 性离子不 能大量共存。如:MnO4-和I-,MnO4- 和S2-,MnO4-和 Fe2+,Fe3+和S2-, Fe3+和I-,Fe2+和NO3-(在酸性条件下), MnO4- 和Cl-(在酸性条件下),H+和S2O32-等都不能在溶 液中共存。
高考化学二轮复习专题课件离子方程式的书写及正误判断

(10)将少量SO2气体通入Na2CO3溶液中: _S_O_2_+__C_O__23-_=_=_=_S__O_23_-_+__C_O_2__。
(11)将过量CO2气体通入Na2SiO3溶液中: _2_C_O_2_+__S_i_O_23_-_+__2_H_2_O_=_=_=__H_2_S_iO__3↓__+__2_H__C_O__- 3 _。
(6)碳酸氢钙溶液加到醋酸中:Ca(HCO3)2+2CH3COOH===Ca2++2CH3COO-
+2CO2↑+2H2O( × ) (7)稀硫酸与氢氧化钡溶液反应:Ba2++SO24-===BaSO4↓( × ) (8)(NH4)2SO4溶液与Ba(OH)2溶液反应:Ba2++SO24-===BaSO4↓( × ) (9)向FeI2溶液中通入少量Cl2:2Fe2++Cl2===2Fe3++2Cl-( × )
2023届高考化学二轮复习专题 课件★★
离子方程式的书写及正误判断
正误判断,正确的打“√”,错误的打“×” (1)向AlCl3溶液中加入过量氨水:Al3++4NH3·H2O===AlO- 2 +4NH+4 +2H2O
(×)
(2)往NaClO溶液中通入少量SO2:2ClO-+SO2+H2O===2HClO+SO23-
归纳总结
“少定多变”法书写与量有关的离子方程式
先根据题给条件判断“少量物质”,以少量物质的离子计量数(充分 反应)确定所需“NaOH溶液的离子方程式的书写方法为
3.复分解型离子反应的顺序 (1)向含有H+、Al3+、NH+ 4的溶液中滴入NaOH溶液,写出依次反应的离子 方程式:_H_+__+__O_H__-_=_=_=_H__2O__、_A__l3_+_+__3_O__H_-_=_=__=_A_l_(O__H_)_3_↓_、_N_H__+4_+__O_H__- _=_=_=_N__H_3_·_H_2_O__、_A__l(_O__H_)_3+__O__H_-_=_=_=_A__lO__- 2_+__2_H_2_O__。 (2)向含有OH-、CO23-、CH3COO-的溶液中滴入盐酸,写出依次反应的离 子方程式:_O_H__-_+__H__+_=_=_=_H__2O__、_C__O_23_-_+__H_+_=_=_=_H__C_O_-3__、_H_C_O__-3 _+__H_+_=_=_=_ _H_2_O_+__C_O__2↑__、_C_H__3C__O_O__-_+__H_+__=_=_=_C_H__3C__O_O__H__。
离子方程式的正误判断

离子方程式的书写及判断正误的方法一、高考展望:离子方程式的书写及判断正误是历年高考中必考的试题之一。
主要以选择题形式出现。
重点考查客观性原理、等电性原理、书写规则和规范原则。
涉及的知识点有电解质、非电解质、强弱电解质、酸碱盐的溶解性及其复分解反应、氧化还原反应、盐的水解反应等多方面的内容。
同时也涉及反应物用量的问题。
从命题的内容上看,存在以下四个特点:⑴所考查的化学反应均为中学化学教材中的基本反应,错因大都属于化学式能否拆分、电荷是否配平、产物是否合理和是否漏掉部分反应等;定量离子方程的书写近几年考查的重点内容,也是这部分的难点。
⑵所涉及的化学反应类型以复分解反应为主,溶液中氧化还原反应所占比例较小。
⑶一些重要的离子反应方程式,在历年高考卷中多次重复。
如:碳酸盐与酸反应,Na与H2O 反应,金属Al或Fe与盐酸或稀硫酸的反应等。
⑷根据信息或实验现象书写离子方程式。
这类题型多贯穿在实验或简答题中。
离子方程式的书写步骤:一写二拆三删四查,其重点是拆,“拆”则必须符合“一拆三不拆”的原则。
二、考点归纳:1. 判断离子方程式书写正误的方法:看离子反应是还符合客观事实,不事主观臆造产物及反应。
如:看“==” “” “↓ ” “↑”等是否正确。
看表示各物质的化学式是否正确。
如HCO3-不能写成 CO32-+H+ , HSO4常写成SO42-+H+ ,HCOO-不可写成COOH –等。
看是否漏掉离子反应。
如Ba(OH)2溶液与CuSO4溶液反应,既要写Ba2+与SO 的离子反应,又要写Cu2+与OH-的离子反应。
看原子和电荷是否守恒。
如FeCl2溶液与Cl2溶液反应,不能写成Fe2+==2Fe3++2Cl-,应写成2Fe2++Cl2 ==2Fe3++2Cl-,同时两边的各原子数也应相等。
看反应物与产物的配比是否正确。
如稀H2SO4与Ba(OH)2溶液反应不能写成+OH-+SO42-+Ba2+==BaSO4↓+H2O ,应写成:2H++2OH-+SO +Ba2+==BaSO4↓+2H2O 。
离子方程式的书写及正误判断
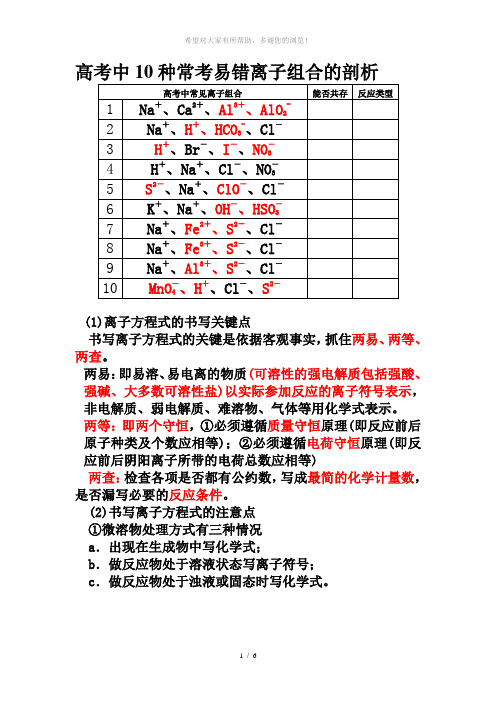
高考中10种常考易错离子组合的剖析(1)离子方程式的书写关键点书写离子方程式的关键是依据客观事实,抓住两易、两等、两查。
两易:即易溶、易电离的物质(可溶性的强电解质包括强酸、强碱、大多数可溶性盐)以实际参加反应的离子符号表示,非电解质、弱电解质、难溶物、气体等用化学式表示。
两等:即两个守恒,①必须遵循质量守恒原理(即反应前后原子种类及个数应相等);②必须遵循电荷守恒原理(即反应前后阴阳离子所带的电荷总数应相等)两查:检查各项是否都有公约数,写成最简的化学计量数,是否漏写必要的反应条件。
(2)书写离子方程式的注意点①微溶物处理方式有三种情况a.出现在生成物中写化学式;b.做反应物处于溶液状态写离子符号;c.做反应物处于浊液或固态时写化学式。
②盐类水解的离子方程式不要忘记“”。
③溶液中铵盐与碱反应加热放出NH3↑,不加热写NH 3·H2O。
④浓HCl、浓HNO3在离子方程式中写离子符号,浓H2SO4不写离子符号。
⑤HCO-3、HS-、HSO-3等弱酸的酸式酸根不能拆开写。
离子反应中的多重反应两种电解质溶液混合,至少电离出两种阴离子和两种阳离子,这四种(或更多种)之间都能两两结合成难电离(或难溶)的物质。
这样的离子反应称为多重反应。
在写这类反应的离子方程式时易丢其中的一组反应。
【例题】完成下列反应的离子方程式:(1)Ba(OH)2溶液与(NH4)2SO4溶液混合:(2)NH4HCO3与过量NaOH溶液混合:(3)Fe2O3溶于HI溶液中:(4)FeBr2溶液中通入过量Cl2:用分类思想突破跟量有关的离子方程式的书写1.连续型(1)可溶性多元弱酸(或其酸酐)与碱溶液反应。
如CO2通入NaOH溶液中:①碱过量:______________________________②碱不足:___________________________(2)多元弱酸盐与强酸反应。
如Na2CO3溶液与稀盐酸:盐酸不足:_______________________________;盐酸过量:_______________________________。
2023届高中化学二轮复习:离子方程式正误
B
H+、K+、S2O23-、SO24-
不能大量共存,因发生反应:2H++S2O23- ===S↓+SO2↑+H2O
C Na+、Fe3+、SO24-、H2O2
能大量共存,粒子间不反应
D H+、Na+、Cl-、MnO-4
能大量共存,粒子间不反应
答案
知识梳理
1.离子反应的本质离子反应的本质是溶液中某些物质的物质的量的减少(离子 间不共存)。2.离子不共存类型
看是否符合题设条件的要求,吉过量、少量、等物质的量、任意量以及滴加顺序对反应产物的影响。、如 在 FeBr2 溶液中通入少量 Cl2 的离子方程式为2Fe2++Cl2 === 2Fe3+ +2Cl-,在 FeBr2 溶液中通入 过量 Cl2 的离子方程式为2Fe2++4Br-+3Cl2 === 2Fe3++6Cl-+2Br2。 5. 判断下列离子方程式的正误 (1)向FeI2中通入少量Cl2:2Fe2++Cl2 === 2Fe3++2Cl-( )
A.碱转化为酸式盐:OH-+2H++CO23-===HCO- 3 +2H2O B.碱转化为两种盐:2OH-+Cl2===ClO-+Cl-+H2O C.过氧化物转化为碱:2O22-+2H2O===4OH-+O2↑ D.盐转化为另一种盐:Na2SiO3+2H+===H2SiO3↓+2Na+
正确的离子方程式为:CH3COOH+NH3·H2O CH3COO-+NH4++H2O (2)碳酸氢钙溶液加到醋酸中: Ca( HCO3 )2+2CH3COOH == Ca2++2CH3COO-+2CO2↑+2H2O( )
正确的离子方程式为:HCO3-+CH3COOH CH3COO-+CO2↑+H2O
“少定”
就是把相对量较少的物质定为“1 mol”,若少量物质有两种或两种以上 离子参加反应,则参加反应的离子的物质的量之比与原物质组成比相符
高考化学考点微专题04 突破离子方程式书写正误判断中的“六大陷阱”(解析版)
微专题04 突破离子方程式书写正误判断中的“六大陷阱”陷阱一、是否符合反应事实离子反应必须符合客观事实,而命题者往往设置不符合“反应原理”的陷阱,如Fe和非氧化性酸反应生成Fe2+,金属和氧化性酸反应不放H2,Na不能置换出CuSO4中的Cu;忽略氧化还原反应等。
【对点训练】1.判断下列离子方程式的正误(正确的“√”错误的打“⨯”)。
(1)向AlCl3溶液中通入过量氨水:Al3++4NH3·H2O AlO2-+4NH4++2H2O( ) (2)往NaClO溶液中通入少量SO2:2ClO-+SO2+H2O2HClO+SO32-( )(3)将Na投入到FeCl3溶液中:3Na+Fe3+2Na++Fe( )(4)Fe和稀盐酸反应:2Fe+6H+2Fe3++3H2↑()(5)Zn和浓硫酸反应:Zn+2H+H2↑+Zn2+( )(6)Fe3O4与稀硝酸反应:2Fe3O4+18H+6Fe3++H2↑+8H2O( )【答案】(1)⨯(2)⨯(3)⨯(4)⨯(5)⨯(6)⨯【解析】(1)⨯,NH3·H2O为弱碱,Al(OH)3不能溶于氨水,其离子方程式为:Al3++3NH3·H2OAl(OH)3↓+3NH4+(2)⨯,NaClO具有氧化性,SO2具有还原性,发生氧化还原反应,其离子方程式为:ClO-+SO2+H2O Cl-+SO42-+2H+(3)⨯,钠先和水反应生成氢氧化钠和氢气,氢氧化钠再和氯化铁反应生成氢氧化铁,其离子方程式为:6Na+2Fe3++6H2O 2Fe(OH)3↓+6Na++3H2↑(4)⨯,Fe 和稀盐酸反应生成亚铁离子,其离子方程式为: Fe +2H+Fe 2++H 2↑(5)⨯,Zn 和浓硫酸反应生成硫酸锌、二氧化硫和水,因为是浓硫酸,所以应写成化学式的形式,则其离子方程式和化学反应方程式一样为:2H 2SO 4(浓)+Zn△ZnSO 4+SO 2↑+2H 2O(6)⨯,Fe 3O 4与稀硝酸反应生成一氧化氮,其离子方程式为:3 Fe 3O 4 +NO 3- + 28H + == 9Fe 3+ + NO ↑+ 14H 2O陷阱二、“”“”“↑”“↓”是否使用恰当弱电解质水解的离子方程式用“”,若两种离子水解相互促进,可以进行到底,则要写成“”,如Al 3++3HCO 3-AJ(OH)3↓+3CO 2↑, NH 4+和OH -的反应,条件为浓溶液或加热,生成的NH 3要标明气体,若为稀溶液,则写成NH 3·H 2O 。
《课堂离子方程式正误判断方法》优秀教案
离子方程式正误判断1、铁与硫酸反应:2Fe +6H +===2Fe 3++3H2↑2、氢氧化亚铁溶于稀硝酸 222()22Fe OH H Fe H O +++===+3、AlCl3溶液中加入过量氨水:Al 3++4OH -= AlO 2-+2H 2O4、向次氯酸钙溶液中通人过量的二氧化硫 Ca 2++2C1O 一+SO 2+H 2O=CaSO 3↓+2HClO5、HCO 3-的水解:HCO 3- + H 2OH 3O + + CO 32-1、看离子反应是否符合客观事实,不可主观臆造产物及反应。
1、氯气溶于水:Cl 2 + H 2O === Cl - + ClO - + 2H +2、氯化铁溶液显酸性:Fe 3++3H 2O=Fe(OH)3↓+3H +3、醋酸铵溶于水:CH 3COO -+NH 4++H 2ONH 3·H 2O + CH 3COOH4、饱和氯化铁溶液滴加沸水中:+++↓=+3H )Fe(OH O 3H Fe 3235、NaHS 水解反应:O H HS 2+--+OH S H 22、看“===”“”“↑”“↓”等是否正确。
1、碳酸钙与盐酸反应:CO 32—+2H +=H 2O+CO 2↑2、碳酸氢钠和稀硫酸反应: CO 32-+2H +=CO 2↑+H 2O3、氢氧化亚铁与稀硫酸反应 2OH -+2H +=H 2021、澄清的石灰水与稀盐酸反应 Ca(OH)2 + 2H + = Ca 2+ + 2H 2O5、用湿润的醋酸铅试纸检验硫化氢气 +++↓=+2H PbS Pb S H 223、看各物质的拆分是否正确。
1、氢氧化钡溶液与稀 H 2SO 4 反应:Ba 2++SO 42—=BaSO 4↓2、碳酸氢铵溶液中加入过量O H CO OH HCO NaOH 2233+=+---4、看是否漏掉离子反应。
1、钠和冷水反应 Na +2H 2O =Na ++2OH -+H 2↑2、铜片插入硝酸银溶液中 Cu + Ag + = Cu 2+ + Ag3、FeCl 2溶液与Cl 2反应,:Fe 2++Cl 2===Fe 3++2Cl -5、看电荷及质量是否守恒。
离子方程式书写与正误判断的“七项”注意
6 向溴乙 烷中 滴人硝酸银溶液检验其中溴元素误写成:
A +B-一A B ( g+r: gr 应该考虑溴 乙烷先用 NO aH水 解 , H O 酸化才生成 AB 再加 N , gr I)
点, 但也并不是所有实验都可用之代替的。微型化学实验 和常规化学实验的关系应是有机结合, 是实验教学的“ ・ 体两 。 翼 在教学中, 应根据实验的内容、 目的 现象和定量
要求等进行选择, 使常规实验和微型实验相结合, 两者取 长补短 , 这样可以发挥更好的教学效果
阻、 臻 | . . 当前, 我国课程改革正深入发展, 在化学课程改革中
革中更应加以推广。 因此, 我们可以相信, 微型化学实验在 今后的中学教学中将拥有更大的空间。 一
参考文’ 呶
和 HO 而不放出 H ) z,
3四氧化三铁与稀硝酸反应误写成 : . F 8 + F22e+H0 ( e +H一 e+F34 2 稀硝酸强氧化性 , 0 + + 氧 化 F2并且生成 N e, * O和 HO )
4氢氧化铁与过量氢碘酸反应误写成: . F O ,3 + - e +H 0 ( e( H) H  ̄ F3 3 2 考虑 F¨ + - * e 氧化 I 一 生成
理 科 教 学 探 索
离 子 方 程 式 书 写 与 正 误 判 断 的 “ 项 ’ 意 七 ’ 注
孙
(. 1 石家庄 外国语 学校 ,河北 石家庄
晓 李海清z ,
0 0 2 ;2 陉县第 一中学 ,河北 50 1 . 井 石家庄 0 0 0 ) 5 30
摘
要: 离子反应是 高中化学重要 的基本概 念之 一 , 也是 高考试题的热点题型之一 。离子反应贯 穿于整个 中
安全, 实验现象也更明显, 学生在课后易于模仿。 近年中考 试题已加大了对化学实验的考查, 为此, 开展化学实验研 究意义重大。而微型化学实验由于本身的 特色, 在教学改
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
基本信息
浙江省嘉兴市海宁一中2007年高考化学专题复习一离子方程式的书写及判断正误的方
法 新课标 人教版
一、高考展望:
离子方程式的书写及判断正误是历年高考中必考的试题之一。主要以选择题形式出现。
重点考查客观性原理、等电性原理、书写规则和规范原则。不过,也要注意反应物的物质的
量之间的关系,哪种反应物过量的问题。从命题的内容上看,存在以下四个特点:
⑴所考查的化学反应均为中学化学教材中的基本反应,错因大都属于化学式能否拆分、
电荷是否配平、产物是否合理和是否漏掉部分反应等;
⑵所涉及的化学反应类型以复分解反应为主,溶液中氧化还原反应所占比例较小。
⑶一些重要的离子反应方程式,在历年高考卷中多次重复。如:碳酸盐与酸反应,Na
与H2O 反应,金属Al或Fe与盐酸或稀硫酸的反应等。
⑷根据信息或实验现象书写离子方程式。这类题型多贯穿在实验或简答题中。
二、考点归纳:
1. 判断离子方程式书写正误的方法:
⑴看离子反应是还符合客观事实,不事主观臆造产物及反应。
⑵看―==‖ ― ‖ ―↓ ‖ ―↑‖等是否正确。
⑶看表示各物质的化学式是否正确。如HCO3- 不能写成 CO32- +H+ ,HSO4- 通
常写成SO42-+H+ ,HCOO- 不可写成COOH – 等。
⑷看是否漏掉离子反应。如Ba(OH)2 溶液与CuSO4 溶液反应,既要写Ba2+与SO42
-的离子反应,又要写Cu2+与OH-的离子反应。
⑸看电荷是否守恒。如FeCl2 溶液与Cl2 溶液反应,不能写成Fe2++Cl2 ==2Fe3++2Cl
-,应写成2Fe2++Cl2 ==2Fe3++2Cl-,同时两边的各原子数也应相等。
⑹看反应物与产物的配比是否正确。如稀H2SO4 与Ba(OH)2 溶液反应不能写成
H++OH-+SO42-+Ba2+==BaSO4↓+H2O ,应写成2H++2OH-+SO42-
+Ba2+==BaSO4↓+2H2O 。
⑺看是否符合题设条件及要求。如―过量‖ ―少量‖ ―等物质的量‖ ―适量‖ ―任意量‖ ―滴加顺序‖
对反应方式或产物的影响。
2. 定量离子方程式的书写方法:
书写这类离子方程式时,首先要搞清反应物物质的量之比,若没告诉比例关系,则要弄
清滴加顺序。
⑴开始滴加时,滴管中的反应物是不足量的,而锥形瓶(或烧杯等反应容器)中反应物过
量。
①对于中和反应来说:
若碱过量,中和产物为正盐,
若酸或酸性气体在与碱反应时过量,可能生成酸式盐(对多元酸来说)。
②在氧化还原反应中:
若氧化剂过量,能被氧化的元素都将被氧化;
若氧化剂不足量,则还原性强的元素首先被氧化,就像Cl2和FeBr2溶液反应那样。
⑵要具体情况具体分析,看清题意,再写出符合题意的离子方程式。
例1. ⑴将少量NaOH溶液滴入过量的Ca(HCO3)2溶液中;
⑵将Ca(HCO3)2溶液与 NaOH溶液以溶质的物质的量之比1∶1混合;
⑶将Ca(OH)2溶液与NaHCO3溶液以溶质的物质的量比1∶1混合;
⑷少量NaHCO3溶液滴加到过量的Ca(OH)2溶液中。
以上离子方程式均可用下式来表示: HCO3- + OH- + Ca2+ == CaCO3↓+H2O
例2. ⑴过量的NaOH溶液与Ca(HCO3)2溶液反应;
⑵NaOH溶液与Ca(HCO3)2溶液以溶质的物质的量之比2∶1反应;
⑶Ca(OH)2溶液与NaHCO3溶液以溶质的物质的量比1∶2反应;
⑷Ca(OH)2溶液与过量的NaHCO3溶液反应。
离子方程式均可用下式表示:2HCO3—+2OH- +Ca2+ == CaCO3↓+2H2O+ CO32-
例3. ⑴氢氧化钡和硫酸溶液反应(物质的量任意比);
⑵氢氧化钡和硫酸氢钠以溶质的物质的量之比1∶2反应;
⑶氢氧化钡溶液与过量的硫酸氢钠溶液反应。
均可用下式表示其离子反应:2H++2OH-+SO42-+Ba2+==BaSO4↓+2H2O
例4. ⑴硫酸氢钠溶液和氢氧化钡溶液以溶质的物质的量比1∶1反应;
⑵NaHSO4溶液和过量的Ba(OH)2溶液反应。
均用下式表示其离子反应:H++OH-+SO42-+Ba2+==BaSO4↓+H2O
例5. ⑴CO2与NaOH溶液以反应物物质的量之比1∶2反应;
⑵CO2通入过量的NaOH溶液中。
均用下式来表示其离子反应: CO2 + 2OH- == CO32—+H2O
请思考如下反应的离子方程式应如何表示:
⑴过量CO2通入NaOH溶液中: CO2 + OH- == HCO3-
⑵CO2与NaOH溶液以反应物物质的量之比1∶1反应:CO2 + OH- ==HCO3-
SO2跟NaOH溶液的反应呢?
例6. ⑴将少量盐酸滴入NaAlO2溶液中;
⑵NaAlO2溶液与盐酸以溶质的物质的量之比1∶1反应。
均可用下式表示其离子反应:AlO2—+H+ == Al3++2 H2O
例7. ⑴将少量NaAlO2溶液滴入盐酸溶液中;
⑵将NaAlO2溶液与盐酸溶液以溶质的物质的量之比1∶4反应。
均用下式表示其离子反应:AlO2—+4H++ H2O== Al(OH)3↓
请思考如下反应的离子方程式应如何表示:?
⑴少量NaOH 溶液滴加到AlCl3溶液中:Al3++3OH—== Al(OH)3↓
⑵NaOH溶液与AlCl3溶液以反应物物质的量之比3∶1反应(同上)。
例8. ⑴将少量AlCl3溶液滴加到过量的NaOH溶液中;
⑵NaOH溶液与AlCl3溶液以反应物物质的量之比4∶1反应。
均用下式表示其离子反应:Al3++4OH—== AlO2—+2 H2O
例9. ⑴将CO2通入过量的NaAlO2溶液中;
⑵CO2与NaAlO2以1∶2的物质的量比反应(在溶液中)。
其离子方程式均可用下式表示:CO2+2AlO2-+3H2O==2Al(OH)3↓+CO32-
请思考如下反应的离子方程式应如何表示:
⑴若将过量的CO2通入NaAlO2溶液中:
CO2+AlO2-+2H2O==Al(OH)3↓+HCO3-
⑵CO2与NaAlO2以1∶1的物质的量之比在溶液中反应。(同上)
例10. ⑴将少量CO2通入Na2SiO3溶液中;
⑵CO2与Na2SiO3以物质的量之比1∶1反应。
其离子方程式均可用下式表示:CO2+SiO32—+ H2O== H2SiO3↓+ CO32-
