第七章 卤代烃
最新大学有机化学重点知识总结第七章 卤代烃

C H 2 C l + H 2 O
§7.5 卤代烷的化学性质
δ+
C C
HH
消除反应 :B
亲核取代 反应
δ-
X Nu-:
极性共价键 断裂
一、亲核取代反应
C–X 的极化:
δδ
CX
亲核试剂, Nu 负电荷或未共用电子对 RO-, OH-, CN-, NH3 离去基团, L
Nu + δ C Lδ
C Nu + L
B r
C H 2C H C H C H 3 C H 3
C 2H 5O N a C 2H 5O H
C HC H C H C H 3 C H 3
若能形成共轭体系,以形成稳定的共轭体系 为主要产物。注意不是脱含H少的碳上的H
c.邻二卤代烷脱卤化氢
Hβ X + 2NaOH 乙 醇 X
Hβ'
+ 2NaX + 2H2O
2–甲基–3–氯丁烷
B rC H 2C H 2 C HC H 2C H 2C H 3 3–乙基–1–溴己烷
C 2H 5
CH3CH2CHCH2 CH3 CH2Cl
3–氯甲基戊烷
卤代烷的命名
Cl 2-氯乙基环己烷
Cl
CH3 H Br
C 3H 7
1-氯二环[2.2.1]庚烷 (S)-2-溴戊烷
3、卤代烯烃的系统命名法
叔 卤 烷 仲 卤 烷 伯 卤 烷
易
难
b. 对于含不同β–H的RX, 消除方向遵循Saytzeff
(萨伊切夫)规则:
生成双键C原子上取代较多的烯烃
C H 3C H C H C H 2C 2H 5C O 2N H a5O 或 H N aO H HBrH
有机化学-第七章 卤代烃
1 加NaOH是为了加快反应的进行,使反应完全。 2 此反应是制备醇的一种方法,但制一般醇无合成价值,可用 于制取引入OH比引入卤素困难的醇。
2.与醇钠(RONa)反应—醇解—制备(混合)醚(称为威廉森合成)
' R-X + RONa
R-O R' + NaX 醚
R-X一般为1°RX,(仲、叔卤代烷与醇钠反应时,主要发生消 除反应生成烯烃)。 3.与氨反应
二、消除反应 从分子中脱去一个简单分子生成不饱和键的反应称为消除反应, 用E表示。 卤代烃与NaOH(kOH)的醇溶液作用时,脱去卤素与β碳原子 上的氢原子而生成烯烃。
R-CH-CH2 + NaOH H X
KOH- 醇 R-CH=CH-CH=CH-R + 2NaX + 2H2O
醇
R-CH=CH2 + NaX + H2O
CH3 叔丁基溴 tert-butyl bromide 叔溴丁烷
2、IUPAC命名法
(1)饱和卤代烃
CH 3-CH2-CH--CH-CH 3 H3C Cl
Cl 3- 甲基 -5- 氯庚烷 3- 氯 -5- 甲基庚烷 × 4- 甲基 -2- 氯己烷 CH 3-CH2-CH-CH -CH-CH -CH3 2 2 CH 3
亲核取代反应机理小结
卤代烃亲核取代的两种机理: SN2 和 SN1 机理
SN2 机理:双分子取代,一步机理
反应速率 = k[RX][Nu-]
手性底物反应发生构型转换 反应速率:1º RX>2º RX>3º RX (空间位阻效应)
SN1 机理:单分子取代,二步机理
反应速率 = k[RX] 手性底物反应发生消旋化
第七章 卤代烃

• 常将卤烷与强碱(NaOH、KOH)的水溶液共热
NaOH
ROH + NaX
• 一般的卤烷是由醇制得。
• 但在实际上在一些比较复杂的分子中要引入一个 羟基常比引入一个卤素原子困难。因此,对这类分 子的合成往往可以先引入卤素原子,然后通过水解 再引入羟基。
•卤烷水解反应的速度与卤烷的结构、使用的 溶剂及反应条件等都有关。
NHR'2(H)
R R NH2 伯胺 R NHR' 仲胺 R NR'2 叔胺
SH R SR' 硫醇(硫醚)
R-X为重要有机中间体(intermediates)
3. 还原反应 卤原子被氢取代的反应:
——在卤烃的取代反应中,卤原子也能被氢原子取代。 例如:在卤烃在催化化加氢或用碘化氢还原时,卤烃 上的卤原子被氢取代:
偕二卤代烷
X R R C R
X C R R
R
卤代烯烃
卤代芳烃 X与sp2碳相连 性质特殊
邻二卤代烷
3. 卤代烷的命名
普通法和俗称:
CH3 CH3 Br CH3CHCH2 异丁基溴 isobutyl bromide 异溴丁烷 Br Br CH3CH2CH 仲丁基溴 sec-butyl bromide 仲溴丁烷
CH2Cl
( 8)
•
3. 一卤代芳烃的异构(卤素在苯环上的异构,卤素在侧链上的异构)
第二节 卤代烷的物理性质
1. 卤代烷的物理性质简介
物态:一般为液体,高级为固体,少量为气体(溴甲烷,氯乙烷) 比重: 一氯代物通常 d < 1。 溶解度:不溶于水,易溶于有机溶剂
其它:多卤代物一般不燃烧
卤代烯烃和卤代芳烃的命名:将卤素作为取代基,其余与烯烃、芳烃类同
第七章卤代烃

CH3CH2OH + HBr
在一般情况下,此反应很慢。为增大反应速率,提高醇的产 率,常加入强碱(氢氧化钠),使生成的HX与强碱反应,可 加速反应并提高了醇的产率。
CH3CH2Br + NaOH
CH3CH2OH + NaBr
• 此反应工业用途不大,因卤烷在工业上是由醇制取,但可用 于有机合成中官能团的转化。用于复杂分子中引入羟基(先 卤代,再水解)。
醇 R-X + AgNO3
R-O NO2 + AgX 硝酸酯
反应通式如下:
R - L + :Nu RCH2X + -OH 反应物 亲核试剂 (底物) 进攻基团
R - Nu + L-
RCH2-OH + X-
产物
离去基团
1. 卤烃的水解
• 卤代烷与水作用,水解为醇,反应是可逆反应。如:
CH3CH2Br + H2O
• 查依采夫规则: • 卤代烷脱HX时,总是从含H较少的碳上脱去H原子。
Saytzeff规则应用
CH3
CH3
KOH / 醇
CH3 CH C CH2
CH3 CH C CH3 71%
CH3
H Br H
CH3 CH2 C CH2 29%
• Saytzeff规则的实质上是生成一个较稳定的烯烃。
• 总是要生成共轭效果较好的结构(较稳定)。如:
•而仲卤烃和叔卤烃在碱(氰化钠、氰化钾)的作用
下易发生消除反应,生成烯烃,此反应一般不用仲、 叔卤烃反应。
•产物腈还可转化为胺、酰胺和羧酸。
4. 卤烃的氨解
• 此反应既可用氨反应,也可用氨的衍生物反应,来 制取伯、仲、叔胺。
有机化学-卤代烃

(4)被硝酸根取代
RX + AAgg+NOONO32— 醇
R ONO2 + AgX
硝酸酯
•卤化银沉淀产生,反应可作为卤代烃的鉴别反应。
卤代烃反应活性: 烯丙基卤>叔卤代烃>仲~>伯~
(5)卤素交换
丙酮
R-Br(Cl) + KI
R-I + NaBr(Cl)
难溶于丙酮
难溶于丙酮
(6)被氨基(-NH2)取代
三、命名
普通命名法 俗名 系统命名法
1.普通命名法
在烃基名称之前(或后)加上卤素的名 称,称为卤(代)某烃或某烃基卤。
CHCl3
三氯甲烷 氯 仿 (俗名)
C2H5Cl
氯乙烷 乙基氯
(CH3)3CBr
叔丁基溴
CH2=CHBr 溴乙烯
H2C CH CH2 烯丙基溴
Br
Br
溴苯
CH3
Br
邻-溴甲苯(2-溴甲苯) 2-bromotoluene
3-甲基-5-氯庚烷 3-chloro-5-methylheptane
H2C C CH3
Cl
2-氯丙烯 2-chloro-propene
CH3CH CHCH2Cl
1-氯-2-丁烯 1-chloro-2-butene
H37C
CH
6
CH
5
C4H2
CH
3
CH
2
C1H3
CH3 I
Cl CH3
2,6-二甲基-3-氯-5-碘庚烷
•(一) 亲核试剂:具有孤对电子的物质, 能与底物中带部分正电荷的碳发生反应, 这 种 物 质 称 为 亲 核 试 剂 。 ( 也 是 Lewis 碱)。
第七章 卤代烃(有机)

(2) 极性非质子溶剂,当极性增大对SN1反应有利; 对亲核试剂为Nu-的SN2反应不利, Nu 的有利。 (因为SN1反应过渡态极性增大,SN2反应过渡 态极性减小)。
(3)非极性溶剂对SN1、 SN2反应都不利。 (Nu-不溶于非极性溶剂)
45
三 -消除反应的三种反应机制为: E1 E2 E1cb
一 、Nucleophilic Substitution (一) 亲核取代和亲核试剂
δ+ δ -
8
(二)、常见的亲核取代反应
负离子亲核试剂,如OR - ,OH - ,SH - ,CN - 等,实验室中常用它们的钠盐,钾盐或锂盐,例: NaOR′ NaOH RX KSH NaSR′ ROR′ ROH
第七章 卤代烷
第一节 卤代烃的结构、分类和命名 一 、碳卤键的结构特点
极性共价键,成 键电子对偏向X.
成键轨道
C
178 6.838
X
190 6.772 212 6.371
1
pm 10-30
142
诱导效应:由于成键电子对偏向而发生的极化现象称 为诱导效应(Inductive effect),用“I”表示,I效应是 以氢原子为基准,比氢原子“吸”电子的称其具有-I效
52
消除构象
H CH 3 CH3
优势构象
CH3
H3C Br
产物从区域选择性看, 不符合Zaitsev规则。
Cl Cl H H R R
53
(三)E1反应机理
E1、E2反应条件:稀碱、弱碱,20、30卤代烃易发生 E1消除;浓强碱及低级性溶剂中易发生E2;10卤代烃 E1难,E2慢。
54
四、消除反应与亲核取代反应的竞争
第七章 卤代烃
1
2
Br
Br
FH
Cl
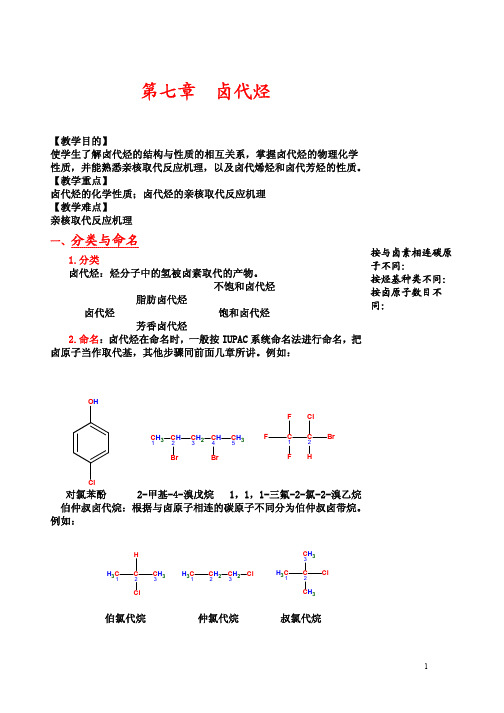
对氯苯酚
2-甲基-4-溴戊烷 1,1,1-三氟-2-氯-2-溴乙烷
伯仲叔卤代烷:根据与卤原子相连的碳原子不同分为伯仲叔卤带烷。
例如:
H
H3C1
C
2
C3 H3
Cl
H3C1
C2 H2 C3 H2 Cl
伯氯代烷
仲氯代烷
H3C1
C3 H3 C Cl
2
CH3
叔氯代烷
1
有些卤代烃常用俗名例如:
H2N- >HO- >F-
R3C- > R2N- > RO- > F-
⑶同一族元素中,周期高的原子亲核性大,碱性则降低。例如:
亲核性:
I- >Br- > Cl- >F-
RS- > RO-
碱性:
I- <Br- < Cl- <F-
RS- < RO-
在质子溶剂中,一些常见的亲核试剂的亲核性的顺序大概如下:
亲核取代:由于亲核试剂的进攻而发生的取代反应。
(elimination
⑴ 卤代烃的水解: ⑵ 威廉姆逊合成(williamson) ⑶ 卤代烃的氨解:
reaction); ⑴ 脱 HX 的能力: ⑵ 札依采夫规律: 在反应中,主要产
与过量的氨作用,卤原子被氨基取代生成胺。
物为双键上烷基取
⑷ 被氰基取代: 氰可进一步水解,生成酸,这是制备酸的一个重要方法,在合成 中非常有用。
脱氢。
⑵ 脱卤素
3.与金属反应
格氏试剂性质活波,与含活波氢的化合物反应,如:H2O、RCOOH、
RCH3OH、NH3、RC≡CH 等等
其中 Y= —OH、—OR、—NH2、—C≡CR
第七章 卤代烃

CH3COCH3
R
I + BrRelative Rate
Relative Rate
Compound
CH3Br CH3CH2Br (CH3)2CHBr (CH3)3CBr
30 1 0.02 ~0
CH3CH2Br CH3CH2CH2Br (CH3)2CHCH2Br (CH3)3CCH2Br
100 28 3 0.00001
相反的过程。构型转化是SN2反应的立体化学特征。
为什么亲核试剂总是从离去基团的背面进攻中心碳原子?
.
sp3 sp2
Nu:- +
C L
Nu
C
L
p轨道
Nu C + :L- .
基团的排斥;过渡态能量;亲核试剂与离去基团的距离。
2. 单分子亲核取代反应(SN1)机理及其立体化学
CH3 CH3 C Br + OH CH3
R2CHX R3CX
卤代烃的命名 a.普通命名法
一些分子中的烃基部分有简单的非系 统名称的卤代烃可采用普通命名,即在相 应烃基名前加卤素名称。
CH3 CH3 CH2CH2CH 2Br
正丁基溴 溴代正丁烷
H3C H
CH2Br
异丁基溴 溴代异丁烷
系统命名法,把卤素作为取代基。其它 的命名原则与烷烃的命名基本相同。 当烷基和卤素相同编号时,优先考虑烷 基。当双键和卤素并存时,优先考虑给 双键以尽可能小的编号 。
-
CH3COCH3 H2O
CH3 CH3 C OH + BrCH3
V= k1[(CH3)3CBr]
反应分步进行:
CH3 (1) CH3 C Br CH3 CH3 (2) CH3 C + OH CH3
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第七章 卤代烃重点内容提要一. 结构特点卤代烃可看作是烃分子中的氢被卤原子取代的产物。
卤代烷的通式可用C n H 2n+1X 或RX 来表示,其中R 为烷基,X 为F 、Cl 、Br 、I ,分子中主要存在的是σ键。
碳卤键为极性共价键,即: δ δC X +,X 为官能团。
二. 构造异构卤代烷主要存在碳链异构及由于卤原子的位置不同而产生的位置异构。
卤代烯烃的同分异构现象比较复杂,除了存在碳链异构外,还存在着由于卤素和双键位置不同而产生的位置异构,此外还存在着顺反异构。
三. 命名原则卤代烃可用两种命名法来命名。
(1)系统命名法,即以卤原子为取代基,烃基为母体,命名原则与烃相似。
(2)习惯命名法,即以卤原子为母体,烃基作为取代基,称为“某烃基卤”。
四. 化学性质1.卤代烷烃的化学性质 (1)亲核取代反应 a.水解:RX + H 2O ROH + NaXNaOH△b.醇解:RX + NaOR'R-O-R' + NaXc.氰解:RX + NaCNRCN + NaX C 2H 5OHd.氨解:RX + NH 3RNH 2 + HX C 2H 5OHe.与硝酸银反应:AgNO 3RX +RONO 2 + AgX(2)消除反应:R CH CH 2HXRCH=CH 2+HX(3)与金属镁反应:RMgX 无水乙醚2. 卤代烷烃亲核取代反应历程卤代烃的取代反应是亲核取代反应。
卤代烃的结构不同,反应历程也不同。
一般情况下叔卤代烷易进行S N 1反应,伯卤烷,甲基卤代烷易进行S N 2反应,仲卤烷介于两者之间。
(1)S N 1反应历程(以卤代烷水解为例): 第一步:R 3C X R 3C + + X 慢第二步:R 3C + + OHR 3C OH 快反应活性:R 3C X X R 2CH>> RCH 2X > CH 3X(2)S N 2反应历程(以卤代烷水解为例):δHHCOH HHO+ X H +H过渡态反应活性:CH 3X > RCH 2X > R 2CH X > R 3C X3、卤代烯烃和卤代芳烃的化学性质卤代烯烃兼具卤代烃和烯烃的性质,既可发生亲核取代反应,也可发生亲电加成反应。
卤代芳烃兼具卤代烃和芳烃的性质,既可发生亲核取代反应,又可发生亲电取代反应。
但是不同结构的卤代烯烃、卤代芳烃发生亲核取代反应及与金属镁作用时,反应活性差别很大,反应活性顺序为:烯丙型卤代烃>隔离型卤代烃(或卤化烷)>乙烯型卤代烃。
五. 制备方法1.醇与HX 的作用(或与PX 3,PX 5,SOX 2作用)ROH + HX RX +H 2O2.烃的卤代RH + X 光RX + HX RCH 2CHCH 2+ XRCH CHCH 2X+ HXArH + X 23Fe ArX + H X3. 烯烃、炔烃加卤素,加卤化氢R CH CH 2+ X R CH 2X CHX R CH CH 2R CHX CH 3RC CH + 2X 2R CX 2CHX 2RCX 2CH 3RCCH典 型 例 题 解 析例一 用系统命名法命名下列化合物:CH 3CH 3CH CH 2CH CH 3(1)CH 3CHCHC3CH 3ClCl (2)CH 3CH 2CH CHCH C CH 3CH 3Cl I BrCH 3(3)CH 3CHCH 2CH 3CH 2CH 2ClC(4)[解析] 复杂卤代烃可用系统命名法命名,即选择含卤原子的最长链作为主链,把卤原子作为取代基,从靠近支链或取代基的一端给主链编号,支链或取代基的位次、名称按“次序规则”写在母体之前。
例如:CH 33CH CH 2CH ClCH 312345(1)2-甲基-4-氯戊烷上式中-CH 3和-Cl 与两端等距,编号由原子序数的顺序决定。
原子序数较小的编号则较小。
在书写名称时,则按“次序规则”,较优先的原子或基团应写在后面。
该化合物应命名为2-甲基-4-氯戊烷。
CH 3Cl CHCH CCH 3CH 3Cl Cl 12345(2)3-甲基2.2.4-三氯戊烷-,,主链上若连有多个取代基时,编号要遵循“最低系列原则”,该化合物应命名为3-甲基-2,2,4-三氯戊烷。
CH 3CH 2CH CH CH CCH 3CH 3Br3Cl123456I(3)2-甲基-3-乙基-5氯-3-溴-4-碘己烷分子中若含有多个不同的卤原子,书写名称时则按F →Cl →Br →I 的次序,该化合物称为2-甲基-3-乙基-5氯-3-溴-4-碘己烷。
CH 3CHCH 2CH 2CH 2ClCCH 312345(4)3-乙基-5-氯-2-戊烯卤代烯烃的命名是以烯烃为母体,卤原子为取代基。
应选择同时含有碳碳双键和卤原子的最长碳链作为主链,从靠近双键的一端给主链编号,最后确定名称。
该化合物命名为:3-乙基-5-氯-2-戊烯。
例二 用习惯命名法命名下列各化合物CH 3CHCH 2CH 2CH 2F CH 3(1)CH 3C CH 3Br CH 3(2)CH 3C CH 3CH 2ICH 3(3)CH 3CH CH 2CH 3Cl(4)CH 2Cl (5)(6)CH 2CHCH 2Br[解析] 卤代烃的习惯命名法是以卤原子作为母体,烷基作为取代基进行命名。
因此必须首先确定烷基的名称,然后加上卤素名就是全称。
CH 3CHCH 2CH 2CH 2F CH 3CH 3CHCH 2CH 2CH 2CH 3(1)异己基氟异己基CH 3CCH 3BrCH 3(2)CH 3C CH 3CH 3叔丁基叔丁基溴CH 3C CH 3CH 2I3CH 3CCH 3CH 2CH 3(3)新戊基新戊基碘CH 3CHCH 2CH 3CH 3CH CH 2CH 3(4)仲丁基仲丁基氯CH 2(5)CH 2Cl苯甲基或苄基苯甲基»或苄氯氯 CH 2CH CH 2Br CH 2CH CH 2(6)烯丙基烯丙基溴例三 完成下列反应式Cl2Cl+ Mg (1 mol)(1)Cl+ Mg (1 mol)(2)(3)CHBrCH 2Cl NaCN (1 mol )+CH=(4)C 2H 5ONa (1 mol )CH=CHCH 2Br +Cl[解析](1)烯丙型氯的活性大于乙烯型氯,故反应式为:Cl2Cl + Mg (1 mol)ClCH 2MgCl (2)碘代烃的活性大于氯代烃,故反应式为:Cl四氢呋喃Cl(3)烯丙型氯的活性大于乙烯型溴,故反应式为:CH=CHBrCH 2Cl+CH 2CNCH=CHBr(4)烯丙型溴的活性大于乙烯型氯,故反应式为:CH=CHCH 2BrC 2H 52OC 2H 5+例四 用化学方法区别下列化合物ClCl ClCl 、、和[解析]上述四种物质都是环状氯代烃,但氯原子在分子结构中的位置不同。
ClCl和属于乙烯型卤代烃,它们分别与硝酸银的醇溶液反应时,Cl室温下立刻产生白色沉淀,Cl加热后产生白色沉淀。
Cl和没有沉淀产生。
但Cl可使溴的四氯化碳溶液或高锰酸钾溶液褪色。
这样便可把这四种物质区别开。
可用简式表示如下:ClCl褪色ClCl也可用下列方法进行区别Cl褪色白色ClCl例五 用给定的原料合成化合物CH 3CH 2CHCH 2CH CH 2OHClCl(1)CH 2CH 2 、CH 2CH 3C 3CH 3CH 3O(2)CH 2C CH CH 3[解析]CH 3CH 2CHCH 2CH CH 2ClCl(1)首先选择合理的合成路线,要得到2、3—二氯—1—丙醇,需要进行三步反应。
即:先进行α—H 原子的卤代,再进行水解反应,最后进行加成反应。
故反应式为:CH 3CH 2CHCH 2CH CH 2ClCl+ Cl 2500℃CH 2CHCH OHCH 2CH ClCl 2CHCH 3CH 3CH 2CH 2 、CH 2CH 3C CH 3CH 33O(2)C CH 2制备混醚的最好方法是采用威廉森合成法,既选用醇钠和卤代烷反应制得。
要制备叔丁基醚应选择叔丁醇钠和伯卤烷为原料,如选择叔卤烷为原料,主要产物是烯烃而不是醚,因为叔卤烷在强碱中易发生消除反应。
反应式如下: CH 2CH 2 + HBrCH 3CH 2B rCH 3CH 3C 3CH 3CH 3OHCH 2C C 3CH 3CH 3ON +aH 2OCH 2CH 3C CH 3CH 3CH 3OC CH 3CH 3CH 3ONa + BrCH 2CH例六 比较下列各组化合物的化学活性(从大到小排列) (1) S N 1反应活性:CH 2CH 2CH 2CH 3CH CH 2CH 3CH 2CHClCl(2) S N 2反应活性: 1-氯丁烷,2-氯丁烷, 2-氯-2-甲基丙烷,(3) 水解反应活性:ClClClClNO 2NO 2NO 2NO 2NO 2O 2N(4) 消除反应活性:CH 3CH 3CH 2C BrCH 2CH 2CH 3CHCHBrCH 3CH 3CH 2CH 2CH 2CH 2BrCH 3CH 3[解析](1)卤代烷进行S N 1 反应时分两步进行。
首先是卤代烷在极性试剂的影响下发生离解,形成碳正离子,碳正离子越稳定,第二步反应就越容易进行。
反应式如下:CH 2CH 2CH 2ClCH 2CH 2CH 2++ ClCH 3CH CH CH 3CHCH 2++ ClCH 3CH 2CHCl+ ClCH 3CH 2CH+碳正离子的稳定性:CH 3CH 2CH+>CH 3CHCH 2+CH 2CH 2CH 2+>,因此S N 1的反应活性为:CH 3CH 2CHCl>>CH 3CH CH 2CH 2CH 2CH 2。
(2) 卤代烃进行S N 2反应不分阶段,形成过滤态的中心碳原子上连的支链越少,空间阻碍效应越小,反应越容易进行。
因此S N 2反应活性为:1—氯丁烷>2—氯丁烷>2—氯—2—甲基丁烷。
(3).上述四种物质都是乙烯型的卤代烃。
除Cl外,在邻、对位上都连有不同数目的—NO 2,—NO 2是强吸电子基。
当它连在—Cl 的邻位或对位上时就会产生吸电子的诱导效应(-I)和吸电子共轭效应(-C),这两种效应的方向一致,都能使C-Cl 键之间的电子云密度下降,使氯原子的活性大大增强。
—NO 2越多,氯原子的活性越大。
因此水解反应活性为:>2NO 22>>22(4).卤代烃在氢氧化钾(钠)醇溶液的作用下,加热发生消除反应。
仲卤烷和叔卤烷消除卤化氢时遵守查依采夫规则,反应向生成多支链的烯烃方向进行,因为多支链的烯烃能量低,稳定性高。
因此消除反应活性为:CH 3CH 3CH 2C Br CH 2CH 2CH 3CHCHBrCH 3CH 3CH 2CH 2CH 2CH 2BrCH 3CH 3>>这是因为生成烯烃的稳定性是:CH2CH 3CH 3CHC CHCH 2CH 3CHCHCH 3CH 3CH 2CH 2CH 2CH CH 3CH 3>>习 题一、填空题 1.CH 2Cl的系统名称为 ,习惯名称为 它属于型卤代烃。
