第七章 卤代烃
合集下载
第七章_卤代烃_有机金属化合物

CHF3 氟仿(fluroform) CHCl3 氯仿 (chloroform) CHBr3 溴仿(Bromoform) CHI3 碘仿(Iodoform)
一级卤代烷: (CH3)2CHCH2Cl Br 二级卤代烷: CH3CH2CHCH3 三级卤代烷: (CH3)3C-I
CH3 H CH3CH2CH C2H5
三 偶极矩与有机分子的极性 有机分子的偶极矩大,极性大。
四 电负性与键的分类
C (2.5) F (4.0) Cl (3.16) Br (2.96) I (2.66)
差值
1.5
0.66
0.46
0.16
极性共价键,极性逐渐减弱
五、卤代烷的构象
Cl H H H Cl H
1,2-二氯乙烷的构象
Cl H H Cl H H
应用一:制备高级炔烃
CH3CH2CH2MgBr + CH3CCH CH3C C MgBr + CH3CH2CH3 CH2=CHCH2X CH3CCCH2CH=CH2
应用二:在分子中引入同位素 RMgX + D2O RD
3. 格氏试剂、有机锂试剂、二烃基酮锂 与卤代烃的偶联
(1) RMgX + R’X
I + C4H9Li
Li + C4H9I
(3) 二烃基铜锂的制备
RLi + CuX RLi + RCu
RCu + LiX R2CuLi
2. 格氏试剂、有机锂试剂 与O2、CO2、H2O的反应。
(1) 与O2的反应 RMgX + O2 RMgX RLi + O2 ROOMgX
2ROMgX
ROOLi
R X
最新大学有机化学重点知识总结第七章 卤代烃

C H 2 C l + H 2 O
§7.5 卤代烷的化学性质
δ+
C C
HH
消除反应 :B
亲核取代 反应
δ-
X Nu-:
极性共价键 断裂
一、亲核取代反应
C–X 的极化:
δδ
CX
亲核试剂, Nu 负电荷或未共用电子对 RO-, OH-, CN-, NH3 离去基团, L
Nu + δ C Lδ
C Nu + L
B r
C H 2C H C H C H 3 C H 3
C 2H 5O N a C 2H 5O H
C HC H C H C H 3 C H 3
若能形成共轭体系,以形成稳定的共轭体系 为主要产物。注意不是脱含H少的碳上的H
c.邻二卤代烷脱卤化氢
Hβ X + 2NaOH 乙 醇 X
Hβ'
+ 2NaX + 2H2O
2–甲基–3–氯丁烷
B rC H 2C H 2 C HC H 2C H 2C H 3 3–乙基–1–溴己烷
C 2H 5
CH3CH2CHCH2 CH3 CH2Cl
3–氯甲基戊烷
卤代烷的命名
Cl 2-氯乙基环己烷
Cl
CH3 H Br
C 3H 7
1-氯二环[2.2.1]庚烷 (S)-2-溴戊烷
3、卤代烯烃的系统命名法
叔 卤 烷 仲 卤 烷 伯 卤 烷
易
难
b. 对于含不同β–H的RX, 消除方向遵循Saytzeff
(萨伊切夫)规则:
生成双键C原子上取代较多的烯烃
C H 3C H C H C H 2C 2H 5C O 2N H a5O 或 H N aO H HBrH
有机化学-第七章 卤代烃
1 加NaOH是为了加快反应的进行,使反应完全。 2 此反应是制备醇的一种方法,但制一般醇无合成价值,可用 于制取引入OH比引入卤素困难的醇。
2.与醇钠(RONa)反应—醇解—制备(混合)醚(称为威廉森合成)
' R-X + RONa
R-O R' + NaX 醚
R-X一般为1°RX,(仲、叔卤代烷与醇钠反应时,主要发生消 除反应生成烯烃)。 3.与氨反应
二、消除反应 从分子中脱去一个简单分子生成不饱和键的反应称为消除反应, 用E表示。 卤代烃与NaOH(kOH)的醇溶液作用时,脱去卤素与β碳原子 上的氢原子而生成烯烃。
R-CH-CH2 + NaOH H X
KOH- 醇 R-CH=CH-CH=CH-R + 2NaX + 2H2O
醇
R-CH=CH2 + NaX + H2O
CH3 叔丁基溴 tert-butyl bromide 叔溴丁烷
2、IUPAC命名法
(1)饱和卤代烃
CH 3-CH2-CH--CH-CH 3 H3C Cl
Cl 3- 甲基 -5- 氯庚烷 3- 氯 -5- 甲基庚烷 × 4- 甲基 -2- 氯己烷 CH 3-CH2-CH-CH -CH-CH -CH3 2 2 CH 3
亲核取代反应机理小结
卤代烃亲核取代的两种机理: SN2 和 SN1 机理
SN2 机理:双分子取代,一步机理
反应速率 = k[RX][Nu-]
手性底物反应发生构型转换 反应速率:1º RX>2º RX>3º RX (空间位阻效应)
SN1 机理:单分子取代,二步机理
反应速率 = k[RX] 手性底物反应发生消旋化
第7章 卤代烃-SN1、SN2亲核取代

带部分正电荷,易 被带负电荷或带孤 对电子的分子进攻
(一)亲核取代反应 SN
Nucleophilic substitution
δδδ+
δδ+
δ+
δ-
CH3
Substrate
CH2
CH2 Nu:
Cl
Cl-
Leaving group 离去基团
底物
特点:
Nucleophile
亲核试剂
带负电荷或 孤对电子
诱导效应可沿共价键在碳链上传递,随着距离的增加
而迅速减弱,一般通过三根单键以后,已基本消失 。
与C-H键相比
H H
Cg
ddd+
H
C
b
dd+
H C
d+
a
Cl
极性共价键
d-
H
H
H
三、化学性质
诱导效应,易 断裂,“消除” d+ d- X吸电子,且C-X键键 能较小(C-F除外), 易断裂,且生成的X-更 稳定。X被“取代”
CH2
CH
CH 2Cl
3-氯-1-丙烯
CH2
CH
CH
CH3
CH2 Cl
3-甲基- 4 -氯-1-丁烯
二、结构(structure)
卤代烷中所有的键都是 σ 键,碳原子为 sp3 杂化, C-X 共价键为极性键。
H
H
ห้องสมุดไป่ตู้
d+
C
d-
X
C-F 139pm
C-H 110pm
H
C-Cl 176pm
C-Br 194pm C-I 214pm
C
O-
• 5)中心原子为同种元素,受溶剂影响较大
第七章 卤代烃

• 常将卤烷与强碱(NaOH、KOH)的水溶液共热
NaOH
ROH + NaX
• 一般的卤烷是由醇制得。
• 但在实际上在一些比较复杂的分子中要引入一个 羟基常比引入一个卤素原子困难。因此,对这类分 子的合成往往可以先引入卤素原子,然后通过水解 再引入羟基。
•卤烷水解反应的速度与卤烷的结构、使用的 溶剂及反应条件等都有关。
NHR'2(H)
R R NH2 伯胺 R NHR' 仲胺 R NR'2 叔胺
SH R SR' 硫醇(硫醚)
R-X为重要有机中间体(intermediates)
3. 还原反应 卤原子被氢取代的反应:
——在卤烃的取代反应中,卤原子也能被氢原子取代。 例如:在卤烃在催化化加氢或用碘化氢还原时,卤烃 上的卤原子被氢取代:
偕二卤代烷
X R R C R
X C R R
R
卤代烯烃
卤代芳烃 X与sp2碳相连 性质特殊
邻二卤代烷
3. 卤代烷的命名
普通法和俗称:
CH3 CH3 Br CH3CHCH2 异丁基溴 isobutyl bromide 异溴丁烷 Br Br CH3CH2CH 仲丁基溴 sec-butyl bromide 仲溴丁烷
CH2Cl
( 8)
•
3. 一卤代芳烃的异构(卤素在苯环上的异构,卤素在侧链上的异构)
第二节 卤代烷的物理性质
1. 卤代烷的物理性质简介
物态:一般为液体,高级为固体,少量为气体(溴甲烷,氯乙烷) 比重: 一氯代物通常 d < 1。 溶解度:不溶于水,易溶于有机溶剂
其它:多卤代物一般不燃烧
卤代烯烃和卤代芳烃的命名:将卤素作为取代基,其余与烯烃、芳烃类同
(有机化学课件)第七章 卤代烃

7.3.1 烃的卤代
烷烃的卤化、烯烃的α–卤代、芳烃的α–卤代:
7.3.2 由不饱和烃制备
烯烃与Br2或HX的加成:
7.3.3 由醇制备
常用的卤化试剂:HX, PX3, PX5, SOCl2(亚硫酰氯).
7.3.4 卤原子交换反应
在适当条件下,卤代烃与含卤负离子的盐类可以发生卤原子的交换反应。
(2) 烯丙型和苄基型卤代烃 卤原子与碳碳重键或苯环相隔一 个饱和碳原子。 特点:C–X键活性高,易发生异 裂,产生烯丙型(苄型)正离子 活性中间体,具有p,π–共轭效应。
(3) 隔离型卤代烃
卤原子与碳碳重键或苯环相 隔两个或多个饱和碳原子,与 一般卤代烷性质接近。
7.2 卤代烃的命名
普通命名法
简单卤代烃的命名,一般是由烃基的名称加上卤原子的名称而成。
(有机化学课件)第七章 卤代烃
内容
卤代烃 —— 烃分子中的氢原子被卤原子取代后的化合物。
卤代烃的分类、命名、制法和物理性质 卤代烃的亲核取代、消除反应及与活泼金属的反应 亲核取代反应机理及邻基参与 消除反应机理 亲核取代反应及消除反应的影响因素 卤代烯烃和卤代芳烃的化学性质 氟代烃
CH3
14% 2%
86% 98%
偕二卤代烃与连二卤代烃
CX X
偕二卤代烃
偕二卤代烃与连二卤代烃脱卤化氢得卤代烯烃;
PCl5 O
(C2H5)3N Cl
Cl
Cl
XX
连二卤代烃
开链偕二卤代烃与连二卤代烃脱二分子卤化氢得炔;
(2) 脱卤素
CH3 CH CH CH3 Br Br
Zn, CH3CH2OH 或 NaI, 丙酮
注:英文命名不按次序规则,而是按取代基名称的第一个字母的顺序,所 以有时与中文命名结果不一致
第七章卤代烃

CH3CH2OH + HBr
在一般情况下,此反应很慢。为增大反应速率,提高醇的产 率,常加入强碱(氢氧化钠),使生成的HX与强碱反应,可 加速反应并提高了醇的产率。
CH3CH2Br + NaOH
CH3CH2OH + NaBr
• 此反应工业用途不大,因卤烷在工业上是由醇制取,但可用 于有机合成中官能团的转化。用于复杂分子中引入羟基(先 卤代,再水解)。
醇 R-X + AgNO3
R-O NO2 + AgX 硝酸酯
反应通式如下:
R - L + :Nu RCH2X + -OH 反应物 亲核试剂 (底物) 进攻基团
R - Nu + L-
RCH2-OH + X-
产物
离去基团
1. 卤烃的水解
• 卤代烷与水作用,水解为醇,反应是可逆反应。如:
CH3CH2Br + H2O
• 查依采夫规则: • 卤代烷脱HX时,总是从含H较少的碳上脱去H原子。
Saytzeff规则应用
CH3
CH3
KOH / 醇
CH3 CH C CH2
CH3 CH C CH3 71%
CH3
H Br H
CH3 CH2 C CH2 29%
• Saytzeff规则的实质上是生成一个较稳定的烯烃。
• 总是要生成共轭效果较好的结构(较稳定)。如:
•而仲卤烃和叔卤烃在碱(氰化钠、氰化钾)的作用
下易发生消除反应,生成烯烃,此反应一般不用仲、 叔卤烃反应。
•产物腈还可转化为胺、酰胺和羧酸。
4. 卤烃的氨解
• 此反应既可用氨反应,也可用氨的衍生物反应,来 制取伯、仲、叔胺。
第七章 卤代烃
1
2
Br
Br
FH
Cl
对氯苯酚
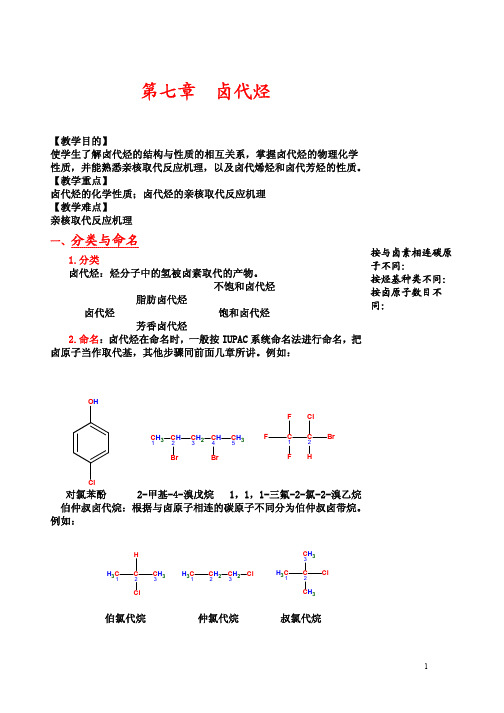
2-甲基-4-溴戊烷 1,1,1-三氟-2-氯-2-溴乙烷
伯仲叔卤代烷:根据与卤原子相连的碳原子不同分为伯仲叔卤带烷。
例如:
H
H3C1
C
2
C3 H3
Cl
H3C1
C2 H2 C3 H2 Cl
伯氯代烷
仲氯代烷
H3C1
C3 H3 C Cl
2
CH3
叔氯代烷
1
有些卤代烃常用俗名例如:
H2N- >HO- >F-
R3C- > R2N- > RO- > F-
⑶同一族元素中,周期高的原子亲核性大,碱性则降低。例如:
亲核性:
I- >Br- > Cl- >F-
RS- > RO-
碱性:
I- <Br- < Cl- <F-
RS- < RO-
在质子溶剂中,一些常见的亲核试剂的亲核性的顺序大概如下:
亲核取代:由于亲核试剂的进攻而发生的取代反应。
(elimination
⑴ 卤代烃的水解: ⑵ 威廉姆逊合成(williamson) ⑶ 卤代烃的氨解:
reaction); ⑴ 脱 HX 的能力: ⑵ 札依采夫规律: 在反应中,主要产
与过量的氨作用,卤原子被氨基取代生成胺。
物为双键上烷基取
⑷ 被氰基取代: 氰可进一步水解,生成酸,这是制备酸的一个重要方法,在合成 中非常有用。
脱氢。
⑵ 脱卤素
3.与金属反应
格氏试剂性质活波,与含活波氢的化合物反应,如:H2O、RCOOH、
RCH3OH、NH3、RC≡CH 等等
其中 Y= —OH、—OR、—NH2、—C≡CR
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
产物构型相反
SN2历程的特点:
(1)反应速率与卤代烷和亲核试剂的浓度有关;
(2)反应一步完成,旧键的断裂和新键的生成同时进行;
(3)SN2历程的立体化学特征是构型反转(Walden转化)。
SN1和SN2比较
SN1 SN2 双分子反应历程 V∝C(卤代烷) · C(亲核试剂) 反应一步完成 产物构型发生翻转
叔卤代烷
2-甲基-2-丁烯
70%
2-甲基-1-丁烯
30%
Saytzeff(札依切夫)规律: 卤代烃脱卤化氢时,主要从含氢较少的碳原子 上脱氢 。
二、消除反应机理(E1、E2)
E1反应机理
慢
进攻-H
快
SN1反应机理
CH 3 CH3 C CH 3 Br
慢 -Br
-
进攻C+
CH 3 CH3 C
+
CH 3 C2H5OH
1.键能:
C—Cl 339kJ/mol
C—Br 285kJ/mol
C—I 218kJ/mol
2.键的可极化性 : C- F < C- Cl < C- Br < C- I
§7.3 卤代烷的化学性质
7.3.1 取代反应 7.3.2 消除反应 7.3.3 与金属反应
7.3.1 取代反应 一、亲核取代反应 SN (Nucleophilic Substitution Reaction)
δ δ δ δ
消除反应 E1 R X
δ δ
SN2
E2
HO
δ
H C C 电荷分散在 五个原子上
X
δ
溶剂的极性↑,对电荷分散的反应不利,即对SN2、E2反应均 不利,但对E2反应更不利。因为在E2反应中,过渡状态的电荷分 散程度更大。
2
+ NaX + H 2O
X
从分子中脱去一个简单小分子,如HX、H2O等, 同时产生不饱和键的反应称为消除反应。 反应中除α碳脱去X外,在β碳上脱去H,故称为 β-消除反应。
注意
NaOH/H2O
NaOH/醇
取代反应
消除反应
反应的活性与烃基结构的关系是:
叔卤代烷 > 仲卤代烷 > 伯卤代烷
应用:该反应在有机合成上常作为在分子中引入碳 碳双键和碳碳三键的方法。
RX + NaOH
水溶液
R OH
醇
+ Na X + Na X
RCOOH
RX + Na CN
RX + NaOR'
醇溶液
R CN
腈
H2O
H+
R OR'
醚 胺
醇溶液
+ Na X
HX
RX +
HNH2
RNH2 +
RX + Ag NO 3
RONO 2 + Ag X
硝酸酯
应用:用于合成醇、腈、醚、胺等化合物,以及与 硝酸银的醇溶液反应可用于鉴别卤代烷。 活性顺序:
(平面结构)
(从左边进攻) 构型转化
(从右边进攻) 构型保持
• 碳正离子的生成产生两个结果:
1. 如果中心碳原子是手性的,则反应后所生成的产物是两种
构型的等量混合物——外消旋体。这个过程叫外消旋化。
2. 中间体碳正离子的形成有可能导致重排现象的发生。
CH3 CH3-C-CH-CH3 H3C Br
CH3-X
RCH2-X R2CH-X R3C-X
SN2增加
卤代烃活性次序的解释: SN1反应的难易取决于中间体碳正离子的生成, 生成的碳正离子越稳定,所需活化能越低,反应速率
越快。
在SN2反应中主要影响因素是位阻效应或称空 间效应。空间位阻越大,SN2 反应速率越小。
R
Br
+
I
丙酮 SN2
R
I + Br
快
CH3
C CH 3
+ OC2H5 H
CH 3 -H+
CH 3 CH3 C CH 3 OC2H5
试剂碱性强,升温对E1有利。
E2反应机理
E2反应机理
CH3 C2H5O + CH3
-
进攻-H
CH3
C Br
[
C2H5O
-
H CH2
CH3 C Br CH 3
]
CH3 CH3 C =CH2 + C2H5OH + Br-
Cl Cl Cl
六六六(林丹)
§7.2 卤代烃的物理性质 沸点: 碳原子数相同的卤代烷:RI>RBr >RCl 溶解度: 卤代烃均不溶于水。 密度: 一氟代烃、一氯代烃的密度小于1,其它卤代 烃的密度大于1。
§7.3 卤代烷的化学性质
极性: R-F>R-Cl>R-Br>R-I 活性:R-F<R-Cl<R-Br<R-I
Nu
R +
L
7、SN1与SN2历程的比较:
比较项目: 反应速度: 反应步数: 产物的立体化学: 溶剂的影响: 烃基结构的影响: 离去基团的影响: SN1 只与底物的浓度有 关 分两步完成,生成 中间产物 ---- 碳正离 子 外消旋体 SN2 与底物和亲核试剂 的浓度都有关 一步完成,有过渡 态(过程中的活化 状态)生成。 构型翻转
卤代芳烃
2、按卤素数目分类 CH3CH2Br
一卤代烃
ClCH2子分类
R
R-CH2-X
伯卤代烃
CH R
仲卤代烃
X
R R R
C
叔卤代烃
X
7.1.2卤代烃的命名 1、习惯命名法
习惯命名法是根据卤原子所连的烃基的名称将其命名为 “某烃基卤”或“卤(代)某烷”。
各种R-Br过渡态
H H I C H Br I
H CH3 C H Br I
CH3 CH3 C H Br I
CH3 CH3 C CH3 Br
从左至右,随着烃基的增多,过渡状态的拥挤程度增大, 达到过渡状态所需的活化能增加,因此,反应速率降低。
2. 卤素(离去基团)的影响(可极化性)
离去基团的倾向越大,亲核取代反应(SN1、 SN2)就越容易进行,反应速度就越快。 X-离去倾向:I- > Br- > Cl- > F(CH3)3C-X + H2O (CH3)3C-OH + HX
C2H5ONa, C2H5OH SN2
CH 3CCH 2OC 2H5 + Br CH 3 CH 3 + CH3C=CHCH3
E1
CH 3CCH 2CH3 OC2H5 (2)
(3)
SN1历程的特点: (1)反应速度只与反应物的浓度有关; (2)反应分两步进行,反应过程中有活性中间体
碳正离子生成;
(3)如果反应中心碳原子是*C,则产物外消旋化; (4)SNI历程常伴随有重排和消除反应发生。
一、消除反应的取向
CH3CH2 CH CH3 Br
β α
β
NaOH,C2H5OH
CH3CH CHCH3
+ CH3CH2CH CH2
1-丁烯 19%
CH3
仲卤代烷
CH3 β α β CH3CH2 C CH3 Br
β
2-丁烯 81%
NaO H ,C 2H5O H
CH3 CH3CH C CH3
+
CH3CH2 C CH2
顺式消除 反式消除
H C C X
C
C
按 E2 机理进行消除的反应中,一般情况下发生的是反式消除。
CH3CH2CHCH 3 Br
KO Et / EtO H 。 70 C
CH3 H
C =C 60%
H + CH3
CH3
CH3 C =C + CH3CH2CH =CH2 H H 20% 20%
四、亲核取代反应与消除反应的关系: 四、亲核取代反应与消除反应的关系
有机化学
Organic Chemistry
第七章 卤代烃
§7.1 卤代烃的分类和命名 §7.2 卤代烷烃的物理性质 §7.3 卤代烷烃的化学性质 §7.4 卤代烯烃和卤代芳烃
§ 7.1 卤代烃的分类和命名
7.1.1卤代烃分类 1、按烃基的结构分类
CH3CH2X
CH2=CHCH2X
Cl
卤代烷烃
卤代烯烃
。 。 。 3 RX > 2 RX > 1 RX ( X 原子相同 )
R-I
室温下与 硝酸银发 生沉淀 加热时才与硝 酸银发生沉淀
亲核取代反应通式:
RCH2
反应底物 卤代烷
δ+
X +
δ-
Nu
-
RCH2Nu +
产物 醇、腈、 醚、胺 硝酸酯等
X
-
亲核试剂 HO- 、CN- 、 OR-、NH3 ONO-2等
2. 双分子亲核取代反应历程 (SN2) CH3Br + OH- → CH3OH+Br 反应速度
H HO- +
-
υ = k [ CH3Br ] [ OH- ]
H H
δ+ δ- slow C Br
[
δHO
H C H
H δBr
H
]
fast
HO
C H
H
+
Br-
过渡态
Walden转化
•瓦尔登转化是SN2反应的重要标志之一。
E1更有利。这是因为:
R
sp3 SN1
R
sp3
R R C
+
sp2
OH
R C OH 重新引入张力 CH2R’ R
