高中化学常见离子的检验和物质的鉴别
常见离子的检验方法.

则含CO32则含SO32则含SO32则含HCO32则含HSO32-
现象同上
3 SO42- 稀盐酸
酸 化
无明显变化 BaCl2(aq) 若有不溶白 则含SO42色沉淀生成 白色沉 过滤 BaCl2(aq) 若有不溶白 滤液 2则含 SO 淀生成 4 色沉淀生成
排除Ag+ SiO32-等的干扰
注意: 先用稀盐酸酸化(一定不能用稀硝酸酸化),后加BaCl2溶液, 顺序一定不颠倒。 HCl(aq)或H2SO4(aq) 若产生有刺激性气味 24 S2O3 则含S2O32的气体,淡黄色沉淀 5 NO3- Cu屑 浓H2SO4 若有红棕色气体冒出 则含NO36 SCN- FeCl3(aq) 若有血红色溶液生成 则含SCN若生成不溶的白色沉淀 则含Cl稀硝酸酸化 若生成不溶的浅黄色色沉淀 则含Br7 Cl Br I 的AgNO 3(aq) 若生成不溶的黄色色沉淀 则含I注意:稀硝酸和AgNO3(aq)先无关后顺序。 或 Br
例5 A B C D四种可溶性盐,阳离子分别可能是Ba2+Na+Ag+Cu2+ 中的某一种,阴离子分别可能是NO3- Cl- SO42- CO32-中的某一种。 (1)把四种盐分别溶于盛有蒸馏水的试管中,只有C盐的溶液呈蓝色。 (2)向(1)的四支试管中分别加盐酸,B溶液有沉淀产生,D溶液有 无色无味气体逸出。则它们的化学式应为: Ba(NO3)2 ,B __________ AgNO3 ,C _________ CuSO4 ,D ___________ Na2CO3 。 A __________
例6 下列是某化学研究性学习小组对某无色水样成分的检验过程, 已知该水样中只可能含有K+ Mg2+ Fe3+ Cu2+ Al3+ Ag+ Ca2+ CO32SO42- Cl- 中的若干种离子,该小组同学取100ml水样进行实验:向 样品中先滴加Ba(NO3)2溶液,再滴加1ml/mol硝酸,实验过程中沉 淀质量的变化如图所示:
高考复习离子的检验、鉴别及推断复习知识点

⾼考复习离⼦的检验、鉴别及推断复习知识点离⼦的检验、鉴别及推断基础盘点⼀、常见阳离⼦的检验1.常规检验法(1)⽤NaOH溶液能检验出Cu2+、Fe3+、Fe2+、Al3+、NH+4Cu2+:产⽣Fe3+产⽣Fe2++先产⽣,然后迅速变为.最终变为Al3+:产⽣⽩⾊沉淀,继续加⼊氢氧化钠溶液,⽩⾊沉淀⼜会_________NH4+:共热,⽣成能使湿润的红⾊⽯蕊试纸变_____的⽓体(2)焰⾊反应⽤焰⾊反应可检验出溶液中的钾离⼦和钠离⼦K+:⽕焰成________⾊(透过蓝⾊钴玻璃)Na+:⽕焰成_____⾊2、特殊检验法Fe3+:加⼊KSCN溶液呈_____⾊Fe2+:加⼊KSCN溶液⽆现象,滴加新制氯⽔后溶液呈_______⾊。
⼆、常见阴离⼦的检验1.利⽤酸碱指⽰剂检验OH-:滴⼊酚酞试液,溶液变⾊, 滴⼊紫⾊⽯蕊试液,溶液变⾊2.利⽤盐酸和其他试剂进⾏检验CO32-:加⼊BaCl2溶液后⽣成,再加⼊稀盐酸,并放出的⽓体SO42-→加⼊稀盐酸⽆沉淀⽣成,⽆⽓体放出,再加⼊BaCl2溶液有产⽣SO32-―→加⼊BaCl2溶液后⽣成,再加⼊稀盐酸,并放出有的⽓体3.利⽤AgNO3(HNO3酸化)溶液检验Cl-→⽣成不溶于稀硝酸的沉淀三、H+和OH-的检验四、熟练掌握在溶液中有特征颜⾊的离⼦4——呈,常见的溶液中有颜⾊的离⼦有:MnO-Cu2+——呈,Fe2+——呈,Fe3+——呈。
沉淀的颜⾊:Cu(OH)2——蓝⾊沉淀,Fe(OH)3——红褐⾊沉淀。
解题中特别注意题⼲条件是“⽆⾊透明”还是“澄清透明”。
考点精讲考点⼀检验常见物质的⼀般程序与思路1.⽆⾊溶液的检验例1 根据下列实验内容得出的结论正确的是()即时巩固1 关于某⽆⾊溶液中所含离⼦的鉴别,下列判断正确的是()A.加⼊AgNO3溶液,⽣成⽩⾊沉淀,加稀盐酸沉淀不溶解时,可确定有Cl-存在B.通⼊Cl2后,溶液变为深黄⾊,加⼊淀粉溶液后溶液变蓝,可确定有I-存在4存在C.加⼊Ba(NO3)2溶液,⽣成⽩⾊沉淀,加稀盐酸后沉淀不溶解时,可确定有SO2-3存在D.加⼊稀盐酸,⽣成的⽓体能使澄清⽯灰⽔变浑浊,可确定有CO2-考点⼆物质的鉴定、鉴别物质的检验通常有鉴定、鉴别。
高中化学离子鉴定

离子定性分析1.碳酸根离子:用稀盐酸(当碳酸根离子遇到稀盐酸时,会生成二氧化碳和水,有气体生成时,所检验物质中就含碳酸根离子了)2.氯离子:用硝酸银和稀硝酸(银离子会和氯离子结合成氯化银,生成沉淀,但由于碳酸银也不溶于水,所以要用稀硝酸,当没有气体生成时,所检验物质中就含氯离子了)3.硫酸根离子:1)用硝酸钡和稀硝酸(钡离子会和硫酸根离子结合成硫酸钡,生成沉淀,但由于碳酸钡也不溶于水,所以要用稀硝酸,当没有气体生成时,所检验物质中就含硫酸根离子了) 2)用稀盐酸和氯化钡(钡离子会和硫酸根离子结合成硫酸钡,生成沉淀,但由于碳酸钡也不溶于水,所以要用稀盐酸,同时氯化银也不溶于水,因此要先加稀盐酸,这样,银离子会和氯离子结合成氯化银,生成沉淀,此时溶液中就没有银离子,再加氯化钡,生成沉淀的就只有硫酸钡了)4.银离子:用氯化钠(银离子会和氯离子结合成氯化银,生成沉淀)5.氢离子:1)活泼金属(有氢气生成,现象会产生气泡) 2)酸碱指示剂:紫色石蕊试剂(石蕊变红) 3)金属氧化物:如带锈的铁钉(铁锈会退去)6.氢氧根离子:酸碱指示剂:无色酚酞(酚酞变红)7.铁离子:1)溶液中呈淡黄色 2)用氢氧化钠(铁离子和氢氧根离子结合成氢氧化铁,生成红褐色沉淀)8.亚铁离子:溶液中呈浅绿色9.铜离子:1)溶液中呈蓝色 2)用氢氧化钠(铜离子会和氢氧根离子结合成氢氧化铜,生成蓝色沉淀)10.铵根离子:用碱和和湿润的红色石蕊试纸(铵根离子和碱反应生成呈碱性的氨气,使石蕊试纸变蓝)11.钡离子:用稀硫酸(钡离子会和硫酸根离子结合成硫酸钡,生成沉淀)化学】高中化学所有离子的鉴别采用试剂:石蕊、酚酞和甲基橙操作步骤和反应现象: 含 OH-的试液能使红色石蕊试纸变蓝,酚酞变红色;甲基橙变黄;pH 试纸的变色范围中紫色加深Cl-的检验采用试剂:AgNO3 溶液、HNO3 溶液操作步骤和反应现象: 滴加 AgNO3 溶液生成白色沉淀,再加稀 HNO3 沉淀不溶, 有关的离子方程式: Ag++Cl- AgCl↓Br-的检验采用试剂:AgNO3、HNO3 溶液,Cl2 水操作步骤和反应现象: 滴加 AgNO3 溶液生成浅黄色沉淀,沉淀不溶于稀 HNO3;滴加 Cl2 水振荡后加几滴汽油,油层红棕色有关的离子方程式: Ag++Br- AgBr↓ Cl2+2Br- 2Cl-+Br2I-的检验采用试剂:AgNO3、HNO3 溶液,Cl2 水操作步骤和反应现象: 滴加 AgNO3 溶液生成黄色沉淀,沉淀不溶于稀 HNO3;滴加 Cl2 水,振荡用 CCl4 萃取呈紫色有关的离子方程式: I-+Ag+ AgI↓ Cl2+2I- I2+2ClS2-的检验采用试剂:Pb(NO3)2 或 Pb(Ac)2操作步骤和反应现象: 用玻璃棒蘸取被测液于 Pb(NO3)2 或 Pb(Ac)2 试纸上,试纸变为黑色有关的离子方程式: Pb2++S2- PbS↓SO42-的检验采用试剂:BaCl2、HNO3 溶液操作步骤和反应现象: 向被测溶液滴加 BaCl2 或 Ba(NO3)2 溶液,出现白色沉淀,再滴加稀 HNO3 沉淀不溶有关的离子方程式: Ba2++SO42- BaSO4↓SO32-的检验采用试剂:稀 HNO3、BaCl2、HCl 溶液操作步骤和反应现象: 取含 SO32-的溶液,滴加 HCl 溶液(少量)出现能使品红褪色的气体;如滴加 BaCl2 溶液生成白色沉淀;再加过量 HCl 能溶解,但用硝酸白色沉淀则不溶有关的离子方程式: SO32-+2H+ SO2↑+H2O SO32-+Ba2+ BaSO3↓ BaSO3+2H+ Ba2++H2O+SO2↑ 3BaSO3+2H++3NO3-=3BaSO4↓+2NO↑+H2OCO32-的检验采用试剂:HCl 溶液、Ca(OH)2 溶液操作步骤和反应现象: 取含 CO32-溶液于试管中滴加 HCl 溶液,发生气泡,再将气泡通入 Ca(OH)2 溶液中, 溶液发浑浊有关的离子方程式: CO32-+2H+ CO2↑+H2O CO2+Ca2++2OH- CaCO3↓+H2ONO3-的检验采用试剂:Cu、浓 H2SO4操作步骤和反应现象: 在 Cu 屑和浓 H2SO4 混合物的试管中加入少许含 NO3-物质的粉末或浓缩溶液,在加热条件下出现棕色气体有关的离子方程式: 2NO3-+4H++Cu Cu2++2NO2↑+2H2OPO43-的检验采用试剂:AgNO3、稀 HNO3 操作步骤和反应现象: 向含有 PO43-溶液的试管中滴加 AgNO3 溶液,生成黄色沉淀,再加 HNO3 后沉淀溶解有关的离子方程式: PO43-+3Ag+ Ag3PO4↓ Ag3PO4+3H+ 3Ag++H3PO4SO42-:加入 BaCl2,产生白色沉淀,再加稀 HNO3,沉淀不消失。
新教材2022年高中化学苏教版必修第1册学案:专题2 第1单元 第2课时 物质的检验物质的性质和变化

第2课时 物质的检验 物质的性质和变化探究一、几种常见离子的检验1.NH +4 的检验:(1)实例探究:取一支试管,加入2 mL NH 4Cl 溶液,再加入2 mL NaOH 溶液,加热试管,将湿润的红色石蕊试纸靠近试管口: ①实验现象:观察到湿润的红色石蕊试纸变蓝。
②反应原理:化学方程式是NH 4Cl +NaOH=====△ NaCl +NH 3↑+H 2O 。
(2)方法总结:取少量待测液,加入NaOH 溶液,并加热,若产生使湿润的红色石蕊试纸变蓝的气体,则原溶液中含有NH +4 。
2.Cl -的检验:(1)实例探究:取一支试管,加入少量KCl 溶液,再滴加几滴AgNO 3溶液和稀硝酸,现象是生成白色沉淀,该沉淀不溶于稀HNO 3,反应的化学方程式为KCl +AgNO 3===AgCl↓+KNO 3。
(2)方法总结:取少量待测液,加入AgNO3溶液,产生白色沉淀,加入稀硝酸,沉淀不溶解,则原溶液中含有Cl-。
3.SO2-4的检验:(1)实例探究:取一支试管,加入少量K2SO4溶液,再滴加几滴稀盐酸和BaCl2溶液,生成白色沉淀,该沉淀不溶于稀盐酸,反应的化学方程式为K2SO4+BaCl2===BaSO4↓+2KCl。
(2)方法总结:取少量待测液,先加入过量稀盐酸,无现象后再滴加BaCl2溶液,若产生白色沉淀,则原溶液中含有SO2-。
4(1)检验SO2-时,先加入BaCl2溶液,再加入稀盐酸,产生不溶于4盐酸的白色沉淀,是否一定存在SO2-,正确的操作是什么?4提示:不一定,可能含有Ag+;正确的操作是先加入足量稀盐酸,若有白色沉淀过滤,向滤液中加入BaCl2溶液,若产生白色沉淀,则含有SO2-4。
(2)(情境思考)水是生命之源,人类在生活和生产活动中都离不开水。
自来水出厂时余氯值不能小于0.3 mg·L-1,防止自来水管网中细菌滋生污染水质。
检验自来水中的氯离子时,可先用稀盐酸酸化,再加AgNO3溶液,这种做法是否正确?提示:不正确。
2019新优化高考化学一轮(全国通用版)精致讲义:常见物质的检验与鉴别Word版含答案
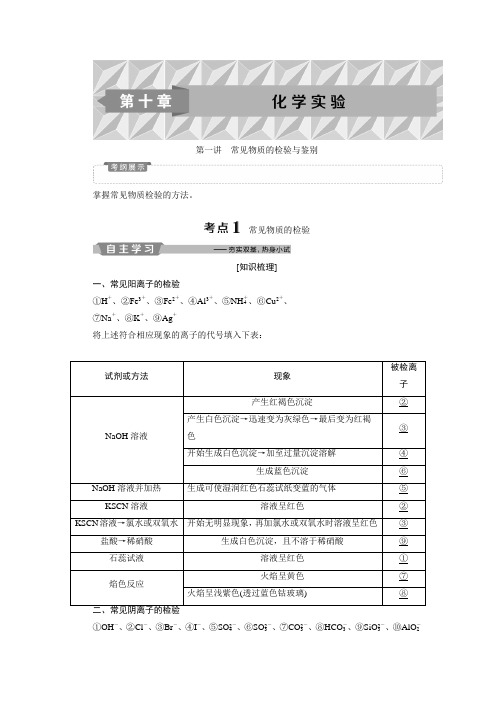
第一讲常见物质的检验与鉴别掌握常见物质检验的方法。
常见物质的检验[知识梳理]一、常见阳离子的检验①H+、②Fe3+、③Fe2+、④Al3+、⑤NH+4、⑥Cu2+、⑦Na+、⑧K+、⑨Ag+将上述符合相应现象的离子的代号填入下表:试剂或方法现象被检离子NaOH溶液产生红褐色沉淀②产生白色沉淀→迅速变为灰绿色→最后变为红褐色③开始生成白色沉淀→加至过量沉淀溶解④生成蓝色沉淀⑥NaOH溶液并加热生成可使湿润红色石蕊试纸变蓝的气体⑤KSCN溶液溶液呈红色②KSCN溶液→氯水或双氧水开始无明显现象,再加氯水或双氧水时溶液呈红色③盐酸→稀硝酸生成白色沉淀,且不溶于稀硝酸⑨石蕊试液溶液呈红色①焰色反应火焰呈黄色⑦火焰呈浅紫色(透过蓝色钴玻璃) ⑧①OH-、②Cl-、③Br-、④I-、⑤SO2-4、⑥SO2-3、⑦CO2-3、⑧HCO-3、⑨SiO2-3、⑩AlO-2将上述符合相应现象的离子的代号填入下表:试剂或方法现象被检离子先加氯化钡溶液,再加稀盐酸,生成的气体分别通入品红溶液先产生沉淀,后溶解,生成的气体能使品红溶液褪色⑥品红溶液,澄清石灰水先产生沉淀,后溶解,生成的气体不能使品红溶液褪色,但能使澄清石灰水变浑浊⑦澄清石灰水无沉淀生成,生成的气体能使澄清石灰水变浑浊⑧先加稀盐酸,再加氯化钡溶液开始无明显现象,加入氯化钡溶液后产生白色沉淀⑤硝酸银溶液和稀硝酸产生白色沉淀,且不溶于稀硝酸②产生浅黄色沉淀,且不溶于稀硝酸③产生黄色沉淀,且不溶于稀硝酸④氯水,四氯化碳下层呈橙色③下层呈紫红色④续表试剂或方法现象被检离子酸碱指示剂石蕊试液变蓝色①酚酞试液变红色稀盐酸生成白色胶状沉淀⑨生成白色絮状沉淀,盐酸过量时溶解⑩三、常见气体的检验1.可燃性气体的检验2.酸性气体的检验3.碱性气体(NH3)的检验4.强氧化性气体的检验5.NO的检验——无色气体,与空气接触后立即变为红棕色。
[自我检测]1.判断正误(正确的打“√”,错误的打“×”)。
高中化学第07讲 离子共存 离子的检验和推断(精讲)(原卷版)

第7讲 离子共存 离子的检验和推断【核心素养分析】宏观辨识与微观探析:能从宏观和微观相结合的视角理解化学反应和离子反应,并运用离子反应解决实际问题。
证据推理与模型认知:知道可以通过分析、推理等方法认识研究对象的本质特征;能运用正确的模型理解离子的检验与推断的规律。
【重点知识梳理】 知识点一 离子共存所谓几种离子在同一溶液中能大量共存,就是指离子之间不发生任何反应;若离子之间能发生反应,则不能大量共存。
发生下列反应而不能大量共存的情况:1、发生复分解反应。
(1)生成难溶物或微溶物:如:Ba 2+与CO 2-3,Ag +与Br -,Ca 2+与SO 2-4等不能大量共存。
(2)生成气体或挥发性物质:如:NH +4与OH -,H +与CO 2-3、HCO -3、S 2-、HS -、SO 2-3、HSO -3 等不能大量共存。
(3)生成难电离物质:如:H +与CH 3COO -、CO 2-3、S 2-、SO 2-3等因生成弱酸不能大量共存;OH -与NH +4因生成的弱碱不能大量共存;H +与OH -生成水不能大量共存。
2、发生氧化还原反应:氧化性离子(如Fe 3+、NO -3、ClO -、MnO -4 (H +)等)与还原性离子(如S 2-、I -、Fe 2+、SO 2-3等)不能大量共存。
3、离子间发生水解相互促进不能共存:弱酸对应的阴离子和弱碱对应的阳离子相互促进双水解进行到底。
如Al 3+、Fe 3+、NH +4与CO 2-3、HCO -3、S 2-、HS -、AlO -2等。
4、络合反应:如Fe 3+和SCN -。
【知识拓展】多种离子能否大量共存于同一溶液中,归纳起来就是一句话:一色、二性、三特殊、四反应。
1、一色。
即溶液颜色。
若限定无色溶液,则Cu2+、Fe3+、Fe2+、MnO-4、Co2+、Cr2O2-7、CrO、Cr3+等有色离子不能存在。
2、二性。
即溶液的酸性和碱性。
在强酸性溶液电,OH-及弱酸根阴离子(CO2-3、SO2-3、S2-、CH3COO-等)均不能大量存;在强碱性溶液中,H+及弱碱阳离子(如NH+4、Mg2+、Al3+、Fe3+等)均不能大量存在;酸式弱酸根离子(如HCO-3、HSO-3、HS-、H2PO-4等)在强酸性或强碱性溶液中均不可能大量存在。
苏教版高一化学必修1_《常见物质的检验》复习课件
(B )
①滴加 Mg(NO3)2 溶液 ②过滤 ③滴加 AgNO3 溶液
④滴加 Ba(NO3)2 溶液
A.①②④②③
B.④②①②③
C.①②③②④
D.④②③②①
解析 首先滴加足量 Ba(NO3)2 溶液,如果出现白色沉淀, 证明有 CO23-,同时除去 CO23-;过滤后,在滤液中加入足 量 Mg(NO3)2 溶液,如果出现白色沉淀,证明有 OH-,同 时除去 OH-;过滤后,滴加 AgNO3 溶液,如果出ห้องสมุดไป่ตู้白色 沉淀,证明有 Cl-。
答案 D
7.现有硫酸钠、氯化铵、氯化钠、硫酸铵四种无色溶液,
只用一种试剂且各取一次将它们鉴别开来(可加热),
这种试剂是
(C )
A.盐酸
B.碳酸钠溶液
C.氢氧化钡溶液
D.氢氧化钠溶液
8.某溶液中含有较大量的 Cl-、CO23-、OH-三种阴离子, 如果只取一次该溶液就能够分别将三种阴离子依次检
验出来,下列实验操作顺序正确的是
12.检验 KClO3 中含有氯元素,可供选择的仪器和操作 如下:
仪器
实验操作
①试管;②酒精灯; ③石棉网;④胶头滴 管;⑤橡胶塞;⑥量筒; ⑦试管夹;⑧烧杯; ⑨玻璃棒;⑩温度计; ⑪漏斗
a.加热至完全分解; b.溶解;c.过滤;d.蒸 发;e.滴加稀硝酸; f.滴加氯化钡溶液;
g.滴加 AgNO3 溶液
因此实验步骤应该是:与 MnO2 混合后加热至完全分 解、溶解、过滤除去催化剂、滴加稀硝酸酸化除去 CO23-等 干扰离子、滴加 AgNO3 溶液。
各步操作涉及的实验装置如下:
因此所用仪器应该是:①试管、②酒精灯、④胶头滴管、 ⑤橡胶塞、⑧烧杯、⑨玻璃棒、⑪漏斗。不需要③石棉网、 ⑥量筒、⑦试管夹和⑩温度计。
高一化学(必修一)常见物质的检验
一、常见离子的检验人们通常根据_____________________的某些特征反应对物质进行检验,以确定物质的 。
1.NH +4检验(1)原理:NH +4+OH -=====△NH 3↑+H 2O ,NH 3可使湿润的_____石蕊试纸_____。
(2)实验:氯化铵、硫酸铵溶液分别与氢氧化钠溶液加热反应。
实验步骤取氯化铵、硫酸铵各1 g ,分别放到两支试管中,各加入2 mL 稀氢氧化钠溶液,加热试管,并将湿润的____________ (或_______)靠近试管口上方。
实验现象 湿润的_____石蕊试纸变为蓝色。
实验结论 氯化铵、硫酸铵中含有_____。
2.Cl -检验(1)原理:__________________,AgCl 为不溶于水也不溶于稀HNO3的白色沉淀。
(2)实验:氯化铵溶液与硝酸银溶液的反应。
实验步骤在一支试管中加入少量氯化铵晶体,再加入2 mL 蒸馏水使其溶解,向试管中加入少量硝酸银溶液,再加入稀硝酸。
【注意】 检验Cl -时,加入稀HNO 3的作用是_________________等的干扰。
___________也能与AgNO 3反应生成白色沉淀,但沉淀__溶于稀硝酸。
实验现象 氯化铵溶液和硝酸银溶液混合,生成不溶于稀硝酸的_____沉淀。
实验结论 氯化铵中含有_____。
3.SO 2-4检验(1)原理:____________________,BaSO 4为不溶于水也不溶于稀HNO 3的白色沉淀。
(2)实验:硫酸铵溶液与氯化钡溶液的反应。
实验步骤 在一支试管中加入少量硫酸铵晶体,再加入2 mL 水使其溶解,向试管中分别加入几滴氯化钡溶液和稀盐酸。
【注意】 检验 SO 2-4 时,加入稀盐酸的作用是 等的干扰。
与BaCl 2溶液反应生成的 沉淀能溶于稀盐酸。
实验现象 硫酸铵溶液与氯化钡溶液反应生成不溶于稀盐酸的_____沉淀。
实验结论 硫酸铵中含有______。
高中化学 专题三 物质的检验与鉴别 课题2 亚硝酸钠和食盐的鉴别学案 苏教版选修6
课题2 亚硝酸钠和食盐的鉴别一、NaNO 2与NaCl 的鉴别1.根据NaNO 2和NaCl 的熔点不同氯化钠的熔点为801 ℃,亚硝酸钠的熔点为271 ℃,且容易分解。
把亚硝酸钠和氯化钠置于同一小块金属片上,用酒精灯对金属片加热,先熔化或分解的是亚硝酸钠;用酒精灯加热不熔化的是氯化钠。
2.根据NaNO 2和NaCl 溶解度的不同氯化钠和亚硝酸钠虽然都溶解于水,但是两者的溶解度却大不相同。
温度对氯化钠的溶解度影响很小;而亚硝酸钠极易溶于水,且溶解时吸热,其在热水中溶解得更快。
在室温时,分别称取1 g 亚硝酸钠和氯化钠,置于小试管中,分别加2 mL 水使其溶解。
由于亚硝酸钠溶解时吸热,一支试管中的溶液温度显著下降,且固体逐渐溶解,此为盛有亚硝酸钠的试管;另一支试管为盛有氯化钠的试管。
3.与硫化钠反应亚硝酸钠可与具有还原性的硫化钠反应,生成单质硫;氯化钠不与硫化钠反应。
2NaNO 2+Na 2S +2H 2SO 4===2Na 2SO 4+2NO↑+S↓+2H 2O在两支试管中分别加入0.1 mol·L -1亚硝酸钠和氯化钠溶液,再分别加入 1 mL 0.1mol·L -1硫化钠溶液,试管中均无明显现象;滴加稀硫酸酸化后,一支试管中析出浅黄色的硫,为亚硝酸钠溶液;另一支试管中无明显现象,为氯化钠溶液。
4.与铜丝反应铜丝在亚硝酸钠的存在下,能与盐酸发生反应;但铜丝在有氯化钠存在的情况下却不与盐酸反应。
铜丝、亚硝酸钠与盐酸的反应为:Cu +2NaNO 2+4HCl===2NaCl +CuCl 2+2H 2O +2NO↑2NO +O 2(空气)===2NO 2(红棕色)将光亮的铜丝插入装有2 mol·L -1盐酸的试管中,无明显现象;在试管中加入1~2 mL0.1 mol·L -1亚硝酸钠后,铜丝缓慢溶解,铜丝表面有大量气泡;溶液逐渐变成深绿色,液面上方有红棕色气体逸出,能嗅到刺激性气味。
离子的检验.
2.溶液中离子鉴定的原则:
(1)选择被鉴定物质中阴、阳离子的特性反应,分别 鉴定阴、阳离子的存在,并设法排除可能的干扰。 (2)所选择的反应,应具备灵敏快速、操作简便的特 点。 (3)选择鉴别试剂时,要注意其是否可以与前面已加 入的试剂作用或是否会与后面将加入的试剂发生作 用而产生干扰。若实在无法排除干扰,则被测定溶 液应该另取。 (4)注意加入试剂的量。加入方式依据具体反应的要 求,选择控制是“少量”、“适量”还是“过量”, 是“加入”还是“滴加”。
2.怎样用一种试剂鉴别硝酸铵、硫酸钠、硝酸钠、硫酸 铵四种溶液,写出试剂名称、产生的现象和结论
3.鉴定某种白色固体是纯碱晶体,写出鉴定的 化学原理,现象和结论。
三、物质的鉴定
见书上75页《鉴定某种化肥的主要成分是硫酸 铵》
四、几种物质的鉴别
[实验设计] 现有四瓶溶液,它们是硫酸钠、氯化钾、 碳酸钠、氯化铵,试设计实验步骤,并用实 验将它用的化肥有氯化铵、硫酸铵、硝酸铵、 碳酸氢铵,他们都是白色固体,试通过实验把他们一 一区别开来。
完成书上74页<<思考与讨论>>
[练习题]
为确定某溶液的离子组成,进行如下实验: 1.测定溶液的PH,溶液显强碱性; 2.取少量溶液加入稀盐酸至溶液呈酸性,产生无刺激性、能使澄 清石灰水变浑浊的气体; 3.在上述溶液中在滴加硝酸钡溶液,产生白色沉淀; 4.取上层清夜继续滴加硝酸钡溶液至无沉淀时,再滴加硝酸银溶液 产生白色沉淀。 根据实验以下推测正确的是( B、C ) A . 一定有亚硫酸根离子 B . 一定有碳酸根离子 C.不能确定氯离子是否存在 D .不能确定碳酸氢根离子
§13.1离子的检验
一、鉴定和鉴别
1.物质的鉴定:是确定一种物质的成分或确定 混合物中的各种成分 2.物质的鉴别:将两种或两种以上的物质一一 区分开来。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高中化学常见离子的检验和物质的鉴别
TYYGROUP system office room 【TYYUA16H-TYY-TYYYUA8Q8-
(一)常见阳离子的检验方法
加NaOH溶液加NaOH溶产生红褐色沉
淀
Fe3++3OH-=Fe(OH)
3
↓
Fe2+
①KSCN溶
液,新制的
氯水
①取少量待测
溶液于试管
中,加入KSCN
溶液,新制的
氯水
①加入KSCN
溶液不显红
色,加入少量
新制的氯水
后,立即显红
色。
2Fe2+ + Cl
2
2Fe3+ + 2Cl-
Fe3++3SCN-=Fe(SCN)
3
②加NaOH溶
液
②取少量待测
溶液于试管
中,加入NaOH
溶液并露置在
空气中
②开始时生成
白色Fe(OH)
2
沉淀,迅速变
成灰绿色,最
后变成红褐色
Fe(OH)
3
沉
淀。
Fe2++2OH —=Fe(OH)
2
↓
4Fe(OH)
2
十
O
2
+2H
2
O=4Fe(OH)
3
②加K3
[Fe(CN)
6]
取少量待测溶
液于试管中,
加入铁氰化钾
特征性蓝色沉
淀
Al3+NaOH溶液取少量待测溶
液于试管中,
逐滴加入NaOH
溶液至过量
加入适量NaOH
溶液后生成白
色沉淀,该沉
淀溶于过量
NaOH溶液中
Al3++3OH-=Al(OH)
3
↓
Al(OH)
3
+OH-=AlO
2
-+ 2H
2
O
Cu2+NaOH溶液取少量待测溶
液于试管中,
加入NaOH溶液
加入适量NaOH
溶液后生成蓝
色沉淀
Cu++2OH-=Cu(OH)
2
↓
(二)常见阴离子的检验方法
离子检验试剂实验步骤实验现象
离子方程式
OH-①酸度计
②pH试纸
③酚酞或
石蕊试液
①将酸度计的
探头浸泡在待
测液中②用玻
璃棒蘸取少量
待测液滴到干
燥的pH试纸上
③取样,滴加
石蕊试液
③②pH>7
③酚酞变红
或石蕊变蓝
1.若SO
42-与Cl-同时检验,需注意检验顺序。
应先用Ba(NO
3
)
2
溶液将SO
4
2-检出,并滤去
BaSO
4,然后再用AgNO
3
检验Cl-。
2.检验SO
32-的试剂中,只能用盐酸,不能用稀硝酸。
因为稀硝酸能把SO
3
2-氧化成SO
4
2-。
3.若Ag+和Ba2+同时检验,也需注意检验顺序,应先用盐酸将Ag+检验出并滤去沉淀,然后再用稀硫酸检验Ba2+。
4.若Ag+和Ba2+同时检验,也需注意检验顺序,应先用盐酸将Ag+检验出
5.若CO
32-和HCO
3
-同时检验,应先用足量的BaCl
2
溶液将CO
3
2-检出,静置,取上层清夜用Ba(OH)
2
或Ca(OH)
2检出HCO
3
-
(1)苯能与纯溴、铁屑反应,产生HBr白雾。
能与浓硫酸、浓硝酸的混合物反应,生成黄色的苦杏仁气味的油状(密度大于1)难溶于水的硝基苯。
(2)乙醇能够与灼热的螺旋状铜丝反应,使其表面上黑色CuO变为光亮的铜,并产生
有刺激性气味的乙醛。
乙醇与乙酸、浓硫酸混合物加热反应,将生成的气体通入饱和Na
2CO
3
溶
液,有透明油状、水果香味的乙酸乙酯液体浮在水面上。
(3)苯酚能与浓溴水反应生成白色的三溴苯酚沉淀。
能与FeCl
3
溶液反应,生成紫色溶液。
(4)乙醛能发生银镜反应,或能与新制的蓝色Cu(OH)
2加热反应,生成红色的 Cu
2
O沉
淀。
