pH值与氢离子浓度换算表
ph和氢氧根离子浓度的换算关系

ph和氢氧根离子浓度的换算关系首先呢,咱们得从最基本的pH说起。
pH其实就是一种用来衡量溶液酸碱度的指标。
酸碱嘛,听起来像是化学课上最枯燥的部分,其实不然。
酸性液体像是柠檬汁、醋这些,pH值就小;而碱性液体像是肥皂水、清洁剂这些,pH值就大。
中性液体,比如纯净水,pH值就在7左右,既不酸也不碱。
说白了,pH就像是一个衡量酸碱“气质”的尺子,数字越小越酸,数字越大就越碱。
好啦,话说回来,pH值和氢氧根离子浓度又有什么关系呢?其实它们是通过一个公式来联系在一起的。
你知道,酸性溶液里其实有很多氢离子(H⁺),而碱性溶液则是氢氧根离子(OH⁻)占主场。
pH越低,氢离子浓度越高;pH越高,氢氧根离子浓度就越高。
你看,这就像一对“冤家”,你中有我,我中有你。
咱们可以这么记:当pH值增加时,氢氧根离子的浓度也会增加。
哦对了,这个关系可是反向的哦。
换句话说,pH值一低,氢氧根离子的浓度就跟着掉头下降。
是不是感觉自己像个化学小侦探,能在这俩之间来回推理了?。
那么具体怎么换算呢?给大家讲个简单的公式吧,别担心,我保证没有什么高深的数学。
公式长得像这样:。
pOH = 14 pH再来个具体点的公式,氢氧根离子的浓度 OH⁻就是:。
OH⁻ = 10^{pOH如果你有了pH值,首先算出pOH,然后通过公式找出氢氧根离子的浓度。
听起来有点复杂?其实一点也不!就是要牢记,14是个“常数”,它就像是个魔法数字,帮你穿梭在酸碱的世界里。
有了这些公式,你就能轻松搞定酸碱溶液的pH和氢氧根离子的浓度换算了。
比如,你手里有个pH值为9的溶液,那它的pOH就是14减去9,等于5,然后按照公式可以计算出氢氧根离子的浓度。
看吧,其实一点都不难!。
pH值和氢氧根离子浓度的关系,实际上也可以帮咱们理解很多身边的现象。
比如你家里的洁厕剂,它的pH值通常都很高,甚至可能接近13,表示它是个强碱性溶液,氢氧根离子浓度超级高。
这个时候,清洁的效果当然杠杠的,能把你想象中的“脏东西”都消灭掉。
ph换算浓度的公式

ph换算浓度的公式
pH是用来表示溶液酸碱性强弱的指标,它是负对数的浓度单位。
浓度与pH之间的关系可以通过公式pH = -log[H+]来表示,其中
[H+]表示溶液中氢离子的浓度。
这个公式可以帮助我们计算溶液的
pH值,从而了解溶液的酸碱性。
另外,如果我们已知溶液的pH值,也可以通过反推的方式计算出溶液中的氢离子浓度。
这个公式在化
学和生物学实验中经常被使用,可以帮助我们了解溶液的性质以及
进行相应的实验操作。
因此,pH值与溶液浓度之间的关系是非常重
要的,并且这个公式也为我们提供了一种便捷的计算方法。
分析化学PH公式总结

分析化学PH公式总结分析化学中,PH公式是一个非常重要的概念,用于表示溶液中氢离子(H+)的浓度。
PH值是衡量溶液酸碱性的指标,它代表了溶液中氢离子的浓度大小。
下面是对PH公式的详细总结。
PH公式是指PH值与氢离子浓度的关系表达式。
PH的定义是负对数的十进制数,表示溶液中H+离子浓度的大小。
PH的计算公式可以通过以下方式得到:PH = -log[H+]其中[H+]表示溶液中的氢离子浓度,以摩尔/升(mol/L)为单位。
PH值的范围从0到14,其中7表示中性溶液,低于7的溶液为酸性,高于7的溶液为碱性。
具体来说,PH值为0表示溶液中氢离子浓度非常高,而PH值为14表示溶液中氢离子浓度非常低。
PH值的计算可以通过以下步骤进行:1.确定溶液中氢离子的浓度,以摩尔/升为单位。
2.将氢离子浓度带入PH公式中,计算出PH值。
在实际应用中,可以使用PH计或PH试纸来测定溶液的PH值。
PH计是一种电子设备,可以直接测量溶液中的氢离子浓度,并将其转换为PH 值。
PH试纸则是一种便携式测量工具,通过改变颜色来指示溶液的PH值范围。
PH值的重要性在于它对溶液的性质和反应有很大影响。
不同PH值的溶液具有不同的化学性质,影响溶液中物质的溶解度、电离程度和反应速率等。
例如,酸性溶液中氢离子浓度高,容易导致腐蚀和刺激性;碱性溶液中氢离子浓度低,容易对生物体产生刺激。
此外,PH值对于许多实际应用也非常重要。
例如,在环境科学中,PH值可以用来评估水体和土壤的酸碱性,判断其适宜性和环境健康状况。
在生物医学研究中,PH值可以用来评估体液酸碱平衡状态,判断人体健康状况。
总之,PH公式是分析化学中的重要概念,用于表示溶液中氢离子的浓度。
PH值是一种衡量溶液酸碱性的指标,可以通过PH公式计算得到。
PH值的范围从0到14,低于7的溶液为酸性,高于7的溶液为碱性。
PH值对溶液的性质和反应有很大影响,并在许多实际应用中具有重要意义。
弱酸的氢离子浓度与ph的关系

弱酸的氢离子浓度与ph的关系1. 引言嘿,朋友们!今天我们要聊聊一个看似有点枯燥但其实特别有趣的话题,那就是弱酸、氢离子浓度和pH值之间的关系。
你可能会想:“这和我有什么关系呢?”其实,这些知识就像调味料一样,能让我们的生活更有滋味。
比如,你喝的果汁、吃的酸奶,甚至是用来清洗家里的清洁剂,都是和弱酸有关系的呢!那么,话不多说,咱们就开始吧!2. 弱酸的基础知识2.1 什么是弱酸?先来认识一下弱酸,简单来说,就是那些在水里不完全离解的酸。
举个例子,醋酸就是个典型的弱酸。
当你把醋倒进沙拉里,那个酸爽的味道就来源于醋酸。
可别小看它,弱酸虽然名声在外,但在水里可不如强酸那样“咄咄逼人”,它们只是一小部分分子会变成氢离子(H⁺),剩下的则还是“老老实实”的待在那儿。
2.2 pH值是啥?接下来,咱们聊聊pH值。
pH值其实就是一种用来测量酸碱性的指标。
用通俗的话说,pH值越低,酸性越强;而pH值越高,碱性就越强。
它的范围是从0到14,中间的7就是中性。
想象一下,pH值就像是你饮料的“辣度”标签,告诉你这东西酸不酸。
3. 弱酸与氢离子浓度的关系3.1 为什么氢离子浓度重要?好啦,咱们现在进入重头戏。
氢离子浓度和pH值之间的关系就像是干柴烈火,一碰就着!当弱酸溶解在水里时,它释放的氢离子越多,pH值就越低。
比如说,咱们刚才提到的醋酸,在它的浓度高的时候,味道酸得直冲鼻子,这就是因为氢离子浓度上升了。
3.2 酸的浓度与pH的神奇公式说到这里,可能有些小伙伴就要问:“那到底怎么计算pH值呢?”其实,pH值的计算公式非常简单,公式是:pH = logH⁺。
在这个公式里,H⁺代表氢离子的浓度,单位是摩尔每升(mol/L)。
如果你一开始听到这个公式,可能会觉得有点复杂,但别担心,咱们一步一步来。
就好像做菜一样,先准备好食材,再一步步加调料,最后就能吃上一道美味的佳肴!3.3 实际例子假设我们有一种弱酸,浓度是0.1 mol/L。
PH值换算
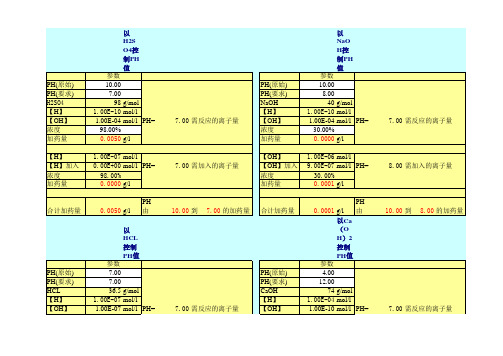
以H2SO4控制PH值以NaOH控制PH值PH(原始)10.00PH(原始)10.00PH(要求)7.00PH(要求)8.00H2SO4 98g/molNaOH40g/mol【H】1.00E-10mol/l【H】1.00E-10mol/l【OH】1.00E-04mol/lPH=7.00【OH】1.00E-04mol/lPH=7.00浓度98.00%浓度30.00%加药量0.0050g/l加药量0.0000g/l【H】1.00E-07mol/l【OH】1.00E-06mol/l【H】加入0.00E+00mol/lPH=7.00【OH】加入9.00E-07mol/lPH=8.00浓度98.00%浓度30.00%加药量0.0000g/l加药量0.0001g/l合计加药量0.0050g/lPH由10.00到7.00的加药量合计加药量0.0001g/lPH由10.00到8.00的加药量以HCL控制PH值以Ca(OH)2控制PH值PH(原始)7.00PH(原始)4.00PH(要求)7.00PH(要求)12.00HCL36.5g/molCaOH74g/mol【H】1.00E-07mol/l【H】1.00E-04mol/l【OH】1.00E-07mol/lPH=7.00【OH】1.00E-10mol/lPH=7.00浓度10.00%浓度10.00%加药量0.0000g/l加药量0.0370g/l【H】1.00E-07mol/l【OH】1.00E-02mol/l【H】加入0.00E+00mol/lPH=7.00【0H】加入1.00E-02mol/lPH=12.00浓度10.00%浓度10.00%加药量0.0000g/l加药量7.3999g/l合计加药量0.00004g/lPH由7.00到7.00的加药量合计加药量7.43693g/lPH由4.00到#####的加药量需反应的离子量需反应的离子量需加入的离子量需加入的离子量需加入的离子量需加入的离子量参数参数参数参数需反应的离子量需反应的离子量
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
pH值与氢离子浓度换算表
pH [H+],mol/L pH
[H+],mol/L
n.00 1.00×10-n n.50
3.16×10-(n+1)
n.05 8.91×10-(n+1) n.55
2.82×10-(n+1)
n.10 7.91×10-(n+1) n.60
2.51×10-(n+1)
n.15 7.08×10-(n+1) n.65
2.25×10-(n+1)
n.20 6.31×10-(n+1) n.70
2.00×10-(n+1)
n.25 5.65×10-(n+1) n.75
1.78×10-(n+1)
n.30 5.00×10-(n+1) n.80
1.59×10-(n+1)
n.35 4.47×10-(n+1) n.85
1.41×10-(n+1)
n.40 3.98×10-(n+1) n.90
1.26×10-(n+1)
n.45 3.55×10-(n+1) n.95
1.12×10-(n+1)
用法举例:
1. 已知溶液pH值为2.40,求氢离子浓度。
查表n.40对应氢离子浓度[H+]=3.98×10-(n+1)
其中n=2,代入上式:
[H+]=3.98×10-(2+1)=3.98×10-3 mol/L
2. 已知溶液氢离子浓度8.91×10-3 mol/L,求溶液pH值。
与表中8.91×10-(n+1)相对应,可知n+1=3,
亦即n=2
故溶液pH值为2.05。
