海藻酸钠作为药物载体材料的研究进展
亲水性小分子药物缓释微球制备方法的研究进展

亲水性小分子药物缓释微球制备方法的研究进展李静涵,魏振平(天津大学化工学院,天津300072)【摘要】摘要:缓释微球可以延长药物的作用时间,从而能够解决亲水性小分子药物由于半衰期较短需要长期频繁给药的问题。
本文综述了亲水性小分子药物缓释微球制备方法的研究现状和发展方向,分别从使用非水溶性载体材料和水溶性载体材料两个方面介绍了亲水性小分子微球制备方法的优缺点。
使用非水溶性载体材料方面,重点阐述了乳化溶剂挥发法和相分离法;使用水溶性载体材料方面,重点阐述了乳化交联法和喷雾干燥法。
并着重分析了层层自组装法以及结合磁性粒子的溶剂挥发法的技术原理和制备过程。
最后指出亲水性小分子药物缓释微球的制备方法将朝着操作简单、安全有效和智能靶向的方向发展。
【期刊名称】化工进展【年(卷),期】2016(000)001【总页数】6【关键词】药物;制备;载体;缓释微球;亲水性小分子;智能靶向第一作者:李静涵(1990—),女,硕士研究生。
联系人:魏振平,副教授。
E-mail zpwei2000@。
微球(microspheres,MS)是一种将药物分子包裹于高分子聚合物中以实现药物长时间平稳释放的缓释药物传递系统[1],具有控制药物释放、提高药物稳定性、掩盖药物不良味道、使药物浓集于靶器官等特点[2],是近年来医药工业和生物化工领域的研究热点。
目前包封于微球中的药物多为大分子亲水性药物或小分子疏水性药物,制备出的微球形态圆整,包封良好,能够达到缓释的目的。
不同于大分子亲水性和小分子疏水性药物微球,将亲水性小分子药物制备成微球存在两方面的挑战:一方面是包封率低,由于微球表面和内部会存在细小的孔隙或通道,因此在制备过程中小分子物质极易穿过通道逃出[3];另一方面是突释,分子量过小的药物在释放过程中经常出现初期大剂量释放的现象[4]。
事实上,大部分的临床用药是小分子化合物,而相对分子质量小于500的分子大都是水溶性的[5],因此制备亲水性小分子药物的缓释微球是一项具有意义的工作。
《壳聚糖-氧化海藻酸钠水凝胶的制备及其初步应用》

《壳聚糖-氧化海藻酸钠水凝胶的制备及其初步应用》壳聚糖-氧化海藻酸钠水凝胶的制备及其初步应用一、引言水凝胶是一种具有高度吸水性且能够保持其体积的三维网状聚合物,其在药物释放、生物材料、化妆品等多个领域有广泛的应用。
其中,壳聚糖和氧化海藻酸钠这两种生物材料制备的水凝胶因具有优异的生物相容性和生物降解性,成为近年来研究的热点。
本文将详细阐述壳聚糖/氧化海藻酸钠水凝胶的制备方法及其初步应用。
二、壳聚糖/氧化海藻酸钠水凝胶的制备1. 材料与试剂本实验所需材料包括壳聚糖、氧化海藻酸钠、交联剂等。
所有试剂均为分析纯,购买自国内知名化学试剂供应商。
2. 制备方法(1)将壳聚糖溶解在醋酸溶液中,形成壳聚糖溶液;(2)将氧化海藻酸钠溶解在去离子水中,形成氧化海藻酸钠溶液;(3)将两种溶液混合,加入适量的交联剂,搅拌均匀;(4)将混合溶液置于冰浴中,缓慢搅拌并逐渐升温,使溶液形成凝胶状态。
三、水凝胶的表征通过扫描电子显微镜(SEM)观察水凝胶的微观结构,并通过红外光谱(IR)分析水凝胶的化学结构。
结果表明,制备的壳聚糖/氧化海藻酸钠水凝胶具有三维网状结构,且化学结构符合预期。
四、初步应用1. 药物释放壳聚糖/氧化海藻酸钠水凝胶具有良好的药物载体性能,可用于药物释放。
将药物与水凝胶混合,制备成载药水凝胶。
通过模拟体内环境,观察药物的释放情况。
结果表明,载药水凝胶具有缓慢且持续的药物释放特性,可有效延长药物在体内的作用时间。
2. 伤口敷料壳聚糖/氧化海藻酸钠水凝胶具有良好的吸湿性和保湿性,可用于伤口敷料。
将水凝胶敷于伤口处,可吸收伤口渗出液,为伤口提供湿润的环境,促进伤口愈合。
同时,水凝胶的生物相容性和生物降解性也使其成为理想的伤口敷料材料。
五、结论本文成功制备了壳聚糖/氧化海藻酸钠水凝胶,并对其进行了表征。
该水凝胶具有优异的药物载体性能和伤口敷料应用潜力。
通过模拟体内环境的药物释放实验和伤口敷料实验,验证了其应用效果。
海藻酸钠
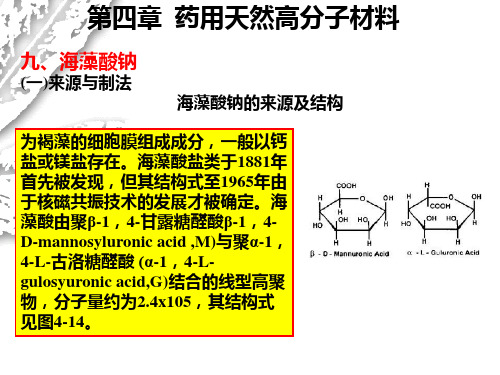
(三)应用
1.无毒及刺激性
海藻酸钠广泛用于化妆品、食品及药物制剂(如 片剂及创伤敷料等外用制剂),其无毒,无刺激 性。海藻酸钠粉末吸入或遇眼粘膜有刺激性。 海藻酸钠的急性毒性LD50如下:猫腹腔注射 LD50为0.25g/kg;兔静脉注射LD50为0.lg/kg; 大鼠静注LD50为l g/kg;大鼠口服LD50>5 g/kg。
(3)如果钙离子加人的量接近二者反应完全时的浓度,则形成的凝胶有 脱水收缩 (syneresis)的倾向。
㈡性质
溶解性 相容性 吸湿性 粘性和流动 胶凝与交联 染菌与灭菌
海藻酸钠贮藏时易染菌,进而影响其溶液的粘度,溶液
可用环氧乙烷灭菌。高压灭菌法也可使粘度下降。不宜应用 Y射线照射,因其能显著影响溶液的粘度。本品外用时可加 0.1%的氯甲酚、0.1%的氯二甲苯酚或对轻基苯甲酸酯类作 防腐剂。
海藻酸钠的胶凝作用与其分子中古洛糖醛酸的含量和聚合度有关,古 洛糖醛酸(G)含量越高则凝固硬度越大。甘露糖醛酸(M)柔性较大,海藻 酸钠凝胶的溶胀性与其中M单体在内部的溶胀有关。
海藻酸钠与大多数多价阳离子反应会形成交联,如与钙离子交联形成 的网状 结构,控制水分子的流动性,用此方法可得热不可逆性的刚性结 构,其失水收缩不显著。将钙离子加人海藻酸钠溶液中的方法大大地影 响最终形成凝胶的性质,如果钙离子加得太快,结果形成不均匀凝胶, 结构失去连续性;使用慢速控制溶解的钙盐可以得到较均匀的凝胶
半数致死量(median lethal dose),简称 LD50
(三)应用
2.口服及局部外用
(1)海藻酸钠可用于口服及局部外用,其应用浓度为:在片剂 中可用作粘合剂(1%-3%),崩解剂(2.5%-10%)、增稠剂及助悬 剂 (1-5g/100ml),乳剂的稳定剂(1-3g/100ml),糊剂及软膏基质 (5%-10%)。最近还用作药物的水性微囊的膜材,以代替用有机 溶剂的包囊技术和用作缓释制剂的载体。
大茴香醛改性海藻酸钠凝胶的制备及释药性能

1 1 主要原 料与 仪器 .
海藻 酸钠 ( l, R, 海迈潮 化 学试 剂有 限公 Ag 上 司 )对 甲氧 基苯 甲醛 、 ; 牛血 清 白蛋 白 ( S A 国 B A, R,
物制剂 、 组织工程、 临床治疗 、 细胞培养、 食品加工 等 领域 【 。 C a 人 将 海 藻 酸 钠 与 戊 二 醛 通 过 2 ] hn等
1 实验部分
将海藻酸钠 、 大茴 香醛按一定 的配 比依次加
盐酸催化下与 大茴香醛 发生缩醛化反应 , 使其 疏水改性 , j并制成凝胶作为药物载体 , 发现药物 负载及缓释性能得到改善。
器公 司) 梅特勒 T A热重分析仪 ( ; G 苏州佐藤精密
仪器有限公 司) S 5 ;- 0扫描 电镜 ( 4 日立公 司) 透 ;
射电子显微镜 ( 本电子株式会社 ) 1 3 。 12 疏水改性海藻酸钠的制备 .
W U Mi NIC i u n, a — a h
( col f hm cl n tr l 幛 n e n , aga nvrt, x,hn ) Sho o C e ia adMa i eaE er g J nnnuie i WuiC ia i i sy
Ab t a t Hy r p o i al d f d a gn t r b an d tr u h a e aiai n o li ae w t - t o y b n a d h d aay t d sr c : d o h b c l mo i e i a ewe eo t ie h o g c t z t f g n t i p meh x e z e y e c t se y i l l o a h l l b n a i. e mo i e gn t sc a a tr e y FI R s e t , u r s e c ,r n mi in ee t n c mir s o y, a n n - y a cd Th d f d a i a ewa h cei d b . p cr f o e c n e ta s s o l cr i c o p s n i g e i l r z I al s o c c lc mnc mir s o y UV p c r m ,h r l a ay i. h d i e gn t y r g l w s u e s a d a re o n a s l t n e t i c o c p , s e tu t ema n lss T e mo f d a i a e h d e a s d a mg c r rf r e c p ua i i l e i o a d r la e o o ie s r m lu n Th e u t s o d t a r g la i g a i t n lw rl. e w r b e v d n ee s fb vn e u ab mi . e r s l h we t u d n b ly a d s e s e e o s re . s h d o i o e a
海藻酸钠水凝胶氯化钙交联原理

海藻酸钠水凝胶氯化钙交联原理海藻酸钠水凝胶是一种高分子材料,其具有良好的生物相容性和生物可降解性,因此在生物医学领域得到广泛应用。
而氯化钙是一种常用的交联剂,可以有效地将海藻酸钠水凝胶进行交联,增强其物理性能和稳定性。
本文将从海藻酸钠水凝胶和氯化钙交联原理的角度进行阐述,以期对相关领域的研究者和读者有所启发。
一、海藻酸钠水凝胶的特性海藻酸钠是从海藻中提取的一种多糖类化合物,具有良好的生物相容性和生物可降解性。
它可以在水中形成均匀透明的胶体溶液,并在一定温度下形成稳定的凝胶。
海藻酸钠的凝胶性质主要是由于它分子链间的静电排斥力和分子链内的氢键作用所导致的。
因此,海藻酸钠水凝胶具有良好的柔韧性和可塑性。
二、氯化钙的作用机理氯化钙是一种离子交联剂,可以与海藻酸钠中的阴离子进行交联反应。
在交联过程中,氯化钙中的钙离子与海藻酸钠中的羧基发生离子键的形成,从而使海藻酸钠分子链之间发生交联。
交联后的海藻酸钠水凝胶形成了三维网状结构,增加了凝胶的机械强度和稳定性。
此外,氯化钙还可以通过与海藻酸钠分子链中的羧基形成钙盐的方式来增加凝胶的稳定性。
三、海藻酸钠水凝胶氯化钙交联的应用海藻酸钠水凝胶氯化钙交联后,具有较好的生物相容性和生物可降解性,适合用于组织工程、药物缓释等领域。
在组织工程中,海藻酸钠水凝胶氯化钙交联后可以用作三维支架材料,用于细胞培养和组织修复。
在药物缓释方面,海藻酸钠水凝胶氯化钙交联后可以用作药物缓释载体,实现药物的控制释放。
四、海藻酸钠水凝胶氯化钙交联的优势相比于其他交联方法,海藻酸钠水凝胶氯化钙交联具有以下优势:1. 简单易行:交联过程简单,不需要复杂的设备和条件。
2. 生物相容性好:海藻酸钠水凝胶和氯化钙都是生物相容性较好的材料,对人体无毒副作用。
3. 可控性强:通过调整交联剂的浓度和交联时间,可以控制凝胶的性质和稳定性。
海藻酸钠水凝胶氯化钙交联是一种简单易行、生物相容性好、可控性强的方法,可用于组织工程和药物缓释等领域。
海藻酸钠固定化脂肪酶的制备及性质研究

海藻酸钠固定化脂肪酶的制备及性质研究摘要:本文采用海藻酸钠包埋法得到了固定化脂肪酶。
通过条件优化得到了最佳固定化条件:海藻酸钠浓度1.5%,CaCl2浓度3%,固定化时间为1 h。
该固定化脂肪酶连续反应4批之后,酶活保持稳定,显示了较好的催化稳定性。
关键词:海藻酸钠脂肪酶固定化催化稳定性脂肪酶(Lipase,EC3.1.1.3),又称甘油三酯水解酶,是一类能催化长链脂肪酸甘油酯水解为甘油和长链脂肪酸的酶类,许多脂肪酶还能催化酯化反应酯交换反应、醇解反应、酸解反应以及氨解反应等。
目前,脂肪酶已广泛应用于食品、医药、皮革、日用化工等行业。
但游离脂肪酶稳定性差、容易失活、难以回收利用等缺点,限制了其在工业生产中的应用。
通过固定化技术,将脂肪酶固定化在一定的载体上可以提高活力和稳定性,而且易于回收重复使用,因此酶固定化技术被广泛地应用,以降低生产成本、提高生产效率[1,2]。
海藻酸钠作为一种生物相容性较好、机械强度较高、对酶蛋白无毒副作用的高分子载体,经常用于酶催化剂的固定化[3,4]。
本文以海藻酸钠作为载体,制备固定化脂肪酶,并对固定化条件和酶学性质作了详细的研究。
1实验部分1.1仪器与试剂恒流泵(苏州江东精密仪器有限公司,BT-100B),恒温水浴振荡器(太仓市实验设备厂,SHZ-88A),多能搅拌器(金坛市白塔金昌实验仪器厂,HJ-5),分析天平(AB204-N)。
海藻酸钠(生物级,阿拉丁试剂(上海)有限公司),牛胰脂肪酶(13-35 units/mg),橄榄油(分析纯,阿拉丁试剂(上海)有限公司),聚乙烯醇(分析纯,阿拉丁试剂(上海)有限公司),其余试剂均为分析纯。
1.2 固定化脂肪酶的制备将海藻酸钠加热溶解,使海藻酸钠最终浓度为1.5% (w/v),冷却后使海藻酸钠溶液与微生物细胞混合均匀,用蠕动泵滴入3.0% (w/v)的CaCl2溶液中,固定化一定时间后,滤出颗粒,用0.9%(w/v)生理盐水洗净后,浸在相同浓度的生理盐水中备用。
海藻酸钠分子量与粘度
海藻酸钠分子量与粘度海藻酸钠(Sodium Alginate)是一种多糖类化合物,广泛存在于海藻中。
由于其独特的理化和生物活性,被广泛应用于食品、制药、化妆品等行业。
本文将探讨海藻酸钠分子量与粘度的关系,以及分子量对海藻酸钠应用的影响。
海藻酸钠分子量是指海藻酸钠分子中糖基的数量和排列顺序。
分子量的大小直接影响海藻酸钠的物理和化学性质,如溶解性、凝胶形成性等。
分子量主要由制备方法和来源决定,一般来说,海藻酸钠的分子量在1000-1000000Da 之间。
海藻酸钠的粘度与其分子量密切相关。
分子量越大,分子间相互作用力越强,溶液粘度越大。
反之,分子量越小,溶液粘度越小。
在一定范围内,海藻酸钠分子量增加,粘度也随之增加。
但当分子量超过一定值后,分子间的相互作用力趋于稳定,粘度增加幅度减小。
分子量对海藻酸钠的应用具有显著影响。
较高分子量的海藻酸钠形成的凝胶具有较好的强度和稳定性,适用于制作果冻、软糖等食品。
而在制药领域,低分子量的海藻酸钠可作为药物载体,实现靶向给药。
此外,海藻酸钠还应用于生物医学领域,如组织工程支架、生物医用材料等。
为了提高海藻酸钠的分子量和粘度,可以通过以下方法:1.优化制备工艺:采用合适的加热、搅拌速度和反应时间,提高分子链的交联程度。
2.选择适宜的来源:不同海藻来源的海藻酸钠分子量和粘度存在差异,选用优质原料有助于提高产品性能。
3.添加助剂:在制备过程中,加入一定比例的助剂,如钙离子、铁离子等,可提高海藻酸钠的分子量和粘度。
4.后处理:对制备的海藻酸钠进行进一步处理,如干燥、粉碎、筛选等,有助于提高产品分子量和粘度。
总之,海藻酸钠分子量与粘度密切相关,掌握这一关系有助于优化制备工艺和拓宽应用领域。
---壳聚糖_海藻酸钠微胶囊对布洛芬的缓释作用
随着临床需求的不断提高,对缓控 释制剂的需求量也在与日俱增。由于缓 控释材料的局限,使得目前能够广泛应 用于临床的缓控释制剂的数量还不够 理想。壳聚糖-海藻酸钠微胶囊的出现, 不仅为缓控释制剂的发展带来了新的 机会,也为缓控释制剂的发展提供了更 多的发展空间。
使用壳聚糖- 海藻酸钠微胶囊能 够有效地实现非甾体抗炎药、蛋白质类 药物的缓释给药,可以有效地增加药物 的生物利用度和释放特性。胶囊已经在 非甾体抗炎药、心血管药物以及中药提 取物的缓释制剂中得到了较好的应用。 随着医药科技的发展,将壳聚糖-海藻
关键词:壳聚糖 海藻酸钠 布洛芬 缓释
引言 壳聚糖- 海藻酸钠纳米微胶囊不
仅具有较好的缓释作用,并且具有较好 的生物相容性和可降解性,具有安全无 毒、顺应性好的特点[1]。并且壳聚糖与海 藻酸钠具有价廉易得的特点,是较为优 越的缓控释载体材料。在溶液中,海藻 酸钠可以与氯化钙反应并瞬间形成微 囊[2]。当向微囊溶液中添加壳聚糖时,海 藻酸钠分子中的羧基和壳聚糖中的伯 氨基通过正负电荷相互吸引,最终形成 聚电解质膜[3]。该类生物膜的形成不仅 能够加强壳聚糖-海藻酸钠微胶囊的稳 定性,还能够对包裹其中的药物具有较 好的缓控释作用。布洛芬作为非甾体抗 炎的一种,具有非甾体类抗炎药最为典 型的毒副作用,即为胃肠道刺激和胃肠 道损伤[ 4 ]。将 布 洛 芬 载 入 壳 聚 糖- 海藻 酸钠微胶囊中,由于微胶囊的缓释作用 而使布洛芬的刺激性更为缓和,且能够 延缓布洛芬的释放时间,使其能够到达 结肠部位释放[5]。通过微胶囊的载药,不 仅能够有效地纠正或减轻布洛芬本身 的不良反应,而且能够延长布洛芬的作
海藻酸钠
实验步骤
1海藻酸钠样品的制备 a原始样品:将1%(w/v)的海藻酸钠水溶液,经0.22pm的膜过
滤,冷冻干燥12h后的样品配成1%(w/v)的水溶液,供检测。 b活性炭吸附法处理的样品:称取一定量的活性炭加之1%(冻干
燥12h后的样品配成1%(w/v)的水溶液,供检测。 c活性炭吸附+透析法处理的样品:称取一定量的活性炭加到1%
公司主要以海藻和葡萄糖为原料,加工生产纯天然、绿色、环保型的化 工、药物、食品、饲料等五大系列产品,兼营国际贸易和发电供热。代表性 的产品有海藻酸盐系列(钠、钾、镁等)、甘露醇、山梨醇、山梨糖醇液、 碘、海藻肥、藻酸丙二醇酯、海藻酸、海藻饲料、海藻水合胶体等。
公司的产品为“明月”牌,产品广泛应用于印染、纺织、食品、保健品、 医药、环保、日用化工、乳制品、啤酒、饮 料等领域。公司拥有健全、完善的营销网络和 服务体系,产品畅销全国各地,远销欧盟、美 国、亚洲、非洲等全球80多个国家和地区,与 世界多家知名企业建立了长远的合作伙伴关系。
2、消化:放入250mL的烧杯中。 然后往烧杯中加入3%的Na2CO3 溶液50mL,在50℃下消化4个 小时。2M(ALG)n + nNa2CO3 →2nNaALG+M2(CO3)n。式中M 为Ca2+、Fe2+ 等金属离子。
3、过滤:消化后,海带变成了糊 状,比较粘稠。要先加入一定 体积的水将糊状液体稀释,再 过滤。由于直接抽滤这种糊状 的液体速度太慢,因此首先用 纱布初滤一次,再将滤液用真 空泵抽滤。
海藻酸钠的提取
提取原理:
海藻酸钠:白色或淡黄色粉末,几乎无臭无味。ALG易 溶于水,不溶于乙醇、乙醚、氯仿和酸。其稳定性以pH值在 6—11之间较好,低于6时析出海藻酸,不溶于水;高于11时 又要凝聚。黏度在pH值为7时最大,但随温度升高而显著下 降。海藻酸钠不耐强酸、强碱及某些重金属离子,因为他们 会使海藻酸凝成块状,但钠、钾除外。海藻酸钠水溶液遇酸 会析出海藻酸凝胶,遇钙、铁、铅等二价以上的金属离子会 立即凝固成这些金属的盐类,不溶于水而析出。
海藻酸钠的特征峰
海藻酸钠的特征峰海藻酸钠是一种常见的天然多糖类物质,具有许多独特的特征峰。
本文将以海藻酸钠的特征峰为标题,详细介绍海藻酸钠的特征峰及其在科学研究和工业应用中的重要性。
一、海藻酸钠的基本介绍海藻酸钠是一种由海藻提取得到的天然多糖类化合物,化学式为(C6H7NaO6)n。
它是一种无色或微黄色的粉末状物质,在水中具有良好的溶解性。
海藻酸钠在食品工业、医药领域、生物技术等各个领域都有广泛的应用。
1. 红外吸收峰:海藻酸钠在红外光谱中有独特的吸收峰,主要集中在3500-3200 cm-1和1700-1500 cm-1两个区域。
前者是由于海藻酸钠中的羟基和胺基的振动引起的,后者则是由于羧基和羧酸盐的振动引起的。
这些特征峰的存在可以用来鉴定海藻酸钠的存在和纯度。
2. 核磁共振峰:海藻酸钠的核磁共振谱可以提供关于其分子结构和化学环境的信息。
在13C NMR谱中,海藻酸钠的特征峰通常出现在50-100 ppm的范围内,这些峰对应于碳原子的化学位移。
在1H NMR谱中,海藻酸钠的特征峰通常出现在3-5 ppm的范围内,这些峰对应于氢原子的化学位移。
三、海藻酸钠的科学研究应用1. 药物控释:海藻酸钠的天然多糖结构使其在药物控释方面具有潜在的应用价值。
研究表明,海藻酸钠可以作为药物的载体,通过调节其释放速率来实现药物的持续释放。
2. 抗氧化性能:海藻酸钠具有较强的抗氧化性能,可以有效清除自由基,减少氧化应激对细胞的损伤。
因此,海藻酸钠在抗氧化剂研究和开发方面具有重要的潜力。
3. 生物活性研究:海藻酸钠具有多种生物活性,如抗菌、抗病毒、抗肿瘤等。
研究人员通过分离和纯化海藻酸钠中的活性成分,并研究其作用机制,以期开发新的药物和治疗方法。
四、海藻酸钠的工业应用1. 食品工业:海藻酸钠作为食品添加剂,可用于增稠、凝胶化和乳化等方面。
它具有良好的稳定性和生物相容性,在食品中被广泛应用于果冻、糖果、冰淇淋等产品中。
2. 化妆品工业:海藻酸钠具有保湿、抗菌、抗炎等功效,被广泛应用于化妆品中。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Vol135No18#20#化 工 新 型 材 料NEWCHEMICALMATERIALS第35卷第8期2007年8月
基金项目:国家自然科学基金资助项目(50573061)四川省应用基础研究项目(07JY029-065);西南交通大学科学研究基金资助项目(2006B52)作者简介:魏靖明(1983-),男,硕士研究生,研究方向:高分子药物缓控释材料。张志斌,教授,硕导,研究方向:生物医用材料。
综述与专论海藻酸钠作为药物载体材料的研究进展*魏靖明 张志斌* 冯 华 林 松 张 琨(西南交通大学生物工程学院,成都610031)摘 要 综述海藻酸钠作为药物载体材料的研究进展;依据国内外的文献报道来阐述海藻酸盐凝胶材料、海藻酸钠共混材料、海藻酸钠化学改性材料作为药物载体材料的研究进展;海藻酸钠作为药物载体材料有很广阔的应用前景。关键词 药物载体材料,海藻酸钠,壳聚糖
StudyonalginateasdrugcarriermaterialWeiJingming ZhangZhibin* FengHua LinSong ZhangKun(CollegeofBioengineering,SouthwestJiaotongUniversity,Chengdu610031)Abstract Objective:overviewtheresearchprogressonalginateasdrugcarriermaterial;method:accordingtothe
domesticandforeignliteraturetoreportsaboutalginate,thestudyadvancementonalginategelatummaterial、alginatein-corporatedmaterialandalginatechemicallymodifymaterialwasexpounded;resultandconclusion:alginatewillbebroadlyusedasdrugcarriermaterial.Keywords drugcarriermaterial,alginate,chitosan
海藻酸钠(ALG)又称海藻胶、褐藻酸钠或海带胶,是从褐藻类的海带或马尾藻中提取碘和甘露醇以后的副产品。海藻酸钠是海藻细胞壁和细胞间质的主要成分,海藻酸分子是由B-D-甘露糖醛酸(M)和A-L-古洛糖醛酸(G)2种单体组成的嵌段线性聚合物。在1个海藻酸分子中,可能只含有其中1种糖醛酸构成的连续链段,也可能由2种糖醛酸链节构成嵌段共聚物[1]。而海藻酸钠是海藻酸用碱中和后的产物。海藻酸钠易溶于水,是1种电荷密度很高的聚电解质,具有良好的生物降解性和相容性。随着药物制剂的迅速发展,具有无毒、可生物降解、良好的生物相溶性、缓释和控释的药物载体材料已日益引人注目。海藻酸钠具有以上特性,已被大量用于药物载体材料。可将海藻酸钠药物载体材料分为海藻酸盐凝胶药物载体材料、海藻酸钠共混药物载体材料、海藻酸钠化学改性药物载体材料。下面介绍这3种药物载体材料的研究进展。1 海藻酸盐凝胶药物载体材料海藻酸钠是1种阴离子聚电解质多糖,利用二价阳离子交联其羧基可形成凝胶微球[2]。在海藻酸钠水溶液中加入Ca2+、Ba2+等阳离子后,海藻酸钠G单元上的Na+与二价离子发生离子交换反应,G基团堆积而成交联网络结构,从而转变成水凝胶。海藻酸凝胶具有pH敏感性,粒径适宜,可防止突释,口服无毒等特点。其作为药物载体已得到广泛的关注。马萍等[3]用滴制的方法使海藻酸钠溶液与氯化钙溶液发生胶凝反应,制备了海藻酸钙凝胶微球,并考察了凝胶微球的溶胀特性。结果显示,海藻酸钙凝胶微球在蒸馏水和pH=110的介质中均不溶胀;而在pH=618的磷酸缓冲液中,40min即溶胀完全,然后逐渐崩解分散。这些结果说明海藻酸钙凝胶微球能在胃液中保持原状,在肠液中溶胀,可作为药物的缓释载体。海藻酸钙凝胶具有pH值依赖特性,所以海藻酸钙凝胶经常作为酸敏感性药物的载体材料。Sung等[4]就将酸敏感性非甾体抗炎药布洛芬制成海藻酸钙凝胶微球制剂,考察了制备方法、赋形剂及海藻酸钠/布洛芬的比例对包封率和溶出特性的影响。结果表明,在凝胶微球制备过程中赋形剂除了起赋形作用外,还对药物的溶出度有影响,由不同处方制备得到的凝胶微球布洛芬的包封率均>93%,不受海藻酸纳与布洛芬比例及赋形剂的影响。Kengo等[5]制备了硝苯地平海藻酸钙凝胶微球,以市场销售的硝苯地平缓释片Adalat-L20为对照品做了狗体内药动学研究。结果表明硝苯地平凝胶微球缓释可达24h,有效血药浓度可以维持10h。而Adalat-L20在口服1h后就达到了最高血药浓度,24h后已检测不到药物,凝胶微球的药时曲线下的面积是Adalat-L20的215倍。这说明海藻酸钙凝胶可以作为疏水性药物的载体材料。Sumihiso等[6]制备了吲哚美辛的海藻酸盐凝胶微球制第8期魏靖明等:海藻酸钠作为药物载体材料的研究进展剂,用贝克狗做了体内实验及在健康志愿者中考察了其生物利用度。实验结果显示,给药2h后可达最大血药浓度,有效血药浓度可以维持12h。可见海藻酸凝胶也是一种很好的酸性药物的载体材料材料。贾云等[7]以牛血清白蛋白(BSA)为模型药物,海藻酸钠为包埋材料制备了微囊,研究了不同阳离子、BSA浓度对微囊的形态、粒径和包埋率的影响,并对该微囊包埋前后的完整性和体外溶出速度进行了测定。实验结果表明,用Ba2+制备的微囊成型稳定,粒径均一且具有良好的包埋率;在微囊制备过程中,BSA没有受到破坏,BSA蛋白分子保持了结构的完整性;用海藻酸钠作为包埋材料对蛋白有一定的缓释效果。这说明海藻酸钠微囊是一类好的蛋白药物或多肽等其它大分子药物的载体材料。TakagiI等[8]研究了海藻酸钠凝胶在包埋脂质体的过程中对药物包埋率的影响因素,发现海藻酸使得脂质体内的水溶性药物泄漏,其与聚合物浓度、混合时间及钙离子有关;而从凝胶中挤压出水则不影响脂质体的包埋率。在药物的释放介质中药物的释放主要靠凝胶的降解,降解后仍有药物包埋在脂质体中。此外,海藻酸钠对于滴眼剂来说也是1个理想的载体材料,给药方便。Cohen等[9]证明了海藻酸钠水溶液无需外加钙离子或其它二价、多价阳离子,在眼部便可形成凝胶。海藻酸钠形成凝胶的程度及相应毛果芸香碱的释放,取决于海藻酸钠主链上G单元的百分含量。当海藻酸钠主链上G单元含量超过65%时,只要和模拟泪液接触便可形成凝胶。体外释放实验表明,毛果芸香碱在24h内从海藻酸钠凝胶中缓慢释放,释放主要是通过扩散进行的。2 海藻酸钠共混药物载体材料2.1 海藻酸钠-壳聚糖共混药物载体材料海藻酸钠引入聚阳离子可通过静电作用在微球表面形成聚电解质复合物膜[10]。壳聚糖生物相容性良好。在海藻酸钠中添加壳聚糖,海藻酸钠和壳聚糖之间发生静电相互作用,形成聚电解质复合物。这类聚电解质复合物既可以作为药物的释放载体,从而提高微囊的稳定性和载药量,又可以调节药物释放度,同时可以加强海藻酸钠的pH值依赖性。海藻酸钠-壳聚糖共混材料也已作为多种药物的载体材料。付加雷等[11]使用注射器手工滴制的方法以海藻酸钠和壳聚糖为原料,制备了干扰素-tau微囊。结果表明,海藻酸钠-壳聚糖微囊具有pH敏感性,可以根据药物的吸收特点来调节海藻酸钠和壳聚糖的浓度,使其在不同的pH值时膨胀以释放药物,即在不同的胃肠道部位进行药物释放,以达到药物的最佳吸收利用。海藻酸钠-壳聚糖微囊法用于干扰素-tau等肽类药物的包封,其制备方法简单、快速,且干扰素-tau包封率很高。制备的微囊在模拟胃液中释放率很低,而在小肠液中释放率却很高,从而避免了胃酸和胃酶的分解。因此,海藻酸钠-壳聚糖微囊有望用于干扰素-tau或其它肽类药物等大分子药物的载体材料。Sezer等[12]用葡聚糖70000作为大分子模型药物,证实了海藻酸钠-壳聚糖微球比单独的海藻酸微球载药量大,且微球的熔蚀速率也慢,微球中药物的释放也受到了限制。王毅超等[13]以海藻酸钠、壳聚糖为主要材料包裹幽门螺杆菌(HP)全菌超声蛋白抗原,制备了新型HP疫苗微球。所制备的微球形态规则;平均粒径3133tan;蛋白包封率约为6418%;微球呈显著缓释模式;缓释时间可达6d。海藻酸钠-壳聚糖微球包裹全菌蛋白可以作为疫苗的新型缓释制剂。李军等[14]采用乳化凝胶法研制了海藻酸钠-壳聚糖包被的猪血红蛋白微囊。结果表明,海藻酸钠-壳聚糖-血红蛋白微囊具有较佳的形态和较小的粒径,平均粒径约1Lm,且具有相对较窄的高斯分布;血红蛋白在微囊中包埋率超过了90%;从微囊中持续释放时间可达1个月以上。海藻酸钠-壳聚糖-血红蛋白微囊有望成为可供静脉注射用的具有缓释作用的人工携氧治疗剂。丘晓琳等[15]以低分子肝素为囊芯,通过乳化分散制备成微囊核,然后依次用壳聚糖和海藻酸钠通过大分子自组装形成了多层结构的复合微囊。微囊球形圆整;粒度分散好;平均粒径为(619?0185)Lm;对肝素的包封率最高可达到9315%。微囊的体外释放实验表明,药物半释放率的释放时间可长达3d。随着壳聚糖浓度或海藻酸钠浓度的增大,药物释放速率减小;释药速率随药物与壳聚糖质量比的增大而加大;交联度越高,微囊的释药速率越小;微囊在酸性条件下释药较快。2.2 其它共混药物载体材料MachlufM等[16]研究了用海藻酸-聚赖氨酸-海藻酸微球包埋间质细胞可产生睾丸激素,避免了频繁注射、口服失活、药物浓度不稳定及皮肤给药中的皮肤损伤等问题。睾丸激素浓度0151ng/ml在小鼠体内可保持超过3d,有望用于治疗男性荷尔蒙缺乏症和前列腺癌。周英辉等[17]用海藻酸钠/明胶交联互穿网络聚合物作为基材,以戊二醛和氯化钙溶液作为交联剂,对质子泵抑制剂药物奥美拉唑进行包埋,制备了pH敏感型微囊药物制剂。测定了不同交联时间及不同pH值环境下的释放规律,结果表明,此制剂在酸性环境中可持续释放,且释放百分率较小,而在碱性环境中为突释型制剂。此体系适用于在酸性环境(如胃)中需要保护药效,防止药物失活;在碱性环境(如小肠)中发挥药效的药物制剂。颜秋平等[18]用微乳化-离子交联法制备包覆阿霉素的海藻酸钠/碳包铁复合纳米微球,以水溶性碳二亚胺作为交联剂,将载药微球与单抗Habl8连接,制备出了免疫磁性药物纳米微球。该微球平均粒径约为17112nm,铁含量为1416%,载药量可达1018%,具有强磁响应性和长时间的药物缓释效果。同时在体外该微球能够与靶细胞特异性地结合。这种免疫磁性药物纳米微球可望成为一种优良的靶向肿瘤药物载体。大豆分离蛋白也具有良好的生物相容性,能用于保养胃肠道,缓解慢性肾病,预防和治疗骨质疏松症及癌症[19]。陈云等[20]用钙离子交联海藻酸钠/大豆分离蛋白共混溶液,制备了海藻酸钠/大豆分离蛋白凝胶微球。海藻酸钠/大豆分离蛋白凝胶微球同时兼有海藻酸钠pH响应性质和大豆分离蛋白的生理活性,可望用于功能集成的药物载体。另外,该共混微球经碱处理可形成大孔凝胶微球,有利于大量药物的负载与控释。
