不合格药品处理记录表
药学部不合格药品管理制度

不合格药品管理制度1、目的:为严格不合格药品的控制管理,严防不合格药品进入或流出医院,保证药品的质量和人民群众的用药安全有效,特制定本制度。
2、依据:《药品经营质量管理规范》、《医疗机构药事管理办法》3、适用范围:适用于药学部不合格药品的控制管理。
4、职责:仓管员、养护员、验收员、药品质量管理员、采购员对本制度的实施负责。
5、内容:5.1、不合格药品的含义:不合格药品包括内在质量不合格、外观不合格和包装不合格的药品。
5.2.不合格药品的发现与确认:5.2.1、验收员在进货验收时发现的外观质量及包装质量不符合法定质量标准的药品。
5.2.2、各级药品监督管理部门抽查检验不合格的药品。
5.2.3、过期、失效、霉烂变质及有其它质量问题的药品。
5.2.4、各级药品监督管理部门发文通知禁止销售的药品。
5.2.5、其它不符合国家有关法律、法规规定的药品。
5.3、不合格药品的报告及处理:5.3.1、药库在验收过程中发现不合格药品,验收员不得验收入库,应将不合格品存放于不合格区,立即报告药库负责人,即时通知供货公司采取更换的措施,并在《不合格药品拒收记录表》中注明不合格事项及处置措施,以确定拒收或退货处理。
5.3.2、药库、药房养护发现质量可疑药品应立即挂黄色待验牌,报药品质量管理室复核或送药检室复检。
5.3.3、由各级药品监督部门抽检验出的不合格药品或药监部门发文通知禁止销售、使用的药品,必须立即通知回收,集中存放于不合格品区内,等候处So5.3.4、过期失效、霉烂变质的药品,调入不合格品区后需要报损的,由养护员填写《不合格药品台账》以及《不合格药品报损审批及销毁表》,经药库或药房负责人、药品质量管理室负责人、药品会计室审核签署意见后交药学部主任审批同意后方可报损。
5.3.5、凡因质量不合格报损的药品,应在药品质量管理室、药品会计室的监督下予以销毁,销毁方法按《医疗废物处理管理条例》中的有关规定执行,并做好销毁记录。
药品不合格问题处理与处罚措施

药品不合格问题处理与处罚措施药品是维护人们健康的重要物品,然而,不合格药品问题却时常引起人们的关注。
为了保障公众的用药安全,各国制定了一系列的药品不合格问题处理与处罚措施。
本文将重点探讨药品不合格问题的处理办法以及相应的处罚措施。
一、药品不合格问题的处理办法1.严格的生产质量管理药品生产企业应当建立健全质量管理体系,确保每一个生产环节都符合相关法律法规的要求。
这包括从原材料采购、生产过程监控、设备设施维护到产品出厂前的检验等环节。
通过严格的生产质量管理,能够有效减少药品不合格问题的发生。
2.完善的药品检验体系药品检验是保障药品质量的重要环节。
药品监管部门应当加强对药品生产企业的监管力度,确保药品质量检验工作的科学性和严谨性。
此外,完善的药品检验体系还需要与国际接轨,吸取国际先进的检验技术和标准,提高我国药品检验水平,确保公众的用药安全。
3.加强信息公开和风险提示药品监管部门应当及时公开药品不合格问题的相关信息,提醒公众慎重选择和使用药品。
同时,对于可能存在严重安全风险的药品,要及时发布风险提示,引导公众合理用药,减少药品不合格问题对人民群众的危害。
二、药品不合格问题的处罚措施1.责令停产停售对于被发现存在严重安全隐患或者质量问题的药品,药品监管部门有权责令停产停售。
这一措施的目的是为了及时阻止不合格药品流入市场,保护公众的用药安全。
2.吊销药品生产许可证对于多次生产不合格药品或涉嫌违法违规生产药品的企业,药品监管部门有权吊销其药品生产许可证。
这一处罚措施是对严重违法行为的严厉打击,以便从根本上杜绝不合格药品问题的发生。
3.行政处罚在药品不合格问题中,对于药品生产企业和相关责任人的违法行为,药品监管部门还可以依法给予行政处罚。
行政处罚的力度和种类将根据情况的严重性而定,旨在通过处罚起到警示和威慑作用。
综上所述,药品不合格问题的处理与处罚措施是保障公众用药安全的关键环节。
各国应加强监管力度,加强药品生产过程的质量管理,完善药品检验体系,加强信息公开和风险提示,严惩不合格药品的生产企业和相关责任人。
药品不合格品处理程序

文件制修订记录一、目的:为了规定不合格品处理办法,特起草本制度。
二、适用范围:适用于公司不合格品的处理。
三、责任者:质控部、生产技术部、仓库保管员。
四、正文:不合格品包括不合格成品、不合格原辅料、不合格包装材料、不合格中间体。
具体处理程序如下:1不合格成品1.1凡发现成品不合格,检验人员必须进行复检,复检仍不合格,下达不合格报告单,并发给“不合格证”。
1.2仓库接到不合格报告单后,应立即将不合格品单独放在不合格品存放区,挂红色状态牌,周围用红色线条围住,在不合格品上逐件贴上“不合格证”,标明品名、规格、批号、生产日期。
1.3质控部召集有关人员召开质量分析会,查明原因,根据不同原因再作不同处理。
1.3.1含量不合格重新返工,增加原料量。
1.3.2装量不够重新返工,增加装量。
3.3.3药品被污染作销毁处理1.3.4包装不合格重新换包装1.4凡是返工的成品,必须按正常生产批号请检、取样、检验、发报告单,并做好记录。
1.5车间主任须制订返工工艺,报质控部审查,批准后进行返工处理。
1.6销毁不合格品必须在部门填写不合格品处理申请单,经总经理批准后,并由质控部人员监督销毁过程,并有详细记录和经办人、监督人签名。
2不合格原辅料2.1不合格的来源:2.1.1进厂后经检验不合格的原辅料。
2.1.2在仓库贮存保管过程中由于保管不当或超过有效期而造成不合格的原辅料。
2.1.3在生产过程中被污染的剩余物料。
2.2经检验不合格的原辅料,由原辅料仓库填写《不合格品处理报告单》,提出书面处理意见报质控部审核。
2.3不合格原辅料的处理方法:2.3.1退回原供应商或换货。
2.3.2降级使用(仅限于干燥失重不符合规定的情况,经处理后不影响产品质量)。
2.3.3报废销毁。
(具体程序同成品销毁程序)2.4进厂经检验不合格原辅料由质控部通知物料供应部,尽快通报给生产厂家并提出处理意见。
2.5不合格原辅料由仓库登记《不合格品汇总台帐》以便备查。
药店GSP管理表格-全套
商品名称
外文名称
有效期
规格
批准文号
剂型
GMP认证
生产企业
地址
邮编
用途
建档目的
检验项目
性状
包装情况
内:
储存条件
中:
外:体积:
养
护
质
量
问
题
摘
要
时间
生产批号
质量问题饮片装斗复核记录
日期
品名
规格
生产日期
生产厂商
装斗数量
操作人
质量状况
复核人
备注
药品拆零销售记录表
药品通用名称:商品名称:
药品通用名称
商品名称
品种类别
剂型
规格
有效期
批准文号
储存条件
生产企业
GMP证书号
供货联系人
电话
传真
质量状况
综
合
评
价
经审核符合规定,可以列为合格经营品种。
该药品品种编码为:
主要负责人:质管部负责人:
年月日年月日
备
注
附:1.药品质量标准、2.药品外包装、3.药品说明书
首营企业审批表
编号:
企业名称
进货数量
验收人员
验收日期
不合格数量
不合格情况发现地点
不合格情况发现日期
不合格原因
保管员:年月日
不合格情况复查
负责人:年月日
质量管理部意见
负责人:年月日
主管负责人审批意见
负责人:年月日
备注
不合格药品台帐
编号:
日期
通用
名称
商品
名称
生产
药品抽检不合格处理流程

药品抽检不合格处理流程朋友们!今天来跟你们唠唠药品抽检不合格的那些事儿,还有处理的流程。
先说个我刚入行时候的事儿啊,那时候我啥都不懂,碰到个抽检不合格的情况,整个人都懵圈了!别提多狼狈了。
咱先来说说发现药品抽检不合格的时候该咋办。
这第一步啊,就像是打仗的先锋队,可得重视!一般来说,发现不合格,咱得赶紧把相关的药品先控制住,别让它再流通出去祸害人。
我记得有一次,就在我们这小县城的一家药店,发现了一批不合格的感冒药,哇,那可不得了!这时候有人可能要问了,咋控制啊?嘿这就得通知相关的销售点和仓库,把这批药给封存起来。
这过程可不能马虎,得仔仔细细的,一个都不能漏。
接下来呢,就得调查原因啦!这可不好弄,有时候感觉就像在一团乱麻里找线头。
我记得好像是有一次,查了好久都没个头绪,唉,把我急得哟!不过后来发现,居然是生产过程中的一个小环节出了岔子。
调查的时候,要从源头查起,生产环节、运输环节、储存环节,一个都不能放过!说不定是运输的时候温度没控制好,或者储存的环境太潮湿了,啥情况都有可能。
哦,对了!说到这,我想起之前听说的一个八卦,有个厂家为了省钱,用了劣质的原材料,结果药品抽检不合格,那厂家可惨喽!在调查的过程中,咱还得把相关的证据都收集好,这可重要了,就像打官司要有证据一样。
有时候我都觉得自己像个侦探,到处找线索,哈哈!然后呢,根据调查的结果,该处罚的处罚,该整改的整改。
这处罚可不能心软,不然那些不良商家还会有恃无恐。
不过整改的时候,咱也得给人家机会,不能一棒子打死。
我这又扯远啦!咱接着说,处理完了这些,还得把处理的结果向社会公布,让大家都知道,咱这监管可不是闹着玩的!嗯...我想想,还有啥没说的。
哦,对了!这整个过程中,一定要严格按照法律法规来,可不能乱来。
我刚开始的时候,就因为不太熟悉法规,走了不少弯路。
好啦,朋友们,这就是药品抽检不合格的处理流程,希望对你们有用!要是有啥不对的地方,或者你们有啥更好的想法,可得跟我说哟!。
不合格药品处理操作规程

一、目的:通过制定实施不合格药品质量管理操作规程,有效控制不合格药品的处理过程,以保证经营药品的质量符合规定的要求。
二、职责:质量管理部、业务部负责对不合格药品的确认、报告、报损、销毁全过程实施控制性管理。
三、范围:适用于不合格药品处理的全过程。
四、主要内容:1.不合格药品的定义:凡不符合国家有关法律、法规,不符合药品质量标准,包装不符合规定以及药监部门明文规定禁止销售的药品均属不合格药品。
有以下情形的,按不合格品处理:1.1《药品管理法》规定的假药、劣药。
1.2质量证明文件不合格的药品。
1.3包装、标签、说明书内容不符合规定的药品。
1.4包装破损、被污染,影响销售和使用的药品。
1.5批号、有效期不符合规定的药品。
1.6各级药品监督管理部门公告的抽检不合格的。
1.7各级药品监督管理部门发文通知禁止销售的。
1.8质量管理部抽样送检确认不合格的。
2.不合格药品的处理:2.1购进验收时发现不合格药品的:2.1.1验收员进行验收时,填写《药品采购入库质量验收记录单》后,根据拒收数量自动生成《药品拒收报告单》报质量管理部。
质量管理人员依据《药品拒收报告单》所反映的情况,依据国家有关法规及企业内部有关规定,对验收过程中质量有疑问的药品进行复核,确认为不合格药品的予以审核,通知采购员填写《到货拒收单》,及时通知供货方,并按购销合同或质量保证协议的有关规定进行处理,并通知保管员将货物放到退货区,同时若确认为不合格品的药品应存放于不合格品库(区);2.1.2验收员进行验收时,填写《药品采购入库质量验收记录单》后,如填写了不合格品数量,则通知质量管理人员进行处理判定,质量管理员根据实际情况,并依据判定标准,做出相应的处理意见,在系统内参照生成《不合格品处理审批单》,并经过质管部负责人、质量负责人二级审批后,将确认为不合格品的药品存放于不合格品库(区),做好标识,等待处理,处理意见一般分为三种,直接报损,入库报损,先暂存后退货。
药品按月检查记录表
药品检查记录表
检查日期
养护区域及类别
检查内容
处理情况
卫 生
包装标签、标识、说明书
分类陈列
储存条件
近效期药
品种数
橱窗
货架商品Βιβλιοθήκη 药库药房本季
检查
小结
本季度对药房、药库所陈列的全部药品进行了内外包装、外观性状、标签、说明书、有效期等项目检查,检查结果如下:
发现不合格药品批次;
发现近效期药品批次;
发现可疑假、劣药品或上级有关部门公告确认假、劣药品批次;
检查人员签名:药房主任签名:
药品检查记录表
检查日期
养护区域及类别
检查内容
处理情况
卫 生
包装标签、标识、说明书
分类陈列
储存条件
近效期药
品种数
橱窗
货架
商品
药库
药房
本季
检查
小结
本季度对药房、药库所陈列的全部药品进行了内外包装、外观性状、标签、说明书、有效期等项目检查,检查结果如下:
发现不合格药品批次;
发现近效期药品批次;
发现可疑假、劣药品或上级有关部门公告确认假、劣药品批次;
2024年不合格药品管理制度(四篇)
2024年不合格药品管理制度不合格药品与退货药品管理制度一、目的为确保不合格药品不流入市场,保障人民用药安全有效,特制定本管理制度。
二、依据本制度依据《中华人民共和国药品管理法》及其实施条例制定。
三、职责1. 质量管理员:负责对不合格药品实施全面监控管理,具有药品质量确认权及不合格药品处置权。
2. 采购员:负责不合格药品的退货等后续处理工作。
3. 保管员:负责将确认的不合格药品移入指定区域存放,并确保其有效隔离。
四、内容1. 不合格药品存放与管理不合格药品应统一存放于不合格药品专区或专库,并实行严格管理。
其确认、报损、销毁等流程需遵循完善的手续和记录制度。
2. 不合格药品范围界定不合格药品包括但不限于以下情形:(1) 药品所含成分与国家药品标准不符;(2) 以非药品冒充药品或以他种药品冒充该品种药品;(3) 药品监管部门明确禁止使用的;(4) 未经批准生产、进口或未经检验即销售的药品;(5) 变质或被污染的药品;(6) 使用未经批准文号的原料药生产的药品;(7) 适应症或功能主治超出规定范围的药品;(8) 未注明或更改有效期、超过有效期的药品;(9) 未注明或更改生产批号的药品;(10) 直接接触药品的包装材料和容器未经批准的;(11) 擅自添加着色剂、防腐剂、香料、矫味剂及辅料的药品;(12) 其他不符合药品标准规定的药品;(13) 经抽样检验,内在质量不符合药品标准的药品;(14) 外包装严重破损或不符合国家相关规定的药品;(15) 国家或省、市各级药品监督管理部门发布的通报或质量公告中明确不合格的药品。
3. 不合格药品处理流程(1) 一旦发现不合格药品,质量管理员应立即发出药品停用通知,并迅速回收所有问题药品。
(2) 若不合格药品问题源于供货企业或生产企业,采购员应立即停止采购,并启动退货程序。
(3) 对于无法退货的药品,需经质量管理小组审批并签字后,退回药库。
药库人员需填写《药品报损单》,并对这些药品进行统一销毁。
GSP认证表格大全(内含31个)
药品购进验收记录1 / 38库存药品质量养护检查记录编号:检查日期:备注:1.进库达一个季度以上的药品方列入养护之列。
2.如检查中无质量问题,在质量情况一栏中,填写“正常”即可。
3.数量栏填写库存实际数量。
2 / 38不合格药品报销销毁记录3 / 38药品购进记录年月日4 / 38药品储存记录表5 / 38药品出库复核、配送记录6 / 38药品质量查询、投诉、抽查情况记录库房温湿度记录表(常温库□阴凉库□冷库□)药品购进退出记录9 / 38药品销后退回验收记录10 / 38计量器具检定记录表制表人:年月日质量事故报告书报告单位(人):质量管理制度执行情况检查考核记录14 / 3815 / 3816 / 38处方药留存和处方药销售记录17 / 38枣庄康维药业连锁有限公司销售凭证枣庄康维药业连锁有限公司销售凭证药品缺货记录表顾客意见簿员工健康检查档案员工培训档案编号:药品质量档案表药品养护档案质量问题,应填写质量问题状况。
处理措施栏:有质量问题应填写具体处理措施,无质量问题填写“——”。
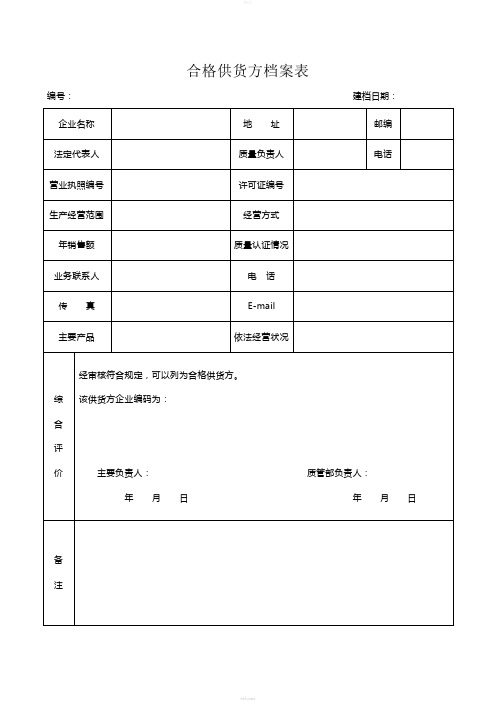
供货方档案表设施和设备及定期检查、维修、保养档案计量器具管理档案29 / 38供货企业资质审批表药品资质审批表注:本表附药品生产许可证、营业执照、批准文件、质量标准、出厂检验报告书、样品、价格批文、GMP证书以及临床总结报告等资料。
不合格药品报损审批表编号:报告时间:年月日药品质量信息汇总表药品质量问题查询追踪记录表35 / 38近效期药品催销表36 / 38药品不良反应 / 事件报告表新的□严重□一般□医疗卫生机构□生产企业经营企业□个人□编码□□□□□□□□□□□□□□□□□□□单位名称:部门:电话:报告日期:年月日37 / 3838 / 38。
不合格药品处理操作规程
一、目的规范不合格药品处理全过程。
二、依据《药品经营质量管理规范》 (国家食品药品监督管理总局令第28 号)。
三、合用范围合用于不合格药品的报告、确认、处置、报损、销毁等工作的管理。
四、内容1、不合格药品是指不符合药品质量标准规定,以及不符合药品监督管理法规规定要求的药品。
包括定性、定量、微生物检测不符合有关规定或者外观性状、包装、标签、说明书等不符合有关规定的药品。
药品经营过程中,不合格药品的主要包括以下几种形式。
( 1 )药品包装形式不符合标准。
表现为药品包装、标签、说明书内容或者形式不符合法律规定,存在错误行为。
①药品的包装、标签、说明书标示的药品批准文号、生产企业系伪造、冒用的,未标明或者更改生产批号、有效期的,或者标明的适应症或者功能主治超出规定范围的,属于假劣药品范围。
②药品标签、说明书的内容、格式、颜色、标识等缺失或者形式不规范,药品标签印有误导使用和不适当宣传产品的文字和标识的,药品商品名称字体以单字面积计大于通用名称字体的二分之一的,说明书或者标签中使用未经注册的商标的,以及特殊管理药品、外用药品、非处方药专有标识缺失或者不符合规定的。
③药品包装夹带介绍或者宣传产品、企业的文字、音像及其他资料。
④最小销售包装缺失药品使用说明书的。
(2)药品包装质量不符合标准。
表现为药品包装质量存在创造缺陷或者因外界因素影响发生物理、化学及生物学特性的变化,存在可能使药品内在质量变异的风险,或者存在安全隐患的。
①因包装的材质、生产工艺问题,导致药品包装变形、软化、破损、受潮、被污染,以及封口松动、内容物渗漏或者挥发等。
②在流通过程中的不合理因素导致包装变形、软化、破损、受潮、被污染,以及封口松动、内容物渗漏或者挥发等。
③外包装发生变形、软化、破损等异常,但经检查确认最小包装完好、外观性状无异常的药品,按合格药品管理。
( 3 )药品内在质量不符合标准。
表现为药品存在创造缺陷或者不符合法定检验标准,可能影响疗效或者存在安全隐患。
