铝及铝合金基本性质介绍
5000铝合金成分

5000铝合金成分铝合金是一种使用广泛的材料,具有优良的性能和广泛的应用领域。
5000系列铝合金是其中一种常见的类型,它由铝和其他合金元素组成。
本文将深入探讨5000铝合金的成分及其影响。
一、铝的基本性质铝是一种轻金属,具有低密度、良好的延展性和导电性,同时具备出色的耐腐蚀性能。
这些特性使得铝成为航空航天、汽车、建筑等行业的理想选择。
二、5000铝合金的基本成分5000铝合金是以铝为基础,并添加了一定比例的合金元素。
最常见的成分包括镁(Mg)和锰(Mn)。
镁和锰的添加能够显著改善铝合金的性能表现。
三、镁的作用与影响1. 强度提升:镁的加入可以增强铝合金的强度。
镁在固溶态中与铝形成固溶体,能够阻碍晶界的滑移和延展,从而提高材料的抗拉强度和屈服强度。
此外,镁能形成相互交错的晶体结构,进一步增强合金的强度。
2. 耐腐蚀性改善:镁的加入还能提高铝合金的耐腐蚀性,特别是对于海洋环境或含有氯化物的介质更加有效。
镁能与氧化物形成致密的保护层,防止进一步的氧化和腐蚀。
3. 加工性能优化:镁的存在可以提高铝合金的塑性,减小了材料的断裂倾向,使得铝合金更容易进行压铸、挤压等加工过程。
四、锰的作用与影响1. 合金强度提升:锰的加入能够显著提高铝合金的强度,特别是在低温下的强度。
锰和铝形成的固溶体能够增加合金的抗拉强度和屈服强度。
2. 精细晶粒调控:锰能够促进铝合金的细化晶粒,使其具有更好的机械性能。
细小的晶粒可以提高材料的塑性和韧性,增强强度和延展性的平衡。
五、其他合金元素除了镁和锰之外,5000铝合金中还可能添加少量的其他合金元素,如铜(Cu)和锂(Li)。
铜的加入可以提高合金的抗腐蚀性和机械性能,而锂则可以改善合金的密度和强度。
六、5000铝合金的应用领域由于其良好的性能和成本效益,5000铝合金在多个领域得到广泛应用。
它常用于船舶制造、汽车车身、储罐以及建筑领域。
铝合金制造的产品重量轻,而且具有出色的抗腐蚀性能,能够满足不同行业的需求。
高一化学必修一铝知识点归纳总结

高一化学必修一铝知识点归纳总结化学是一门探索物质组成、性质以及变化规律的科学,而铝作为重要的金属元素之一,在化学中扮演着重要的角色。
本文将对高一化学必修一中关于铝的知识点进行归纳总结。
一、铝的基本性质1. 原子结构:铝的原子序数为13,原子结构为2, 8, 3。
2. 物理性质:铝是一种银白色的轻金属,在常温下具有良好的延展性和导电性。
3. 化学性质:铝与氧气反应生成三氧化二铝,与非金属元素如硫、碳等反应生成相应的硫化物和碳化物等。
二、铝的制备与加工1. 制备方法:铝的主要制备方法有金属铝的电解法、熔融法和气相还原法等。
2. 加工工艺:铝可通过挤压、拉伸、锻造等加工工艺进行成型,可制备成各种形状的铝材。
三、铝的化合物1. 氧化物:铝的氧化物为三氧化二铝(Al2O3),是一种无机化合物,常见的矿石为矾土。
2. 盐类:铝与酸反应可生成相应的铝盐类化合物,如硫酸铝(Al2(SO4)3)等。
3. 氢氧化物:铝的氢氧化物为氢氧化铝(Al(OH)3),常见的形式为白色胶状物。
四、铝的应用1. 金属铝:铝是一种重要的金属材料,广泛应用于航空航天、汽车制造、建筑等领域,具有轻质、强度高、耐腐蚀等优点。
2. 铝合金:铝合金是将铝与其他金属元素进行合金化制备而成,具有较高的强度和热性能,常用于制造飞机、火箭等。
3. 铝的化合物:铝的氧化物与硅、氧化镁等化合可制备陶瓷材料,氢氧化铝则常用于药物制剂和消化剂等领域。
综上所述,铝作为一种重要的金属元素,在化学中扮演着重要的角色。
它的基本性质、制备与加工方法、化合物以及应用领域等知识点对于高一化学学习至关重要。
我们应该深入学习铝的相关知识,加深对其性质和应用的理解,为今后的学习打下坚实的基础。
高中化学课件铝

高中化学课件铝高中化学课件:铝一、引言铝(Al)是一种具有广泛应用的金属元素,位于元素周期表的第三周期,原子序数为13。
在我国,铝资源丰富,开发利用历史悠久。
本课件旨在介绍铝的基本性质、制备方法、应用领域及环境保护等方面的内容,帮助学生全面了解铝的相关知识。
二、铝的基本性质1. 物理性质铝是一种银白色金属,具有良好的导电性、导热性和延展性。
密度约为2.7g/cm³,熔点约为660℃。
在常温下,铝与空气中的氧气发生化学反应,一层致密的氧化铝薄膜,从而具有良好的耐腐蚀性。
2. 化学性质铝的化学性质较为活泼,位于金属活动性顺序表的中等位置。
在化学反应中,铝容易失去电子,表现出还原性。
铝能与许多非金属元素发生反应,如与氧气、氯气、硫等形成相应的化合物。
此外,铝还能与强酸、强碱发生反应,相应的盐和氢气。
三、铝的制备方法1. 铝土矿的提取铝土矿是铝的主要原料,其主要成分是氧化铝(Al₂O₃)。
提取铝土矿的方法有露天开采和地下开采两种。
露天开采适用于铝土矿埋藏较浅的地区,地下开采适用于铝土矿埋藏较深的地区。
2. 氧化铝的制备将铝土矿经过破碎、研磨、浮选等工序,得到精矿。
然后,采用拜耳法或烧结法等方法,将精矿中的氧化铝提取出来。
拜耳法是将精矿与氢氧化钠溶液反应,偏铝酸钠,再通过酸化、沉淀、过滤、洗涤、干燥等工序,得到氧化铝。
烧结法是将精矿与石灰石、煤炭等原料混合,经高温烧结,得到氧化铝。
3. 铝的冶炼铝的冶炼采用霍尔-埃鲁法,即在熔融的氧化铝中通入氯气,使其中的氧化铝还原成铝。
反应方程式为:2Al₂O₃ + 3C → 4Al + 3CO₂。
通过电解槽,将熔融的氧化铝和冰晶石(Na₃AlF₆)混合物作为电解质,通入直流电,使铝离子在阴极上还原成铝。
电解过程中,产生的氧气在阳极上与氯气反应,氯气。
四、铝的应用领域1. 建筑行业铝在建筑行业中的应用十分广泛,如铝合金门窗、幕墙、铝塑板等。
铝合金具有质轻、强度高、耐腐蚀等优点,越来越受到建筑行业的青睐。
《铝 金属材料》 知识清单

《铝金属材料》知识清单一、铝的基本性质1、物理性质铝是一种银白色的轻金属,具有良好的延展性、导电性和导热性。
它的密度较小,约为 270 g/cm³,这使得铝在航空航天、汽车制造等领域有广泛的应用。
铝的熔点为 66037℃,沸点为 2467℃。
2、化学性质(1)铝在空气中容易与氧气反应,形成一层致密的氧化铝保护膜,阻止内部的铝进一步被氧化。
化学方程式为:4Al + 3O₂= 2Al₂O₃。
(2)铝能与酸反应,生成铝盐和氢气。
例如,与盐酸反应的化学方程式为:2Al + 6HCl = 2AlCl₃+ 3H₂↑ 。
(3)铝也能与碱溶液反应,生成偏铝酸盐和氢气。
例如,与氢氧化钠溶液反应的化学方程式为:2Al + 2NaOH + 2H₂O = 2NaAlO₂+ 3H₂↑ 。
二、铝的制备1、电解法工业上通过电解熔融的氧化铝来制取铝。
氧化铝在电解槽中,在高温和直流电的作用下分解为铝和氧气。
化学反应方程式为:2Al₂O₃(熔融)通电 4Al + 3O₂↑ 。
三、铝合金1、定义铝合金是以铝为基添加一定量其他合金化元素的合金,是轻金属材料之一。
2、性能特点(1)强度高:铝合金的强度比纯铝高,能够满足许多结构件的强度要求。
(2)耐腐蚀:通过添加一些合金元素和进行适当的表面处理,铝合金具有较好的耐腐蚀性能。
(3)加工性能好:易于进行各种加工,如铸造、锻造、挤压、轧制等。
3、常见的铝合金种类(1)防锈铝合金:主要合金元素是锰和镁,具有良好的耐蚀性和塑性。
(2)硬铝合金:合金元素包括铜、镁、锰等,强度较高。
(3)超硬铝合金:含有较多的锌、铜、镁等元素,强度和硬度很高。
(4)锻铝合金:具有良好的热塑性、锻造性能和较高的力学性能。
四、铝在生活中的应用1、航空航天领域由于铝的密度小、强度高,在飞机制造中大量使用,如机身、机翼等部件。
2、汽车工业用于制造汽车的车身、发动机部件等,减轻车辆重量,提高燃油效率。
3、建筑行业铝合金门窗具有美观、耐腐蚀、质量轻等优点。
铝合金的分类及牌号介绍

一、铝及铝合金的基本性质纯铝呈银白色,因其在潮湿的空气中能形成一层防止金属腐蚀的氧化膜,能阻止其进一步氧化从而具有一定抗蚀性。
铝相对密度2.7g/cm3,熔点660℃,沸点2327℃;面心立方体结构,故而有很高的塑性,易于加工,可制作成各种型材、板材。
但纯铝强度比较低,难以满足使用要求。
工业上铝都是采用电解法生产的,通常会以铝为基体,加入少量金属或非金属元素,采用合金化方式制作成铝合金并运用热处理等方法,使其在保持质轻等优点的同时还具有较高的强度。
铝及其合金主要有以下优点:(1)质轻,约为钢的1/3,比强度和比刚度高;(2)塑性好,易于加工及适用于各种表面处理:(3)导热、导电性好,导热、导电率仅次于铜,约为钢铁的3~4倍;(4)良好的耐腐蚀性和低温性能。
二、铝合金分类(1)铝按其纯度分为高纯铝和工业纯铝。
纯铝的牌号用“铝”字拼音首字母“L”和其后面的编号表示。
高纯铝的牌号有L01、L02、L03、L04、L05,后面的数字越大,纯度越高,含铝量在99.85%-99.99%之间。
工业纯铝的牌号有L1、L2、L3、L4、L4-1、L5、L5-1、L6,后面的数字表示纯度,数字越大,纯度越低。
(2)铝合金一般通过其成分、组织和工艺等特点,可以将其分为铸造铝合金与变形铝合金两大类。
变形铝合金:将铝合金铸锭通过压力加工(轧制、挤压、模锻等)制成半成品或模锻件,要求有良好的塑性形变能力铸造铝合金:将熔融的铝合金直接浇铸成形状复杂的甚至是薄壁的成型件,要求合金有良好的铸造流动性。
工程上常用铝合金相图大都与上图类似,D点成分以左的合金在加热至高温时能形成单相固溶体组织,其塑性较高成为变形铝合金;于D点成分以右的合金,因含有共晶组织,液态流动性较高适用于铸造,称为铸造铝合金。
对于变形铝合金而言位于F点以左成分的合金不能进行热处理强化,称为热处理不可强化的铝合金;成分在F和D之间的铝合金,由于合金元素在铝中有溶解度的变化会析出第二相,可以通过热处理使合金强度提高,称为热处理强化铝合金。
什么是铝合金铝合金的理化性质

什么是铝合金铝合金的理化性质铝合金是工业中应用最广泛的一类有色金属结构材料,在航空、航天、汽车、机械制造、船舶及化学工业中已大量应用。
那么你对铝合金了解多少呢?以下是由店铺整理关于什么是铝合金的内容,希望大家喜欢!铝合金的介绍工业经济的飞速发展,对铝合金焊接结构件的需求日益增多,使铝合金的焊接性研究也随之深入。
目前铝合金是应用最多的合金。
氧化铝在1808年在实验室利用电解还原为铝材,于1884年即被作为建筑材料使用在美国华盛顿纪念碑尖顶上至今;铝材加入各种金属元素合成的铝合金材料已被建筑工业广泛应用在各环节上。
1908年美国铝业公司发明电工铝合金1050,并制成钢芯铝绞线,开创高压远程输电先锋。
1915年美国铝业公司发明2017合金,1933年发明2024合金,使铝在航空器中的应用得以迅速扩大。
1933年美国铝业公司发明6061合金,随即创造了挤压机淬火工艺,显著扩大了挤压型材应用范围。
1943年美国铝业公司发明了6063合金及7075合金,开创了高强度铝合金的新纪元。
1965年美国铝业公司又发明了A356铸造铝合金,这是经典铸造铝合金。
随着对铝合金材料方面的研究深入,高强铝合金(2000、7000系列)以其优异的综合性能在商用飞机上的使用量已经达到其结构质量的80%以上,因此得到全球航空工业界的普遍重视。
铝合金开始逐渐应用于生活、军事、科技方面。
铝合金的理化性质物质特性铝合金密度低,但强度比较高,接近或超过优质钢,塑性好,可加工成各种型材,具有优良的导电性、导热性和抗蚀性,工业上广泛使用,使用量仅次于钢。
一些铝合金可以采用热处理获得良好的机械性能、物理性能和抗腐蚀性能。
硬铝合金属AI—Cu—Mg系,一般含有少量的Mn,可热处理强化.其特点是硬度大,但塑性较差。
超硬铝属Al一Cu—Mg—Zn系,可热处理强化,是室温下强度最高的铝合金,但耐腐蚀性差,高温软化快。
锻铝合金主要是Al—Zn—Mg—Si 系合金,虽然加入元素种类多,但是含量少,因而具有优良的热塑性,适宜锻造,故又称锻造铝合金。
铝合金基本知识
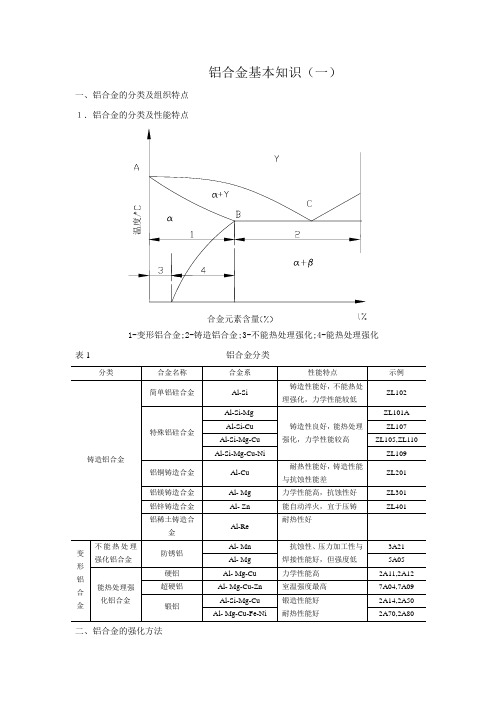
铝合金基本知识(一)一、铝合金的分类及组织特点1.铝合金的分类及性能特点合金元素含量1-变形铝合金;2-铸造铝合金;3-不能热处理强化;4-能热处理强化表1 铝合金分类二、铝合金的强化方法1.固溶强化在纯铝中加入合金元素(Si Cu Mg Zn Mn Ni……等),形成铝基固溶体,从而提高铝合金的力学性能。
2.时效强化合金元素在铝中的固溶度随温度的降低而减少,通过加热到一定温度、保温、淬火而得到过饱和的铝基固溶体,过饱和的铝基固溶体在室温下放置一段时间,或加热到某一温度,其强度、硬度随时间的延长而增高,塑性、韧性降低。
在室温下放置产生时效的现象叫自然时效。
加热产生时效的现象叫人工时效。
3.过剩相强化合金元素超过其极限溶解度时,这些合金元素与铝或元素间形成硬而脆的金属间化合物,在合金中起阻碍滑移和位错运动的作用,使强度、硬度提高,塑性、韧性降低。
4.变质处理加入微量元素(钛、锆、铍、锶、稀土等),在合金结晶时,作为晶核,起细化晶粒作用,提高合金的强度和塑性。
在铝合金液中加入微量钠或钠盐作为变质剂,进行变质处理,细化晶粒可以显著提高其强度和塑性。
5.冷作硬化金属材料在再结晶温度以下变形,变形后材料即被强化,强化的程度随变形程度、变形温度及材料的性质而不同。
同种材料,在同一温度下冷变形时,其变形程度越大,则强度越高。
这是不能热处理的防锈铝合金和纯铝的强化方法。
三、铸造铝合金1.铸造铝合金牌号○1在牌号的最前面用“Z”表示铸造,其后用化学元素符号及数字表示。
例如:ZAlSi7Mg表示该平均含硅量为7%,平均含镁量为1%的铸造镁合金。
○2用合金代号表示。
合金代号由字母“Z”,“L”(它们分别是“铸”、“铝”的汉语拼音第一个字母)及其后的三位数字组成。
ZL后面的第一位数字表示合金系列,1—表示铝硅合金;2—表示铝铜合金;3—表示铝镁合金;4—表示铝锌合金。
其后的两位数字是表示该组合金的顺序。
若为优质合金则在数字后加“A”,例如:ZL101A是铝硅合金,相当于ZAlSi7MgA。
铝及铝合金ppt课件2 〔苏教版〕

110.每天安静地坐十五分钟·倾听你 的气息 ,感觉 它,感 觉你自 己,并 且试着 什么都 不想。 ――[艾 瑞克·佛洛姆]
111.你知道何谓沮丧---就是你用一 辈子工 夫,在 公司或 任何领 域里往 上攀爬 ,却在 抵达最 高处的 同时, 发现自 己爬错 了墙头 。--[坎伯]
112.「伟大」这个名词未必非出现 在规模 很大的 事情不 可;生 活中微 小之处 ,照样 可以伟 大。― ―[布鲁 克斯]
与铝反应 的物质
盐酸
氢氧化钠 溶液
实验现象
铝溶解 铝溶解
结论或离子方程式
2Al+6H+=2Al3++3H2↑
2Al+2H2O+2OH-=2AlO2-+3H2↑
设疑三?
铝桶能否盛放浓硝酸、浓硫酸?为什么? 实验 Al片分别浸入浓硝酸、浓硫酸中,观察现象。
与铝反应 的物质
实验现象
浓硝酸 无气泡产生
浓硫酸 无气泡产生
7、人往往有时候为了争夺名利,有时 驱车去 争,有 时驱马 去夺, 想方设 法,不 遗余力 。压力 挑战, 这一切 消极的 东西都 是我进 取成功 的催化 剂。 8、真想干总会有办法,不想干总会有 理由;面对困 难,智 者想尽 千方百 计,愚 者说尽 千言万 语;老实 人不一 定可靠 ,但可 靠的必 定是老 实人;时 间,抓 起来是 黄金, 抓不起 来是流 水。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1.3.1 合金元素与铝的作用 ⑴元素在铝中的溶解度
Mg, Cu, Zn 和 Si 在铝 中固溶度较大,是常 用合金化元素。 Cr, Mn 和 Zr 与铝形成 化合物,常用于控制 晶粒尺寸。
Zn(31.6→2) Mg(17.4→1) Cu(5.65→0.5) Li(4.2) Mn(1.82) Si (1.65) Ag(56.5) Ge(7.2) Ti(1.3)
拜耳工艺流程图
拜耳-烧结联合法
先用石灰石与铝土矿反应生成 Ca2SiO4,滤除后得到高含量Al2O3。
若直接采用拜耳法时,NaOH 与硅反应生成Na2SiO3, Na2SiO3 与 NaAlO2 反应生成不溶于水的硅铝酸钠,将降低Al2O3的收得率。
碱石灰烧结法 用Na2CO3 代替 NaOH 。在800-1200 ℃下,磨碎的铝土矿与 Na2CO3 反应, 生成铝酸钠 和 CO2。 铝酸钠经进一步磨碎后溶解于90-95℃ 水中, Al(OH) 3 以沉 淀物析出,浸出液体后通过加热脱水得到Al2O3 粉末。
Ca Co Cu Cr Ge Fe Li Mg Mn Ni Si Ag Sn Ti V Zn Zr
最大溶解度:Cr、Ti、V、Zn、Zr发生在包晶温度;其余元素在共晶温度。 室温溶解度:Mg、Zn约为2%;Ge、Li、Ag为0.1~0.25%;其余小于0.1%
⑵二元铝合金相图
Al-Cu共晶相图
Al-Ti包晶相图
Hall-Hé roult电解槽
由于比重的差别在阴极上析出的铝液汇集于电解槽槽底,而在阳极上析出二 氧化碳和一氧化碳气体,铝液从电解槽中吸出,经过净化去除氢气、非金属 和金属杂质并澄清后,铸成铝锭。
电解质: 80-90%NaAlF6, 2-8%Al2O3。添加剂AlF3、CaF3。
电极反应机理 阴极 阴离子在阴极表面失去电荷形成 NaF。 阳极 溶于电解液中的Al2O3 在阳极区形成铝离子和AlO33- ,铝离子 得到电荷形成金属 Al 并放出氧 , 氧与C 形成 CO2。
第二步: 在50℃左右, NaAlO2 分解得到Al2O3 · 3H2O 。通过附加促结 晶剂 ,促进(Al2O3 · 3H2O) 沉淀。 第三步: 调整煅烧温度、压力,除去Al2O3 · 3H2O中的水。可获得不 同形态的α、β或γ Al2O3 。 400~600℃煅烧,得到γ- Al2O3 。 1200℃煅烧,得到 α-Al2O3。
主要公司: (2007年)
世界原铝产地: 北美、西欧(德、法)、中、俄、澳大利亚、巴西。 俄罗斯铝业联合公司【第一大铝公司】420万吨(12%) 力拓公司(加铝): 【第二大铝公司】 约400万吨 美国铝业公司【Alcoa,第三大铝公司 】约380万吨 中国铝业公司:【第四大铝公司】 288 万吨 雷诺兹金属公司[美] 凯撒铝及化学公司[美] 波施涅铝工业公司[法] 德国联合工业公司 日本轻金属公司 澳大利亚科马尔科铝业公司 APA公司【加拿大铝业公司、瑞士铝集团、法国佩希公司 】
年度
年度
产量
1995
1996 1997 1998 1999
186
190 217 243 259
电解铝产量/万吨
2000
2001 2002 2003 2004
279
337 451 554 668
2005
2006 2007 2008
780
935 1255 1317
世界电解铝产量
世界与中国电解铝产量
年度
4500 4000 3500 3000 2500 2000 1500 1000 500 0 2001 2003 2005 2007
全球 产量 2443
中国 产量 337
2001
电解铝产量/万吨
2002
2003
世界 中国
2607
2800 2992 3189 3321 3815 3930
451
554 668 780 935 1255 1317
1.3.2 铝合金的时效强化机制
固溶时效处理的一般步骤 ①固溶: 将铝合金加热到单相固溶体区 (固溶线以上、固相线以下),使 合金元素溶入,获得成分均匀的固 溶体。
②淬火: 快冷到室温获得单相过饱和固 溶体。 ③时效: 过饱和固溶体加热到室温以上 某一温度,使其分解形成细小分散 沉淀相。
自然时效:室温下时效 人工时效:在高于室温进行时效
2004 2005 2006 2007 2008
应用ConstrucFra bibliotekion & Equipment
Containers & Packaging
Aerospace
Automotives
1.2 铝的制取
制取方法的演化
木炭和铝土(氧化铝) 钾汞齐 铝汞齐 氯气 氯化铝 隔绝空气蒸发 一种金属
1807年:英国H· 维达用电化学法分离明矾时发现铝的存在。 1825年:丹麦化学家奥斯德用电化学法分离出铝。 1827年:德国武勒重复奥斯德实验,并加以改进。 1854年:德国化学家德维尔用钠代替钾还原氯化铝,制得铝锭,并于 1855年在巴黎世博会展出。 1855年:法国圣· 克莱尔· 德维尔 用钠从氯化铝中还原出铝,于1859年生 产出1.9吨铝。 1886年:霍尔[美]及埃鲁[法]用电解法生产金属铝(霍尔-埃鲁工 艺:用碳质阳极电解熔于熔融Na3AlF6中的Al2O3来制取铝) 1888年:澳大利亚卡尔· 约瑟夫· 拜耳发明了拜耳工艺 Bayer process:用240℃的氢氧化钠溶液溶解破碎的铝土矿 1910年:铝产量达45000吨
第1 章
1.1 1.2 1.3 1.4 1.5
铝及其铝合金
概述 铝的制取 铝的物理冶金 工业纯铝 铝合金
目的: 本章介绍铝及其合金的不同生产方法、热处理方面的基本知 识,以及铸造铝合金、变形铝合金的各种应用; 讨论成分、组织和热处理对铝合金的化学性能、力学性能的 影响及其与应用的关系。
1.1 概述
氧化铝制取原理
拜耳法:氧化铝生产总量的95% 碱石灰烧结法 拜耳-烧结联合法
铝土矿 Bauxite
高岭石 kaolinite
霞石 (Nepheline)
拜耳法:高品位铝土矿 碱石灰烧结法和拜耳-烧结联合法:中低品位铝土矿
拜耳法
将粉碎的铝土矿放入240℃的强 NaOH 溶液中提取出Al2O3
第一步: 将含有Al2O3的NaAlO2溶解于水中,滤除Fe和Si 氧化物组成的 不溶解于水的残留物或红土。
G P区是溶质原子富集的、排列有序的、 与基体共格的原子束,均匀分布在基体上。其 数量完全取决于淬火后存在的空位浓度,与基 体中非均匀分布的位错无关。因为溶质原子可 借助空位进行迁移富集,空位越多,富集迁移 越易进行;凡能提高空位浓度的因素均能促进 GP区的形成,如:提高固溶温度,加快冷却 速度,淬火后固溶体中存在较多空位,这有利 于获得尺寸细小、数量多GP区。
过渡相有确定的成分和晶体结构,与基体共格或部分共格,有一 定结晶学位向关系,尺寸比GP区稍大。 过渡相结构与基体存在较大差异,需要较大的形核功才能形核 。 为了降低形核功(应变能、界面能),过渡相常在位错、小角晶界、 层错、空位团以及 GP 区等处不均匀形核。因此,其形核速率与基体 中位错密度有关。 300000× θ″相:圆碟片状, Φ30nm×2nm;正方 点阵, a = b = 0.404nm , c = 0.768nm 。为均 匀形核 、 分布均匀,与基体完全共格,位向 关系为{100}θ″//{100}基体;θ″相周围比GP区 存在更大的共格应变,故其强化效果大于 GP 区。 θ′相:圆碟片状,Φ100nm×几十 nm; 正方点阵,a=b=0.404nm,c=0.58nm。与 基体部分共格,位向关系为{100}θ′//{100}基 体;成分为Cu2Al3.6,接近于平衡相θ (CuAl2)。 α基体上析出θ”相
资源 地壳中含量近8.2%,列全部化学元素含量的第三位 (仅次于氧和硅),列全部金属元素含量的第一位 (Fe: 5.1%;Mg: 2.1%;Ti: 0.6%)。 铝以化合态存在于各种岩石或矿石中,如长石、 云母、高岭土、铝土矿、明矾。 霞石(Nepheline):岩浆矿物,长石类矿物。 氧化铝(Alumina ) 菱镁铀矿(Bayleyite ) 明矾(Alunite)
铝的净化:电解铝中通过含有碳粉、电解质、氢气等杂质。用 石墨管将 Cl2 吹入铝的熔池中形成 AlCl3 ,AlCl3与杂质一起浮 出去除。
1.3 铝的物理冶金
密度 (20 ℃) : 2.70 g.cm-3 熔点 : 660 ℃ 100 ℃时的热容: 0.2241 cal.g-1K-1 / 938 Jkg-1K-1 熔化潜热: 94.7 cal.g-1 / 397.0 kJ.kg-1 20 ℃ 时的电导率:64.94 (相当标准退火铜的百分数) 热导率 : 0.5 cal.sec-1cm-1K-1
Bauxite铝土矿
Bauxite-pebbly 矾土卵石
Kaolinite clay高岭土
性能 • • • • • 密度小 高的热导率、电导率 高的耐腐蚀性 优异的机加工性能 高的韧性、成形性
Comparison of Al and steel
中国电解铝产量 中国年电解铝产量随年度的变化
1400 1200 1000 800 600 400 200 0 1995 1997 1999 2001 2003 2005 2007
Al-4%Cu铸态组织及淬火态组织
⑴时效分解(析出)过程和产物
时效分解【析出,脱溶(或沉淀)】:过饱和固溶体中析出一 个成分、结构与基体均不同的新相,或由溶质原子富集形成亚 稳过渡相的过程。属于固态相变。
过饱和固溶体 分解产物 GP区 过渡相(中间沉淀相) 平衡相
Al-Cu合金: 过饱和固溶体随着时效时间的增加,将发生下列分解: α过 → GP区 → θ″ → θ′ → θ 其中 G· P区、θ″、θ′为亚稳定相 ( θ″又称为GPⅡ区) 随着时效时间的延长,组织变化过程为: α过 → α+ GP区 → α+ θ″ → α+ θ′ → α+ θ
